Антифосфолипидный синдром в акушерстве и гинекологии

Антифосфолипидный синдром в акушерстве. Это выступление врача ЦИР, Печёриной Екатерины Юрьевны, на IV Всероссийской конференции “Репродуктивное здоровье женщин и мужчин”.
Доклад называется “Антифосфолипидный синдром в акушерской практике”. В этом докладе Екатерина Юрьевна очень подробно рассказывает про диагностику, клинические проявления и про помощь беременным женщинам при наличии у них антифосфолипидного синдрома.
Доброе утро, коллеги! Прекрасное воскресное утро, радостно всех видеть здесь! Сегодня мы поговорим об антифосфолипидном синдроме. В какой-то степени я продолжу то, о чем рассказывал Игорь Иванович. Но остановлюсь на несколько других аспектах, в том числе, лабораторных.
Антифосфолипидный синдром (АФС) – это заболевание аутоиммунное, которое связано с двумя направлениями. Это – клинические факторы и лабораторные признаки. АФС очень четко описан. К клиническим факторам антифосфолипидного синдрома относятся патологии беременности и тромбозы, каждый из которых четко регламентирован и описан в критериях антифосфолипидного синдрома.
К лабораторным признакам антифосфолипидного синдрома относится обнаружение одного из трех компонентов: это волчаночный антикоагулянт, антикардиолипиновые антитела и антитела к β2-гликопротеину 1. Причем, для того чтобы поставить диагноз антифосфолипидного синдрома, достаточно определить всего один показатель, но обязательно 2 раза. То есть для того, чтобы исключить какое-то транзиторное появление этих антител под влиянием инфекционных процессов, аутоиммунных процессов, необходимо проводить повторные исследования через 12 недель.
Антифосфолипидные антитела, которые служат для диагностики антифосфолипидного синдрома очень часто встречаются вместе, но, как я уже сказала, достаточно одного критерия. Мы часто видим сочетание волчаночного антикоагулянта и антикардиолипинов, волчаночного антикоагулянта и антител к β2-гликопротеину 1. При этом при всем важно определять действительно полную панель этих антител, потому что, чем больше антител в данном организме женщины, тем более высокие риски. То есть тройная позитивность имеет гораздо более высокие риски, чем двойная и чем монопозитивность. Иммуноглобулины IgG гораздо более активны, нежели иммуноглобулины IgМ и иммуноглобулины IgА, которые пока вообще не включены в критерии. Иммуноглобулины IgА рекомендуется исследовать в том случае, если клиническое подозрение на антифосфолипидный синдром очень велико, а других иммуноглобулинов не обнаружено.
У 2% здорового населения антифосфолипидные антитела есть, но нет клинической картины. И очень часто антитела имеют транзиторный характер, именно поэтому для подтверждения диагноза рекомендуется определять их повторно через 12 недель.

Помимо тех антител, которые перечислены в критериях антифосфолипидного синдрома так же определяются и могут быть определены антитела к другим фосфолипидам: к фосфатидилсерину, к фосфатидилэтаноламину и другим. И антитела к кофакторам антифосфолипидного синдрома, антитела к тем белкам, которые связываются с фосфолипидами. Это, в первую очередь, β2-гликопротеин 1 (GPBB1), это антитела к аннексину V, антитела к протромбину, к протеину С, к протеину S и другим кофакторам.
Когда-то, когда только назвали антитела к фосфолипидам, еще не было того понимания, что основной действующий агент – это не сам по себе фосфолипид, а комплекс фосфолипида и белка, который является неоэпитопом для действия вот этих антител. И вся дальнейшая картина связана с взаимодействием антител (комплексом фосфолипида и белка).

Антифосфолипидный синдром на данный момент является, скажем так, одной нозологической единицей, но всегда выделяется отдельно сосудистый антифосфолипидный синдром и акушерский антифосфолипидный синдром. Это связано с тем, что их развитие, факторы риска, проявления – разные.
Если в сосудистом антифосфолипидном синдроме основным фактором является тромбоз, то в акушерском основную роль играют совершенно другие механизмы.
Итак, какие же механизмы, в первую очередь, обуславливают развитие антифосфолипидного синдрома в акушерстве?
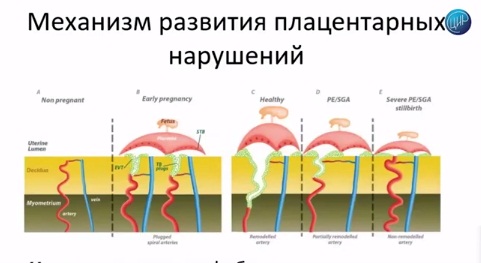
Место действия – плацента и плацентарные нарушения, которые развиваются и обуславливают всю дальнейшую картину во втором и третьем триместре, с грозными осложнениями беременности. Всё закладывается на самых ранних сроках беременности. Вот вторая картинка, там очень четко это показано.
На раннем сроке беременности происходит инвазия трофобласта. Клетки трофобласта замещают мышечный слой артерии, происходит ремоделирование спиральных артерий: они становятся широкими, через них хорошо протекает кровь, плацентарное кровообращение хорошее. Эти сосуды не отзываются на сосудистые факторы, которые могут регулировать давление в остальных сосудах, и беременность протекает хорошо: плацентарных осложнений нет.
При развитии осложнений нарушается инвазия трофобласта, нарушается ремоделирование спиральных артерий, нарушается кровоток и развивается вся остальная клиническая картина. Можно видеть: последние 2 картинки – преэклампсия и рождение детей с малым весом; последняя картинка – это уже тяжелая преэклампсия, мертворождение. Значительно сосуд отличается от того, который мы видим при здоровой беременности. Они узкие, они реагируют на все материнские факторы, которые изменяют давление, и развивается плацентарная недостаточность.
Важно, что всё это закладывается в первом триместре беременности. Но в первом триместре этого еще клинически не видно. Всё будет видно в третьем триместре беременности, когда компенсаторных возможностей будет недостаточно.
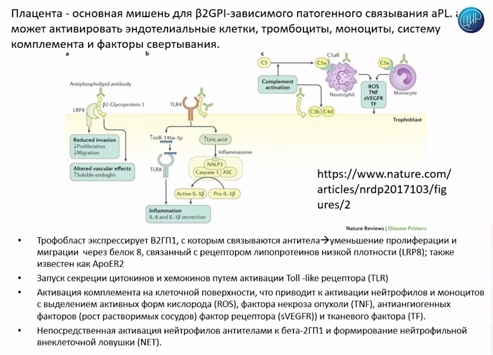
Очень важное отличие антифосфолипидного синдрома при беременности от сосудистого в том, что при беременности появляется новый орган, на котором огромное количество β2-гликопротеина 1, с которым могут связываться антитела. И они все устремляются туда, и именно там антитела связываются с β2-гликопротеином и фосфолипидами. Там активируются эндотелиальные клетки, тромбоциты, моноциты; активируется система комплемента, активируются факторы свертывания. И там разворачивается такое огромное поле действия. Частично оно описано на этой схеме. Мы видим, как антифосфолипидные антитела связываются с комплексом бета-2-гликопротеина и активируя те или иные факторы, в частности – LPR8, Toll-like рецепторы (TLR), активируя комплемент, вызывают те изменения, которые в дальнейшем будут нарушать плацентарную функцию. Через этот механизм нарушается инвазия, нарушается миграция, нарушается соотношение ангиогенных и антиангиогенных факторов. Через Toll-like рецепторы (TLR) активируются цитокины, хемокины и развивается воспалительная реакция.
Крайне важное действие (о чем уже говорил Игорь Иванович) – это активация комплемента; активация нейтрофилов, моноцитов; мощнейший выброс различных агентов – это и фактор некроза опухоли, и активные радикалы кислорода, и тканевый фактор, который сразу активирует свертывание крови. Антитела, сами по себе, могут просто активировать клетки. В частности, активируя нейтрофилы, они вынуждают нейтрофилы выбрасывать свои нейтрофильные внеклеточные ловушки и усиливать всю эту реакцию.

Волчаночный антикоагулянт – это первое, что определяется при подозрении на антифосфолипидный синдром. Представляет собой смесь аутоантител. Определяется он пролонгацией фосфолипид – зависимого свертывания крови. Именно поэтому его назвали когда-то антикоагулянтом, потому что оказалось, что его добавление удлиняет время свертывания крови. Это происходит потому, что эти антитела блокируют один этап свертывания крови, но на самом деле, вызывают не гипокоагуляцию, а тромбоз.

Так как это очень гетерогенная группа антител, и нет одного анализа, который можно выполнить и сразу получить ответ – есть волчаночный антикоагулянт или его нет, то для того, чтобы это выяснить, определяется серия анализов. Сначала делается скрининговый тест. Первый тест, например, с разведенным ядом гадюки Рассела. Если он оказывается отрицательным, проводится второй скрининговый тест, чтобы убедиться, что волчаночного антикоагулянта уж точно нет. Это – АЧТВ, чувствительный к волчаночному антикоагулянту. Если один из тестов оказывается положительным, проводится подтверждающий тест. Если один из тестов оказался положительным, обязательно проводится миксинг – тест.
Дело в том, что все тесты на определение волчаночного антикоагулянта являются так называемыми клоттинговыми тестами. То есть мы добавляем какой-то реагент в пробирку и наблюдаем за тем, как образуется в этой пробирке сгусток крови. На образование этого сгустка могут влиять многие факторы. Например – дефицит фактора свертывания крови. Если факторов свертывания крови мало, сгусток будет образовываться так же долго, как и в случае присутствия волчаночного антикоагулянта. Поэтому мы добавляем туда обычную нормальную плазму, в которой много факторов свертывания крови, и если кровь начинает свертываться нормально, то, значит, дело не в волчаночном антикоагулянте.
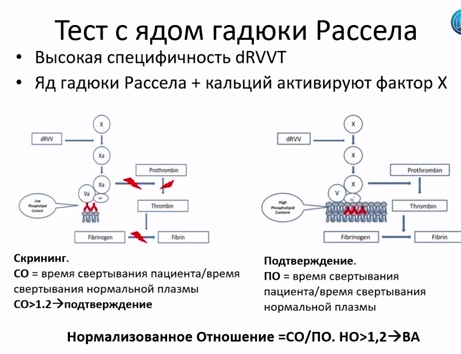
Здесь, как раз, приведен пример: в исходном тесте у нас мало фосфолипидов, видите? Они связаны с волчаночным антикоагулянтом. Поэтому свертывание крови происходить не может: нет фосфолипидов для образования протромбиназного комплекса.
Во втором случае мы добавили много фосфолипидов, и свертывание крови может происходить дальше.

Для того, чтобы определить волчаночный антикоагулянт, нужно соблюдать очень много правил: медсестра должна знать, как брать кровь и в какую пробирку; ее должны правильно обработать, там есть двойное центрифугирование; кровь должна после этого правильно храниться, если сразу не исследуется, то замораживается. Клиницист должен очень хорошо знать и понимать, когда можно применять какие препараты, и когда можно проводить обследование на волчаночный антикоагулянт, с точки зрения тех препаратов, которые принимают пациенты. Поэтому определение волчаночного антикоагулянта в остром периоде тромбоза не проводится, потому что пациент применяет терапию. Однако, антитела проводить можно. Антитела определяют совершенно другим методом, и исследование антител проводить можно, независимо от применяемой антикоагулянтной терапии.

Мы называли ранее «некритериальные» так называемые антитела, о которых сейчас очень много пишут, очень много говорят. Постепенно они, я думаю, будут дополнять критерии антифосфолипидного синдрома. Их определение рекомендуется и имеет значение в следующих случаях:
Во-первых, они сами по себе могут вызывать определенные изменения, которые ведут к проявлениям антифосфолипидного синдрома.
Во-вторых, они могут помогать в оценке степени тяжести течения антифосфолипидного синдрома: использоваться для диагностики серонегативного АФС, когда других антител нет, а мы очень предполагаем, что синдром присутствует.
Эти антитела присутствуют в некоторых шкалах риска, которые используются для оценки антифосфолипидного синдрома. Например, вот здесь анти-протромбин/фосфатидилсерин комплекс дает целых 3 балла; анти-β2-гликопротеина 4 балла, антикардиолипин антитела – 5. Шкала – одна из самых известных шкал по диагностике антифосфолипидного синдрома GAPSS.

Один из важных факторов, на который мы проводим обследования, это – аннексин V. В 1988 году он был назван «плацентарным антикоагулянтом» за счет того, что он оказывает активное антикоагулянтное действие, образуя на поверхности вот такой «аннексин – щит», за счет которого к фосфолипидам не поступают факторы свертывания.
Что делают антитела? Они этот щит разрушают, в нем образуются «дырки», и факторы свертывания могут проникать и связываться с фосфолипидами, тем самым активировать свертывание. То есть, антитела к аннексину активируют вот эту прокоагулянтную активность эндотелиальных клеток.
Вторые антитела – это антитела к протромбину. В статьях и в лабораторной диагностике чаще используется термин «антитела к фосфатидилсерин протромбиновому комплексу». Этот независимый фактор риска антифосфолипидного синдрома встречается примерно у 13% в группе с акушерскими осложнениями. Сам по себе, независимо от других антител, связан с неблагоприятными исходами: с тромбозами и с акушерской патологией.

Но обследовать пациента на весь этот список антител, каждый из которых может быть определен отдельно: антитела иммуноглобулина IgG, антитела иммуноглобулина IgМ, IgА, к кардиолипину, к фосфатидилсерину –это можно с делать огромную «простыню», при этом антитела достаточно редко встречаются, обследование будет очень дорогим. И для скрининга это не всегда подходит. Поэтому возможная тактика – использование так называемых скрининг – методов. Я привела здесь те, которые совершенно точно доступны в Российской Федерации. Это – антифосфолипид – скрининг, в который включен фосфатидилсерин, фосфатидиловая кислота, или к 8 различным антигенам.

Это то, что касается, непосредственно, диагностики антифосфолипидного синдрома. Однако, во время беременности этого недостаточно. Необходимо проводить дополнительные исследования. Одно из самых важных исследований, которое проводится, в частности и в нашей лаборатории, это оценка уровня плацентарного фактора роста. Уже на ранних сроках беременности мы можем увидеть, как меняется плацентарный фактор роста у женщин в группе с серьезными осложнениями второй половины беременности. Что происходит?
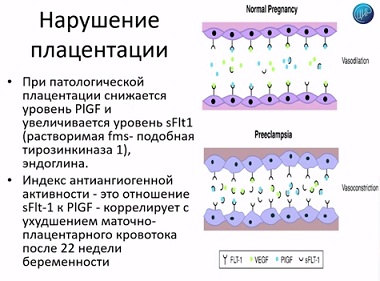
Здесь видно – нормальная беременность, практически все рецепторы заняты. А в случае с патологической беременностью факторы роста связаны с растворенными в крови рецепторами. Они не действуют. Действуют только те, которые зафиксированы. Растворенные – не действуют. Поэтому, факторы роста, в данной ситуации, перестают действовать. Плацентация может быть нарушена. И в первом триместре беременности, определяя плацентарные факторы роста, мы можем предположить эти осложнения во второй половине беременности.
Чуть позже, уже со второго триместра, можно определять индекс антиангиогенной активности соотношения sFIt-1 иплацентарного фактора роста, который коррелирует с дальнейшим нарушением маточно – плацентарного кровотока и другими осложнениями.

Вот так выглядит примерная схема того обследования, которое можно использовать в случаях проблем с течением беременности, в частности при антифосфолипидном синдроме.
Первый триместр: расширенный пренатальный скрининг, ультразвуковое исследование, измерение артериального давления.
Во втором триместре: также расширенное исследование и наблюдение за теми факторами, которые могут свидетельствовать о развитии осложнений. Очень важно наблюдать за тем, как растет и развивается плод; каждый визит беременной, каждое ультразвуковое исследование фиксировать, для того чтобы наблюдать, нет ли отставания развития плода во время этой беременности.

И, конечно, необходимо учитывать все остальные факторы риска, которые могут сопровождать беременную женщину с антифосфолипидным синдромом, потому что каждый дополнительный маркер усиливает и усугубляет эту ситуацию. В частности, исключить системную красную волчанку, оценить предшествующие тромбозы, оценить полиморфизм генов гемостаза сосудистого тонуса и, возможно, остановиться на том, как ведет себя комплемент: нет ли гипокомплементемии, нет ли активации
комплемента во время беременности, для того чтобы оценит эти риски. 
Основное лечение антифосфолипидного синдрома – низкодозированный аспирин и препараты гепарина. Очень важно, чтобы пациентка тщательно соблюдала прием – вот, как доктор назначил, так пациентка и должна принимать. Тогда успех очень
значительный: при антифосфолипидном синдроме почти 85% женщин будут иметь проблемы, но 85-ти % женщин мы сможем помочь, если они будут использовать наши назначения правильно. И гепарин, и аспирин оказывают множественный эффект. Гепарин – это не просто антикоагулянт. Он влияет, практически на все факторы, которые мы рассмотрели ранее. И еще один препарат, который уже называл сегодня Игорь Иванович – Плаквенил, который также активно включается сейчас в терапию при антифосфолипидном синдроме.
Спасибо за внимание, коллеги.
Источник
В настоящее время все большее внимание уделяется изучению роли иммунопатологических процессов в патогенезе акушерских осложнений и перинатальной патологии.
При решении этой проблемы особое значение приобретает исследование влияния аутоиммунных реакций к фосфолипидам — универсальным компонентам важнейших структур организма — клеточных мембран и митохондрий.
В клинике невынашивания беременности доказана роль антифосфолипидных антител (АФА) в патогенезе неразвивающихся беременностей, задержке внутриутробного развития плода, вплоть до антенатальной гибели плода во 2-м и 3-м триместрах.
Во всех вышеуказанных случаях предвестником осложнений является развитие хронический формы ДВС синдрома.
С ранних сроков беременности отмечается повышение функциональной активности тромбоцитов, снижается белковосинтезирующая и гормональная функция плаценты.
При отсутствии адекватной терапии присоединяется гиперкоагуляция в плазменном звене гемостаза, что ведет к нарастанию нарушений в микроциркуляторном русле, развитию плацентарной недостаточности, хронической гипоксии и гибели плода.
Согласно литературным данным, без проведения лечения гибель эмбриона/плода наблюдается у 90—95% женщин, имеющих АФА.
Впервые способность сывороток больных реагировать с фосфолипидными экстрактами была установлена в 1906 г. при разработке серологических методов диагностики сифилиса — реакции Вассермана.
В начале 50-х годов было показано, что положительные серологические реакции могут выявляться у больных с аутоиммунными, хроническими воспалительными и гематологическими заболеваниями при отсутствии каких-либо признаков сифилитической инфекции. Это послужило основанием для формирования представления о ложноположительной реакции Вассермана.
Так, в тот же период было обнаружено, что сыворотка больных СКВ способна in vitro подавлять фосфолипидзависимые коагуляционные реакции, не влияя на активность специфических факторов свертывания крови.
Циркулирующий в крови сывороточный ингибитор, названный «волчаночным антикоагулянтом», представляет собой популяцию антител, относящихся к различным классам иммуноглобулинов, специфически реагирующих с фосфолипидным компонентом протромбиназы активаторного комплекса.
Эти данные позволили предположить, что своеобразная активность ВА и развитие ложноположительной реакции Вассермана обусловлены продукцией антител к фосфолипидам, в частности к кардиолипину, являющемуся основным антигеном РВ и входящему в состав комплекса прокоагулянтных фосфолипидов.
В начале 60-х годов в процессе клинических наблюдений за больными, в сыворотке которых обнаруживали ВА, E.W. Bowie и соавт. обратили внимание на парадоксальный факт — присутствие ВА ассоциируется не с кровоточивостью, как это можно было ожидать с учетом способности антител in vitro удлинять время свертывания крови, а с частым развитием тромботических осложнений.
Это наблюдение привлекло внимание к возможному участию иммунологических механизмов, в частности аутоиммунных реакций в нарушении свертывания крови.
В процессе клинических наблюдений за больными СКВ, в сыворотке крови которых обнаруживали ВА, антитела к кардиолипину, было установлено, что присутствие этих антител часто ассоциируется с развитием своеобразного довольно четко очерченного симптомокомплекса, проявляющегося венозным и артериальным тромбозом различной локализации, акушерской патологией, тромбоцитопенией, неврологической и сосудистой патологией, причем перечисленные проявления часто выходили на первый план в клинической картине заболевания и определяли его тяжесть.
Обобщая накопленные данные, GR,VHughes и соавт. в 1986 г. впервые высказали мнение о существовании особого синдрома, в основе которого лежит развитие аутоиммунной реакции к широко распространенным фосфолипидным детерминантам, присутствующим на мембранах тромбоцитов, клеток эндотелия сосудов, клеток нервной ткани.
Этот синдром, впервые описанный в рамках СКВ, был вначале назван «антикардиолипиновым» синдромом.
В дальнейшем было доказано первостепенное значение гетерогенной группы антител к фосфолипидам в развитии нарушений системы гемостаза и других клинических проявлений, в связи с чем те же авторы предложили более общее определение «антифосфолипидный синдром» (АФС). Позже оказалось, что различные признаки синдрома могут развиваться не только при СКВ, но и при отсутствии достоверных клинических и лабораторных признаков этого заболевания. В настоящее время АФС изучается учеными различных медицинских специальностей: невропатологами, акушерами, кардиологами, сосудистыми хирургами, ревматологами.
В последние годы разработаны и стандартизированы чувствительные и специфичные радиоиммунологический и иммуноферментный методы определения антител к «чистым» фосфолипидным антигенам, что позволило провести широкие исследования распространенности антител при различных заболеваниях человека.
В настоящее время считается общепризнанным, что антитела к фосфолипидам представляют собой гетерогенную группу антител, различающихся по иммунохимической специфичности. Это в первую очередь связано с существованием нескольких классов мембранных фосфолипидов, различных по структуре и иммуногенности.
Антитела, содержащиеся в сыворотке больных, реагируют с различными фосфолипидными антигенами: фосфатидилхолином, фосфатидилэтаноламином, фосфатидилсерином, фосфатидилинозитолом.
Данная группа антител, называемая «волчаночный антикоагулянт» (ВА), удлиняет in vitro фосфолипидзависимые коагуляционные реакции, воздействуя на Са++ зависимое связывание протромбина и фактора Ха, Va в процессе сборки протромбинактиваторного комплекса (протромбиназы).
В отдельную группу выделены антитела к кардиолипину, присутствующему на внутренней мембране митохондрий. Антикардиолипиновые антитела (АКЛ) определяются иммунологическими тестами на основе кардиолипина. АКЛ и ВА обладают не одинаковой иммунологической активностью. Можно полагать, что антикардиолипиновые антитела являются чувствительным, но в отличие от ВА не специфичным серологическим маркером АФС, так как встречаемость АКЛ при различных заболеваниях значительно выше, чем частота развития АФС. Однако выявление АКЛ может иметь и прогностическое значение, указывая на возможность развития АФС.
Результаты недавно проведенных исследований свидетельствуют о возможных перекрестных реакциях антител к фосфолипидам с другими аутоантигенами, в частности с ДНК, Fc фрагментом IgG, мембраной тромбоцитов, эндотелия сосудов, эритроцитов.
Аутоантитела к фосфолипидам могут образовываться под влиянием эндогенных и экзогенных стимулов.
Антителообразование под действием экзогенных стимулов (наиболее часто инфекционных агентов) носит преходящий характер, не вызывает тромбоэмболических нарушений и не требует терапии. При повторном исследовании через 6—8 недель ВА в венозной крови не выявляется.
Антитела, образующиеся под воздействием эндогенных стимулов, связаны с нарушением эндотелиального гемостаза, их концентрация в сыворотке высокая, персистирующая, присутствует патогенетическая связь с АФС.
В клинической практике для определения антител к фосфолипидам используют несколько взаимодополняющих подходов. Для выявления ВА наиболее распространены функциональные тесты, основанные на подавлении in vitro сывороткой больных фосфолипидзависимых коагуляционных реакций. Определение АКЛ производится радиоиммунологическим или иммуноферментным методом.
Однако с клинической точки зрения для диагностики антифосфолипидного синдрома важной представляется комплексная оценка анамнестических, клинических и лабораторных данных, что позволяет правильно оценить риск осложнений и своевременно назначить необходимую терапию.
Для классического симптомокомплекса АФС характерно:
— выявление ВА в венозной крови;
— наличие в анамнезе у женщины в молодом возрасте до 45 лет венозных или артериальных тромбозов, в частности инфарктов, инсультов, преходящих нарушений мозгового кровообращения, тромбоэмболии легочной артерии, тромбоза сосудов сетчатки;
— тромбоцитопения, которая может проявляться клинически или быть бессимптомной;
— наличие в анамнезе потерь плода на разных сроках беременности.
Частота встречаемости АФС среди пациенток с привычным невынашиванием беременности составляет 27—42%. В популяции по данным американских авторов частота АФС составляет 5%.
Различают первичный АФС и вторичный при наличии какого-либо системного аутоиммунного заболевания. Предположить развитие АФС можно при наличии привычного невынашивания беременности неясного генеза, аутоиммунных заболеваний, при раннем развитии гестоза, гипотрофии плода в течение предыдущих беременностей, тромбоцитопении неясной этиологии, ложноположительных реакциях Вассермана.
При истинном аутоиммунном процессе патогенетическое действие антифосфолипидных антител реализуется через развитие хронической формы ДВС синдрома. Существует множество теорий, объясняющих роль АФА в развитии коагулопатии.
Доказано, что ВА in vitro подавляет активность белков С и S, а также тромбомодуллина, который является кофактором эндотелия. Активированный белок С обладает высокой антикоагулянтной активностью, вызывая деградацию факторов Va и Villa в присутствии фосфолипидов и белка S. Недостаточность белков С и S приводит к развитию тромбозов, особенно в системе микроциркуляции.
L.O. Carreras и J.G. Vermylen (1982) показали, что ВА in vitro, культивируемыми эндотелиальными клетками и миометрием, подавляют синтез простациклина. Дефицит простациклина, обладающего мощным сосудорасширяющим и антиагрегатным действием, также может являться одной из причин коагулопатии.
Учитывая осложненное течение беременности, послеродового периода, увеличение риска антенатальных и перинатальных потерь у женщин, страдающих АФС, чрезвычайно важной представляется проблема обследования данного контингента больных вне беременности, своевременная диагностика и коррекция гемостазиологических, метаболических и иммунных нарушений, динамический контроль на протяжении всей беременности и послеродового периода.
В случаях выявления ВА вне беременности и при наличии в анамнезе потерь плода, тромбозов и других клинических проявлений АФС считается целесообразным назначение глюкокортикоидной терапии. Наиболее эффективно назначение преднизолона уже во II фазе предполагаемого фертильного цикла в начальной дозе 5 мг. Доза преднизолона или метипреда должна быть адекватной, то есть подавлять аутоиммунные реакции. Если доза в 5 мг недостаточна, то она увеличивается на 2,5 мг до исчезновения ВА, но не более 10—15 мг.
Стероидная терапия должна быть длительной на протяжении всей беременности и 10—15 дней послеродового периода с последующей постепенной отменой. Особое внимание уделяется коррекции гемостазиологических нарушений. При гиперфункции тромбоцитов назначаются антиагреганты — курантил 75—150 мг в сут. за 1 ч до еды, трентал 300—600 мг или теоникол 0,015 мг 3 раза в день во время еды. Контроль гемостазиологических показателей целесообразно осуществлять 1 раз в 2 недели, при необходимости — ежедневно.
В случаях когда патологическая активность тромбоцитов сочетается с гиперкоагуляцией в плазменном звене и появлением маркеров внутрисосудистого свертывания (ПДФ, РКМФ, комплекс тромбин-антитромбин III), а также снижением антитромбина III и протеина С патогенетически обосновано раннее применение малых доз гепарина (15000 ЕД в сутки подкожно). Возможно применение малых доз гепарина — 10000 ЕД в сутки в/в капельно на 400 мл реополиглюкина.
Длительность гепаринотерапии определяется степенью выраженности гемостазиологических нарушений.
Назначение гепарина позволяет стабилизировать параметры хронометрической коагуляции, вызвать лизис фибриновых сгустков, предотвратить инфаркты в плацентарной ткани, улучшить фетоплацентарный кровоток и предупреждает развитие тромбоэмболических нарушений у беременной.
Возможно также назначение малых доз аспирина 100 мг в сутки.
Несмотря на выраженный положительный эффект гепаринотерапии, у ряда пациенток отмечается толерантность к препарату, а в некоторых случаях аллергическая реакция в виде покраснения, отека, зуда в местах инъекций.
В связи с этим приобретает особую актуальность использование эфферентных методов терапии, в частности плазмафереза.
Плазмаферез может быть использован как в качестве подготовки к беременности, так и во время беременности. Применение данного метода позволяет нормализовать реологические свойства крови, снизить гиперкоагуляцию, уменьшить дозу кортикостероидных препаратов и гепарина, что особенно важно при плохой их переносимости.
Под действием плазмафереза происходит деблокирование естественных систем детоксикации, изменение направленности иммунного ответа и повышается чувствительность к медикаментозным веществам. Плазмаферез можно проводить в дискретном или непрерывном режиме с использованием в качестве плазмозамещающих растворов кристаллоидных, коллоидных и белковых препаратов.
Процедуру целесообразно повторить 3 раза с интервалами в 2 дня. Объем удаляемой плазмы за 1 сеанс составляет 30% объема циркулирующей плазмы (600—900 мл).
Для профилактики тромбообразования в/в вводится гепарин в дозе 5—10 тысяч ед. Соотношение объема удаляемой плазмы к объему плазмозамещающих растворов должно быть вне беременности 1:1,2, во время беременности 1:2.
Необходимость повторения курса процедур определяется индивидуально в зависимости от клинических и лабораторных данных.
По нашим данным, после сеансов плазмафереза происходит улучшение гемостазиологических показателей — нормализация параметров в плазменном и тромбоцитарном звене, снижение уровня АФА в циркулирующей крови, нормализация биохимических показателей, в том числе кислотно-основного состояния, транспорта кислорода, восстановление активности иммунокомпетентных клеток
Таким образом, применение плазмафереза является эффективным методом лечения у больных АФС и может быть использован как в качестве базовой терапии, так и в комплексе с другими медикаментозными средствами.
Помимо мониторинга гемостазиологических показателей необходим контроль за состоянием фетоплацентарной системы. Особую ценность приобретает ультразвуковая допплерометрия, которая проводится с 24 недель с интервалом 3—4 недели до родоразрешения. Допплерометрия позволяет своевременно диагностировать снижение фетоплацентарного кровотока и служит критерием эффективности проводимой терапии.
Для лечения плацентарной недостаточности у пациенток с АФС используется в/в капельное введение растворов актовегина, инстенона, эссенциале-форте, альвезина, а также пероральный прием троксевазина, эссенциале.
Данные КТГ, информативные с 34 недель беременности, также позволяют оценить состояние плода и способствуют выбору сроков и способов родоразрешения.
В родах необходим тщательный кардиомониторный контроль в связи с наличием хронической внутриутробной гипоксии плода той или иной степени выраженности, а также повышенного риска отслойки нормально расположенной плаценты, развития острой в/у гипоксии плода на фоне хронической.
Желателен контроль гемостазиограммы непосредственно перед родами или в родах для предотвращения кровотечений в III и в раннем послеоперационном периодах.
Особое значение приобретает наблюдение за состоянием родильниц, т.к. именно в послеродовом периоде возрастает риск тромбоэмболических осложнений. Стероидная терапия продолжается в течение двух недель с постепенной отменой. Целесообразно проводить контроль системы гемостаза на 3 и 5 сутки после родов. При выраженной гиперкоагуляции необходим короткий курс гепаринотерапии — 10 дней 10—15 тыс. ЕД в сутки подкожно, назначение аспирина 100 мг в течение месяца.
Родильнице рекомендуется диета с ограничением продуктов, повышающих потенциал свертывания крови и исследование гемостаза 1 раз в 6 мес.
Таким образом, своевременная диагностика, подготовка и рациональное ведение беременности у женщин с АФС с использованием как медикаментозных, так и эфферентных методов терапии уменьшает риск осложнений во время беременности и способствует рождению доношенных жизнеспособных детей.
В.Н. Кулаков, В.Н. Серов, A.M. Абубакирова, Т.А. Федорова
Опубликовал Константин Моканов
Источник
