Антифосфолипидный синдром в акушерстве рекомендации

Статья посвящена особенностям течения антифосфолипидного синдрома у беременных и вариантам терапии
Беременность существенным образом влияет на иммунную систему матери: депрессия клеточного звена иммунитета, повышенная секреция иммуноглобулинов, снижение функции лимфоцитов вследствие экспрессии особых белков PSP (pregnancy-specific proteins). Все эти преобразования направлены на выживание плода. Процессы изменения цитокинового профиля Т-хелперов 2 типа являются доминирующими в поддержании «иммунотолерантности» при беременности и могут влиять на различные аутоиммунные заболевания. Существует ряд феноменов, с помощью которых можно увидеть влияние ревматической патологии на беременность, и наоборот. Процессы эти носят разнонаправленный характер: с одной стороны, может отмечаться как дебют системного аутоиммунного заболевания (САЗ), так и обострение существующей патологии (например, вспышка люпус-нефрита), с другой стороны, описаны многочисленные случаи ремиссии, индуцированной беременностью, у пациенток с ревматоидным артритом. Кроме того, аутоиммунная дисфункция, характерная для САЗ, наличие антифосфолипидных антител (АФА) могут привести к повышению риска выкидыша, гибели плода и преэклампсии. Трансплацентарный транспорт патологических макромолекул, особенно анти-Ro/La или SS-A, SS-B антител, напрямую влияет на плод и повышает вероятность развития неонатальной волчанки. Наконец, высокая иммуновоспалительная активность, поражение внутренних органов в рамках САЗ могут оказать существенное влияние на показатели материнской и фетальной смертности.
Беременность вызывает множество физиологических изменений в организме матери помимо дисфункции иммунной системы. Так, отмечается значительное увеличение объема циркулирующей крови (до 40–45%), что может усугубить течение заболеваний почек или сердечно-сосудистой системы. Скорость клубочковой фильтрации (СКФ) увеличивается примерно на 50% при нормальном течении беременности, поэтому у пациентки с предшествующей протеинурией почти наверняка будет отмечаться некоторое увеличение количества белка в моче. В результате изменений коагуляционного звена гемостаза, активности тромбоцитов, фибринолиза, венозного стаза, компрессии сосудов беременной маткой, вынужденного постельного режима повышается вероятность тромботических осложнений. Отмечаются отек и кровоточивость десен, желудочно-пищеводный рефлюкс, значительные потери костной массы из-за беременности, лактации, а также возможного применения глюкокортикостероидов (ГКС). Таким образом, даже нормальная беременность может усугубить течение САЗ.
Физиологические или патологические изменения, в т. ч. вызванная беременностью гипертензия, могут также имитировать активность САЗ, что представляет собой определенные трудности при проведении дифференциального диагноза. Например, покраснение или гиперпигментацию лица легко спутать с центробежной скуловой сыпью по типу «бабочки». Ладонная эритема у беременных может выглядеть, как кожный васкулит. Физиологический лейкоцитоз, анемия и низкий уровень тромбоцитов вследствие гемодилюции, распространенной у беременных, могут имитировать гематологические проявления САЗ. В результате повышения уровня фибриногена, анемии может отмечаться ускорение скорости оседания эритроцитов, и данный параметр не может быть объективным маркером активности заболевания. Многие женщины предъявляют жалобы на диффузные артралгии, боли в мышцах и костях, особенно во время первой беременности. Гипертензия, протеинурия, почечная недостаточность и отеки, связанные с гестозом, могут имитировать различные заболевания или их обострение, включая волчаночный нефрит, острую склеродермическую нефропатию, рецидив васкулита, некротизирующего гломерулонефрита. HELLP-синдром – вариант преэклампсии, характеризующийся низким количеством тромбоцитов, повышенным уровнем печеночных ферментов, гемолизом, болью в животе, может имитировать системную красную волчанку (СКВ) или обострение системного васкулита. Наконец, эклампсию, которая включает в себя судорожный синдром или нарушение мозгового кровообращения, можно спутать с поражением центральной нервной системы при СКВ или нейроваскулитом.
Антифосфолипидный синдром
В начале 1950-х гг. антифосфолипидный синдром (АФС) был описан как вариант СКВ или волчаночноподобного синдрома. Однако очень скоро было установлено, что связь между гиперпродукцией АФА и тромботическими нарушениями наблюдается в отсутствие достоверных клинических и серологических признаков СКВ или какого-либо другого ведущего заболевания. Для определения этой новой нозологической формы был предложен термин «первичный антифосфолипидный синдром».
Разработка методов радиоиммунологического (1983) и иммуноферментного анализа для определения антител к кардиолипину способствовала расширению исследований, касающихся роли АФА при заболеваниях человека. Оказалось, что эти антитела являются серологическим маркером своеобразного симптомокомплекса, включающего венозные и/или артериальные тромбозы, различные формы акушерской патологии (в первую очередь привычное невынашивание беременности), тромбоцитопению, а также другие разнообразные неврологические, кожные, сердечно-сосудистые, гематологические нарушения. В 1986 г. G. Hughes et al. предложили обозначать этот симптомокомплекс как АФС. В 1994 г. на VI международном симпозиуме, посвященном изучению АФА, было предложено называть АФС синдромом Hughes – по имени английского ревматолога, впервые описавшего его и внесшего наибольший вклад в разработку этой проблемы.
В 2006 г. в Сиднее произошел последний пересмотр критериев этого заболевания. Несколько изменена была трактовка клинических проявлений, в лабораторные критерии добавлены антитела к бета-2 гликопротеину I (АБ2ГП) (табл. 1). На основе австралийских критериев в настоящее время строится практическая диагностика АФС.
![Таблица 1. Дополненные критерии антифосфолипидного синдрома (Сидней, 2006) [1] Таблица 1. Дополненные критерии антифосфолипидного синдрома (Сидней, 2006) [1]](https://www.rmj.ru/upload/medialibrary/f85/f85acd6d40c7dfd5904308d4df8c6b29.png)
Клинический спектр проявлений, которые связывают с АФС, достаточно широк: мигрень, артриты/артралгии, легочная гипертензия, livedo reticularis, язвы ног и др. Хотя большинство из них не были включены в итоговые критерии диагностики АФС от 2006 г., место этих феноменов активно обсуждается в литературе.
Потеря беременности является частым осложнением АФС в акушерской практике, кроме того, обращает на себя внимание тот факт, что преэклампсия и эклампсия часто встречаются при сочетании АФС и СКВ. HELLP-синдром в сочетании с циркуляцией АКЛА протекает тяжелее и часто встречается во II, а не III триместре. Риск развития инфаркта печени у пациентов с HELLP-синдромом, ассоциированным с АКЛА, увеличивается в 30 раз по сравнению с таковым при серонегативном варианте HELLP-синдрома [2]. Кроме того, при АФС часто развиваются другие множественные тромботические осложнения, которые требуют более агрессивного лечения, чем у пациентов с традиционным течением HELLP-синдрома. Сама по себе беременность является фактором риска развития гиперкоагуляции, и при появлении АФС вероятность тромбозов у матери существенно увеличивается. В редких случаях во время беременности может формироваться катастрофический АФС: в проанализированных работах было выявлено 15 случаев, характерной особенностью которых явился тот факт, что почти половина пациенток до этого имела в анамнезе латентно протекающий АФС [3]. Пациентки могут иметь и другие гематологические осложнения АФС, такие как выраженная тромбоцитопения во II и III триместрах беременности.
Наиболее распространенными нежелательными явлениями, связанными с АФС у беременных, являются преждевременные роды и задержка внутриутробного развития. Преждевременные роды наиболее часто встречаются у пациенток, у которых есть сочетание АФС и СКВ, а заболеваемость колеблется от 10 до 40%. В одном исследовании авторы попытались определить причины неблагоприятных неонатальных исходов (преждевременные роды, задержка внутриутробного развития, низкая оценка по шкале Апгар). Такими факторами явились присутствие ВАК, АКЛА, АБ2ГП антител, наличие в анамнезе сосудистых тромбозов перед беременностью. При отсутствии этих факторов (даже при наличии предшествующего отягощенного акушерского анамнеза) отмечался более благоприятный неонатальный исход [4].
В редких случаях у плода или новорожденного формируются тромбозы вследствие трансплацентарного транспорта АФА. В таких случаях речь может идти о наличии неонатального АФС [5]. Риск тромбозов в данной когорте пациентов уменьшается вместе со снижением концентрации материнских АФА, однако в дальнейшем отмечаются затруднение обучаемости, снижение памяти и других когнитивных функций. В настоящее время существуют регистры (European registry to babies born to mothers with antiphospholipid syndromе) по наблюдению за отдаленными нейропсихическими последствиями неонатального АФС [6].
ВАК, по-видимому, является наиболее важным фактором риска неблагоприятного исхода беременности, в т. ч. ее потери. В настоящее время способы определения концентрации ВАК являются нестандартизованными в отличие от тестов, связанных с определением антикардиолипинов и бета-2 гликопротеина I. В настоящее время завершается многоцентровое проспективное наблюдательное исследование PROMISSE, основная цель которого – наблюдение за АФС-позитивными и СКВ-ассоциированными беременными женщинами. Недавний анализ промежуточных данных установил, что только уровень ВАК является единственным лабораторным маркером АФС, связанным с такими неблагоприятными исходами беременности, как интранатальная гибель плода, задержка внутриутробного развития и преждевременные роды [7]. С другой стороны, появляются данные о том, что только совокупность ВАК, АКЛА и АБ2ГП у конкретной пациентки является предиктором интранатальной гибели плода [8]. Эта информация несколько обнадеживает тех пациенток, которые имеют низкий или умеренный титр АКЛА, АБ2ГП. Для своевременной оценки риска тромбозов у пациенток с АФС необходимо проводить тщательный скрининг на наличие маркеров наследственной тромбофилии (гены фибринолиза: PAI-I, PLAT; гены тромбоцитарных рецепторов: ITGA2, ITGB3, Gplba; гены системы свертывания крови: Fl, F2, F5, F7), наличие гипергомоцистеинемии [8–10]. В последнее время появляются данные о взаимосвязи изменения уровня комплемента в сыворотке во время беременности и неблагоприятных исходов. Интерпретация этого феномена представляется весьма затруднительной: при эклампсии и первичном АФС возможно повышение титра, а при СКВ и вторичном АФС – гипокомплементемия. Комплемент является важным прогностическим фактором неблагоприятного исхода беременности и смертности в мышиной модели АФС [11], представляется вероятным, что активация системы комплемента играет такую же негативную роль и в человеческой популяции.
Рекомендации по ведению беременных женщин с АФС
Своевременное становление лечения акушерского АФС относится к 1980–1985 гг., когда пациентки с наличием АКЛА, ВАК и акушерскими неудачами стали получать ГКС (преднизолон) и ацетилсалициловую кислоту (АСК) в небольших дозах. Более того, дозу ГКС постепенно увеличивали вплоть до достижения ВАК или другими маркерами АФС приемлемых уровней. В 1990-х гг. исследования показали, что низкие дозы гепарина в сочетании с малыми дозами АСК оказались столь же эффективными, как ГКС, но с гораздо меньшим количеством побочных эффектов. На сегодняшний момент комбинация антитромбоцитарных препаратов и прямых антикоагулянтов является стандартной: дозировка низкомолекулярного гепарина (НМГ) обычно – 40 мг эноксапарина ежедневно, некоторые специалисты используют 30 мг 2 р./сут, доза для нефракционированного гепарина (НФГ) обычно – 5000 ЕД 2 р./сут [12].
Исследования показывают, что сочетание низких доз гепарина и низких доз АСК более эффективно, чем монотерапия АСК [13], с успешностью около 75% против 40%. Не получено принципиальных отличий между малыми и высокими дозами антикоагулянтов, а также НФГ и НМГ гепарина [14, 15]. Такой вид терапии относится к первой линии и является наиболее эффективным в плане профилактики потери беременности на ранних сроках [16].
Терапия второй линии включает в себя применение внутривенного человеческого иммуноглобулина (ВВИГ). Некоторые эксперты на этом этапе рекомендуют увеличение дозы гепарина до общетерапевтических доз. В единственном контролируемом исследовании с использованием ВВИГ не было получено достоверного улучшения исходов беременности. Однако существует значительное количество неконтролируемых исследований, опубликованных клинических случаев с блестящим эффектом при комбинированном применении ВВИГ, низких доз АСК и НМГ. При дальнейшем повышении уровня АКЛА, ВАК с успехом может применяться плазмаферез. Наиболее перспективными методами лечения АФС в будущем являются ингибирование комплемента [11], а также применение средств генно-инженерной биологической терапии [17].
Лечение средними/высокими дозами ГКС в настоящее время практически не применяется из-за отсутствия доказательств их эффективности и негативного воздействия на организм как матери, так и плода. Применение ГКС оправданно, только если АФС развивается на фоне какого-то заболевания (СКВ, болезни Шегрена и др.). Использование ГКС в этих случаях направлено на лечение не АФС, а основного заболевания.
В послеродовом периоде антикоагулянтная терапия должна быть продолжена на срок от 6 до 8 нед. даже у пациенток без тромбозов в анамнезе.
Тактика ведения беременных с АФС, режим дозирования во многом зависят от предшествующего анамнеза (наличия/отсутствия неплацентарных тромбозов, количества спонтанных абортов, предшествующей терапии). В связи с этим можно выделить следующие подгруппы:
1. Пациентки только с серологическими маркерами АФС (без предшествующей беременности, с одним эпизодом необъяснимого спонтанного аборта до 10 нед. гестации), без тромбозов в анамнезе.
Тактика ведения этой категории женщин заключается в применении малых доз АСК, которая назначается на весь период беременности и в течение 6 мес. после родоразрешения.
При наличии у беременных высокопозитивных АКЛА (более 65 ЕД GPL) целесообразно назначение НМГ. Риск развития тромботических осложнений высок не только во время беременности, но и в послеродовом периоде (в течение 6 мес. после родов). При родоразрешении естественным путем целесообразно возобновление лечения НМГ в послеродовом периоде. В случае проведения кесарева сечения введение НМГ отменяется за 2—3 дня и возобновляется в послеродовом периоде с последующим переходом на прием непрямых антикоагулянтов.
2. Пациентки с АФС без неплацентарных тромбозов в анамнезе и женщины с серологическими маркерами АФС и двумя или более необъяснимыми спонтанными абортами (до 10 нед. гестации) в анамнезе.
Тактика ведения данной категории беременных заключается в сочетанном применении малых доз АСК (50–150 мг/сут) с момента зачатия до родоразрешения и НФГ (эноксапарина и др.) или НФГ (5000–10 000 ЕД каждые 12 ч) с момента документированной беременности и до родов. Через 12 ч после родов необходимо возобновить лечение НМГ, НФГ (или варфарином).
Длительная терапия гепарином у беременных женщин может приводить к развитию остеопороза. Вследствие этого все беременные, получающие гепаринотерапию, обязательно должны принимать препараты кальция (1500 мг/сут) и витамина D3 (не менее 1000 МЕ/сут).
3. Пациентки с АФС и неплацентарными тромбозами в анамнезе (получавшие варфарин до беременности).
Необходимо до 6 нед. беременности отменить варфарин. В последующем беременная принимает АСК в низких дозах в сочетании с НФГ.
4. При неэффективности стандартной терапии в период следующей беременности применяют иммуноглобулин в/в 0,4 г/кг в течение 5 сут каждый месяц беременности.
Источник
Антифосфолипидный синдром в акушерстве. Это выступление врача ЦИР, Печёриной Екатерины Юрьевны, на IV Всероссийской конференции “Репродуктивное здоровье женщин и мужчин”.
Доклад называется “Антифосфолипидный синдром в акушерской практике”. В этом докладе Екатерина Юрьевна очень подробно рассказывает про диагностику, клинические проявления и про помощь беременным женщинам при наличии у них антифосфолипидного синдрома.
Доброе утро, коллеги! Прекрасное воскресное утро, радостно всех видеть здесь! Сегодня мы поговорим об антифосфолипидном синдроме. В какой-то степени я продолжу то, о чем рассказывал Игорь Иванович. Но остановлюсь на несколько других аспектах, в том числе, лабораторных.
Антифосфолипидный синдром (АФС) – это заболевание аутоиммунное, которое связано с двумя направлениями. Это – клинические факторы и лабораторные признаки. АФС очень четко описан. К клиническим факторам антифосфолипидного синдрома относятся патологии беременности и тромбозы, каждый из которых четко регламентирован и описан в критериях антифосфолипидного синдрома.
К лабораторным признакам антифосфолипидного синдрома относится обнаружение одного из трех компонентов: это волчаночный антикоагулянт, антикардиолипиновые антитела и антитела к β2-гликопротеину 1. Причем, для того чтобы поставить диагноз антифосфолипидного синдрома, достаточно определить всего один показатель, но обязательно 2 раза. То есть для того, чтобы исключить какое-то транзиторное появление этих антител под влиянием инфекционных процессов, аутоиммунных процессов, необходимо проводить повторные исследования через 12 недель.
Антифосфолипидные антитела, которые служат для диагностики антифосфолипидного синдрома очень часто встречаются вместе, но, как я уже сказала, достаточно одного критерия. Мы часто видим сочетание волчаночного антикоагулянта и антикардиолипинов, волчаночного антикоагулянта и антител к β2-гликопротеину 1. При этом при всем важно определять действительно полную панель этих антител, потому что, чем больше антител в данном организме женщины, тем более высокие риски. То есть тройная позитивность имеет гораздо более высокие риски, чем двойная и чем монопозитивность. Иммуноглобулины IgG гораздо более активны, нежели иммуноглобулины IgМ и иммуноглобулины IgА, которые пока вообще не включены в критерии. Иммуноглобулины IgА рекомендуется исследовать в том случае, если клиническое подозрение на антифосфолипидный синдром очень велико, а других иммуноглобулинов не обнаружено.
У 2% здорового населения антифосфолипидные антитела есть, но нет клинической картины. И очень часто антитела имеют транзиторный характер, именно поэтому для подтверждения диагноза рекомендуется определять их повторно через 12 недель.

Помимо тех антител, которые перечислены в критериях антифосфолипидного синдрома так же определяются и могут быть определены антитела к другим фосфолипидам: к фосфатидилсерину, к фосфатидилэтаноламину и другим. И антитела к кофакторам антифосфолипидного синдрома, антитела к тем белкам, которые связываются с фосфолипидами. Это, в первую очередь, β2-гликопротеин 1 (GPBB1), это антитела к аннексину V, антитела к протромбину, к протеину С, к протеину S и другим кофакторам.
Когда-то, когда только назвали антитела к фосфолипидам, еще не было того понимания, что основной действующий агент – это не сам по себе фосфолипид, а комплекс фосфолипида и белка, который является неоэпитопом для действия вот этих антител. И вся дальнейшая картина связана с взаимодействием антител (комплексом фосфолипида и белка).

Антифосфолипидный синдром на данный момент является, скажем так, одной нозологической единицей, но всегда выделяется отдельно сосудистый антифосфолипидный синдром и акушерский антифосфолипидный синдром. Это связано с тем, что их развитие, факторы риска, проявления – разные.
Если в сосудистом антифосфолипидном синдроме основным фактором является тромбоз, то в акушерском основную роль играют совершенно другие механизмы.
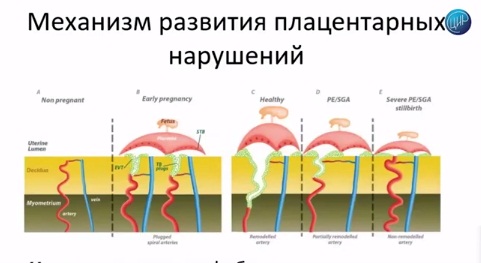
Итак, какие же механизмы, в первую очередь, обуславливают развитие антифосфолипидного синдрома в акушерстве?
Место действия – плацента и плацентарные нарушения, которые развиваются и обуславливают всю дальнейшую картину во втором и третьем триместре, с грозными осложнениями беременности. Всё закладывается на самых ранних сроках беременности. Вот вторая картинка, там очень четко это показано.
На раннем сроке беременности происходит инвазия трофобласта. Клетки трофобласта замещают мышечный слой артерии, происходит ремоделирование спиральных артерий: они становятся широкими, через них хорошо протекает кровь, плацентарное кровообращение хорошее. Эти сосуды не отзываются на сосудистые факторы, которые могут регулировать давление в остальных сосудах, и беременность протекает хорошо: плацентарных осложнений нет.
При развитии осложнений нарушается инвазия трофобласта, нарушается ремоделирование спиральных артерий, нарушается кровоток и развивается вся остальная клиническая картина. Можно видеть: последние 2 картинки – преэклампсия и рождение детей с малым весом; последняя картинка – это уже тяжелая преэклампсия, мертворождение. Значительно сосуд отличается от того, который мы видим при здоровой беременности. Они узкие, они реагируют на все материнские факторы, которые изменяют давление, и развивается плацентарная недостаточность.
Важно, что всё это закладывается в первом триместре беременности. Но в первом триместре этого еще клинически не видно. Всё будет видно в третьем триместре беременности, когда компенсаторных возможностей будет недостаточно.
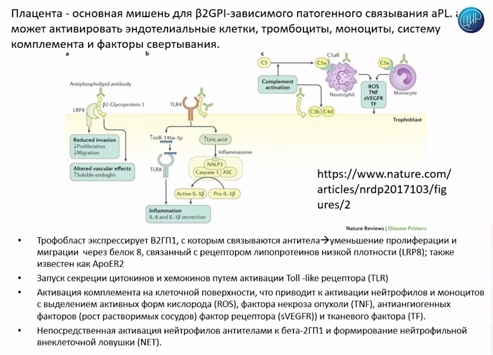
Очень важное отличие антифосфолипидного синдрома при беременности от сосудистого в том, что при беременности появляется новый орган, на котором огромное количество β2-гликопротеина 1, с которым могут связываться антитела. И они все устремляются туда, и именно там антитела связываются с β2-гликопротеином и фосфолипидами. Там активируются эндотелиальные клетки, тромбоциты, моноциты; активируется система комплемента, активируются факторы свертывания. И там разворачивается такое огромное поле действия. Частично оно описано на этой схеме. Мы видим, как антифосфолипидные антитела связываются с комплексом бета-2-гликопротеина и активируя те или иные факторы, в частности – LPR8, Toll-like рецепторы (TLR), активируя комплемент, вызывают те изменения, которые в дальнейшем будут нарушать плацентарную функцию. Через этот механизм нарушается инвазия, нарушается миграция, нарушается соотношение ангиогенных и антиангиогенных факторов. Через Toll-like рецепторы (TLR) активируются цитокины, хемокины и развивается воспалительная реакция.
Крайне важное действие (о чем уже говорил Игорь Иванович) – это активация комплемента; активация нейтрофилов, моноцитов; мощнейший выброс различных агентов – это и фактор некроза опухоли, и активные радикалы кислорода, и тканевый фактор, который сразу активирует свертывание крови. Антитела, сами по себе, могут просто активировать клетки. В частности, активируя нейтрофилы, они вынуждают нейтрофилы выбрасывать свои нейтрофильные внеклеточные ловушки и усиливать всю эту реакцию.

Волчаночный антикоагулянт – это первое, что определяется при подозрении на антифосфолипидный синдром. Представляет собой смесь аутоантител. Определяется он пролонгацией фосфолипид – зависимого свертывания крови. Именно поэтому его назвали когда-то антикоагулянтом, потому что оказалось, что его добавление удлиняет время свертывания крови. Это происходит потому, что эти антитела блокируют один этап свертывания крови, но на самом деле, вызывают не гипокоагуляцию, а тромбоз.

Так как это очень гетерогенная группа антител, и нет одного анализа, который можно выполнить и сразу получить ответ – есть волчаночный антикоагулянт или его нет, то для того, чтобы это выяснить, определяется серия анализов. Сначала делается скрининговый тест. Первый тест, например, с разведенным ядом гадюки Рассела. Если он оказывается отрицательным, проводится второй скрининговый тест, чтобы убедиться, что волчаночного антикоагулянта уж точно нет. Это – АЧТВ, чувствительный к волчаночному антикоагулянту. Если один из тестов оказывается положительным, проводится подтверждающий тест. Если один из тестов оказался положительным, обязательно проводится миксинг – тест.
Дело в том, что все тесты на определение волчаночного антикоагулянта являются так называемыми клоттинговыми тестами. То есть мы добавляем какой-то реагент в пробирку и наблюдаем за тем, как образуется в этой пробирке сгусток крови. На образование этого сгустка могут влиять многие факторы. Например – дефицит фактора свертывания крови. Если факторов свертывания крови мало, сгусток будет образовываться так же долго, как и в случае присутствия волчаночного антикоагулянта. Поэтому мы добавляем туда обычную нормальную плазму, в которой много факторов свертывания крови, и если кровь начинает свертываться нормально, то, значит, дело не в волчаночном антикоагулянте.
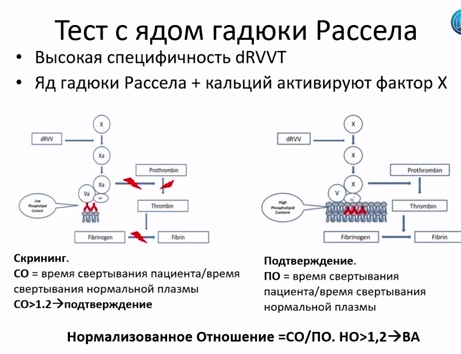
Здесь, как раз, приведен пример: в исходном тесте у нас мало фосфолипидов, видите? Они связаны с волчаночным антикоагулянтом. Поэтому свертывание крови происходить не может: нет фосфолипидов для образования протромбиназного комплекса.
Во втором случае мы добавили много фосфолипидов, и свертывание крови может происходить дальше.

Для того, чтобы определить волчаночный антикоагулянт, нужно соблюдать очень много правил: медсестра должна знать, как брать кровь и в какую пробирку; ее должны правильно обработать, там есть двойное центрифугирование; кровь должна после этого правильно храниться, если сразу не исследуется, то замораживается. Клиницист должен очень хорошо знать и понимать, когда можно применять какие препараты, и когда можно проводить обследование на волчаночный антикоагулянт, с точки зрения тех препаратов, которые принимают пациенты. Поэтому определение волчаночного антикоагулянта в остром периоде тромбоза не проводится, потому что пациент применяет терапию. Однако, антитела проводить можно. Антитела определяют совершенно другим методом, и исследование антител проводить можно, независимо от применяемой антикоагулянтной терапии.

Мы называли ранее «некритериальные» так называемые антитела, о которых сейчас очень много пишут, очень много говорят. Постепенно они, я думаю, будут дополнять критерии антифосфолипидного синдрома. Их определение рекомендуется и имеет значение в следующих случаях:
Во-первых, они сами по себе могут вызывать определенные изменения, которые ведут к проявлениям антифосфолипидного синдрома.
Во-вторых, они могут помогать в оценке степени тяжести течения антифосфолипидного синдрома: использоваться для диагностики серонегативного АФС, когда других антител нет, а мы очень предполагаем, что синдром присутствует.
Эти антитела присутствуют в некоторых шкалах риска, которые используются для оценки антифосфолипидного синдрома. Например, вот здесь анти-протромбин/фосфатидилсерин комплекс дает целых 3 балла; анти-β2-гликопротеина 4 балла, антикардиолипин антитела – 5. Шкала – одна из самых известных шкал по диагностике антифосфолипидного синдрома GAPSS.

Один из важных факторов, на который мы проводим обследования, это – аннексин V. В 1988 году он был назван «плацентарным антикоагулянтом» за счет того, что он оказывает активное антикоагулянтное действие, образуя на поверхности вот такой «аннексин – щит», за счет которого к фосфолипидам не поступают факторы свертывания.
Что делают антитела? Они этот щит разрушают, в нем образуются «дырки», и факторы свертывания могут проникать и связываться с фосфолипидами, тем самым активировать свертывание. То есть, антитела к аннексину активируют вот эту прокоагулянтную активность эндотелиальных клеток.
Вторые антитела – это антитела к протромбину. В статьях и в лабораторной диагностике чаще используется термин «антитела к фосфатидилсерин протромбиновому комплексу». Этот независимый фактор риска антифосфолипидного синдрома встречается примерно у 13% в группе с акушерскими осложнениями. Сам по себе, независимо от других антител, связан с неблагоприятными исходами: с тромбозами и с акушерской патологией.

Но обследовать пациента на весь этот список антител, каждый из которых может быть определен отдельно: антитела иммуноглобулина IgG, антитела иммуноглобулина IgМ, IgА, к кардиолипину, к фосфатидилсерину –это можно с делать огромную «простыню», при этом антитела достаточно редко встречаются, обследование будет очень дорогим. И для скрининга это не всегда подходит. Поэтому возможная тактика – использование так называемых скрининг – методов. Я привела здесь те, которые совершенно точно доступны в Российской Федерации. Это – антифосфолипид – скрининг, в который включен фосфатидилсерин, фосфатидиловая кислота, или к 8 различным антигенам.

Это то, что касается, непосредственно, диагностики антифосфолипидного синдрома. Однако, во время беременности этого недостаточно. Необходимо проводить дополнительные исследования. Одно из самых важных исследований, которое проводится, в частности и в нашей лаборатории, это оценка уровня плацентарного фактора роста. Уже на ранних сроках беременности мы можем увидеть, как меняется плацентарный фактор роста у женщин в группе с серьезными осложнениями второй половины беременности. Что происходит?
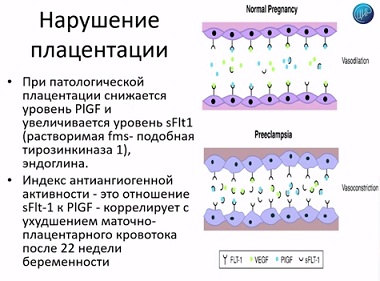
Здесь видно – нормальная беременность, практически все рецепторы заняты. А в случае с патологической беременностью факторы роста связаны с растворенными в крови рецепторами. Они не действуют. Действуют только те, которые зафиксированы. Растворенные – не действуют. Поэтому, факторы роста, в данной ситуации, перестают действовать. Плацентация может быть нарушена. И в первом триместре беременности, определяя плацентарные факторы роста, мы можем предположить эти осложнения во второй половине беременности.
Чуть позже, уже со второго триместра, можно определять индекс антиангиогенной активности соотношения sFIt-1 иплацентарного фактора роста, который коррелирует с дальнейшим нарушением маточно – плацентарного кровотока и другими осложнениями.

Вот так выглядит примерная схема того обследования, которое можно использовать в случаях проблем с течением беременности, в частности при антифосфолипидном синдроме.
Первый триместр: расширенный пренатальный скрининг, ультразвуковое исследование, измерение артериального давления.
Во втором триместре: также расширенное исследование и наблюдение за теми факторами, которые могут свидетельствовать о развитии осложнений. Очень важно наблюдать за тем, как растет и развивается плод; каждый визит беременной, каждое ультразвуковое исследование фиксировать, для того чтобы наблюдать, нет ли отставания развития плода во время этой беременности.

И, конечно, необходимо учитывать все остальные факторы риска, которые могут сопровождать беременную женщину с антифосфолипидным синдромом, потому что каждый дополнительный маркер усиливает и усугубляет эту ситуацию. В частности, исключить системную красную волчанку, оценить предшествующие тромбозы, оценить полиморфизм генов гемостаза сосудистого тонуса и, возможно, остановиться на том, как ведет себя комплемент: нет ли гипокомплементемии, нет ли активации
комплемента во время беременности, для того чтобы оценит эти риски. 
Основное лечение антифосфолипидного синдрома – низкодозированный аспирин и препараты гепарина. Очень важно, чтобы пациентка тщательно соблюдала прием – вот, как доктор назначил, так пациентка и должна принимать. Тогда успех очень
значительный: при антифосфолипидном синдроме почти 85% женщин будут иметь проблемы, но 85-ти % женщин мы сможем помочь, если они будут использовать наши назначения правильно. И гепарин, и аспирин оказывают множественный эффект. Гепарин – это не просто антикоагулянт. Он влияет, практически на все факторы, которые мы рассмотрели ранее. И еще один препарат, который уже называл сегодня Игорь Иванович – Плаквенил, который также активно включается сейчас в терапию при антифосфолипидном синдроме.
Спасибо за внимание, коллеги.
Источник
