Аутовоспалительный синдром у ребенка время излечения
, ,
АУТОВОСПАЛИТЕЛЬНЫЕ СИНДРОМЫ – «НОВАЯ» МУЛЬТИДИСЦИПЛИНАРНАЯ ПРОБЛЕМА ПЕДИАТРИИ И РЕВМАТОЛОГИИ.
ФГБУ «НИИР» РАМН (ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ «НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ РЕВМАТОЛОГИИ» РАМН), Москва
В последние годы в клинической практике и в различных публикациях нередко приходится сталкиваться с так называемыми аутовоспалительными заболеваниями, относящимися к редко встречающимся и являющихся сложными для диагностики и лечения. Аутовоспалительные заболевания/ синдромы человека (Human Autoinflammatory Disease) – АВС/HAIDS – гетерогенная группа редких генетически детерминированных, наследственно обусловленных состояний, характеризующихся периодическими приступами воспаления и манифестирующихся лихорадкой и клинической симптоматикой, имитирующей ревматическую при отсутствии аутоиммунных или инфекционных причин [P. Fietta 2004] [1].
Проблема АВС вызывает большой интерес у исследователей всего мира, она часто обсуждается на международных форумах, конференциях и уже нашла широкое освещение в литературе, преимущественно зарубежной [1,2,3,4]. На прошедшем в сентябре 2011 года в Бельгии XVIII Европейском педиатрическом конгрессе ревматологов также детально обсуждались вопросы, касающиеся АВС у детей.
Распознавание этих синдромов представляет большие диагностические трудности, с которыми может в реальной клинической практике столкнуться педиатр, ревматолог и врачи других специальностей, в силу чего они должны располагать сведениями об этой патологии.
Список болезней группы АВС за время их изучения постоянно расширялся и обновляется до настоящего времени. Имеется несколько вариантов классификации АВС, один из них представлен в табл. 1 [1].
Согласно проекту EUROFEVER, созданному группой исследователей в 2002 году в рамках педиатрического ревматологического европейского сообщества (PRеS)/PRINTO к числу этих заболеваний добавлены еще ряд состояний таких как CINCA/NOMID синдром, хронический рецидивирующий мультифокальный остеомиелит (CMRO), DIRA и другие (табл.2). Одним из важных результатов деятельности EUROFEVER проекта стало создание международного регистра пациентов с АВС, основной целью которого является накопление информации о пациентах, клинических проявлениях, исходах и терапии, обеспечение доступности информации для врачей и пациентов [5]. В целом к 2011 году в регистр были включены 1970 пациентов из 32 стран, в том числе 20 из России [6].
Установлено, что АВС чаще всего дебютируют в детском возрасте, иногда на первом году жизни и являются поэтому, главным образом, педиатрической проблемой. В то же время, эти заболевания могут начинаться и у взрослых, или, дебютируя у детей, сопровождать больного на протяжении многих лет жизни. Большинство синдромов из указанной группы (семейная средиземноморская лихорадка, синдром гипер – IgD, синдром PFAPA, синдром СINCA и др.) относятся к редкой патологии, в силу чего рассматривались нами ранее при изучении лихорадки неясного генеза (ЛНГ) как редкие ревматические заболевания [7]. Эта “редкость” во многом обусловлена трудностью диагностики и недостаточным знанием указанных заболеваний педиатрами. Между тем как реальный шанс встретить пациента с подобной патологией есть у каждого врача.
Ведущий признак АВС – рецидивирующий лихорадочный синдром, являющийся интригующей и загадочной проблемой, волнующей умы исследователей не одно поколение. Именно он представляет сложную дифференциально-диагностическую задачу даже для опытного клинициста и нередко для своего решения требует мультидисциплинарного подхода с привлечением специалистов различного профиля. Для верификации диагноза используется разработанный нами ранее для ЛНГ диагностический алгоритм, предусматривающий исключение широкого спектра инфекционных (бактериальных и вирусных) заболеваний, сопровождающихся периодическим лихорадочным синдромом, а также гематоонкологических, ревматических, аутовоспалительных и других патологических состояний.
Общими клинико-лабораторными проявлениями АВС являются также мышечно-артикулярная симптоматика, разнообразный характер сыпи, воспаление серозных оболочек, высокие лабораторные показатели активности воспаления (СОЭ, лейкоциты, фибриноген, SAA), возможное развитие амилоидоза, отсутствие аутоантител или активации аутоспецифических клеток. Причина (для большинства синдромов) – наличие одного мутантного гена, наличие генов – «модификаторов» течения заболевания, мутации которых меняют течение заболевания (утяжеляют или ослабляют). Основное звено патогенеза – гиперактивация естественного (антигеннеспецифического) иммунитета и гиперпродукция острофазовых реактантов – СРБ, сывороточного амилоида А и др. Основной медиатор воспаления – ИЛ-1.
Впервые больного с периодической лихорадкой в научно-медицинской литературе представил английский клиницист У. Геберден в 1802 г [8]. Видимо, это было первое описание пациента с АВС. Однако на него не обратили внимание. Время для изучения данной проблемы тогда еще не пришло. Первое полноценное описание пациентов с семейной средиземноморской лихорадкой было сделано в 1908 г Janeway и Mosenthal, а в 1945 г. S. Siegal [9,10]. Однако и эти публикации не привлекли внимания к проблеме. Истинным началом изучения АВС можно считать 1948г., когда H. A.Reiman охарактеризовал пациентов с периодической лихорадкой, появившейся в детском возрасте и персистировавшей в течение нескольких лет и десятилетий с циклами определённой продолжительности, предложив для выделенной им патологии термин «периодическая болезнь» [11]. Значительный прогресс в изучении аутовоспалительных синдромов произошёл в последнее двадцатилетие ХХ века и был обусловлен стремительным развитием молекулярной биологии и молекулярной медицины, установившим генетическую природу указанных состояний. В 1982 г. был описан TRAPS-синдром, в 1984 г J. W.M. van der Meer гипер IgD-синдром. Список АВС был увеличен до 4 и стал включать в себя кроме семейной средиземноморской лихорадки, гипер-IgD –синдром (Hyper-Immunoglobulinemia D – syndrome – HIDS), синдром периодической лихорадки, ассоциированный с рецепторами к фактору некроза опухоли (Tumor necrosis factor Receptor-Assotiated Periodic fever Syndrome –TRAPS), и синдром Макл-Уэлса (Makle –Wells syndrome –MWS). В последующем список болезней этой группы периодически расширялся и к настоящему времени включает перечисленные выше состояния. Окончательно принятой классификации АВС нет. В настоящее время всё чаще высказывается гипотеза, что к аутовоспалительным по своей природе заболеваниям могут быть отнесены такие хорошо известные нозологии ревматологической рубрики как подагра, системная форма ювенильного артрита, болезнь Стилла у взрослых, а также синдром Висслера-Фанкони.
В данном обзоре представлены наиболее часто встречающиеся АВС, с которыми в любой момент могут столкнуться как врачи общей практики, так и узкие специалисты.
Семейная средиземноморская лихорадка (Familial Mediterranean Fever –FMF).
Исторически первой из АВС была описана семейная средиземноморская лихорадка – Familial Mediterranean Fever (FMF). FMF является самым распространённым из АВС. В мире этим синдромом страдают более 100000 пациентов. Заболевание встречается в определённых этнических группах, относящихся к народам средиземноморского бассейна. Наиболее подвержены заболеванию представители 4 этнических групп: евреев-сефардов, арабов, турок, армян [1,2]. По данным различных авторов, в основе болезни лежат мутации генов, наиболее распространёнными среди которых являются M694V и V726A и, несколько реже М680I [12,13,14,15]. Дебют заболевания у почти 75-89% пациентов с FMF относится к возрасту до 20 лет [1,2]. В табл. 3 указаны ведущие клинические проявления FMF, кроме того возможно выявление гепатоспленомегалии, затяжной фебрильной миалгии, различных нарушений со стороны сердечно-сосудистой системы, разнообразных неврологических и психоневрологических проявлений. Во время атаки заболевания у пациентов отмечается повышение острофазовах реактантов: СОЭ, сывороточных концентраций СРБ, SAA, гаптоглобина, лейкоцитоз с нейтрофилёзом, которые у 2/3 больных повышены и вне атак [1,2,3].
Основным осложнением FMF является АА-амилоидоз с преимущественным поражением почек, что и являлось в до колхициновую эру ведущей причиной гибели этих больных. Может также развиваться амилоидоз ЖКТ, печени, селезёнки, редко – сердца, яичек и щитовидной железы. Другим осложнением FMF является спаечная болезнь [2,13,14].
Диагноз FMF ставится на основании сочетания периодически повторяющихся, как правило, через определенные промежутки времени «беспричинных» лихорадочных эпизодов продолжительностью от полудня до 3-х суток, с эпизодами мучительных болей в животе с наличием симптомов раздражения брюшины, возможно, в сочетании с болями в груди и артритами у пациента характерной этнической принадлежности. Важным моментом является значительное повышение уровня острофазовых показателей во время атаки.
Для диагностики наиболее часто используются критерии Тель-Хашомера [16], которые, однако, адаптированы для популяций с высокой частотой встречаемости данного синдрома. Определённым подспорьем может служить молекулярно-генетическое типирование характерных мутаций гена MEFV.
Основой лечения FMF является колхицин. С 1972 г, когда лечение колхицином было внедрено в широкую клиническую практику, прогноз у пациентов с FMF коренным образом изменился в лучшую сторону [15]. Даже в тех случаях, когда колхицин не предотвращает рецидивы симптоматики, он значительно снижает риск развития амилоидоза. Максимальной дозой является 2 мг/сутки. Если эта дозировка не предотвращает развитие атак, её дальнейшая эскалация не имеет смысла [2,17,18]. В качестве симптоматического средства во время атак используются НПВП [2]. С развитием средств биологической терапии в лечении FMF у колхицин-резистентных пациентов с успехом стали использоваться генно-инженерные биологические препараты (ГИБП), блокирующие функции Ил-1 (анакинра) и ФНОα (инфликсимаб) [19].
Криопирин – ассоциированные периодические синдромы
(Cryopyrin Assotiated Periodic Syndromes – CAPS).
Криопирин-ассоциированные периодические синдромы (CAPS) – представляют собой группу редких врожденных аутовоспалительных заболеваний, которая включает в себя: 1. семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/Familial Cold Urticaria –FCAS/FCU); 2. синдром Макл-Уэлса (Muckle-Wells Syndrome – MWS); 3.хронический младенческий нервно-кожно-артикулярный синдром/младенческое мультисистемное воспалительное заболевание (Chronic Infantile Onset Neurologic Cutneous Articular/Neonatal Onset Multisystem Inflammatory Disease – CINCA/NOMID).
| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 |
Источник
Автор Клара Галиева На чтение 3 мин. Опубликовано 16.12.2019 16:26
Обновлено 16.12.2019 16:13
Ученые из Австралии и США определили генетическую причину неизвестного ранее аутовоспалительного заболевания человека. Результаты исследования опубликованы в научном журнале Nature.
Актуальность проблемы
Аутовоспалительные заболевания вызваны неправильной активацией врожденной иммунной системы, что приводит к периодическим эпизодам лихорадки и воспаления, которые могут повредить жизненно важные органы.
Материалы и методы обследования
В исследовании ученые описывают пациентов из трех семей с эпизодической высокой температурой и болезненными увеличенными лимфатическими узлами. Пациенты, у которых было диагностировано новое аутовоспалительное заболевание (синдром CRIA), имели множество других воспалительных симптомов, которые начались в детстве и продолжались в зрелом возрасте.
Результаты научной работы
Исследователи определили, что аутовоспалительное заболевание, которое они назвали синдромом CRIA (устойчивый к расщеплению RIPK1-индуцированный аутовоспалительный процесс), вызвано мутацией в критическом компоненте гибели клеток, называемом RIPK1.
Исследовательскую группу возглавлял автор научной работы Джон Силке (John Silke) из Института медицинских исследований им. Уолтера и Элизы Холл (Walter and Eliza Hall Institute of Medical Research) в Австралии. Ученые выявили новое аутовоспалительное заболевание у человека и связанную с ним мутацию в критической молекуле гибели клеток, которая была причиной болезни. При этом заболевании мутация в RIPK1 приводит к неконтролируемой гибели клеток и воспалению. По словам ученых, первая подсказка, что болезнь была связана с гибелью клеток, крылась в экзомах пациентов — части генома, которая кодирует все белки в организме.
«Мы секвенировали весь экзом каждого пациента и обнаружили уникальные мутации в одной и той же аминокислоте RIPK1 в каждом из трех семей», — объясняет Джон Силке. «Каждая из трех мутаций имеет один и тот же результат — он блокирует расщепление RIPK1 — что показывает, насколько важно расщепление RIPK1 для поддержания нормальной функции клетки».
Связь между мутациями RIPK1 и синдромом CRIA подтвердилась в лабораторных моделях мышей.
«Мы показали, что у мышей с мутациями в том же месте в RIPK1, что и у пациентов с синдромом CRIA, было похожее обострение воспаления», — добавляет Джон Силке.
Потенциал для новых методов лечения
«Понимание молекулярного механизма, с помощью которого синдром CRIA вызывает воспаление, дает возможность разобраться в корне проблемы», — считает Джон Силке.
Ингибиторы RIPK1, которые уже доступны на исследовательской основе, могут обеспечить целенаправленный подход к лечению пациентов. Обнаружение синдрома CRIA также предполагает возможную роль RIPK1 в широком спектре заболеваний человека, таких как колит, артрит и псориаз.
«Мутации в RIPK1 могут приводить как к слишком сильному воспалению, такому как при аутовоспалительных и аутоиммунных заболеваниях, так и к слабому воспалению, что приводит к иммунодефициту. Еще многое предстоит узнать о различных ролях RIPK1 в гибели клеток и о том, как мы можем эффективно нацелиться на RIPK1 для лечения болезней», — заключает Джон Силке.
Авторы другого исследования утверждают, что образцы крови из зоопарка помогают прогнозировать заболевания у людей.
Источник

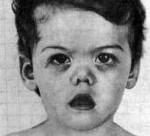
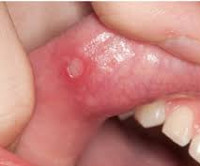
Синдром Маршалла (PFAPA-синдром) – это заболевание преимущественно детского возраста, включающее периодическую лихорадку, афтозный стоматит, фарингит, шейную лимфаденопатию. Симптомами являются регулярно повторяющиеся эпизоды повышения температуры выше 39˚С, боли в горле, язвенные поражение слизистой рта, увеличение шейных лимфоузлов. Диагноз устанавливается на основании клиники, анализов крови, посевов отделяемого из зева, исключения других возможных причин рецидивирующей лихорадки. Лечение ограничено глюкокортикоидами или жаропонижающими препаратами, так как антибиотики и противовирусные средства неэффективны. В редких случаях проводится тонзиллэктомия.
Общие сведения
В 1987 году американским педиатром Г.Маршаллом и соавторами описана ранее неизвестная периодическая лихорадка, которая первоначально была названа синдромом Маршалла. В современных источниках используется название PFAPA-синдром как аббревиатура симптомов, включающих периодическую лихорадку (periodic fever), афтозный стоматит (aphthous stomatitis), фарингит (pharingitis), шейный лимфаденит (cervical adenitis). Распространенность и заболеваемость точно неизвестны. Дебют патологии отмечается в возрасте от 1 до 5 лет и, как правило, к подростковому периоду симптоматика разрешается. В последнее время появились данные о возможности развития PFAPA-синдрома у взрослых. Среди заболевших преобладают мужчины (55-70%).
Синдром Маршалла
Причины синдрома Маршалла
Этиология остается неизвестной. Сегодня PFAPA-синдром рассматривается как полигенное или мультифакториальное заболевание, при котором модифицирующую роль играют генетические, средовые факторы, возможные особенности реагирования организма на инфекцию. У 7-10% пациентов выявляются мутации гена MEFV, который участвует в образовании белка пирина гранулоцитами, моноцитами, дендритными клетками, фибробластами кожи, брюшины и синовиальной оболочки. Его предполагаемая функция состоит в снижении воспалительного ответа путем ингибирования активации и хемотаксиса нейтрофилов. Выявляются мутации TNFRSF1A, МВК, гена, кодирующего белок NLRP3.
Цитокиновый профиль при данной патологии позволяет отметить повышение сывороточных уровней интерлейкина-1β (ИЛ-1β), ТNFα, ИЛ-6, ИЛ12р70, в том числе в период между атаками, что указывает на постоянно текущее субклиническое воспаление. Определенный инфекционный агент не выделен, некоторые исследования указывают на возможное участие вирусов Эпштейна-Барр, простого герпеса 1, 2 типов и цитомегаловируса, а также редких бактериальных агентов: Муcobacterium chelonae (микобактерии хелона), Plasmodium (плазмодии), Borrelia (боррелии), Brucella (бруцеллы). У части исследуемых больных выявляется дефицит витамина D.
Патогенез
Точный патогенез не установлен. Современные исследователи относят PFAPA-синдром к системным аутовоспалительным заболеваниям. Их отличием от аутоиммунных являются генетически обусловленные особенности протекания воспалительной реакции и реагирования иммунитета, а не механизмы синтеза антител и активации Т-лимфоцитов при контакте с антигеном. Наличие мутации гена MEFV ведет к синтезу дефектного пирина, который в норме ослабляет и ингибирует чрезмерную восприимчивость организма, а в измененном виде приводит к дефициту ингибитора хемотаксического фактора С5а, что нарушает функцию контроля процесса воспаления.
Ген NLRP3 кодирует белок криопирин, при его мутации моноциты под влиянием разнообразных триггеров начинают синтезировать огромное количество ИЛ-1β. В норме иммунная система способна защитить себя от избытка данного цитокина. При PFAPA-синдроме эта регуляция нарушена, вследствие чего развивается клиническая картина, так как интерлейкин-1β ответственен не только за гипертермию, но и за повреждение, ремоделирование тканей, повышенный уровень маркеров системного воспаления.
Симптомы синдрома Маршалла
Клиническая картина представляет собой лихорадочные эпизоды, которые повторяются каждые 2-12 недель (средний цикл 28 дней). Температура чаще повышается внезапно, лихорадка достигает высоких цифр (от 40 до 41°C). Иногда за сутки перед повышением температуры появляется общая слабость, астения, снижение аппетита. Затем присоединяется афтозный стоматит, при котором появляются мелкие (до 5 мм) язвенные поражения слизистой полости рта – афты. Фарингит характеризуется болью в горле, гиперемией слизистой глотки. В типичных случаях развивается шейный лимфаденит – лимфоузлы в области шеи увеличиваются, становятся болезненными при пальпации.
В 43-48% наблюдений симптомы возникают все вместе, чаще всего встречается стоматит (55%). Крайне редко пациентов беспокоит головная боль, тошнота, рвота, вздутие живота. На 4-5 сутки температура тела нормализуется, воспалительные явления разрешаются. Интервалы между атаками составляют от 2 до 7 недель. Со временем межприступные промежутки могут удлиняться. Особенностью протекания лихорадки является то, что при температуре 40°C общее самочувствие детей остается относительно удовлетворительным. Между эпизодами восстанавливается аппетит, набирается потерянная масса тела. Рост, общее психоэмоциональное развитие не страдает. Течение заболевания доброкачественное, атаки обычно прекращаются к подростковому возрасту. Описание дебютов синдрома Маршалла во взрослом возрасте делает его актуальным не только для педиатрии.
Осложнения
Осложнений синдрома Маршалла описано не было. Долгосрочных исследований у пациентов не проводилось. Однако на фоне афтозного стоматита, фарингита возможно присоединение вторичной инфекции, что может привести к развитию тонзиллита, заглоточного абсцесса, отита, гнойного медиастинита. Длительно текущий воспалительный процесс повышает риск возникновения амилоидоза. Кроме того, рецидивирующие эпизоды лихорадки оказывают изнуряющее действие, вынуждают ребенка пропускать школьные занятия, могут привести к неуспеваемости.
Диагностика
Для постановки диагноза PFAPA-синдрома используют диагностические критерии, предложенные Маршаллом (1987 г.): регулярно повторяющиеся лихорадки с раннего возраста (начало 2-5 лет); присутствие одного из следующих клинических признаков: афтозный стоматит, шейный лимфаденит, фарингит; полностью бессимптомный интервал между эпизодами лихорадки; нормальное физическое и нервно-психическое развитие ребенка; отсутствие циклической нейтропении. На данный момент нет специфических анализов для установления синдрома Маршалла. Диагностический поиск включает:
- Консультацию педиатра, ревматолога. Производится детальный сбор анамнеза пациента: история течения беременности и родов у матери, наследственность, особенности питания, роста, развития ребенка, перенесенные заболевания, информация о вакцинации, наличие или отсутствие контакта с инфекционными больными. Осматриваются слизистые оболочки щёк, глотки, миндалин; проводится аускультация сердца, легких, измерение АД, пульса; пальпация живота, лимфоузлов.
- Клинико-биохимические анализы. В период лихорадки общий анализ крови выявляет лейкоцитоз с повышением нейтрофилов, ускорение СОЭ. В периоды между приступами все воспалительные параметры нормализуются. Также во время атак повышается уровень С-реактивного белка, печеночные ферменты не изменены. Анализ крови на 25-OH может выявлять дефицит витамина Д3- холекальциферола. IgG, IgA, IgM, IgD, прокальцитонин, антинуклеарные антитела, ревматоидный фактор даже при повышении температуры тела остаются нормальными.
- Дополнительные исследования. Посев отделяемого из верхних дыхательных путей на микрофлору и чувствительность к антибиотикам, посев мочи, крови на стерильность (на высоте лихорадки), рентгенография органов грудной клетки, придаточных пазух носа выполняются для исключения инфекционной природы лихорадки. При синдроме Маршалла патологических изменений при данных исследованиях не выявляется.
Дифференциальный диагноз синдрома Маршалла проводят со следующими нозологиями: возвратный тонзиллит, инфекционные заболевания, ювенильный идиопатический артрит, циклическая нейтропения, семейная средиземноморская лихорадка (FMF), синдром гиперглобулинемии D, болезнь Бехчета.
Лечение синдрома Маршалла
Методы лечения все еще являются предметом споров. Антибиотикотерапия, применение противовирусных, антигистаминных препаратов не имеют эффективности; НПВС обладают только кратковременным жаропонижающим эффектом. На сегодняшний день для терапии PFAPA-синдрома успешно используются:
- Кортикостероиды. Одна или две дозы преднизолона (1-2 мг/кг), бетаметазона (0,1-0,2 мг/кг) могут резко прекратить приступы лихорадки в течение нескольких часов. Другие сопутствующие симптомы требуют больше времени для разрешения. Стероиды применяются только во время приступов, указанные дозировки не вызывают токсических эффектов. Глюкокортикоидная терапия способна сократить интервал между приступами, но не предотвращает рецидивы.
- Колхицин. Может быть эффективным для предотвращения частых эпизодов лихорадки, на течение лихорадочного периода он не влияет. Побочным эффектом являются желудочно-кишечные расстройства (в 20% случаев). Было проведено несколько исследований данного препарата, причем большинство из них – в Израиле, где большая доля пациентов несут патогенные варианты MEFV.
- Циметидин. В исследованиях на небольших группах примерно четверть пациентов (24-27%) имели полное разрешение эпизодов лихорадки при его приеме, а еще 24-32% сообщили о частичной эффективности с уменьшением частоты или тяжести приступов.
- Анакинра. В настоящее время в качестве экспериментальной терапии рассматриваются рекомбинантные антагонисты рецептора интерлейкина-1β (анакинра), проводятся исследования данной группы препаратов. Все пациенты продемонстрировали клиническое улучшение, снижение уровня цитокинов в крови.
- Тонзиллэктомия. Является радикальным методом, который приводит к полному излечению. Операция должна выполняться только в случае непереносимости или неэффективности стандартной лекарственной терапии в связи с определенными рисками инвазивного вмешательства (кровотечение, осложнения анестезии).
Прогноз и профилактика
Все проявления синдрома Маршалла обычно самостоятельно разрешаются до подросткового возраста. Фатальные последствия и серьезные осложнения в литературе не описаны. Несмотря на благоприятный прогноз, при появлении схожих жалоб необходимо обратиться к детским специалистам (педиатру, отоларингологу, стоматологу) для обследования, установления диагноза и подбора адекватной терапии. Специфических методов профилактики не существует. Пациентам, страдающим данным синдромом, рекомендовано применять витамин Д3 в дозе 400 МЕ в зимнее время.
Источник

