Болезнь берже и синдром альпорта
Синдром Альпорта – наследственное заболевание почек, вызванное изменением синтеза коллагена типа IV, образующего базальные мембраны почечных клубочков, структуры внутреннего уха, хрусталика глаза. Мужчины страдают развернутой формой болезни с тяжелой симптоматикой. Женщины часто являются носителями гена, оставаясь здоровыми, или проявления болезни у них выражены слабо. Основные симптомы – микрогематурия, протеинурия, почечная недостаточность, сенсорная тугоухость, деформация и вывих хрусталика, катаракта. Диагноз устанавливается согласно клинико-анамнестическим данным, результатам общего анализа мочи, исследования биоптата почки, аудиометрии и офтальмологического осмотра. Лечение симптоматическое, включает терапию иАПФ и БРА.
Общие сведения
Семейные случаи гематурической нефропатии впервые привлекли внимание исследователей в 1902 году. Спустя почти 30 лет, в 1927 году американский врач А. Альпорт обнаружил частую сочетаемость гематурии с тугоухостью и уремией у мужчин, в то время как у женщин симптомы отсутствовали или были слабовыраженными. Он предположил наследственный характер болезни, которая впоследствии была названа синдромом Альпорта. Синонимы – наследственный нефрит 1 типа, гематурический нефрит, семейный гломерулонефрит. Распространенность невысока – 1 случай на 5 тысяч человек. На долю патологии приходится 1% больных с почечной недостаточностью, 2,3% пациентов, перенесших трансплантацию почек. Заболевание диагностируется у людей всех рас, но соотношение различных форм неодинаково.

Синдром Альпорта
Причины
По своей природе синдром является гетерогенным наследственным заболеванием – его развитие провоцируется дефектом генов, которые кодируют структуру различных цепей IV типа коллагена. Генетические изменения представлены делециями, сплайсинг, миссенс и нонсенс-мутациями. Их локализация определяет тип наследования болезни:
- X-сцепленный доминантный. Связан с мутацией в локусе COL4A5, который находится на половой хромосоме X. Ген кодирует а5-цепь коллагена 4 типа. Данный генетический дефект обуславливает 80-85% случаев наследственного нефрита. В полной мере заболевание проявляется у мальчиков и мужчин, у представительниц женского пола оставшийся нормальный ген в X-хромосоме компенсирует производство функционального коллагена.
- Аутосомно-рецессивный. Развивается на основе мутаций в генах C0L4A3 и COL4A4. Они локализованы на второй хромосоме, отвечают за структуру а3- и а4-цепи коллагена. Пациенты с этим вариантом синдрома составляют около 15% больных. Выраженность симптомов не зависит от пола.
- Аутосомно-доминантный. Нефрит возникает в результате мутаций генов COL4A3-COLA4, находящихся на 2 хромосоме. Как и в случае аутосомно-рецессивной формой болезни, нарушается синтез а4- и а3-цепей коллагена четвертого типа. Распространенность – 1% всех случаев генетического нефрита.
Патогенез
Гломерулярная базальная мембрана имеет сложное строение, ее образует строгая геометрическая последовательность молекул коллагена 4-го типа и полисахаридные компоненты. При синдроме Альпорта имеются мутации, которые задают дефектное строение спиралевидных коллагеновых молекул. На первых этапах болезни базальная мембрана истончается, начинает расщепляться и расслаиваться. Одновременно возникают утолщенные участки с неравномерными просветлениями. Внутри скапливается тонкогранулярное вещество. Прогрессирование болезни сопровождается полным разрушением базальной гломерулярной мембраны клубочковых капилляров, канальцев почек, структур внутреннего уха и глаз. Таким образом, патогенетически синдром Альпорта представлен четырьмя звеньями: мутацией гена, дефектом строения коллагена, деструкцией базальных мембран, патологией почек (иногда – нарушением слуха и зрения).
Симптомы
Самым распространенным проявлением синдрома Альпорта является гематурия. Микроскопически этот симптом определяется у 95% женщин и у 100% мужчин. При рутинном обследовании мальчиков гематурия обнаруживается уже в первые годы жизни. Другой распространенный признак заболевания – протеинурия. Выведение белка с мочой у пациентов мужского пола с X-сцепленным синдромом начинается в раннем детском возрасте, у остальных – позже. У девочек и женщин уровень экскреции белка повышается незначительно, случаи выраженной протеинурии крайне редки. У всех больных отмечается неуклонное прогрессирование симптома.
Артериальная гипертензия характерна для мужчин с классическим типом синдрома и для пациентов обоих полов с аутосомно-рецессивным вариантом наследования. Тяжесть гипертонии увеличивается вместе с нарастанием ХПН. У юношей, мужчин снижение функции почек достигает терминальной стадии к 16-35 годам, при медленном течении болезни – к 45-65 годам. Иногда выявляются диффузные гладкомышечные опухоли пищевода и бронхов, проявляющиеся в позднем детстве дисфагией, рвотой, болями в эпигастрии и за грудиной, одышкой, частыми бронхитами.
Часто у больных формируется нейросенсорная тугоухость. Нарушения слуха дебютируют в детстве, но становятся заметными в подростничестве или молодости. У детей тугоухость распространяется только на звуки высокой частоты, обнаруживается в специально созданных условиях – при аудиометрии. По мере взросления и прогрессирования синдрома нарушается слуховое восприятие средних и низких частот, в том числе человеческой речи. При X-связанном синдроме расстройство слуха к 25 годам имеется у 50% больных мужчин, к 40 годам – у 90%. Тяжесть тугоухости вариабельна, от изменений только в результатах аудиограммы до полной глухоты. Патологии вестибулярного аппарата отсутствуют.
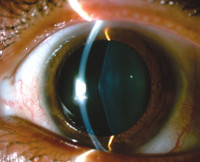
Расстройства зрения включают передний лентиконус – выпячивание центра хрусталика глаза вперед и ретинопатию. Обе патологии проявляются прогрессирующим ухудшением зрительной функции, покраснением, болью в глазах. У некоторых больных имеются стигмы дизэмбриогенеза – анатомические аномалии мочевыделительной системы, глаз, ушных раковин, конечностей. Может наблюдаться высокое расположение неба, укорочение и искривление мизинцев, сращивание пальцев ног, широко расставленные глаза.
Осложнения
Отсутствие лечения больных синдромом Альпорта приводит к быстрому прогрессированию глухоты и слепоты, формированию катаракт. У части пациентов развивается полиневропатия – поражение нервов, сопровождающееся мышечной слабостью, болями, судорогами, тремором, парестезиями, снижением чувствительности. Другим осложнением является тромбоцитопения с высоким риском кровотечений. Наиболее опасным состоянием при наследственном нефрите считается терминальная стадия почечной недостаточности. Больше всего ей подвержены мужчины с типом наследования, сцепленным с половой X-хромосомой. К 60 годам 100% больных этой группы нуждаются в процедурах гемодиализа, перитонеального диализа, трансплантации донорской почки.
Диагностика
В диагностическом процессе принимают участие врачи-нефрологи, урологи, терапевты и генетики. При опросе выясняется возраст дебюта симптомов, наличие у родственников первой линии гематурии, протеинурии или смертельных исходов вследствие ХПН. Для синдрома Альпорта характерно раннее начало и отягощенный семейный анамнез. Дифференциальная диагностика направлена на исключение гематурической формы гломерулонефритов, вторичных нефропатий. Для подтверждения диагноза проводятся следующие процедуры:
- Физикальное обследование. Определяется бледность кожных покров и слизистых оболочек, сниженный мышечный тонус, внешние и соматические признаки дизэмбриогенеза – высокое небо, аномалии строения конечностей, увеличенное расстояние между глазами, сосками. На ранних стадиях болезни диагностируется артериальная гипотония, на поздних – артериальная гипертония.
- Общий анализ мочи. Обнаруживаются эритроциты и повышенное содержание белка – признаки гематурии и протеинурии. Показатель белка мочи напрямую коррелирует с тяжестью синдрома, по его изменению оценивается прогрессирование патологии, вероятность нефротического синдрома, ХПН. Возможно наличие признаков лейкоцитурии абактериального характера.
- Исследование биоптата почек. При микроскопии визуализируется истонченная базальная мембрана, расщепление и разделение ее слоев. На поздней стадии отмечаются утолщенные дистрофичные участки с «сотами» просветления, зоны полной деструкции слоя.
- Молекулярно-генетическое исследование. Генетическая диагностика не является обязательной, но позволяет составить более точный прогноз, подобрать оптимальную схему лечения. Изучается строение генов, мутации в которых обуславливают развитие синдрома. У большей части больных выявляются мутации гена COL4A5.
- Аудиометрия, офтальмологическое исследование. Дополнительно пациентам могут быть назначены диагностические консультации сурдолога и офтальмолога. При аудиометрии обнаруживается снижение слуха: в детском и подростковом возрасте – билатеральная высокочастотная тугоухость, во взрослом возрасте – низкочастотная и среднечастотная тугоухость. Офтальмолог определяет искажение формы хрусталика, поражение сетчатки, наличие катаракты, снижение зрения.
Лечение синдрома Альпорта
Специфическая терапия отсутствует. С раннего возраста проводится активное симптоматическое лечение, снижающее протеинурию. Оно позволяет предотвратить поражение и атрофию почечных канальцев, развитие интерстициального фиброза. С помощью ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов к ангиотензину II удается приостановить прогрессирование заболевания, добиться регрессии гломерулосклероза, тубулоинтерстициальных и сосудистых изменений в почках. Пациентам с терминальной стадией ХПН назначается гемодиализ, перитонеальный диализ, решается вопрос о целесообразности трансплантации почек.
Прогноз и профилактика
Синдром прогностически благоприятен в случаях, когда гематурия протекает без протеинурии, нет расстройств зрения и тугоухости. Кроме этого, прогноз хороший у большинства женщин – даже при наличии гематурии болезнь прогрессирует медленно, не ухудшает общего состояния. Ввиду наследственного характера патологии предупредить ее развитие невозможно. В семьях, где установлено наличие X-сцепленной формы синдрома, возможно проведение пренатальной диагностики. Генетический скрининг особенно рекомендован женщинам, вынашивающим мальчиков.
Источник
IgA нефропатия, также известная как болезнь Берже, — наиболее распространенная форма гломерулонефрита. Встречается у пациентов всех возрастов, но чаще поражает мужчин в возрасте от 15 до 30 лет.
Клиническая картина состоит в основном из гематурии или рецидивирующей гематурии. Течение заболевания зависит от индивидуальных особенностей пациента. У 20% пациентов развивается терминальная стадия почечной недостаточности, связанная с необходимостью диализа.
Результаты исследований, проведенных Американским обществом нефрологов, показали, что IgA-нефропатия (Болезнь Берже), поражающая почки, уменьшает продолжительность жизни в среднем на 6 лет и увеличивает смертность.
Почему возникает болезнь Берже и чем она опасна
Болезнь Берже или IgA-нефропатия — поражение почек, вызванное отложением иммуноглобулинов, нарушающих почечную функцию. Эти вещества, выделяемые иммунной системой для защиты организма, в данном случае, вредят.
Чаще всего болезнь возникает после инфекций. В этом случае значительно увеличивается количество иммуноглобулинов, предназначенных для борьбы с возбудителями. Поэтому заболевание зачастую развивается после ангин, простуд, ларингитов, инфекций желудочно-кишечного тракта.
В пищеварительной системе доминирующим причинным фактором является популярная кишечная палочка. В дыхательной системе — главным образом — стрептококки и вирусы гриппа.
IgA нефропатия может также появляться в ходе аутоиммунных заболеваний, чаще всего болезнь Берже провоцируют:
- гепатит В;
- глютеновая болезнь;
- саркоидоз;
- псориаз;
- анкилозирующий спондилит;
- ревматоидный артрит;
- реактивный артрит;
- воспаления кишечника;
- СПИД.
При болезни Берже костный мозг начинает вырабатывать слишком крупные полимерные молекулы иммуноглобулина А. Из-за своего размера такие соединения не могут пройти через печень, чтобы выделиться из организма. Печеночные клетки – гепатоциты не в состоянии распознать и переработать «неправильные» иммуноглобулины, чтобы удалить их.
Поэтому единственным путем выведения иммуноглобулинов А становятся почки. Однако из-за большого размера IgA ” застревают” в нефронах – почечных структурах, которые фильтруют мочу.
Поскольку глобулины относятся к биологически активным веществам, попав в почечную ткань, они вызывают ее воспаление, приводя к кровотечениям. У больного возникает гломерулонефрит – инфекционно аллергическое поражение почек, нарушающее их функцию.
Болезнь Берже постепенно прогрессирует, приводя к почечной недостаточности. Больных приходится переводить на гемодиализ – «искусственную почку».
Этапы болезни Берже
Формы и симптомы болезни Берже
По происхождению выделяют две формы болезни Берже:
- Идиопатическая IgA-нефропатия обусловлена нарушениями в выработке иммуноглобина А на слизистых оболочках пищеварительной и дыхательной систем.
- Вторичная нефропатия сопровождает другие заболевания, такие как целиакия, ревматоидный артрит, саркоидоз, СПИД, гепатит В, воспалительные заболевания кишечника.
По симптомам и тяжести протекания IgA нефропатия делится на следующие формы:
- Синфарингитная – форма, обостряющаяся на фоне простуд, ларингитов, фарингитов. У больного появляется гематурия – кровь в моче. Иногда выделение крови бывает обильным. Гематурия сопровождается болью в пояснице, повышением температуры, отеками. В период между простудами симптомов не возникает.
- Латентная (скрытая) – опасная форма болезни, при которой примеси крови в моче незаметны. Проявляется небольшими болями в мышцах, пояснице, суставах, слабо выраженными отеками. Несмотря на скудость проявлений, она также приводит к почечной недостаточности.
- Нефротическая – тяжёлая форма, сопровождающаяся выделением с мочой крови, белка, обширными отёками, потерей жидкости. Часто является осложнением других форм заболевания.
Диагностика заболевания
Для выявления IgA-нефропатии урологи рекомендуют все всем переболевшим ларингитом, ангиной, простудными заболеваниями обязательно сдать анализы мочи. При болях в пояснице, отёчности и слабости, возникших на фоне простуд, нужно записаться на консультацию к урологу, исследовать кровь на биохимические показатели и пройти УЗИ почек.
Первый признак заболевания — наличие крови в моче, обнаруженной во время общих анализов мочи. Но чтобы поставить окончательный диагноз необходима более широкая диагностика. На данный момент единственный верный способ диагностики этого типа гломерулонефрита — иммунофлюоресцентный анализ IgA, обнаруживаемых в почечных клубочках.
Чтобы определить причину проблем, назначается биопсия почки — взятие образца тканей почки для гистопатологического исследования.
Болезнь Берже повышает риск летального исхода от различных причин
Исследователи из Университетской клиники Эребру в Швеции сравнили 3622 пациента с этим заболеванием с 18 041 здоровыми людьми, подобранными по возрасту и полу. У всех больных IgA-нефропатией риск смертности был повышен на 53%, а продолжительность жизни была меньше на 6 лет.
Самая высокая смертность наблюдалась в первый год после постановки диагноза. Среди причин лидировали сердечно-сосудистые осложнения. Больные умирали от них на 59% чаще по сравнению с пациентами, не имеющими такой патологии.
Однако исследование выявило одну достаточно интересную особенность – большинство пациентов погибали только после начавшейся некорректируемой почечной недостаточности. Поэтому главным было правильное лечение, позволяющее как можно дольше сохранить функцию почек.
Во время исследования обнаружилось, что кровные родственники таких пациентов в 3 раза чаще болеют тяжёлыми заболеваниями почек. Поэтому при наличии родственника больного IgA нефропатией, нужно контролировать показатели анализов мочи, сдавать кровь на биохимию и периодически проходить УЗИ почек. Это позволит выявить почечные патологии на раннем этапе, чтобы вовремя начать их лечение.
Лечение болезни Берже
Специфического лечения не разработано. Больным назначают препараты, снимающие симптомы воспаления, выводящие лишнюю жидкость, устраняющие отеки. Показаны гормоны, противовоспалительные средства. Для борьбы с сопутствующими инфекциями применяются антибиотики.
Показана диета с исключением соли, копчёных, пряных, острых блюд. Запрещаются курение и алкоголь., Больным нельзя долго время находиться на солнце, чтобы не провоцировать новое появление крови в моче. Следует максимально избегать переохлаждений и простуд.
Продолжительность жизни при IgA нефропатии зависит от полноты и своевременности проведенного лечения, а также от соблюдения больным рекомендаций по образу жизни и диете. Факторы ухудшающие прогноз: гипертония, протеинурия, повышенный уровень креатинина в сыворотке.
Поделиться ссылкой:
Источник
IgA-нефропатия (болезнь Берже) — одна из самых частых форм хронического брайтова нефрита, отличающаяся гематурией с медленным прогрессированием в хроническую болезнь почек (ХБП). Среди больных терминальной уремией, сегодня находящихся на заместительной почечной терапии, у каждого четвертого диагностируется IgA-нефропатия [1]. Более редкие формы IgA-нефропатии характеризуются такими признаками активности, как высокая протеинурия, диффузная пролиферация мезангия, пролиферация эндотелия капилляров клубочков, экстракапиллярная пролиферация, гломерулярные депозиты фибрина, выраженный фокальный гломерулосклероз [2, 3].
Трактовка впервые обнаруженной IgA-нефропатии часто затруднительна. IgA-нефропатия выступает не только как форма распространенного брайтова нефрита, но часто должна расцениваться как «почечная» маска системных заболеваний (геморрагический васкулит, анкилозирующий спондилоартрит), персистирующих инфекций (ВИЧ-инфекция, HCV-инфекция, туберкулез), цирроза печени (ЦП), заболеваний кишечника (целиакия, болезнь Крона, неспецифический язвенный колит — НЯК), тяжелых форм кожных заболеваний — псориаз, герпетиформный дерматит (см. табл.) [4–6].
.gif)
Дальнейшее изучение этиологии и патогенетических механизмов вторичных IgA-нефропатий перспективно для разработки новых методов лечения и профилактики болезни Берже.
IgA-нефропатия при хронических заболеваниях печени
IgA-нефропатия при HCV-инфекции
Для IgA-нефропатии при HCV-инфекции более характерна поздняя манифестация — после многолетнего медленного формирования вирусного ЦП, когда нарушается деградация IgA в печени и формируется инсулинорезистентность. Значительно раньше (на стадии хронического гепатита) формируется вирусный мембранопролиферативный нефрит (МБПГН). Поэтому от характерных проявлений IgA-нефропатии в виде гематурии с умеренной протеинурией на фоне нормотензии необходимо отличать криоглобулинемический МБПГН с рецидивами острого нефритического синдрома (ОНС), а также иммунотактоидный нефрит [7, 8]. При этом важное диагностическое значение имеет обнаружение криоглобулинемии смешанного II типа (СКГ II) с выраженной репликацией вируса гепатита С [9]. Криоглобулиемический МБПГН и иммунотактоидный нефрит отличаются ускоренным прогрессированием или развитием быстропрогрессирующего нефрита. Крайне неблагоприятен прогноз при HCV позитивной тромботической тромбоцитопенической пурпуре с злокачественной гипертензией (ЗГ) и прогрессирующей энцефалопатией.
IgA-нефрит при алкогольном циррозе печени
При алкогольном декомпенсированном ЦП признаки IgA-нефропатии обнаруживаются у каждого десятого больного. При этом механизмы нарастания в крови уровня IgA и IgA-содержащих иммунных комплексов, обусловленные снижением печеночной деградации IgA при прогрессировании цирроза [10], проявляются типичной картиной латентного нефрита с гематурией [11, 12]. Стойкая гипертензия наблюдалась в 15–20%, чаще носит контролируемый характер, ассоциируется с хроническими нарушениями пуринового обмена [13]. У половины больных алкогольным гематурическим нефритом обнаруживается кальцинирующий панкреатит, алкогольная кардиомиопатия, периферическая полинейропатия. Течение почечного процесса медленно прогрессирующее или рецидивирующее [13]. Рецидив нефрита развивается у 30% больных в первые сутки после алкогольного эксцесса, нередко ассоциирован с атакой острого алкогольного гепатита и напоминает ОНС. В 5% развивается экстракапиллярный быстропрогрессирующий нефрит (БПГН), наиболее неблагоприятный прогностически. У больного с далеко зашедшим портальным ЦП необходимо дифференцировать прогрессирующую IgA-нефропатию с гепаторенальным синдромом, алкоголь-парацетамоловым синдромом, а также с отравлениями суррогатами алкоголя (гликолин, метиловый спирт, дихлорэтан).
IgA-нефропатия при ВИЧ-инфекции
У ВИЧ-инфицированных больных [14] белой расы чаше других форм нефрита обнаруживается IgA-нефропатия. Мезангиальные IgA-депозиты обнаруживаются у 8% умерших от СПИДа. Дифференциальную диагностику указанной вторичной IgA-нефропатии следует проводить с такими ВИЧ-ассоциированными формами, как коллабирующий вариант фокально-сегментарного гломерулосклероза, мембранозная нефропатия, люпус-подобный пролиферативный нефрит, тромботическая тромбоцитопеническая пурпура, для которых, в отличие от IgA-нефропатии, характерны тяжелый нефротический синдром (НС), рецидивирующий ОНС или неконтролируемая гипертензия [15, 16].
В 30% ВИЧ-ассоциированной IgA-нефропатии характерна ЗГ. ЗГ сопровождается высокой протеинурией и быстрым прогрессированием в терминальную стадию хронической почечной недостаточности [17]. При этом биопсия почки демонстрировала сочетание мезангиопролиферативного IgA-нефрита с экстракапиллярной пролиферацией в 10–20% клубочков, тяжелым нефроангиосклерозом и фибриноидным некрозом артериол, напоминающим тромботическую микроангиопатию. Выявлена корреляция между тяжестью артериальной гипертензии и нефроангиосклероза, с одной стороны, и степенью вирусной нагрузки (ВИЧ) — с другой. Предполагается, что ЗГ с признаками ТМА обусловлена прямым повреждающим действием ВИЧ на эндотелий почечных артериол.
IgA-нефропатия при серонегативных спондилоартритах
К серонегативным спондилоартритам относятся болезнь Бехтерева, артритры при распространенном псориазе, синдроме Рейтера, НЯК, болезни Крона. Данные формы объединяет патология иммунного ответа с антигеном гистосовместимости HLA В27 [18]. Общим для всех указанных спондилоартритов является нарушение клеточного иммунитета (СD4-Т-лимфоцитов). Реактивные артриты, ассоциированные с хронической воспалительной диареей (НЯК), хроническим уретритом (синдром Рейтера) характеризуются гиперпродукцией IgA с высоким риском прогрессирования ВИЧ-инфекции, нефропатиями и васкулитами [19]. Среди клинических маркеров — сакроилеит, гемоколит, мальабсорбция, прогрессирующий передний увеит, иридоциклит, конъюнктивит с уретритом [20]. IgA-нефропатия, как правило, проявляется микрогематурией с минимальной протеинурией без стойкой гипертензии и медленным прогрессированием.
Дифференциальная диагностика вторичной IgA-нефропатии должна проводиться с лекарственным хроническим тубулоинтерстициальным нефритом при свойственном сакроилеиту длительном приеме ненаркотических анальгетиков, нестероидных противовоспалительных средств, с хроническим уретритом и пиелонефритом (чаще при синдроме Рейтера). При далеко зашедшем спондилоартрите с нарастанием протеинурии и формированием стойкого НС на фоне тенденции к гипотензии вероятен диагноз генерализованного АА-амилоидоза. Решающее значение в диагностике амилоидной нефропатии имеет биопсия почки или слизистой прямой кишки.
IgA-нефропатия при целиакии
Целиакия (лат. Morbus coeliacus; целиакия) — заболевание, характеризующееся непереносимостью глютена (с сенсибилизацией к нему). При этом всасывающиеся продукты неполного расщепления глютена оказывают токсическое действие на желудочно-кишечный тракт, индуцируют аллергические реакции (вплоть до глиадинового шока), что приводит к гиперрегенераторной атрофии слизистой оболочки тонкой кишки с развитием синдрома мальабсорбции.
При врожденной форме целиакии прогрессирующее поражение тонкого кишечника с тяжелым синдромом мальабсорбции препятствует росту и развитию ребенка [21]. Непереносимость глютена у взрослых мало изучена. Популяционные исследования последних десятилетий показали, что серологические и гистологические признаки целиакии регистрируются в десятки и сотни раз чаще, чем манифестные формы заболевания [22]. Также целиакия может иметь приобретенный характер, осложняя хронические энтериты.
Поражение почек при целиакии обусловлено циркулирующими иммунными комплексами, содержащими IgA-антитела к белку глиадину, которые способны фиксироваться на мезангиальных клетках с помощью глиадин-опосредованных лектиновых связей [23]. По данным многочисленных исследований антиглиадиновые IgA-антитела выявляются у большинства больных с IgA-нефропатией (70–100%), в то же время типичная целиакия обнаруживается лишь у 3% из них [24–28]. IgA-нефропатия при целиакии проявляется микрогематурией и протеинурией менее 1 г/сутки без гипертензии или может протекать субклинически [29, 30]. Имеются данные о положительном влиянии аглютеновой диеты на течение IgA-нефропатии [23, 31, 32].
IgA-нефропатия при геморрагическом васкулите
Типичным проявлением геморрагического васкулита (пурпуры Шенлейна–Геноха) является сочетание рецидивов кожной геморрагической пурпуры с преходящим поражением крупных суставов, абдоминальным синдромом и поражением почек [33]. Атака абдоминального синдрома может осложниться желудочно-кишечным кровотечением, кишечной непроходимостью. Наблюдаются случаи нетипичного течения: почечная манифестация с отсроченным (на несколько месяцев, иногда — 1–2 года) присоединением артритов вместе с кожно-абдоминальной пурпурой. Учитывая указанные клинические наблюдения и общность патогенетических механизмов IgA-нефрита при геморрагическом васкулите с болезнью Берже, предполагается, что имеют место системная и локальная (почечная) формы одного и того же заболевания [34].
IgA-нефрит Шенлейна–Геноха чаще проявляется микрогематурией в сочетании с протеинурией, не превышающей 1 г/сутки. Гипертензия наблюдается не чаще чем у 15–20% больных [35]. Нефротический синдром формируется в 20–30% случаев чаще на поздней стадии болезни. В 5–10% случаев развивается БПГН с экстракапиллярной пролиферацией [36].
IgA-нефропатия и синдром Альпорта
Синдром Альпорта — наследственный гематурический нефрит с прогрессирующей потерей слуха, наследуемый по доминантному типу и сцепленный с Х-хромосомой. Поражение почек, приводящее мужчин с синдромом Альпорта к исходу в терминальную стадию ХБП, не связано с иммунокомплексными механизмами, а обусловлено мутацией генов коллагена БМК клубочков [37, 38]. IgA-нефропатия в семьях носителей патологических генов и больных синдромом Альпорта встречается чаще и протекает с более быстрым прогрессированием. Дифференциальная диагностика IgA-нефропатии с синдромом Альпорта осложняется развитием обоих заболеваний в молодом возрасте и преимущественно у мужчин, а также сходством почечной симптоматики. Для разграничения c IgA-нефропатией имеют ценность инструментальное исследование слуха, выявление аномалий хрусталика и роговицы, иммунологических нарушений, а также генетический анализ и изучение родословной. В сложных случаях применяется биопсия почки [39].
Заключение
В основе формирования аномального IgA-опосредованного иммунного ответа могут быть постэнтероколитическая или урогенитальная инфекция, нарушение печеночной деградации IgA при прогрессирующем ЦП, наследственная предрасположенность, включая носительство генов синдрома Альпорта, гена гистосовместимости HLA B27. Повышение в крови полимерного IgA и IgA-содержащих иммунных комплексов наблюдается у большинства ВИЧ-инфицированных, у пациентов с целиакией, НЯК и у 90% больных псориатическим артритом. Общим для большинства форм вторичной IgA-нефропатии является нарушение функции Т-хелперов (СD4-Т-лимфоцитов) с высоким риском иммунокомплексных осложнений, прогрессирования ВИЧ-инфекции. Полимерный IgA1 демонстрирует антительную активность к HIV-IgG и HIV-IgM [40, 41]. При IgA-нефритах необычно высока инфицированность другими вирусами. Так, от 60% до 80% больных алкогольным ЦП являются хроническими носителями HCV или HBV, что дополнительно усугубляет иммунодефицит. Иммунокомплексная патология реализуется рецидивами кожного васкулита, аортита, увеита, иммунокомплексным нефритом, инфекционными осложнениями. У 30–40% указанных больных выявляются инфицирование микобактериями туберкулеза, стафилококками.
Лечение вторичной IgA-нефропатии в первую очередь зависит от основного заболевания. При этом если при алкогольном циррозе и целиакии могут быть эффективны нелекарственные методы (алкогольная абстиненция, аглютеновая диета), то при ВИЧ+ и при HCV+ IgA-нефропатии показана противовирусная терапия, а при IgA-нефропатии в рамках Шенлейн–Геноховского васкулита или активного спондилоартрита показаны иммуносупрессанты.
Литература
- Berthoux F., Lajoie G., Sugar L. Predicting the risk for dialysis or death in IgA nephropathy // J. Am. Soc. Nephrol. 2011; 22: 752–761.
- Lee H. S., Lee M. S., Lee S. M. Histologic grading of IgA nephropathy predicting renal outcome: revising H. S.L. glomerular grading system Nephrol // Dial. Nransplant. 2012; 20: 342–348.
- Wyatt R. L., Julian B. A. IgA nephropathy // N. Engl. J. Med. 2013; 368: 2402–2414.
- Ballardie F. W. IgA-nephropathy treatment 25 year on: can we halt progression? // Nephrol. Dial. Transplant. 2004; 19: 1041–1046.
- Шилов Е. М. Мезангиопролиферативный нефрит. В кн.: Нефрология. Национальное руководство/Под ред. Н. А. Мухина. М.: ГЭОТАР-Медиа, 2009. С. 224–231.
- Floege A., Eitner F. Current therapy for IgA-nephropathy // J. Am. Soc. Nephrol. 2011; 22: 1785–1794.
- Sansonno D., Dammacco F. Hepatitis C virus, cryoglobuliemia and vsaculitis immune complex reaxtions // Lancet. 2005; 5: 227–236.
- Meyers C. M., Seefl L., Stehman-Breen O. Hepatitis C and renal disease: an update // Am. J. Kidney Dis. 2003; 42: 631–657.
- Ramos-Casas M., Stone J. H., Cid M. The cryoglobulinemias // Lancet. 2012; 379: 340–360.
- Rocatello D., Picciotto G., Torchino M. Removal system of Ig A and Ig A containing complexes in Ig A nephropathy and cirrhosis patients: the role of asyaloglycoprotein recerptors // Lab. Invest. 1993; 69: 714–723.
- Arroyo V. The liver and the kidney: mutual clearance and mixed intoxication // Contr. Nephrol. 2007; 156: 17–23.
- Козловская Л. В. Поражение почек при алкогольной болезни печени. В кн.: Практическая гепатология / Под ред. Н. А. Мухина. М., 2004. С. 186–187.
- Николаев А. Ю. Хроническая болезнь почек при алкогольной болезни. В кн.: Алкогольная болезнь. Поражение внутренних органов / Под ред. В. С. Моисеева. М.: ГЭОТАР-Медиа, 2014. С. 176–199.
- Ющук Н., Гаджикулиева М., Волгина Г. Гломерулярные заболевания у ВИЧ-инфицированных пациентов: клиниченская и морфологическая оценка // Терапевт. архив. 2012; 11: 30–33.
- Ryom L., Mockroft A., Kirk O. Predictors of advanced CKD and ESRD in HIV-positive persons // AIDS. 2014; 28: 187–199.
- Wyatt C. M., Klotman P. E., D Agsti V. HIV-associated nephropathy: clinical presentation, pathology and epidemiology in the era of antiretroviral therapy // Semin. Nephrol. 2008; 28: 513–522.
- Morales E., Gutierrez-Solis E., Gutierez E. Malignant hypertension in HIV-associated glomerulonephritis // Nephrol. Dial. Transplant. 2008. Vol. 23. P. 3901–3907.
- Feltkamp T. E. W., Verians Y. M. The pathogenesis of HLA B27 assosiated diseases // Rheumatology in Europe. 1995; 24: 45–47.
- Espinoza L. R. There is an assosiation between HIV infection and spondyloarthropathies // Dis. Clin. North Amer. 1992; 18: 257–266
- Ревматология. Национальное руководство // Под ред. В. А. Насоновой, Е. Л. Насонова. М.: Литтерра, 2008. 600 с.
- Бельмер С. В., Малкоч А. В. IgA-нефропатия при целиакии. В кн.: Целиакия у детей / Под ред. С. В. Бельмера, М. О. Ревновой. М.: ИД «Медпрактика-М», 2010. С. 264–268.
- Van Heel D. A., West J. Resent advances in coeliac disease // Gut. 2006. Vol. 55. P. 1037–1046.
- Coppo R., Amore A., Roccatelbo D. Dietary Antigens and Primary Immunoglobulin A Nephropathy // J. Am. Soc. Nephrol. 1992. Vol. 2. P. S173-S180.
- Collin P., Syrjanen J., Partanen J., Pasternack A., Kaukinen K., Mustonen J. Celiac disease and HLA DQ in patients with IgA nephropathy // Am J Gastroenterol. 2002. Vol. 97. P. 2572–2576.
- Laurent J., Branellec A., Heslan J. M. et al. An increase in circulating IgA antibodies to gliadin in IgA mesangial gbomerubonephnitis // Am J Nephrol. 1987. Vol. 7. P. 178–183.
- Nagy J., Scott H., Brandtzaeg P. Antibodies to dietary antigens in IgA nephropathy // Cbin Nephrol. 1988. Vol. 29. P. 275–279.
- Fornasieri A., Sinico P. A., Maldifassi P., Benascorn P., Vegni M., D’Amico G. IgA-antigliadin antibodies in IgA mesangial nephropathy (Berger’s disease) // Br Med J. 1988. Vol. 295. P. 78–80.
- Rodriguez-Soriano J., Arrieta A., Vallo A., Sebastian M. J., Vitoria J. C., Masdevall M. D. IgA antigliadin antibodies in children with IgA mesangial glomerulonephritis // Lancet. 1988. Vol. 1. P. 1109–1110.
- Малкоч А. В., Бельмер С. В. Нефропатии при целиакии // Лечащий Врач. 2012; 8: 19–21.
- Нефрология. Практическое руководство по детским болезням / Под ред. В. Ф. Коколиной, А. Г. Румянцева. М.: Медпрактика, 2005. Т. 6: 306–390.
- Ferri C., Puccini R., Longombardo G. Low-antigen- content diet in the treatment of patients with IgA-nephropathy // Nephrol. Dial. Transplant. 1993; 8: 1193–1198.
- Coppo R., Rocatello D., Amore A. Effects of gluten-free diet in primary IgA nephropathy // Clin. Nephrol. 1990; 33: 72–86.
- Кривошеев О. Г., Гуляев С. В. Поражение почек при пурпуре Шенлейна-Геноха. В кн.: Нефрология. Национальное руководство/Под ред. Н. А. Мухина. М.: ГЭОТАР-Медиа, 2009. С. 307–319.
- Blanco R., Martinez-Taboada V. M., Rodriguez-Valverde V. Henoch-Schonlein purpura in adulthood and childhood: two different expressions of the same syndrome // Arthritis Rheum. 1997; 40: 959–864.
- Feehally J., Floege J. IgA nephropathy Henoch-Schonlein nephritis. Comprehensive Clinical Nephrology. 4 th ed. Editors: J. Floege, R Johnson, J. Feehally. Elsever; Saunders, 2010: 270–281.
- Сoppo R., Andrulli S., Amore A. Predictors of outcome in Henoch-Schonlein nephritis in children and adults // Am. J. Kidney Dis. 2006; 47: 993-10-03.
- Bekheimia M. R., Reed B., Gregory M. C. Genotype-phenotype correlation in X-linked Alport syndrome // J. Am. Soc. Nephrol. 2010; 21: 826–883.
- Gross O., Netzer K. O., Lambery R. Meta-analysis of genotype-phenotype correlation in X-linked Alport Syndrome // Nephrol. Dial. Transplant. 2002; 17: 1218–1227.
- Jais J. P., Knebelman B., Giatras I. X-linked Alport Syndrome: natural history and genotype — phenotyhe correlations in girls and womens // J. Am. Soc. Nephrol. 2003; 14: 2603–2610.
- Волгина Г. В., Гаджикулиева М. М. Хроническая болезнь почек у ВИЧ-инфицированных. В кн.: Нефрология. Клинические рекомендации/Под ред А. В. Смирнова, Н. Л. Козловской. М.: ГЭОТАР-Медиа, 2016. С. 528–561.
- Ando M., Yanagisawa N. Epidemiology, clinical characteristics and management of CKD in human immunodeficiency virus-infected patients // Word J. Nephrol. 2015; 4: 388–395.
А. Ю. Николаев1, доктор медицинских наук, профессор
А. В. Малкоч, кандидат медицинских наук
ФГБОУ ДПО РМАНПО МЗ РФ, Москва
1 Контактная информация: nickolaev.aleksei2011@yandex.ru
IgA- нефропатия при системных заболеваниях, персистирующих инфекциях, хронических болезнях печени/ А. Ю. Николаев, А. В. Малкоч
Для цитирования: Лечащий врач № 1/2018; Номера страниц в выпуске: 48-51
Теги: инфекция, болезни печени, поражение почек
Источник
