Что такое нефротический синдром финского типа
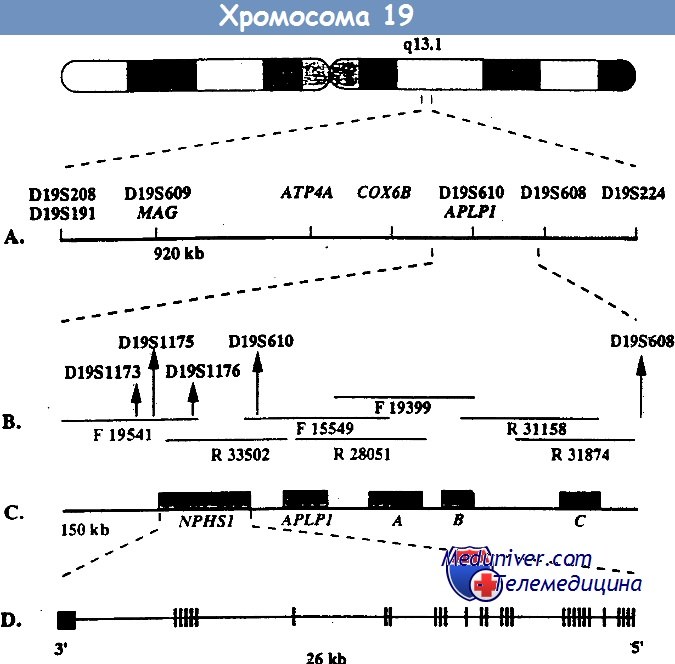
Врожденный нефротический синдром финского типа – клиника, диагностикаВрожденный нефротический синдром финского типа – заболевание наследуется по аутосомно-рецессивному типу и является основной причиной высокой протеинурии у детей первого месяца жизни. Хотя наибольшая распространенность этого заболевания отмечается в Финляндии (1,2 случая на 10 000 беременностей), описано много случаев заболевания у детей других национальностей. При этом заболевании протеинурия возникает еще внутриутробно, что проявляется повышенным уровнем а-фетопротеина в околоплодных водах. Уже на первой неделе жизни часто возникают отеки. Истощение, тяжелые инфекции и тромбозы обусловливают тяжесть заболевания и высокую смертность, ранее больные погибали на первом году жизни. Сегодня при интенсивном лечении больные могут дожить до того момента, когда им можно провести трансплантацию почки. Выживаемость как трансплантата, так и больных очень высокая. Локус, мутация в котором обусловливает данное заболевание, был найден с помощью позиционного клонирования на длинном плече 19-й хромосомы (19q13.1) и в финских, и в других семьях. При определении нуклеотидной последовательности этого локуса был найден ранее неизвестный ген NPHS1, который избирательно экспрессируется в подоцитах. Продукт этого гена получил название нефрин. Он относится к молекулам адгезии из суперсемейства иммуноглобулинов. Нефрин локализован в области щелевых диафрагм — видоизмененных плотных контактов между отростками ножек подоцитов. У больных с мутацией гена NPHS1 нет отростков ножек подоцитов и щелевых диафрагм. Это позволяет думать, что именно нефрин является важнейшим компонентом щелевых диафрагм, предотвращающих выход белка из сосудов клубочка. Среди всех мутаций гена NPHS1 у финнов преобладают две: Fin-major и Fin-minor. Они присутствуют более чем у 90% больных. Мутация Fin-major вызвана делецией двух пар нуклеотидов во 2-м экзоне, который кодирует терминирующий кодон, она встречается примерно у 80% больных финнов. Мутация Fin-minor — нонсенс-мутация в 26-м экзоне, она встречается примерно у 17% больных финнов. У больных других национальностей встречаются различные мутации по типу делеций, вставок, нонсенс- и миссенс-мутаций, а также мутации, нарушающие сплайсинг. Врожденный нефротический синдром финского типа — основная, но не единственная причина нефротического синдрома на первом месяце жизни.
– Также рекомендуем “Синдром Дени-Дрэша – клиника, диагностика” Оглавление темы “Наследственные болезни почек”:
|
Источник
Терминология. Под врожденным нефротическим синдромом понимается НС, развившийся у ребенка до 3-месячного возраста. Врожденный HC может быть первичным, генетически детерминированным и вторичным при врожденной цитомегалии, токсоплазмозе, сифилисе, туберкулезе, тромбозе почечных вен, СПИДе. Особое место среди врожденного HC занимает первичный наследственный, так называемый врожденный нефротический синдром финского типа. Это аутосомно-рецессивно наследуемая патология, проявляющаяся с первых дней жизни ребенка тяжелым нефротическим синдромом с большой протеинурией и резкой гипопротеи-немией. При «естественном» течении летальный исход наступает до 1 года, причем к нему приводят либо развитие почечной недостаточности, либо септические осложнения.
История и эпидемиология. Впервые заболевание описано в 1966 г. R. Norio. При анализе церковно-приходских книг в юго-западном регионе Финляндии, где наиболее часто встречалось это заболевание, был обнаружен родоначальник патологии — финн, который проживал в этом регионе во второй половине XVI в. До проведения антенатальной диагностики заболевание встречалось с частотой 1:8200 рождений. Аналогичные случаи регистрируются в северо-западном районе России, в Ленинградской области. He всегда удается подтвердить этническую (финскую) принадлежность семьи. Этот вариант патологии неоднократно описывался в различных странах мира у лиц нефинской национальности.
Клиническая характеристика. Течение беременности тяжелое, роды, как правило, преждевременные, масса плаценты составляет более 1/4-1/2 массы новорожденного. Чаще ребенок рождается уже с выраженными отеками, но они могут появиться несколько позднее — к концу первого месяца жизни. Протеинурия достигает 10 г за сутки. Резко выражена гипоальбуминемия, имеет место повышение липидов сыворотки крови. При уменьшении отечного синдрома после введения диуретиков обращают на себя внимание резкая дистрофия ребенка, множественные стигмы дизэмбриогенеза. Резко снижены показатели иммунной защиты, что является основой развития гнойных осложнений. Возможны тромбоэмболии. АД снижено или в пределах нормы. В амниотической жидкости и сыворотке крови беременных в высоком титре содержится альфа-фетопротеин. Обнаружение этого феномена позволило проводить своевременную антенатальную диагностику.
Морфология и патогенез. При гистологическом исследовании почек обнаруживаются микрокистоз проксимальных канальцев в кортикомедуллярной зоне, мультигломерулярность и другие признаки незрелости почечной ткани, пролиферация мезангиальных клеток, фиброзные изменения.
Врожденный нефротический синдром финского типа относится к гломерулярным болезням, причем продукт гена — нефрин — локализован на подоцитах. Недостаточность нефри-на вызывает протеинурию еще в антенатальном периоде развития ребенка.
Генетика. Врожденный HC финского типа наследуется аутосомно-рецессивным путем. М. Kestila и соавт. при исследовании 17 семей с указанной патологией не обнаружили дефекта ни в одном из генов альфа-1-, альфа-2-, альфа-3- и альфа-4-цепи коллагена IV типа, а также основных генов цепей ламинина и гепа-рансульфат-протеогликана, кодирующих основные компоненты БМ клубочков. Получены убедительные данные, что мутантный ген локализован на 19ql3, этот ген — NPHSI — кодирует трансмембранный протеин — нефрин, присущий подоцитам.
Современными исследованиями выяснено, что в различных регионах мира, где выявлялся врожденный НС, близкий по сути финскому, имеется около 40 мутаций гена NPHSI. Однако в Финляндии у больных и носителей обнаружены только 2 идентичные мутации этого гена. В семьях, где имеется врожденный НС, в процессе медико-генетического консультирования беременные женщины обязательно обследуются на наличие у них в крови альфа-фетопротеина. При его обнаружении рекомендуется прерывание беременности.
Диагностика. Рождение в семье ребенка с врожденным HC требует прежде всего выяснения этнических корней. Обязательно исключение вторичного НС, связанного с внутриутробными инфекциями. Врожденный HC финского типа следует дифференцировать от семейного НС, который описан в различных странах мира у людей различной национальности (см. ниже). О финском типе HC говорят тяжелая беременность, наличие очень крупной плаценты, обнаружение при морфобиоптическом исследовании микрокистоза проксимальных канальцев.
Лечение. Несмотря на то что в Финляндии проводится активное выявление семей, где возможно развитие врожденного HC финского типа, все же и в настоящее время рождаются дети с этой тяжелой патологией. Ни симптоматическая терапия, ни стероиды и иммуносупрессоры не вызывают улучшения у больных с врожденным HC финского типа.
Рекомендуется высокобелковая и высококалорийная диета наряду со строжайшим водноэлектролитным сбалансированным режимом до 10—12 мес жизни ребенка. К этому возрасту удается довести его массу тела до 10 кг, ликвидировать дистрофию и отечный синдром. После нефрэктомии проводят почечную трансплантацию. Десятилетнее наблюдение за группой, включавшей около 40 детей, убедительно свидетельствует о хорошей реабилитации таких больных.
Источник
Вторичный и врожденный нефротические синдромы у детей. Диагностика
Нефротический синдром может быть также вторичным проявлением многих поражений почечных клубочков: мембранозная нефропатия, мезангиокапиллярный, постинфекционный и волчаночный гломерулонефрит, геморрагический васкулит. Вторичный нефротический синдром следует подозревать у больных старше 8 лет при наличии артериальной гипертонии, гематурии, нарушения функции почек, внепочечных симптомов (сыпь, артралгия и др.) или низкого уровня комплемента в крови.
В некоторых регионах мира ведущими причинами нефротического синдрома являются малярия и шистосомоз. Вызывают нефротический синдром вирусы гепатита В и С, филярии, возбудитель проказы и ВИЧ.
Нефротический синдром сопутствует злокачественным опухолям, особенно у взрослых. У больных с солидными опухолями (например раком легкого, желудка или кишечника) почечная патология часто напоминает мембранозную нефропатию. По видимому, в этих случаях в почках откладываются комплексы опухолевых антигенов со специфическими антителами. При лимфомах, особенно лимфоме Ходжкина, поражение почек чаще всего напоминает болезнь минимальных изменений. Предполагается, что продуцируемый лимфомой лимфокин увеличивает проницаемость стенки клубочковых капилляров. Нефротический синдром возможен и до обнаружения опухоли, но исчезает при ее регрecce и возобновляется при рецидиве.
К развитию нефротического синдрома приводит также многочисленные лекарственные средства и химические вещества. Гистологическая картина почек в этих случаях может напоминать мембранозную нефропатию (пенициллин, каптоприл, препараты золота, НПВС, соединения ртути), болезнь минимальных изменений (пробенецид, этосуксимид, метимазол, литий) или мезангиокапиллярный гломерулонефрит (прокаинамид, хлорпропамид, фенитоин, триметадион, параметадион).
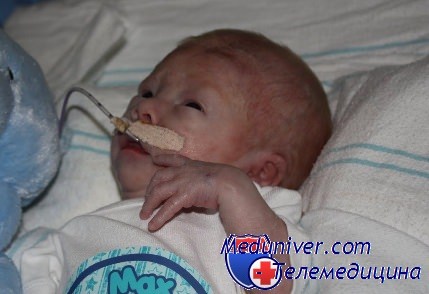
Врожденный нефротический синдром у детей
При развитии нефротического синдрома у детей первых 3 мес. жизни он считается врожденным. Чаще всего наблюдается врожденный нефротический синдром финского типа — аутосомно-рецессивное заболевание, наиболее распространенное среди потомков выходцев из Скандинавии (частота 1:8000). В его основе лежит мутация расположенного на хромосоме 19 гена NPHS1, который кодирует белок нефрин (важнейший компонент фильтрационных щелей между ножками подоцитов). Считается, что нефрин определяет нормальную функцию фильтрационного барьера в почечных клубочках. Гистологически синдром характеризуется в основном расширением проксимальных канальцев, пролиферацией клеток мезангия и склерозом клубочков.
У грудных детей обнаруживаются массивная протеинурия (которую можно определить и внутриутробно по повышению уровня а-фетопротеина) и отеки. Плацента увеличена. Больные часто рождаются недоношенными с респираторным дистрессом и расхождением швов черепа. Отеки сохраняются, часто возникают инфекционные заболевания, и к 5-летнему возрасту больные обычно погибают от почечной недостаточности. Кортикостероиды и иммуносупрессивные средства неэффективны.
Уменьшить протеинурию и улучшить состояние больных можно с помощью ингибиторов АПФ, индометацина и односторонней нефрэктомии. Однако в этих случаях чаще выполняют двустороннюю нефрэктомию с последующим постоянным диализом и активными диетическими мерами. В конце концов требуется трансплантация почки. В семьях, где имелись или имеются больные с врожденным нефротическим синдромом финского типа, для пренатальной диагностики определяют уровень а-фетопротеина в амниотической жидкости. Диагноз можно подтвердить данными анализа ДНК.
Другие причины врожденного нефротического синдрома включают врожденные инфекции, такие как сифилис, токсоплазмоз, краснуха и ЦМВ-инфекция, а также ВИЧ и вирус гепатита В. Поражение почек в этих случаях выражено слабее, чем при врожденном нефротическом синдроме финского типа, и излечение основного заболевания смягчает или устраняет почечную патологию.
У небольшого числа больных с врожденным нефротическим синдромом наблюдается диффузный мезангиальный склероз с прогрессирующим склерозом мезангия клубочков и быстрым ухудшением функции почек. Терминальная стадия почечной недостаточности развивается за несколько месяцев или лет. Диффузный мезангиальный склероз может быть как отдельным заболеванием, так и проявлением синдрома Дени-Дрэша (сочетание нефробластомы с мужским псевдогермафродитизмом). В основе этого синдрома лежит мутация гена опухоли Вильмса (WT1) на хромосоме 11.
– Также рекомендуем “Функция канальцев почек. Канальцевая фильтрация”
Оглавление темы “Заболевания почек у детей”:
- Нефротический синдром у детей. Причины и диагностика
- Идиопатический нефротический синдром у детей. Диагностика
- Лечение нефротического синдрома у детей. Гормоны
- Осложнения нефротического синдрома у детей. Прогноз
- Вторичный и врожденный нефротические синдромы у детей. Диагностика
- Функция канальцев почек. Канальцевая фильтрация
- Почечный канальцевый ацидоз. Проксимальноканальцевый
- Цистиноз у детей. Синдромы Лоу и Фанкони
- Дистальноканальцевый ацидоз у детей. Клиника
- Гиперкалиемический некроз почечных канальцев у детей. Диагностика и лечение
Источник
Нефротический синдром у детей — это симптомокомплекс, который клинически проявляется отеками и снижением диуреза. Лабораторные признаки патологии — протеинурия, гиперлипидемия, гипоальбуминемия и диспротеинемия. Синдром развивается при первичных гломерулопатиях, аутоиммунных, онкогематологических и сердечно-сосудистых заболеваниях. Для диагностики проводят анализы крови и мочи, биопсию почки, ЭхоКГ и ЭКГ. Лечение включает длительные курсы иммуносупрессорной терапии (глюкокортикоиды, алкилирующие агенты, ингибиторы кальциневрина) в комбинации с нефропротекторными, гипотензивными и мочегонными препаратами.
Общие сведения
Распространенность нефротического синдрома составляет 12-16 случаев на 100 тыс. детского населения. Ежегодно нефрологи выявляют от 2 до 7 новых случаев заболевания на 100 тысяч пациентов младше 18 лет. Патология не относится к самостоятельным нозологическим единицам, а представляет собой один из синдромов почечных или внепочечных болезней. Актуальность этой проблемы в педиатрической практике обусловлена сложностью терапии и частыми случаями резистентности к лекарствам.

Нефротический синдром у детей
Причины
У детей чаще выявляются первичные формы нефротического синдрома, вызванные поражением клубочкового аппарата почек. В 85% морфологическим субстратом является болезнь минимальных изменений, до 5-7% составляет фокально-сегментарный гломерулосклероз, 4-6% отводится мезангиопролиферативному гломерулонефриту. Вторичный вариант заболевания имеет несколько этиологических факторов:
- Аутоиммунные процессы. Они сопровождаются образованием иммунных комплексов и провоспалительных цитокинов, которые откладываются в почечных капиллярах, нарушая работу фильтрационной системы органа. У детей причиной могут послужить системные васкулиты, системная красная волчанка, синдром Шегрена.
- Злокачественные опухоли. Почечные поражения возникают при лимфоме Ходжкина и неходжкинских новообразованиях, которые зачастую встречаются в детском возрасте. Среди менее распространенных онкологических факторов выделяют множественную миелому, солидные опухоли.
- Токсические повреждения почек. Нефротический синдром возможен при длительном и бесконтрольном приеме ребенком нестероидных противовоспалительных средств и некоторых антибиотиков. Поражение почек также наблюдается при отравлении солями тяжелых металлов, ядами змей и перепончатокрылых насекомых.
- Нарушения почечного кровотока. Повышенная секреция белка в мочу происходит при структурных повреждениях почечных клубочков на фоне тотальной ишемии. Она может быть вызвана тромбозом почечной вены, серповидно-клеточной анемией, злокачественной гипертензией.
- Врожденные гломерулопатии. У детей встречается синдром Альпорта, для которого характерны мутации коллагеновых волокон в базальных мембранах клубочков. Реже диагностируется болезнь Фабри, когда нефропатия связана с нарушениями метаболизма сфинголипидов.
Патогенез
На начальных этапах нефротического синдрома развивается протеинурия, вызванная повышением проницаемости почечного фильтра для белков. Это обусловлено структурно-функциональными повреждениями компонентов почечного клубочка. Большую роль в этом процессе имеют аутоиммунные механизмы: активированные Т-лимфоциты вырабатывают специфические цитокины, которые повреждают клеточные мембраны и «щелевые» контакты подоцитов.
Повышенная потеря белков с мочой снижает онкотический показатель крови. Как следствие, жидкость по градиенту давления начинает перемещаться из сосудистого русла в ткани. Таким образом формируются массивные нефротические отеки. Их интенсивность зависит от степени белковых потерь и активности компенсаторных механизмов. В 10% случаев отечный синдром развивается вследствие первичной задержки натрия в организме.
Симптомы
Для патологии типично острое начало, связь с перенесенной инфекцией, переохлаждением, вакцинацией или обострением хронической соматической болезни. Сначала ребенок жалуется на общую слабость, недомогание, сонливость и заторможенность. Реже беспокоят головные и абдоминальные боли, тошнота, снижение аппетита. У девочек-подростков бывают нарушения менструального цикла.
Основное проявление нефротического синдрома — отеки. Вначале они возникают на лице (утром) и на голенях (вечером, после длительной ходьбы), а затем постепенно распространяются по всему телу. Первоначально они мягкие, расположены симметрично, кожа над ними теплая и сухая. Параллельно с этим снижается количество суточной мочи. Периферические отеки дополняются полостными — асцитом, гидроперикардом, гидротораксом, что ухудшает состояние ребенка.
Осложнения
Негативные последствия нефротического синдрома вызваны потерей альбуминов, которые в норме выполняют ряд физиологических функций. Потеря иммуноглобулинов ухудшает иммунную защиту организма, что проявляется частыми респираторными инфекциями, рецидивирующими тонзиллитами и синуситами. Снижение количества трансферрина (переносчика железа) приводит к рефрактерной железодефицитной анемии.
Значимым осложнением для детей младшего возраста является потеря витамин-Д-связывающего белка. В результате формируется рахитоподобный синдром, нарушается минерализация и рост костей скелета. В редких случаях развивается повышенная кровоточивость из-за дефицита прокоагулянтов. При стероидорезистентном варианте болезнь в течение 5-10 лет прогрессирует до терминальной ХПН.
Диагностика
При физикальном осмотре детский нефролог обращает внимание на симметричность и расположение отеков, проводит аускультацию сердца и легких, определяет признаки асцита и увеличения печени. Симптомы не дают возможности установить клинический диагноз, поэтому врач назначает полное обследование. Составляющие диагностического комплекса:
- Анализ мочи. Патогномоничными признаками нефротического синдрома являются протеинурия более 50 мг/кг/сутки, соотношение протеин/креатинин более 2 и экскреция альбумина свыше 40мг/м2/час. Для исключения эритроцитурии и лейкоцитурии показан анализ по Нечипоренко. Функцию почек оценивают с помощью пробы Реберга.
- Анализ крови. При биохимическом исследовании выявляют уровень альбумина сыворотки менее 30 г/л, повышение уровня холестерина и триглицеридов, увеличение показателя креатинина. Уровни натрия и кальция крови снижаются, а калий может быть повышен. В коагулограмме наблюдается повышение фибриногена.
- ЭхоКГ. Ультразвуковая визуализация необходима для обнаружения гидроперикарда, морфометрических изменений крупных сосудов вследствие отеков. Также рекомендована ЭКГ, которая позволяет вовремя заметить нарушения ритма и проводимости, связанные с электролитными нарушениями.
- Биопсия почки. Пункционный забор материала выполняется при нефротическом синдроме у младенцев до 1 года и подростков старше 12 лет, а также при неэффективности стандартной медикаментозной терапии. Биоптаты подвергают световой, электронной и иммунофлюоресцентной микроскопии.
Лечение нефротического синдрома у детей
Дети с острым нефротическим синдромом подлежат обязательной госпитализации на 2-3 недели. Двигательная активность при этом не ограничивается и соответствует самочувствию больного. В диете необходимо поддерживать высокий уровень белков, а подросткам с массивными отеками рекомендовано снизить потребление поваренной соли. При выраженных потерях протеинов назначается коррекция гомеостаза коллоидными и кристаллоидными растворами.
Основу патогенетического лечения детей с нефротическим синдромом составляет иммуносупрессивная терапия с применением глюкокортикоидов. Препараты уменьшают образование и поступление в патологический очаг воспалительных клеток, угнетают секрецию медиаторов воспаления, приостанавливают формирование токсических иммунных комплексов. Терапия глюкокортикоидами проводится в 3-х режимах:
- Постоянный. Показан в начале лечения, чтобы быстро достичь фазы ремиссии. Гормоны принимаются перорально в первой половине дня в суточной дозировке 1-2 мг/кг.
- Альтернирующий. Назначается после достижения ремиссии. Стандартные дозы глюкокортикоидов используются через день, чтобы сохранить клинический эффект, но снизить риски побочных реакций.
- Пульс-терапия. Применяется при тяжелом течении нефротического синдрома. Гормоны вводятся внутривенно капельно, чтобы в короткие сроки достичь высоких концентраций лекарства в крови.
При развитии тяжелых побочных эффектов на гормональные препараты или стероидорезистентном варианте заболевания переходят на другие виды иммуносупрессоров. В детской нефрологии наилучший результат показывают ингибиторы кальциневрина, алкилирующие агенты, некоторые моноклональные антитела к лимфоцитам. Они могут вызывать нефротоксичность, поэтому во время лечения врачи контролируют уровень СКФ.
Для устранения массивных отеков проводится терапия петлевыми диуретиками в возрастных дозировках. С целью ликвидации рефрактерных полостных отеков назначаются комбинации петлевых и тиазидных мочегонных. В качестве гипотензивных и нефропротекторных средств у детей лучше всего работают ингибиторы АПФ и блокаторы рецепторов ангиотензина. Коррекцию остеопении производят препаратами витамина Д.
Прогноз и профилактика
У детей с хорошим ответом на стероидную терапию в 95% наблюдается полное выздоровление без снижения функции почек. Менее благоприятный прогноз при стероидорезистентности, поскольку у таких пациентов высокий риск формирования хронической почечной недостаточности. Однако, своевременное применение иммуносупрессоров и нефропротекторов позволяет замедлить патологический процесс.
Первичная профилактика включает рациональное назначение лекарств, раннюю диагностику и терапию аутоиммунных процессов, избегание контактов с нефротоксическими веществами. Вторичная профилактика предполагает курсы гормональной терапии при обострении основной патологии либо в случае интеркуррентного заболевания. Это необходимо для предупреждения рецидивов нефротического синдрома.
Источник
