Диф диагностика отечного синдрома методические рекомендации
План
1. Определение, классификация отеков
2. Дифференциальная диагностика отечного синдрома
3. Отечный синдром у детей ?????
4. Диагностика отеков
5. Принципы лечения отечного синдрома
- Определение, патогенез, классификация отеков
Отечный синдром – избыточное скопление жидкости в тканях организма и серозных полостях, сопровождающееся увеличением объема тканей или уменьшением серозной полости с изменением физических свойств (тургор, эластичность) и функции тканей и органов.
Патогенез:
В норме количество жидкости, притекаемой к ткани, равно количеству жидкости, отводимой от нее. Жидкость выносит из ткани продукты жизнедеятельности и приносит питательные вещества из крови. Кровеносные сосуды имеют пористую стенку, но эти поры настолько малы, что не позволяют клеткам крови, белкам и солям выходить за пределы сосудистого русла. Основные причины отеков – это разбалансировка систем поддержания обмена жидкости между тканями и кровеносными сосудами, поддерживаемая с помощью градиентов давлений.
Классификация отеков:
1) В зависимости от этиологии:
1. Кардиальные отеки – при СН
2. Гипоонкотические – заболеваниях почек, гипопротеинемия при заболеваниях печени, кахексия.
3. Венозные отёки – варикозная болезнь вен ног, тромбофлебит глубоких
4. Лимфатические отёки – лимфангиит, слоновость
5. Мембраногенные отеки – воспаление, аллергический отек, токсический отек
6. Эндокринные отеки – Микседема, водянка беременных, циклические отеки при ПМС
7. Ятрогенные (лекарственные) – Гормоны (кортикостероиды, женские половые гормоны),
гипотензивные препараты (алкалоида раувольфии, апрессин, метилдофа, бета-адреноблокаторы, клофелин, блокаторы кальциевых каналов), противовоспалительные препараты (бутадион, напроксен, ибупрофен, индометацин).
8. Другие варианты доброкачественных отеков: ортостатические и идиопатические.
2) По локализации:
1. Локальные: не воспалительного (транссудат) и воспалительного (экссудат) происхождения, связан с нарушением баланса жидкости в определенном участке тканей и органа.
– при заболеваниях вен, лимфатических сосудов, аллергических состояний.
2. Генерализованные развиваются вследствие общей гипергидротации организма, делятся на периферические и полостные (гидроторакс, гидроперикард, асцит).
1. Кардиальные отеки – при сердечных отёках обычно в анамнезе имеются указания на заболевание сердца или кардиальные симптомы: одышка, ортопноэ, сердцебиения, боли в грудной клетке. Отёки при сердечной недостаточности развиваются постепенно, обычно после предшествующей им одышки. Одновременное с отёками набухание шейных вен и застойное увеличение печени является признаками правожелудочковой недостаточности. Сердечные отёки локализуются симметрично, преимущественно на лодыжках и голенях у ходячих больных и в тканях поясничной и крестцовой областей – у лежачих больных. Кожа над областью отеков холодная, цианотичная. В тяжёлых случаях наблюдается асцит и гидроторакс. Часто выявляется никтурия.
2. Гипоонкотические возникают при гипопротеинемии, особенно дефицита альбумина.
При заболеваниях почек данный тип отёков характеризуются постепенным (нефроз) или быстрым (гломерулонефрит) развитием отёков часто на фоне хронического гломерулонефрита, диабета, красной волчанки, нефропатии беременных, сифилисе, тромбозе почечных вен, некоторых отравлениях. Отёки локализуются не только на лице, особенно в области век (отёчность лица более выражена по утрам), но и на ногах, пояснице, половых органах, передней брюшной стенке. Часто развивается асцит. Одышки, как правило не бывает. При остром гломерулонефрите характерно повышение артериального давления и возможно развитие отёка лёгких. Наблюдаются изменения в анализах мочи. При длительно существующем заболевании почек могут наблюдаться кровоизлияния или экссудаты на глазном дне. При томографии, ультразвуковом исследовании обнаруживается изменение размера почек. Показано исследование функций почек.
Болезни печени приводят к отёкам обычно в поздней стадии постнекротического и портального цирроза. Проявляются они преимущественно асцитом, который часто более выражен по сравнению с отёками на ногах. При обследовании выявляются клинические и лабораторные признаки основного заболевания. Чаще всего имеет место предшествующий алкоголизм, гепатит или желтуха, а также симптомы хронической печёночной недостаточности: артериальные паукообразные гемангиомы («звёздочки»), печёночные ладони (эритема), гинекомастия и развитые венозные коллатерали на передней брюшной стенке. Характерными признаками считаются асцит и спленомегалия.
Отёки, связанные с недостаточным питанием развиваются при общем голодании (кахектический отёк) или при резком недостатке в пище белков, а также при заболеваниях, сопровождающихся потерей белка через кишечник, тяжёлых авитаминозах (бери-бери) и у алкоголиков. Обычно присутствуют другие симптомы дефицита питания: хейлоз, красный язык, снижение массы тела. При отёках, обусловленных заболеваниями кишечника, в анамнезе нередко имеются указания на боли в кишечнике или профузный понос. Отёки обычно небольшие, локализуются преимущественно на голенях и стопах, часто обнаруживается одутловатость лица.
3. Венозные отёки
В зависимости от причины венозные отёки могут быть как острыми, так и хроническими. Для острого тромбоза глубоких вен типичны боль и болезненность при пальпации над поражённой веной. При тромбозе более крупных вен обычно наблюдается также и усиление поверхностного венозного рисунка. Если хроническая венозная недостаточность обусловлена варикозным расширением вен или несостоятельностью (постфлебитической) глубоких вен, то к ортостатическим отёкам добавляются симптомы хронического венозного стаза: застойная пигментация и трофические язвы.
4. Лимфатические отёки
Эта разновидность отёков относится к местным отёкам; они обычно болезненны, склонны к прогрессированию и сопровождаются симптомами хронического венозного застоя. При пальпации область отёков плотная, кожа утолщена («свиная кожа» или корка апельсина»), при поднятии конечности отёчность убывает медленней, чем при венозных отёках. Выделяют идиопатическую и воспалительную формы отёка (самая частая причина последней – дерматофития), а также обструктивную (в результате хирургического вмешательства, рубцевания при радиационном поражении или при неопластическом процессе в лимфатических узлах), приводящих к лимфостазу. Длительный лимфатический отёк приводит к накоплению в тканях белка с последующим разрастанием коллагеновых волокон и деформацией органа – слоновостью.
5. Мембраногенные отеки. Обусловлены повышенной проницаемостью мембран капилляров.
Аллергический отек. Он развивается настолько быстро, что может угрожать жизни человека, если появляется в области шеи и лица. Из-за чрезмерной реакции организма на проникновение чужеродного вещества (аллергена) резко расширяются сосуды в области внедрения, что приводит к выходу жидкости в окружающие ткани. В области шеи этот отек приводит к сдавлению и отеку гортани и голосовых связок, трахеи – затрудняется или прекращается полностью поступление воздуха в легкие и пациент может погибнуть от удушья. Такое состояние обычно называют отеком Квинке.
Травматический отек – отёчность после механической травмы сопровождается болью и болезненностью при пальпации и наблюдаются в зоне перенсенной травмы (ушиб, перелом и т.д.)
Воспалительный отек, сопровождается болью, покраснением, повышением температуры. Причина этого в перерастяжении венозных сосудов из-за повышения притока крови, снижение эффективности их работы по отведению жидкости из воспаленной области и повышение проницаемости их стенки под действием белков, реагирующих на воспаление.
Токсический отек возникает при укусах змей, насекомых, при воздействии боевых отравляющих веществ.
Источник
В статье представлен алгоритм диагностики и диуретическая терапия при отечном синдроме
Отечный синдром встречается часто. Причины его развития весьма многообразны: хроническая сердечная недостаточность (ХСН), патология почек, повышенное венозное давление вследствие недостаточности венозных клапанов, острый венозный тромбоз, сдавление вен извне, нарушение лимфатического оттока, гипопротеинемия и пр.
Пациенты с периферическими отеками направляются к кардиологу, как правило, с диагнозом ХСН. В первую очередь кардиолог решает задачу – подтвердить или исключить сердечное происхождение отеков. Решить эту задачу помогают:
1) клинические особенности отеков при недостаточности кровообращения;
2) выявление системной венозной гипертензии;
3) наличие признаков органического заболевания сердца.
1. Периферические отеки.
• Распределение отеков обусловлено действием силы тяжести – они локализуются в наиболее низко расположенной части тела (у ходячих больных возникают преимущественно отеки ног, у лежачих – отеки спины, поясницы, крестца) и обычно отсутствуют на лице, руках, в верхней части туловища.
• Отеки ног, как правило, симметричны (стопы, голени, бедра увеличены в одинаковой степени).
• Симметричность отеков необходимо оценивать, чтобы связать их с недостаточностью кровообращения. Для этого следует измерить окружности голеней и бедер. Если они окажутся разными, то необходимо искать местные нарушения кровообращения, прежде всего патологию венозной и лимфатической систем.
• Асимметричные отеки ног исключают сердечную недостаточность как единственную их причину.
2. Признаки системной венозной гипертензии.
• Набухлость яремных вен.
• Застойное увеличение печени.
Набухание и пульсация шейных вен – это характерный симптом повышения центрального венозного давления. У здорового человека в вертикальном положении тела вены шеи не видны. Чтобы оценить наполнение наружных яремных вен, следует уложить пациента на спину на кровати с приподнятым под углом в 45 градусов изголовьем (рис. 1). Именно при таком положении тела давление в правом предсердии сердца соответствует 10 см H2O. В норме вены в таком положении выглядят запавшими либо наполняются до уровня не более чем 1–2 см над рукояткой грудины (до нижнего края musculus sternocleidomastoideus), наполнение вен при вдохе меньше, чем при выдохе. 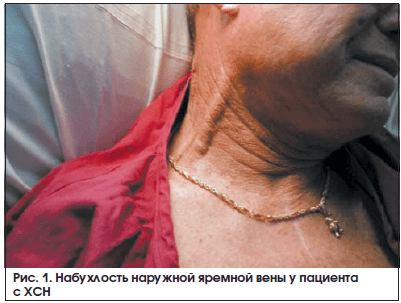
Если же переполнение и расширение шейных вен заметно и в вертикальном положении, значит, имеет место общий (правожелудочковая сердечная недостаточность, а также заболевания, повышающие давление в грудной клетке и затрудняющие отток венозной крови через полые вены) или местный (сдавление вены снаружи – опухоль, рубцы и т. п., либо ее закупорка тромбом) венозный застой. Причем если при заболеваниях органов дыхания шейные вены набухают лишь при выдохе, за счет повышения внутригрудного давления и затруднения притока крови к сердцу, то при ХСН набухание шейных вен отмечается постоянно. Если в положении стоя наполнение яремных вен достигает угла нижней челюсти, то венозное давление превышает 25 см H2O.
При правожелудочковой сердечной недостаточности с застоем венозной крови в большом круге кровообращения может присутствовать и их медленная пульсация (положительный венный пульс). Такая пульсация возникает в результате возврата (регургитации) крови из правого желудочка в правое предсердие. Пульсация шейных вен отличается от пульсации сонных артерий меньшей амплитудой, отсутствием ее ощущения при пальпации.
Признаком венозной гипертензии может быть и расширение вен рук, если при поднимании руки они не спадаются. Густав Гертнер (Gaertner) предложил для клинической практики простой прием ориентировочного определения уровня давления в правом предсердии: чем выше необходимо поднимать руку, чтобы спались поверхностные вены руки, тем выше давление в правом предсердии (высота, на которую поднимается рука от уровня правого предсердия, выраженная в миллиметрах, приблизительно соответствует величине венозного давления).
Застойное увеличения печени. Печень называют резервуаром для застойной крови и манометром правого предсердия. Гепатомегалия представляет классическое проявление недостаточности правого желудочка. Повышенное центральное венозное давление передается в печеночные вены и мешает току крови к центральной части дольки – развивается центральная портальная гипертензия. Полнокровие печени обычно сопровождается увеличением ее размеров. Системная венозная гипертензия может также проявляться пульсацией печени (у больных с недостаточностью правого предсердно-желудочкового клапана). Поэтому у всех больных необходимо определять размеры печени (по крайней мере, по правой среднеключичной линии). Нельзя ограничиваться только определением нижнего края печени, т. к. это может привести к грубой ошибке в оценке размеров печени при низком стоянии купола диафрагмы (например, у больных с эмфиземой легких).
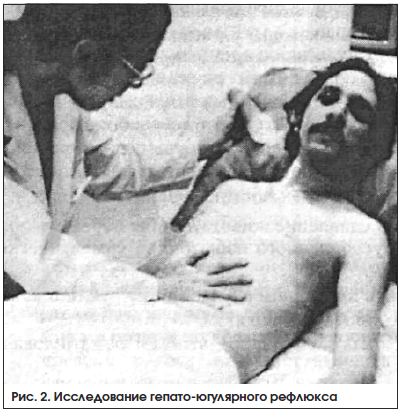
При отсутствии выраженного набухания шейных вен для выявления полнокровия печени применяется проба с надавливанием на живот в области правого подреберья (давить надо осторожно, но достаточно сильно в течение 1 мин, в это время больной нормально дышит и не натуживается).
В норме при надавливании на подреберье или на живот давление в шейных венах либо останется прежним, либо снижается, т. к. повышение внутрибрюшного давления при надавливании на живот снижает венозный возврат из бедренных вен почти так же эффективно, как жгуты, наложенные на бедра. А при венозном полнокровии вследствие правожелудочковой недостаточности выдавливание крови из венозных депо увеличивает венозный возврат и вызывает повышение венозного давления. Чем выше становится набухлость и выраженность пульсации яремной вены при нажатии на живот, тем выше венозное давление. Этот прием носит название гепато-югулярного рефлюкса (рис. 2). Этот термин появился в 1885 г. В то время считалось, что ключевым компонентом рассматриваемой пробы является нажатие на увеличенную печень и что эта проба выявляет исключительно трикуспидальную регургитацию. В действительности же эффект может быть достигнут как при нормальных размерах печени, так и при нажатии на любую область живота, хотя наиболее выраженная реакция действительно имеет место именно при надавливании в правом верхнем квадранте живота. 
Компрессия живота позволяет выявить относительное повышение венозного давления даже в тех случаях, когда его абсолютная величина нормализовалась на фоне терапии.
При недостаточности трехстворчатого клапана может определяться пульсация печени, обусловленная обратным поступлением части крови из правого желудочка сердца в полые вены или препятствием оттоку из них.
3. Признаки органического заболевания сердца. Увеличение размеров правых отделов сердца, определяемое клинически или с помощью инструментальных методов, всегда имеется на той стадии систолической сердечной недостаточности, когда возможно развитие отеков.
Диагностировать сердечную недостаточность с сохранной фракцией выброса труднее, поскольку увеличения размеров камер сердца может не быть. В таких случаях существенную помощь оказывает определение уровня натрийуретических пептидов.
Высвобождение предсердного (ANP) и мозгового (BNP) натрийуретических пептидов происходит в ответ на растяжение стенки миокарда и повышение внутриполостного давления в предсердиях и желудочках. Определение ANP и, особенно, BNP позволяет проводить скрининг среди ранее не леченных больных, у которых имеется подозрение на наличие дисфункции левого желудочка. У пациентов с изолированной диастолической дисфункцией уровень BNP в плазме крови достоверно повышен пропорционально степени тяжести диастолической дисфункции. По динамике концентрации BNP можно судить об эффективности проводимой терапии и титровать дозу препаратов.
Наличие отеков при ХСН является показанием для терапии петлевыми диуретиками. Препараты этой группы блокируют реабсорбцию Na, K и Cl из первичного фильтрата в толстом сегменте восходящего участка петли Генле. Вследствие увеличения выделения Na+ происходит вторичное (опосредованное осмотически связанной водой) усиленное выведение воды и увеличение секреции K+ в дистальной части почечного канальца. У больных с отечным синдромом диуретики дают клиническое улучшение более быстро, чем любое другое лекарственное средство для лечения ХСН.
Основным представителем этого класса является фуросемид. Он вызывает быстро наступающий, сильный и кратковременный диурез. После приема внутрь действие фуросемида начинается через 30–60 мин, достигая максимума через 1–2 ч, эффект длится – 2–3 ч. Во время действия фуросемида выведение Na+ значительно возрастает, однако с окончанием действия фуросемида скорость выведения Na+ уменьшается и становится ниже исходного уровня (синдром рикошета или отмены). Феномен обусловлен активацией ренин-ангиотензинового и других антинатрийуретических нейрогуморальных звеньев регуляции в ответ на массивный диурез. Быстрое снижение объема циркулирующей крови вследствие форсирования диуреза уменьшает уровень предсердного натрийуретического фактора в плазме, стимулирует аргинин-вазопрессивную и симпатическую системы, вызывает вазоконстрикцию. При приеме 1 р./сут, вследствие феномена рикошета, фуросемид может не оказать существенного влияния на суточное выведение Na+.
Торасемид (Тригрим®) при назначении per os быстро и практически полностью абсорбируется, как и фуросемид, пик его концентрации в плазме достигается в течение первых 2 ч. Однако период полувыведения препарата и продолжительность его действия по меньшей мере вдвое выше, чем у фуросемида [1]. Диуретическое действие его плавное [2, 3]. Объем выделенной жидкости, а также экскреция натрия и хлоридов возрастают линейно при назначении препарата в дозе 2,5–100 мг/сут [4].
Благодаря длительному натрийуретическому и диуретическому действию торасемид можно назначать 1 р./сут. В отличие от фуросемида, феномен рикошета не характерен для торасемида. Это объясняется не только его длительным действием, но и присущей ему антиальдостероновой активностью [4]. Наряду с прямым калийуретическим эффектом препарат оказывает косвенное калийсберегающее действие. В результате при лечении торасемидом в дозе до 10 мг/сут экскреция калия с мочой увеличивается лишь во время нескольких часов диуреза, однако общая, суточная экскреция калия при этом практически не изменяется.
Сопоставление влияния торасемида и фуросемида на качество жизни и частоту госпитализаций у больных с ХСН проведено в ряде проспективных рандомизированных исследований [3, 5, 6].
Улучшение переносимости физических нагрузок наблюдалось у 62% пациентов, лечившихся торасемидом, и 55% пациентов, принимавших фуросемид. Была отмечена тенденция к большей эффективности в отношении клинических симптомов ХСН: периферические отеки, одышка, влажные хрипы в легких, никтурия и др. Лечение торасемидом сопровождалось более значительным уменьшением индексов одышки и утомляемости, хотя достоверная разница между группами была выявлена только при оценке утомляемости через 2, 8 и 12 мес. У больных, получавших торасемид, частота госпитализаций по поводу сердечной недостаточности оказалась ниже, чем у пациентов группы фуросемида (17 и 39% соответственно; p<0,01). Меньше оказалась и длительность пребывания больных в стационаре в связи с сердечной недостаточностью (106 и 296 дней соответственно; p=0,02) [6].
Подобные результаты были получены при ретроспективном анализе 12-месячного опыта применения торасемида и фуросемида в Швейцарии и Германии более чем у 1200 больных с сердечной недостаточностью [7]. В обеих странах частота госпитализаций при лечении торасемидом была ниже (3,6 и 1,4% в Швейцарии и Германии соответственно), чем при применении фуросемида (5,4 и 2,0% соответственно). Применение торасемида позволило снизить общие затраты на лечение больных примерно в 2 раза за счет сокращения среднего числа дней, проведенных ими в стационаре.
Изучению эффективности и безопасности неинтенсивного режима дегидратации торасемидом в сравнении с фуросемидом при лечении больных с декомпенсированной ХСН было посвящено многоцентровое рандомизированное сравнительное исследование ДУЭЛЬ–ХСН [8, 9], в котором приняли участие 30 клинических центров из 23 городов РФ.
Начальная доза торасемида составляла 20 мг/сут и титровалась по необходимости. В итоге средняя доза торасемида в активной фазе составила 21,7, а перед выпиской – 14,5 мг/сут. В группе терапии фуросемидом лечение начинали с дозы 80,0 мг/сут и корректировали ее по мере необходимости. Средняя доза фуросемида составила 75,6 мг/сут, а перед выпиской – 50,4 мг/сут.
Начиная с первого же дня лечения потеря массы тела была большей в группе лечения торасемидом, причем со 2–х суток лечения эти различия приобретали достоверный характер. В итоге потеря массы тела около 4 кг, устранение симптомов гипергидратации были достигнуты к 7-му дню в группе торасемида и к 12-му дню в группе фуросемида – разница в скорости наступления компенсации 5 дней. В обеих группах больных улучшение клинического состояния сопровождалось увеличением толерантности к нагрузкам. Полная компенсация достигнута у 94,8% при терапии торасемидом и у 86,1% (р<0,01) при лечении фуросемидом.
По данным крупного сравнительного исследования TORIC (TORsemide in Congestive heart failure), в котором сравнивали фиксированные дозы 40 мг/сут фуросемида и 10 мг/сут торасемида у 1377 больных с ХСН II–III функционального класса [2], торасемид по эффективности превосходил фуросемид. Так, уменьшение функционального класса по NYHA было отмечено у 45,8 и 37,2% больных 1–й и 2-й групп соответственно (p=0,00017). Кроме того, торасемид реже вызывал гипокалиемию, частота, которой в конце исследования в 1-й и 2-й группах составила 12,9 и 17,9% соответственно (p=0,013). Общая и сердечно-сосудистая смертность в группе пациентов, принимавших торасемид, была достоверно ниже (2,2% против 4,5% в группе сравнения; p<0,05)
Торасемид в отличие от большинства других петлевых диуретиков не усугубляет нежелательную у пациентов с ХСН гиперактивацию симпатической нервной системы [10]. При лечении торасемидом плазменная концентрация норадреналина оставалась стабильной, в то время как при применении фуросемида наблюдалось достоверное увеличение этого показателя (с 370±170 до 481±247 пг/мл; р<0,05).
Интересной находкой является торможение развития миокардиального фиброза при применении торасемида [9, 11]. Морфологическое исследование ткани миокарда межжелудочковой перегородки, полученной при биопсии у пациентов с ХСН II–IV функционального класса, выявило достоверное уменьшение экспрессии проколлагена I типа и коллагена I типа в группе, принимавшей торасемид; у тех, кому назначали фуросемид, указанные изменения отсутствовали. Прием торасемида, но не фуросемида, сопровождается угнетением карбокситерминальной протеиназы проколлагена I типа – фермента, обусловливающего внеклеточное накопление коллагена в миокарде, активируемое избытком альдостерона
Минимальный риск возникновения гипокалиемии при назначении торасемида, отсутствие гиперактивации симпатической нервной системы, способность уменьшать выраженность миокардиального ремоделирования во многом позволяют объяснить положительное влияние торасемида на долгосрочный прогноз больных ХСН.
Источник
