Дисфункция эндотелия при метаболическом синдроме
Что является причиной развития метаболического синдрома и инсулинорезистентности (ИР) тканей? Какова связь между ИР и прогрессированием атеросклероза? На эти вопросы пока не получено однозначного ответа. Предполагают, что первичным дефектом, лежащим в основе развития ИР, является дисфункция эндотелиальных клеток сосудов.
Эндотелий сосудов представляет собой гормонально активную ткань, которую условно называют самой большой “эндокринной железой” человека. Если выделить из организма все клетки эндотелия, их вес составит приблизительно 2 кг, а общая протяженность – около 7 км. Уникальное положение клеток эндотелия на границе между циркулирующей кровью и тканями делает их наиболее уязвимыми для различных патогенных факторов, находящихся в системном и тканевом кровотоке. Именно эти клетки первыми встречаются с реактивными свободными радикалами, с окисленными липопротеинами низкой плотности, с гиперхолестеринемией, с высоким гидростатическим давлением внутри выстилаемых ими сосудов (при артериальной гипертонии), с гипергликемией (при сахарном диабете). Все эти факторы приводят к повреждению эндотелия сосудов, к дисфункции эндотелия, как эндокринного органа и к ускоренному развитию ангиопатий и атеросклероза. Перечень функций эндотелия и их нарушений перечислены в таблице 1.
Функциональная перестройка эндотелия при воздействии патологических факторов проходит несколько стадий:
I стадия – повышенная синтетическая активность клеток эндотелия, эндотелий работает как “биосинтетическая машина”.
II стадия – нарушение сбалансированной секреции факторов, регулирующих тонус сосудов, систему гемостаза, процессы межклеточного взаимодействия. На этой стадии нарушается естественная барьерная функция эндотелия, повышается его проницаемость для различных компонентов плазмы.
III стадия – истощение эндотелия, сопровождающееся гибелью клеток и замедленными процессами регенерации эндотелия.
Из всех факторов, синтезируемых эндотелием, роль “модератора” основных функций эндотелия принадлежит эндотелиальному фактору релаксации или оксиду азота (NO). Именно это соединение регулирует активность и последовательность “запуска” всех остальных биологически-активных веществ, продуцируемых эндотелием. Оксид азота не только вызывает расширение сосудов, но и блокирует пролиферацию гладкомышечных клеток, препятствует адгезии клеток крови и обладает антиагрегантными свойствами. Таким образом, оксид азота является базовым фактором антиатерогенеза.
К сожалению, именно NO-продуцирующая функция эндотелия оказывается наиболее ранимой. Причина тому – высокая нестабильность молекулы NO, являющейся по природе своей свободным радикалом. В результате благоприятное антиатерогенное действие NO нивелируется и уступает место токсическому атерогенному действию других факторов поврежденного эндотелия.
В настоящее время существуют две точки зрения на причину эндотелиопатии при метаболическом синдроме. Сторонники первой гипотезы утверждают, что дисфункция эндотелия вторична по отношению к имеющейся ИР, т.е. является следствием тех факторов, которые характеризуют состояние ИР – гипергликемии, артериальной гипертонии, дислипидемии. При гипергликемии в эндотелиальных клетках активируется фермент протеинкиназа-С, который увеличивает проницаемость сосудистых клеток для белков и нарушает эндотелий-зависимую релаксацию сосудов. Кроме того, гипергликемия активирует процессы перекисного окисления, продукты которого угнетают сосудорасширяющую функцию эндотелия. При артериальной гипертонии повышенное механическое давление на стенки сосудов приводит к нарушению архитектоники эндотелиальных клеток, повышению их проницаемости для альбумина, усилению секреции сосудосуживающего эндотелина-1, ремоделированию стенок сосудов. Дислипидемия повышает экспрессию адгезивных молекул на поверхности эндотелиальных клеток, что дает начало формированию атеромы. Таким образом, все перечисленные состояния, повышая проницаемость эндотелия, экспрессию адгезивных молекул, снижая эндотелий-зависимую релаксацию сосудов, способствуют прогрессированию атерогенеза.
Сторонники другой гипотезы считают, что дисфункция эндотелия является не следствием, а причиной развития ИР и связанных с ней состояний (гипергликемии, гипертонии, дислипидемии). Действительно, для того чтобы соединиться со своими рецепторами, инсулин должен пересечь эндотелий и попасть в межклеточное пространство. В случае первичного дефекта эндотелиальных клеток трансэндотелиальный транспорт инсулина нарушается. Следовательно, может развиться состояние ИР. В таком случае ИР будет вторичной по отношению к эндотелиопатии (рис. 1).
Рис. 1. Возможная роль дисфункции эндотелия в развитии синдрома инсулинорезистентности
Для того, чтобы доказать эту точку зрения, необходимо исследовать состояние эндотелия до появления симптомов ИР, т.е. у лиц с высоким риском развития метаболического синдрома. Предположительно, к группе высокого риска формирования синдрома ИР относятся дети, родившиеся с низким весом (менее 2,5 кг). Именно у таких детей впоследствии в зрелом возрасте появляются все признаки метаболического синдрома. Связывают это с недостаточной внутриутробной капилляризацией развивающихся тканей и органов, включая поджелудочную железу, почки, скелетную мускулатуру. При обследовании детей в возрасте 9–11 лет , родившихся с низким весом, было обнаружено достоверное снижение эндотелий-зависимой релаксации сосудов и низкий уровень антиатерогенной фракции липопротеидов высокой плотности, несмотря на отсутствие у них других признаков ИР. Это исследование позволяет предположить, что, действительно, эндотелиопатия первична по отношению к ИР.
До настоящего времени не получено достаточных данных в пользу первичной или вторичной роли эндотелиопатии в генезе ИР. В то же время неоспоримым является факт, что эндотелиальная дисфункция является первым звеном в развитии атеросклероза, связанного с синдромом ИР. Поэтому поиск терапевтических возможностей восстановления нарушенной функции эндотелия остается наиболее перспективным в предупреждении и лечении атеросклероза. Все состояния, входящие в понятие метаболического синдрома (гипергликемия, артериальная гипертония, гиперхолестеринемия) усугубляют дисфункцию эндотелиальных клеток. Поэтому устранение (или коррекция) этих факторов безусловно будет способствовать улучшению функции эндотелия. Перспективными препаратами, позволяющими улучшить функцию эндотелия, остаются антиоксиданты, устраняющие повреждающее воздействие окислительного стресса на клетки сосудов, а также лекарства, повышающие продукцию эндогенного оксида азота (NO), например, L-аргинин.
В таблице 2 перечислены препараты, у которых доказано антиатерогенное действие посредством улучшения функции эндотелия. К ним относятся: статины (симвастатин), ингибиторы ангиотензинпревращающего фермента (в частности, эналаприл), антиоксиданты, L-аргинин, эстрогены.
Экспериментальные и клинические исследования по выявлению первичного звена в развитии ИР продолжаются. Одновременно идет поиск препаратов, способных нормализовать и сбалансировать функции эндотелия при различных проявлениях синдрома инсулинорезистентности. В настоящее время стало совершенно очевидно, что тот или иной препарат только в том случае сможет оказать антиатерогенное воздействие и предупредить развитие сердечно-сосудистых заболеваний, если он прямо или опосредованно восстанавливает нормальную функцию эндотелиальных клеток.
Симвастатин –
Зокор (торговое название)
(Merck Sharp & Dohme Idea)
Эналаприл –
Веро-эналаприл (торговое название)
Источник
Введение
Если вы в последнее время читали о сердечно-сосудистых заболеваниях или недавно разговаривали с врачом о профилактике или лечении сердечно-сосудистых заболеваний, возможно, вы встречали термин «эндотелиальная дисфункция». Концепция эндотелиальной дисфункции стала важной в последние годы для нашего понимания многих сердечно-сосудистых заболеваний, включая ишемическую болезнь сердца (ИБС), артериальную гипертензию, микрососудистую стенокардию (кардиальный синдром Х), диастолическую дисфункцию и другие.
Эндотелиальная дисфункция — это состояние, при котором эндотелиальный слой (внутренняя оболочка) малых артерий не может нормально выполнять все свои важные функции. В результате с тканями, которые снабжаются этими артериями, может случиться несколько неприятных процессов.
Функция эндотелиального слоя
В артериолах организма (небольших артериях, которые точно регулируют поток крови к тканям) эндотелиальный слой (или эндотелий) является внутренней оболочкой клеток, которая выполняет несколько критических функций.
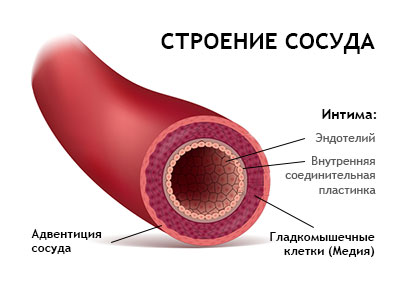
Эндотелий поддерживает правильное расширение и сужение кровеносных сосудов. Эта функция мгновенно определяет, сколько крови поступает в различные ткани организма. Эндотелиальный «тонус» (баланс между дилатацией и сужением) также в значительной степени определяет кровяное давление человека и то, сколько работы сердце должно проделать, чтобы выкачать кровь в организм.
Кроме того, эндотелий также защищает ткани от различных токсических веществ; регулирует механизм свертывания крови; контролирует жидкость, электролиты и многочисленные другие вещества, которые проходят между кровью и тканями; и регулирует воспаление в тканях.
Все это означает, что правильное функционирование эндотелия имеет решающее значение для нормального функционирования тканей и органов организма.
Когда эндотелиальный слой не выполняет все эти функции адекватно — иными словами, при наличии эндотелиальной дисфункции — условие будет благоприятствовать развитию атеросклероза, гипертонии (артериальной гипертензии) и другим сердечно-сосудистым заболеваниям.
Причины эндотелиальной дисфункции
Поскольку эндотелий так важен для многих жизненно важных функций, проводится много исследований, чтобы понять все причины эндотелиальной дисфункции. В этот момент очевидно, что эндотелиальная дисфункция связана со снижением уровня оксида азота (NO) в стенках кровеносных сосудов.
Оксиды азота представляют собой газ, который образуется в результате метаболизма аминокислоты (L-аргинин). Оксиды азота, имеющие очень короткий период полураспада, действуют локально в кровеносных сосудах, помогая модулировать тонус сосудов и другие важные эндотелиальные функции.
Дефицит продукции NO приводит к избыточному сужению кровеносных сосудов (которое может вызвать артериальную гипертензию), способствует активации тромбоцитов (приводит к свертыванию крови), увеличивает стимуляцию воспаления в стенках кровеносных сосудов (что способствует атеросклерозу) и увеличивает проницаемость стенок сосудов для повреждения липопротеинов и различных токсинов.
Подводя итог, можно сказать, что эндотелиальная дисфункция характеризуется снижением уровня оксида азота (NO) в сосудах, что, в свою очередь, приводит к нескольким нарушениям функции кровеносных сосудов. Эти функциональные нарушения способствуют развитию сердечно-сосудистых патологий.
Кроме того, эндотелиальная дисфункция может непосредственно вызывать аномальное сужение мелких артерий, и считается, что она является основным фактором, вызывающим кардиальный синдром Х и, возможно, диастолическую дисфункцию.
Нарушения и расстройства, сопутствующие эндотелиальной дисфункции

Точные причины, по которым у человека развивается эндотелиальная дисфункция, все еще изучаются. Тем не менее, очевидно, что этому способствуют многочисленные медицинские расстройства, привычки и неизбежные жизненные события, в том числе:
- повышенное кровяное давление (артериальная гипертензия);
- сахарный диабет;
- повышенные уровни холестерина и триглицеридов ЛПНП;
- курение;
- сидячий образ жизни;
- эмоциональный стресс (считается, что стрессовая кардиомиопатия, также известная как «синдром разбитого сердца» или кардиомиопатия Такоцубо, возникает в результате острой и тяжелой формы эндотелиальной дисфункции);
- инфекционные заболевания;
- сердечная недостаточность;
- гипотиреоз;
- остеопороз;
- естественное старение;
- химиотерапия и лучевая терапия;
- генетические влияния.
Диагностика
Делать формальный диагноз эндотелиальной дисфункции обычно нет необходимости. Некоторая степень дисфункции эндотелия может быть с уверенностью диагностирована у всех, кто имеет ишемическую болезнь сердца, гипертонию или основные факторы риска сердечно-сосудистых заболеваний (особенно перечисленные выше).
Таким образом, обследование эндотелиальной функции пациента — это не то, чем обычно занимаются врачи. Но если эндотелиальная дисфункция заподозрена у человека без четких причин (например, у человека, предположительно, имеющего кардиальный синдром X), диагноз может быть подтвержден различными диагностическими тестами, которые измеряют способность кровеносных сосудов расширяться (во время катетеризации или с помощью ультразвукового исследования) в ответ на введение ацетилхолина.
Лечение эндотелиальной дисфункции
Функционирование эндотелия может быть улучшено с помощью мер, направленных на снижение риска сердечно-сосудистых заболеваний, включая потерю веса, физические упражнения, прекращение курения, контроль гипертонии и диабета, которые всем нам обычно настоятельно рекомендуются.
Некоторые из этих мер контроля рисков были хорошо зарекомендованы для снижения эндотелиальной дисфункции. К ним относятся:
- применение статинов (фармацевтические препараты, направленные на борьбу с высокими уровнями холестерина в крови человека);
- средиземноморская диета;
- другие пищевые продукты, включая орехи, оливковое масло, темный шоколад, зеленый чай, растительные продукты;
- аэробные упражнения;
- потеря лишнего веса;
- применение ингибиторов АПФ (группа природных и синтетических химических соединений, применяющихся для терапии и профилактики сердечной и почечной недостаточности, для снижения артериального давления).
Кроме того, в настоящее время изучается несколько лекарственных препаратов, специально предназначенных для клинического улучшения эндотелиальной дисфункции. К перспективным агентам относятся нифедипин, эстроген, рунолазин, аспирин, L-аргенин и сильденафил.
Заключение
В последние годы медицинские исследования установили, что эндотелиальная дисфункция является важным фактором, способствующим возникновению многих видов сердечно-сосудистых расстройств. В то время как ведутся активные исследования по поиску путей улучшения лечения эндотелиальной функции и, следовательно, снижения риска сердечно-сосудистых заболеваний, мы уже многое можем сделать сами для решения этой проблемы. В частности, следует уделять большое внимание физическим упражнениям, бросать курить и при наличии таких заболеваний, как гипертония или диабет, работать с докторами.
Источник
Библиографическое описание:
Мухамедова, Н. Х. К механизму дисфункции эндотелия при метаболическом синдроме у женщин репродуктивного и постменопаузального периода / Н. Х. Мухамедова. — Текст : непосредственный // Молодой ученый. — 2015. — № 11 (91). — С. 683-687. — URL: https://moluch.ru/archive/91/19722/ (дата обращения: 21.10.2020).
В последние годы у женщин основными пусковыми моментами формирования метаболического синдрома (МС) служат сахарный диабет (СД) и менопауза. По данным различных авторов, распространенность МС у женщин в пременопаузе, менопаузе и постменопаузе составляет 54 и 69 % соответственно. Автором проанализированы итоги некоторых исследований, показывающих роль МС в развитии ССЗ и эндотелиальной дисфункции.
Ключевые слова: метаболический синдром, инсулинорезистентности, глюкоза, эндотелина-1. фактор Виллебранда, общего холестерина, менопауза, индекс НОМА.
In recent years women’s basic starting torque formation metobolicheskogo syndrome are diabetes and menapauza.According to various avtorov,aspostrane 54and 69 %MS in women premenapauze and postmenapauze is respectively. Analyse the results of the author of some studies suggerst arole in the development of MS and CVD endotelialnoymdisfunktsi.
Keywords:Metabolic syndrome, insulinorezistentnosti, clucoza, endotelin-1,factor Willebrand, total holisterin, menopauz, index НОМА
Около 10 % женской популяции на сегодняшний день составляют женщины в постменопаузе. По данным демографических исследований 26 млн. женщин ежегодно проходят через феномен менопаузы [6]. На постменопаузальный период приходится одна треть женской популяции, в которой она сохраняет свою профессиональную и социальную активность. У женщин основными пусковыми моментами формирования метаболического синдрома (МС) служат сахарный диабет (СД) и менопауза. По данным различных авторов, распространенность МС у женщин в пременопаузе, менопаузе и постменопаузе составляет 53; 54 и 69 % соответственно [4, 5, 6, 8, 9]. По современным представлениям, в основе синдрома инсулинорезистентности (ИР), а также атеросклероза лежит дисрегуляция и активация эндотелия с появлением на его мембране клеточных молекул адгезии. Ряд авторов полагают, что дисфункция эндотелия (ДЭ) служит ранним проявлением атеросклероза и предшествует ангиопатическим проявлением ССЗ [11]. ДЭ имеет значение в развитии тромбоза, неоангиогенеза, ремоделирования сосудов, внутрисосудистой активации тромбоцитов и лейкоцитов путем выработки специфических факторов. Нарушения их обнаруживаются практически при всех ССЗ, атеросклерозе, диабете, гипертонии и др. Совершенно очевидно, что выявление ведущих биомаркеров риска развития артериальной гипертонии в период менопаузы имеет большое значение для разработки методов профилактики развития осложнений постменопаузального периода.В литературе имеются сведения о роли ДЭ в формировании МС [10]. Однако, сравнительный анализ показателей ДЭ у женщин различных возрастных групп с МС не проводился, что и определило цель настоящего исследования.
Цель работы: сравнительный анализ показателей ДЭ у женщин репродуктивного и постменопаузального периодов с МС.
Материал и методы исследования. В исследование включено 89 женщин, больных МС, находившихся на обследовании и лечении в кардиологических отделениях 3-й клиники ТМА. Среди больных было 36 женщин репродуктивного возраста (25–35 лет) (1-я группа) и 53 в постменопаузальном периоде (50–60 лет) (2-я группа). Группу контроля составили 37 практически здоровых женщин репродуктивного (22 женщин) и постменопаузального периода (15 лиц), не имевших клинических признаков острых и хронических заболеваний любой природы. Диагноз МС устанавливали на основании определения Международной Диабетической Федерации (IDF, 2005), в соответствии с которым состояние человека может быть обозначено как МС, если у него имеется: центральное ожирение плюс любые два из 4-х факторов: повышенный уровень триглицеридов (ТГ), сниженный холестерин ЛПВП, повышенное АД, повышенный уровень глюкозы в плазме натощак или ранее диагностированный СД типа 2 [11]. Критерии включения больных в исследование: подписание пациентом добровольного информированного согласия и высокая готовность следовать предписаниям врача; возраст от 30 до 60 лет; наличие достоверного диагноза МС в соответствии с дефинициями универсального (worldwide) определения IDF, 2005. Критерии исключения больных из исследования: возраст старше 60 лет или моложе 37 лет; СД типа 1 или СД тип 2, инсулинопотребный. На всех больных заполнялась индивидуальная регистрационная карта, включавшая паспортную часть, жалобы, данные анамнеза и результаты антропометрических (рост, масса тела, окружность талии (ОТ), окружность бедер (ОБ), физикальных и лабораторно-инструментальных исследований. Всем пациентам проводились лабораторно-инструментальные исследования: общий и биохимический анализы крови (глюкоза, липопротеиды низкой плотности (ЛПНП), ЛПВП, ТГ, общий холестерин (ОХС), креатинин, мочевую кислоту, билирубин, общий белок, С-реактивный белок (СРБ), пероральный глюкозотолерантный тест, рассчитывали индекс HOMA и CARO, исследование крови на маркеры вирусных гепатитов, ЭКГ, ЭхоКГ, УЗИ органов брюшной полости. Уровни инсулина, эндотелина, гомоцистеина в плазме крови определяли иммуноферментным методом на анализаторе АТ-858 (LTD, Китай). Определение уровня эндотелина-1 (ЭТ-1) проводили с использованием набора Endotelin (1) фирмы «Biomedica» (Австрия), гомоцистеина — Homocystein «AXSIS». Определяли количество десквамированных эндотелиацитов, фактор Виллебранда,фибринопектина. Определение активированного частично тромбоцитарного времени (АЧТВ) проводилось с помощью стандартных наборов фирмы Behring (Германия).Биохимические исследования проводились в ЦНИЛ ТМА. Статистическая обработка результатов исследования проводилась с помощью программ «MicrosoftExсelXP» и «Statistica 6,0».
Результаты и их обсуждение. Проведенные исследования показали наличие отягощенной наследственности (у 47,2 и 45,3 %), АГ (у 72,2 и 88,7 %), СД-2 типа (у 11,1 и 22,6 %), наличие толерантности к глюкозе (у 27,8 и 43,2 %), ИБС (у 27,8 и 41,5 %), неалкогольного жирового перерождения печени (36,1 и 66 %) у пациенток 1-й и 2-й групп, соответственно. При этом ИМТ составил 34,6±6,1 и 36,8±3,7 (в контрольной группе 28,3±2,7), показатели САД и ДАД превышали значения практически здоровых женщин в 1,35 и 1,18 раза в 1-й, в 1,61 и 1,33 раза — во 2-й группах, соответственно. Полученные результаты свидетельствовали о наличии основных компонентов МС у женщин, частота и выраженность их зависела от возраста пациенток, т. е. в большей степени выявлялись в постменопаузальном периоде, что соответствует данным литературы [4]. У пациенток 1-й и 2-й групп отмечена нарушенная гликемия натощак (табл. 1). Гиперинсулинемия отмечалась у67,7 и 79,2 % пациенток 1-й и 2-й групп с МС. У 72,2 и 90,6 % пациенток выявлено повышение индекса HОМА, вычисленного по инсулину. При этом его значения в общей популяции статистически значимо превышали в 1,54 и 1,9 раза показатели практически здоровых женщин, а индекс CARO — достоверно снижались в 1,55 и 1,84 раза, соответственно. Полученные данные свидетельствуют о более выраженном нарушении обмена углеводов у пациенток в менопаузе, видимо, обусловленное резким дефицитом эстрогенов [2, 8, 9].
Таблица 1
Основные лабораторные характеристики обследованных пациентов, M±m
Параметры | контрольная, n=37 | 1-я группа, n=36 | 2-я группа, n=53 |
Глюкоза, ммоль/л | 5,13±0,19 | 6,19±0,24а | 6,32±0,33а |
ИРИ, мкЕД/мл | 6,51±0,15 | 12,04±0,43а | 15,22±0,74а |
Индекс НОМА | 1,27±0,04 | 1,95±0,09а | 2,41±0,13а,б |
Индекс CARO | 0,79±0,03 | 0,51±0,02а | 0,43±0,02а,б |
ОХС, ммоль/л | 5,88±0,14 | 5,93±0,24 | 6,59±0,41а,б |
ХС ЛПНП, ммоль/л | 4,38±0,16 | 5,14±0,11а | 5,97±0,33а |
ХС ЛПВП, ммоль/л | 1,72±0,05 | 1,41±0,03а | 1,14±0,04а,б |
ТГ, ммоль/л | 1,09±0,03 | 1,76±0,04а | 2,17±0,14а,б |
Примечание: а — p<0,05 по сравнению с контролем; б — p<0,05 по сравнению с показателями 1-й группы.
Анализ показателей липидного обмена у пациенток 1-й и 2-й групп показал достоверное повышение уровня триглицеридов в 1,61 и 2 раза соответственно, что совпадало с частотой развития ожирения, неалкогольного жирового перерождения печени и увеличением ИМТ в обследованных группах. Если уровень ОХС у пациенток 1-й группы сохранялся в пределах нормативных значений, то во 2-й группе он статистически значимо возрастал в 1,12 раза. Содержание ХС в ЛПНП достоверно превышал показатели практически здоровых лиц в 1,17 и 1,36 раза, а в ЛПВП — достоверно снижалось по мере увеличения возраста женщин. Это совпадало с частотой встречаемости в этих группах АГ и ИБС, указывая на важную роль нарушения обмена ХС в исследованных группах.
Эндотелиальную дисфункцию можно определить как неадекватное (увеличенное или сниженное) образование в эндотелии различных биологически активных веществ. Одним из методов оценки выраженности ДЭ является оценка содержания в крови этих веществ или исследование содержания в крови факторов, повреждающих эндотелий, уровень которых коррелирует с ДЭ. Проведенные в этом плане исследования показали статистически значимое увеличение содержания одного из важных факторов вазоконстрикции — ЭТ-1 в сыворотке крови пациенток с МС (табл. 2). Его значения в 1-й возрастали в 1,56 раза, во 2-й — в 2,42 раза относительно значений практически здоровых женщин. Следует сказать, что в физиологических концентрациях ЭТ-1 действует на эндотелиальные рецепторы, вызывая высвобождение факторов релаксации, а в более высоких — активирует рецепторы на гладкомышечных клетках, стимулируя стойкую вазоконстрикцию. Установлено прогностическое его значение при нарушении сердечной деятельности, он является маркером коронарного атеросклероза и коронарной эндотелиальной дисфункции [11]. Поскольку ЭТ действует преимущественно местно, естественно предположить, что повышение его образования и поступления в кровь может быть причиной возникновения и усугубления тяжести течения ИБС при МС, особенно у пациенток в постменопаузальном периоде. Другим фактором, приводящим к ДЭ, является гомоцистеин. Определение его концентрации у пациенток репродуктивного и постменопаузального периодов с МС показало статистически значимое увеличение в 1,75 и 2,08 раза относительно значений практически здоровых пациенток, соответственно. По мнению ряда авторов, повышенное содержание гомоцистеина является независимым фактором риска возникновения атеросклероза, инфаркта миокарда и смерти. Увеличение концентрации этой аминокислоты в крови (более 22 мкмоль/л) связано с четырехкратным повышением риска возникновения тромбоза глубоких вен. ГГЦ является одним из звеньев патогенеза ранней тромбоваскулярной болезни у больных СД-2 типа. При длительном воздействии повреждающих факторов, каким является гипергомоцистинемия, происходит постепенное истощение компенсаторной дилатирующей способности эндотелия и преимущественным ответом эндотелиальных клеток на обычные физиологические стимулы становится гиперпродукция вазоконстрикторных медиаторов.
В последние годы установлена роль гиперурикемии в развитии ДЭ. Исследование уровня мочевой кислоты показало достоверное повышение его в 1,37 и 1,45 раза у пациенток МС в репродуктивном и менопаузальном периодах. В многочисленных эпидемиологических и клинических исследованиях, доказана связь гипреурикемии с ИР, абдоминальным ожирением, АГ, ИБС, атерогенным дислипопротеинемиями, интенсификацией перекисного окисления липидов, снижением активности ферментов антиокислительной системы [1,3, 10, 11]. При этом ГИ, наблюдаемая при ИР и СД-2 типа, способствуют снижению экскреции мочевой кислоты. Видимо, этим связана более высокая предрасположенность у женщин постменопаузального периода к развитию гиперурикемии. Гипергомоцистеинемия и гиперурикемия сопряжены с повреждением эндотелия и развитием системной воспалительной реакции [7]. Действительно, анализ уровня СРБ и фибриногена показал их достоверное повышение в обеих группах пациенток, особенно у женщин в постменопаузальном периоде. Учитывая проатерогенный, провоспалительный и прокоагулянтный эффекты острофазных белков, можно предположить, что у обследованных нами пациенток будет развиваться ДЭ. Это, в свою очередь, будет приводить к увеличению числа десквамированных эндотелиоцитов, что и наблюдали мы в наших исследованиях. Так, количество десквамированных эндотелиоцитов возросло в 1,75 и 2,48 раза у пациенток 1-й и 2-й групп, соответственно.
Таблица 2
Показатели дисфункции эндотелия у пациенток с метаболическим синдромом, M±m
Параметры | контрольная, n=37 | 1-я группа, n=36 | 2-я группа, n=53 |
Гомоцистеин, мкмоль/л | 9,33±0,39 | 16,34±0,79а | 19,43±1,16а,б |
Мочевая кислота, мкмоль/л | 286,41±11,35 | 391,36±20,34а | 415,22±20,74а |
Эндотелин, пг/мл | 0,50±0,04 | 0,78±0,02а | 1,21±0,07а,б |
Содержание десквамированных эндотелиоцитов, 104/л | 4,01±0,21 | 7,03±0,38а | 9,94±0,42а,б |
ФакторВиллебранда, % | 109,41±8,22 | 118,67±9,44 | 146,59±8,41а,б |
Фибронектин,мкг/мл | 201,33±12,12 | 236,48±14,21а | 285,97±10,33а,б |
Активированное частич-нотромбопластиновое время, сек | 41,41±2,34 | 50,38±4,12а | 70,14±4,04а,б |
СРБ,мг/дл | 2,87±0,18 | 4,25±0,28а | 5,42±0,32а,б |
Фибриноген, г/л | 3,24±0,17 | 3,97±0,19а | 4,92±0,24а,б |
Примечание: а — p<0,05 по сравнению с контролем; б — p<0,05 по сравнению с показателями 1-й группы.
Это указывает на повреждение внутреннего слоя интимы сосудов и развитие начальных проявлений локальных ишемических расстройств. Следствием их, по-видимому, становится подъем содержания фактора Виллебранда и фибронектина в сыворотке крови у женщин репродуктивного и, особенно в менопаузе, существенно превышающие показатели практически здоровых женщин. Изучаемые показатели, секретируемые эндотелием, участвуют в гемостазе, т. е. инициируют адгезию и агрегацию тромбоцитов, а также участвуют в запуске прокоагулянтного звена системы свертывания крови [10, 11]. Наряду с этим в результате нарушения функции эндотелиальные клетки продуцируют аномальное количество коагуляционных факторов, что приводит к смещению баланса между тромбогенными и тромборезистентными свойствами сосудистой стенки в сторону увеличения тромбогенного потенциала. Действительно, анализ уровня фибриногена и АЧТВ у пациенток с МС показал прогрессирующее их статистически значимое увеличение, выраженность которых зависела периода жизни пациенток. Следовательно, дисфункция эндотелия, развитие гиперкоагуляции и системного воспалительного синдрома могут усугублять имеющиеся нарушения в эндотелии и, как следствие риск развития вазоконстрикции и тромбозов, особенно у пациенток в постменопаузальном периоде. Таким образом, у женщин с МС, особенно в постменопаузальном периоде, на фоне гормональных перестроек происходят значимые изменения в сосудистой системе организма, обусловливая ДЭ. Следствием повреждения сосудистого эндотелия становится компенсаторная активация рецепторов гладкомышечных клеток, стимулируя стойкую вазоконстрикцию. В данной ситуации высокоспецифическими маркерами ДЭ служат десквамированные эндотелиоциты, ЭТ-1, фактор Виллебранда и фибронектин.
Литература:
1. Баженов Л. Г., КосниковаИ.В., Шаниева З. А. Гиперурикемия как фактор риска развития сердечно-сосудистых заболевания и их осложнений // Кардиология Узбекистана.- 2013.- Т.28(1–2).- C.92–96.
2. Балан В. Е. Юренева С. В. Сметник В. П. Ильина Л. М. Кардиометаболические расстройства у женщин в постменопаузе: негативная роль андрогенов с позиций доказательной медицины //Проблемы репродукции.- 2013.-№ 3.-С. 77–85.
3. Дмитриев А. Н. Метаболический синдром: маркеры индивидуальной предрасположенности, диагностика доклинической стадии, обоснование тактики ведения пациентов //Автореф. дис… к.м.н.- М., 2011.- 24.с.
4. Зайдиева Я. З. Особенности течения климактерия у женщин с эндокринными заболеваниями // Русский медицинский журнал.- 2007.- Т.15,№ 11.-С.925–928.
5. Каримова А. М. Состояние некоторых компонентов воспалительного статуса у больных метаболическим синдромом //Автореф. дис….к.м.н.- Махачкала, 2008.- 19с.
6. Каюмова Д. Т. Менопаузальный метаболический синдром // Новости дерматовенерологии и репродуктивного здоровья.- 2008.- № 1.- С.38–41.
7. Линева О. И., Глухова М. В., Сумина Н. В., Знобищева Г. В. Сравнительная эффективность негормональных препаратов в купировании климактерического синдрома с метаболическими нарушениями//Акушерство и гинекология.-2013.-№ 12.-С.71–75
8. Мавлянов И. Р., Даминова Д. Т., Абдуллаев А. К., НурметовХ. Т. Патогенетическое значение гиперурикемии в формировании и развитии патологических процессов обусловленной метаболическим синдромом // Кардиология. — 2013. — Т.53,№ 5. — C. 87–93.
9. Маркеры дисфункции эндотелия //В кн. «Каталог БиоХимМак».- 2007.- С.49–55.
10. Мирошниченко И. И., Птицына С. Н., Кузнецова Н. И., Калмыков Ю. М. Гомоцистеин — предиктор патологических изменений в организме человека. //Русский медицинский журнал.- 2009.- Т.17(4).- С.224–227.
11. Петрищев Н. Н. Дисфункция эндотелия. Причины, механизмы, фармакологическая коррекция.-СПб.: Изд-во СПб ГМУ, 2003.-184 с.
Основные термины (генерируются автоматически): женщина, CARO, пациентка, IDF, метаболический синдром, мочевая кислота, раз, достоверное повышение, женская популяция, неалкогольное жировое перерождение.
Источник
