Дроспиренон в лечении предменструального синдрома

Статья посвящена определению эффективности лечения предменструальных симптомов путем назначения комбинированного орального контрацептива, содержащего дроспиренон. Показано, что назначенное лечение способствовало улучшению предменструальных симптомов. Комбинированный оральный контрацептив дроспиренон является препаратом выбора при лечении предменструальных симптомов.

Введение
Предменструальный синдром (ПМС) – патологический симптомокомплекс, проявляющийся нервно-психическими, вегетососудистыми и эндокринно-метаболическими нарушениями при отсутствии органической патологии со стороны центральной нервной системы (ЦНС) и репродуктивной системы. Симптомы появляются во время лютеиновой фазы менструального цикла и исчезают спонтанно с началом менструации. Частота ПМС достигает 75–95% среди женщин репродуктивного возраста, 24–38% женщин по причине выраженных предменструальных симптомов нуждаются в медицинской помощи и соответствующем лечении; от 3–5% до 8% женщин страдают от предменструальных симптомов тяжелой степени, ПМС средней степени тяжести встречается в 14–29% случаев [1, 2].
Большое число авторов считают, что болевой синдром обязательно присутствует в различных формах ПМС, при этом боль играет существенную роль как
в клиническом, так и в социальном плане. Болевые симптомы определяют тяжесть ПМС, ощущение боли влияет на эмоциональное, психическое и общее состояние женщины, на отношения в семье, среди коллег, снижает работоспособность [2, 3].
Много десятилетий исследователи разных стран пытались объяснить патогенетические механизмы ПМС. В настоящее время в медицинской литературе описан ряд теоретических гипотез патогенеза ПМС: теория «водной интоксикации», генетическая (наследственная) теория, гормональная теория, нейроэндокринная теория [1, 4]. Гормональная теория впервые была предложена R. Frank (1931) и позже подтверждена другими исследователями (K. Muse, A. Magos, J. Studd). Эта теория основана на специфической особенности ПМС: предменструальные симптомы отсутствуют до менархе, тесно связаны с фазами менструального цикла, отсутствуют при ровном уровне гормонов яичников (ановуляция, удаление яичников, менопауза и т. д.), предменструальные симптомы отсутствуют в течение беременности и появляются или исчезают при назначении гормонального лечения. Предменструальные симптомы могут быть при аменорее в случае гистерэктомии без придатков [5].
Вовлечение гормонов яичников в патогенез предменструальных симптомов и расстройств на уровне ЦНС представляет особый интерес, в особенности после того, как было открыто действие гормонов яичников как нейромодуляторов.
Многочисленные исследования не показали значимых различий уровня гормонов и биохимических показателей у женщин с проявлениями ПМС по сравнению со здоровыми женщинами. ПМС возникает на фоне нормальной функции яичников (без нарушения баланса гормонов), а овуляция является толчком для запуска ряда нейроэндокринных механизмов, которые проявляются в виде предменструальных симптомов; у женщин с ПМС снижен резерв адаптации. Сущность ПМС состоит в неправильной реакции ЦНС (гипоталамуса) на циклические физиологические колебания репродуктивных гормонов в течение менструального цикла. Запуск развития предменструальных симптомов обусловлен падением уровня гормонов, в особенности эстрогенов в лютеиновой фазе менструального цикла, таким образом, репродуктивные гормоны прямо или косвенно воздействуют на серотонергическую систему и нейромодуляторы [6].
В настоящее время доказано, что появление предменструальных симптомов связано с овуляцией, таким образом, внимание исследователей было направлено на подавление овуляции как метод лечения ПМС, патогенетически аргументированный. С целью достижения подавления овуляции используются несколько групп препаратов: комбинированные оральные контрацептивы (КОК), прогестерон, эстрогены, агонисты гонадотропин-рилизинг гормона (ГнРГ (GnRH)) и даназол [7].
КОК часто применяются в лечении ПМС, эффективность лечения ими составляет 61–63%. При формировании искусственного менструального цикла происходят подавление функции системы гипоталамус – гипофиз – яичник и подавление овуляции. Посредством механизма обратной связи (feed-back) в гипофизе снижается секреция фолликулостимулирующего гормона (ФСГ) и лютеинезирующего гормона (ЛГ), что подавляет циклическую секрецию гормонов в яичниках, таким образом, достигается постоянный уровень гормонов в плазме, отсутствуют циклические колебания уровня гормонов [8, 9].
КОК III поколения обладают высокой селективностью и сниженным андрогенным и метаболическим эффектом. Синтетические прогестины, входящие в состав КОК III поколения, вызывают побочные реакции в виде симптомов, подобных симптомам ПМС (тяжесть в молочных железах, головная боль, задержка жидкости, эмоциональная нестабильность и т. д.) примерно в 30% случаев, чаще всего побочные реакции отмечаются во время семидневного перерыва приема препарата. Т.В. Pearlsein et al. (2005) [10] предложили назначение КОК, содержащих дроспиренон, позже другие исследователи подтвердили высокую эффективность дроспиренона в лечении предменструальных симптомов [11–13].
Дроспиренон – это аналог спиронолактона, антагонист андрогеновых рецепторов, обладает высоким сродством к рецепторам прогестерона и глюкокортикоидов, оказывает антиминералокортикоидный, прогестиновый и антиандрогеновый эффекты. КОК, содержащие дроспиренон, подавляют овуляцию, блокируют циклические колебания репродуктивных гормонов, способствуют устранению задержки жидкости. Важно отметить, что дроспиренон воздействует на различные элементы патогенеза ПМС, доказано его влияние в отношении соматических и психоэмоциональных симптомов. Побочные реакции при приеме по контрацептивной схеме 21/7 достигают 27% [9, 14].
Цель исследования состояла в определении эффективности и приемлемости гормонального лечения ПМС при назначении КОК, содержащего дроспиренон (ДРСП 3 мг / EE30 мкг) по схеме 21/7 дней.
Материал и методы
В исследование были включены 136 пациенток с ПМС в возрасте 15–45 лет, с регулярным менструальным циклом, которые не использовали КОК в последние 6 мес., не являются беременными или кормящими <6 мес. Все пациентки в течение 6 последующих месяцев и более до начала исследования испытывали предменструальные симптомы. Диагноз ПМС был поставлен на основании диагностических критериев Американского колледжа акушеров и гинекологов (ACOG) и Британского королевского колледжа акушеров и гинекологов (RCOG) [15, 16]. Всем пациенткам был назначен КОК, содержащий дроспиренон (ДРСП 3 мг / EE30 мкг) в течение 3 менструальных циклов по контрацептивной схеме 21/7 дней. Пациентки были проинформированы о возможных побочных реакциях, было получено добровольное информированое согласие пациенток на участие в данном исследовании.
В исследовании были использованы медицинские амбулаторные карты и комплексная индивидуальная анкета, из которых были получены общие данные (возраст, социальный статус, образ жизни, вредные привычки, род занятий), анамнез (перенесенная экстрагенитальная и генитальная патология), характер менструального цикла, клинические симптомы, связанные с менструацией, и репродуктивная функция. Клиническое обследование включало общее и гинекологическое обследование, УЗИ органов малого таза и молочных желез. Пациентки с жалобами на головную боль, связанную с менструацией, были дополнительно консультированы врачом-неврологом для исключения очаговой неврологической патологии.
До настоящего времени не существует методов лабораторной диагностики ПМС и, соответственно, нет возможности лабораторно или инструментально определить эффективность назначенного лечения. Эффективность лечения была установлена на основании динамического наблюдения состояния пациенток при оценке данных, полученных при заполнении специальных опросников-анкет. Для определения клинических предменструальных проявлений были использованы менструальный дистресс-опросник (Menstrual Distress Questionnaire, MDQ) [17] и менструальный опросник. Менструальный дистресс-опросник был заполнен дважды в лютеиновой фазе менструального цикла: первый раз – до начала лечения, второй раз – на третьем месяце лечения. Менструальный опросник был заполнен в течение трех циклов еженедельно.
Статистическая обработка результатов исследования была выполнена с использованием программного обеспечения «Статистика 7.0» (StatSoft Inc.). Статистическая обработка позволила рассчитать средние показатели, показатель пропорции. Для того чтобы определить разницу между средними значениями, использовали Т-тест (t), для того чтобы считать различия статистически значимыми,
p-value должно было быть менее 0,05 (p<0,05).
Результаты исследования
В исследование были включены женщины репродуктивного возраста (средний возраст составил 30,33±5,68 года) с предменструальными симптомами. Средняя продолжительность менструального цикла составила 28,66±1,32 дня, длительность менструации – 4,12±0,92 дня. Основные данные пациенток, участвующих в исследовании, представлены в таблице 1. 
Условия труда и жизни у данных пациенток были удовлетворительными. Анализ данных анамнеза не выявил хронических заболеваний.
Средняя длительность заболевания (ПМС) составила 6,6±1,45 года. Симптомы появлялись за 5–10 дней до начала менструации и спонтанно исчезали в 1–2-й дни менструации, средняя длительность симптоматического периода составила 7,69±0,62 дня в месяц. Наиболее часто встречались следующие симптомы: тяжесть и боли в молочных железах, тазовые боли, боли другой локализации, головные боли, нестабильность настроения, утомляемость, отеки. Данные симптомы оказывают отрицательное влияние на общее
состояние и поведение (межличностные отношения и трудоспособность) и требуют назначения лечения [18].
Решение относительно применения КОК в исследовании было принято индивидуально в каждом отдельном случае, с учетом показаний и противопоказаний, необходимости контрацепции, переносимости препарата, информированного согласия пациентки. Пациентки, участвующие в исследовании, соответствовали категориям 1 и 2 критериев
приемлемости методов контрацепции [19].
Применение лечебных мероприятий для подавления овуляции при помощи назначения КОК с целью устранения предменструальных симптомов у пациенток, участвующих в исследовании, способствовало снижению интенсивности предменструальных симптомов, уменьшению количества и продолжительности их экспрессии, отмечались статистически значимые отличия, начиная с первого месяца.
Оценка данных менструальных опросников, заполненных во время лечения, показала значительное снижение симптомов в течение первого месяца лечения и более выраженный результат в третьем месяце (табл. 2). До начала лечения пациентки с ПМС отмечали ряд наиболее часто встречающихся болевых симптомов в предменструальном периоде: головные боли – 66,18% случаев, тяжесть и боль в молочных железах – 83,08%, тазовые боли – 70,58%, вздутие живота и боли в животе – 64,7%, мышечные и суставные боли – 51,47%.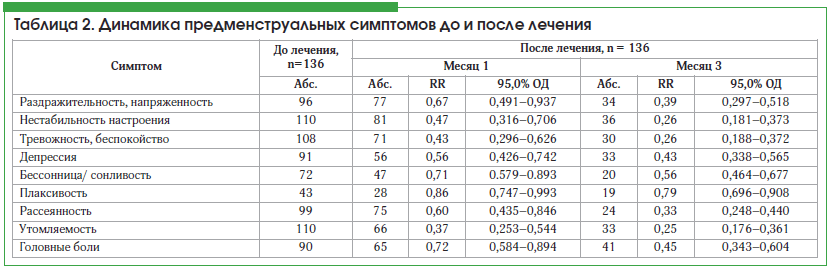
Поскольку дроспиренон проявляет антиминералокортикоидный эффект, выраженные болевые предменструальные симптомы, связанные с задержкой жидкости в организме, значительно уменьшились, в то время как динамика улучшения отличалась, как показано на рисунке 1.
Наиболее очевидные изменения отмечались в категории «тяжесть и боли в молочных железах»: в первый месяц лечения частота была снижена с 83,08±3,21% до 56,62±4,25%, после 3 мес. лечения частота симптомов снизилась в 3 раза – до 25,74±3,75% по сравнению с исходным показателем (рис. 1). Сократился и период клинического проявления симптомов, уменьшилась интенсивность боли.
При заполнении менструального дистресс-опросника до лечения определялись предменструальные симптомы умеренной степени, мы решили оценить клиническое течение, заполнив анкету повторно после трех циклов лечения. Результаты показали статистически значимую положительную динамику и значительное улучшение состояния пациенток. Клиническое улучшение отражалось в статистически значимом снижении показателей опросника, но наиболее выраженные изменения были отмечены в блоке «Болевые проявления» (табл. 3).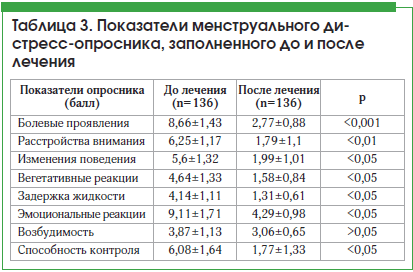
Суммарный показатель менструального дистресс-опросника в начале исследования составил 47,14 балла, а после лечения он уменьшился до 18,71 балла (р<0,001). После лечения суммарный показатель менструального дистресс-опросника достиг значения, соответствующего предменструальным симптомам легкой степени, которые не оказывают неблагоприятного воздействия на общее состояние женщины.
Обсуждение результатов
Лечение ПМС представляет собой достаточно трудную задачу. Несмотря на широкую распространенность ПМС, в терапии этого состояния остаются неразрешенными некоторые вопросы. Основными требованиями к медикаментозной терапии ПМС являются способность препаратов изменять менструальный цикл, блокируя овуляцию, и их эффективность в отношении наиболее беспокоящих симптомов (отеков, головных болей, масталгии, эмоционального дискомфорта) [12, 20].
Предменструальные симптомы проявляются циклически в предменструальном периоде, оказывают отрицательное влияние на общее состояние и поведение (межличностные отношения и трудоспособность) и требуют назначения лечения. Вопрос о причинах и механизмах появления выраженных предменструальных симптомов не решен окончательно, однако ведущее значение большинство исследователей придают циклическим колебаниям уровня репродуктивных гормонов [8, 12].
В настоящее время КОК широко используются в лечении ПМС с эффективностью 61–82,1%. Многочисленные исследования КОК разных поколений и разнообразного состава, особенно в отношении прогестинового компонента, показывают эффективность и приемлемость КОК,
содержащих дроспиренон [8, 12]. Дроспиренон – прогестин IV поколения, аналог спиронолактона с антиандрогенным, антиминералокортикоидным эффектом и прогестагеновым действием, который действует на различные звенья патогенеза ПМС, индуцирует ановуляторный менструальный цикл, предотвращает задержку жидкости, снижает напряжение молочных желез, уменьшает раздражительность и депрессию, таким образом, демонстрирует высокую эффективность в снижении выраженности соматических и психоэмоциональных симптомов ПМС. Дроспиренон включен в состав высокоэффективных КОК с минимальными побочными эффектами, а также входит в состав препаратов для менопаузальной гормональной терапии [11, 14]. Дроспиренон является производным спиронолактона, таким образом, возникает вопрос об эффективности спиронолактона в лечении ПМС. Был проведен ряд исследований относительно эффективности спиронолактона при ПМС, показавших эффективность спиронолактона в отношении соматических предменструальных симптомов. Однако данные исследования относятся к исследованиям с риском смещения («сдвиг» риска) в связи с малым числом участников [16].
Проведенное исследование показывает значительное улучшение состояния пациенток с предменструальными симптомами средней/тяжелой степени. Назначенное лече-ние (КОК, содержащий дроспиренон – ДРСП 3 мг / EE30 мкг)
сопровождалось значительным уменьшением болевых симптомов, что подтверждает снижение показателя менструального дистресс-опросника, достигнутый результат соответствует легкой степени выраженности предменструальных симптомов, которые не оказывают неблагоприятного воздействия на общее состояние женщины и не требуют медикаментозной коррекции.
Головная боль относится к симптомам, определяющим тяжесть ПМС, является причиной снижения трудоспособности и ухудшает качество жизни. Известно, что головная боль, связанная с менструацией, является более устойчивой по отношению к лечению [21]. В настоящем исследовании была проведена оценка эффективности подавления овуляции при помощи КОК в отношении головной боли, связанной с менструацией. Полученные данные свидетельствуют о достоверном снижении частоты и интенсивности головной боли, связанной с менструацией, хотя положительная клиническая динамика менее выражена по сравнению с другими болевыми симптомами.
Полученные результаты подтверждают преимущества данного метода лечения в отношении соматических предменструальных симптомов. Назначенное лечение способствовало уменьшению предменструальных симптомов, которое отмечалось с первого месяца и было значительным к концу третьего месяца, таким образом, можно сделать вывод, что оптимальная продолжительность лечения для облегчения предменструальных симптомов составляет не менее 3 мес.
Заключение
В исследовании показана высокая эффективность лечения предменструальных симптомов путем назначения КОК, содержащих дроспиренон. Назначенное лечение способствовало уменьшению болевых предменструальных симптомов, которое отмечалось с первого месяца и было значительным к концу третьего месяца. 82,1% пациенток отметили улучшение, и 79,7% пациенток оценили лечение как эффективное. Благодаря эффектам, производимым дроспиреноном, КОК (ДРСП 3 мг / EE30 мкг) является препаратом выбора при лечении предменструальных симптомов.
Источник
В.Н. ПРИЛЕПСКАЯ, д.м.н., профессор, А.В. ЛЕДИНА, Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздрава России, Москва
Предменструальный синдром (ПМС) — это часто встречающееся расстройство, ассоциированное с менструальным циклом, для лечения которого предложено множество методов медикаментозного и немедикаментозного воздействия, что обусловлено прежде всего отсутствием единой теории развития ПМС. При этом большинство авторов трактуют предменструальный синдром как гетерогенное состояние. Одним из методов патогенетически обоснованного лечения ПМС служит применение комбинированных гормональных контрацептивов. В проведенном исследовании участвовали 122 пациентки с ПМС средней и тяжелой степени тяжести. Диагноз ПМС был подтвержден проспективной оценкой ПМС-дневников. Участницы наблюдения получали препарат, содержащий 3 мг дроспиренона и 20 мкг этинилэстрадиола, в режиме 24/4. На фоне лечения КОК выраженный положительный эффект в большей степени достигнут в отношении психологических симптомов ПМС.
Женщины в большей степени, чем мужчины, страдают от различных дисфорических и психических расстройств, в частности от лабильности настроения и тревоги. Такие нарушения могут быть ассоциированы с менструальным циклом — в этом случае говорят о ПМС или предменструальном дисфорическом расстройстве (ПМДР). Психические проблемы могут возникнуть во время беременности и в послеродовом периоде, а также в период пери- и постменопаузы.
Одним из наиболее частых нарушений является ПМС, характеризующийся целым комплексом разнообразных соматических и психологических симптомов различной степени тяжести, которые возникают в лютеиновую фазу менструального цикла и прекращаются с началом менструации [1].
Предложено множество теорий для объяснения многообразия клинических проявлений. Патогенез ПМС связывают с нарушением функции гипоталамо-гипофизарно-яичниковой системы [2] и изменениями, связанными с овуляцией уровней половых стероидов[3], нарушением процессов возбуждения и торможения в центральной нервной системе (ЦНС), способных вызывать мигрень, ПМС и ПМДР [4].
Halbreich et al. (1986) и L. Andréen et al. (2009) выявили стойкую корреляцию между уровнем эстрогенов, флюктуациями прогестерона и тяжестью симптомов ПМС [5, 6]. Также одной из причин возникновения ПМС, по мнению специалистов, может быть эстроген-зависимое повышение активности ренин-ангиотензин-альдостероновой системы (РААС), активация секреции ангиотензиногена, повышение уровня ренина, альдостерона в крови [7–10]. Недостаточность прогестерона (антагониста альдостерона) также может привести к развитию гиперальдостеронизма [11], при котором активизируется реабсорбция ионов натрия в почечных канальцах и, как следствие, происходит накопление жидкости в тканях, отеки, боли в молочных железах и другие, характерные для ПМС симптомы. В этом случае патогенетически обосновано назначение комбинированных пероральных контрацептивов (КОК), способствующих восстановлению гормональных взаимоотношений, что оказывает положительный эффект в отношении физических, вегетативных и эмоциональных симптомов [12, 13].
В настоящее время в соответствии с рекомендациями FDA (Food and Drug Administration — Управление по контролю за пищевыми продуктами и лекарственными препаратами США) одним из препаратов, рекомендованных для лечения ПМС и ПМДР, является микродозированный КОК, содержащий в качестве гестагенного компонента дроспиренон. Этот гестаген — производное 17α-спиролактона — по фармакологическому действию наиболее близок к естественному прогестерону, обладает антиминералокортикоидной и антиандрогенной активностью и способен снижать вызванную эстрогенами стимуляцию РААС. Дроспиренон, связываясь с рецепторами альдостерона, оказывает блокирующее действие на альдостерон в почках, способствует повышению выделения натрия, жидкости и уменьшению отеков [14, 15].
Предложен новый и весьма перспективный режим приема препарата, содержащего 20 мкг этинилэстрадиола (ЭЭ) и 3 мг дроспиренона, — укорочение безгормонального интервала с 7 до 4 дней, что в большей степени способствует подавлению фолликулогенеза и уменьшает флюктуации гормонов, в отличие от стандартного режима 21/7. Новая схема приема дроспиренон-содержащего КОК описана некоторыми исследователями [8, 16–18].
В научно-поликлиническом отделении НЦАГиП проведено исследование, целью которого было изучить эффективность и приемлемость гормонального микродозированного КОК, содержащего 3 мг дроспиренона и 20 мкг этинилэстрадиола, при лечении средней степени тяжести и тяжелой форм ПМС у женщин, нуждающихся в контрацепции.
Материал и методы
Исследование состояло из двух этапов и продолжалось в течение 8 мес., на протяжении которых пациентки заполняли дневники для оценки степени тяжести ПМС, определения критериев включения и исключения (I этап — 2 мес.) и эффективности лечения (II этап — 6 мес.). В дневниках пациентки самостоятельно оценивали наличие и интенсивность предменструальных симптомов по шкале, которая включала 18 симптомов: перепады настроения, напряжение/раздражительность, приступы плаксивости, депрессию/уныние, беспокойство/тревожность, агрессивность/вспыльчивость, отеки, нагрубание и боли в молочных железах, вздутие и боли внизу живота, головную боль, усталость, изменение аппетита и пищевых пристрастий, бессонницу. Выраженность этих симптомов участницы наблюдения оценивали в балльной системе (от 0 до 3), при этом оценка «0 баллов» означала отсутствие симптома, «1 балл» — незначительная выраженность, «2 балла» — умеренная, «3 балла» — значительная. Критерием включения в исследование было наличие вышеперечисленных симптомов в течение 1–2 нед. перед менструацией и их исчезновение после. Кроме того, причиной этих симптомов не могли служить иные внешние факторы. Другим условием было наличие у пациенток 5 психологических симптомов и более, причем один из основных (эмоциональная неустойчивость, депрессия, беспокойство, агрессивность) должен быть значительно выраженным и оказывать влияние на социальную жизнь или работоспособность [19], а еще минимум четыре симптома — умеренно выраженными, что в соответствии с Руководством по диагностике и статистике психических расстройств IV пересмотра (DSM-IV-Diagnostic and Statistical Manual of mental disorders), разработанным Американской психиатрической ассоциацией, позволяет диагностировать ПМС.
Во время II этапа, который продолжался приблизительно 6 мес. (6 менструальных циклов), пациентки получали лечение и продолжали заполенние ПМС-дневников, фиксируя все изменения своего состояния. Нежелательные явления, возникшие в период лечения, расценивали как осложнения или побочные эффекты.
В исследование были включены 122 пациентки, которые соответствовали критериям: возраст 16–45 лет; отсутствие тяжелой экстрагенитальной патологии; продолжительность большинства менструальных циклов в течение 12 мес. 25–32 ± 2 дня; наличие подписанного пациентками информированного согласия и заполненных в течение двух менструальных циклов ПМС-дневников с суммой баллов за 7 дней до менструации не менее 18 баллов.
Пациентки при обращении в научно-поликлиническое отделение жаловались на ухудшение состояния перед менструацией. При их лечении основную оценку эффективности препарата проводили по изменению средних суммарных показателей ПМС-дневников после 1, 3 и 6-го циклов лечения в сравнении с соответствующими показателями до начала терапии. Кроме того, оценивали изменения средней суммарной величины ПМС-дневников (средняя арифметическая от суммы баллов за 7 дней до менструации) после 1-го и 2-го циклов лечения в сравнении с исходным состоянием.
Всем пациенткам был назначен препарат, содержащий 3 мг дроспиренона и 20 мкг ЭЭ (Джес®, Германия), который участницы исследования принимали по схеме 24/4 в течение 6 менструальных циклов.
Результаты
К началу исследования средний возраст пациенток составил 28,3 года (медиана 27,0; от 16 до 38 лет) (93,2%), женщины не курили и не злоупотребляли алкоголем. Средний рост пациенток группы 1,64 м (медиана 1,66 м; от 1,54 до 1,76 м), средняя масса тела 59,3 кг (медиана 59,0; от 48,0 до 89,4 кг), среднее значение ИМТ 23,2 кг/м2 (медиана 22,3; от 17,5 до 30,6 кг/м2).
Анализ результатов клинического, биохимического и гормонального обследований и исследования липидного спектра крови перед назначением лечения не выявил клинически и статистически значимых изменений, выходящих за рамки нормативных значений.
Из отмеченных в дневниках психоэмоциональных симптомов наиболее частыми проявлениями ПМС до лечения были внутреннее напряжение и раздражительность — у 92 (75,4%), агрессивность и повышенная конфликтность — у 83 (68,0%), депрессия — у 78 (63,9%) женщин, масталгия и мастодиния — у 76 (62,3%), боли различной локализации — у 67 (54,9%), изменение аппетита — у 62 (50,8%).
На фоне проводимой терапии произошло значимое уменьшение интенсивности проявлений ПМС: через 1 мес. уменьшилось внутреннее напряжение, раздражительность, боязливость, которые до лечения беспокоили 92 (75,4%) женщин, через 1 мес. лечения — 75 (61,5%). К концу периода наблюдения эти проявления сохранились у 45 (36,9%) участниц (р < 0,05). Через 1 мес. такие симптомы ПМС, как повышенная агрессивность, конфликтность, уменьшились и были выявлены у 69 (56,6%) женщин против 83 (68,0%) — до лечения (р = 0,0638), к концу 3 мес. и к окончанию курса лечения агрессивность, конфликтность беспокоили 51 (41,8%) пациентку (р < 0,05). Депрессия, чувство печали и безысходности до лечения отмечены у 72 (59,0%) обследованных, к концу 3 мес. лечения — у 55 (45,1%) пациенток (р < 0,05), к окончанию периода наблюдения — у 54 (44,3%) женщин была депрессия, чувство безысходности, печаль (р < 0,05).
Динамика метаболических проявлений ПМС была не столь выраженной: через 1 мес. повышение аппетита, изменение пищевых пристрастий выявлено у 57 (46,7%) против 62 (50,8%) женщин. Через 3 мес. 52 женщины (42,5%) по-прежнему отмечали повышение аппетита на фоне приема КОК, и этот показатель оставался стабильным на протяжении последующих 3 циклов, в течение которых пациентки получали комбинированный контрацептивный препарат (р > 0,05).
Во II фазу менструального цикла до лечения масталгия и мастодиния были у 76 (62,3%) женщин, через 1 мес. частота масталгии достоверно увеличилась и отмечалась у 89 (73,0%) пациенток (р < 0,05). Боли в молочных железах и нагрубание являются частым и прогнозируемым побочным эффектом, встречающимся при приеме контрацептивных препаратов. К окончанию 2-го мес. лечения частота масталгии/мастодинии уменьшилась до 63,9% (78 женщин), к окончанию 3-го и 6-го циклов лечения — до половины (50,0%/61 и 50,8%/62 соответственно) от исходного уровня (р = 0,0699).
Таким образом, оценка эффективности дроспиренон-содержащего контрацептивного препарата при лечении предменструального синдрома показала, что более выраженный эффект достижим в отношении психологических симптомов и в меньшей степени — физических проявлений и обменно-эндокринных проявлений. В 1-й мес. лечения отмечалось усиление частоты масталгии, интенсивность которой уменьшилась в 3-му циклу лечения (табл. 1).
Выраженность проявлений ПМС оценивали в баллах на основании данных визуальной аналоговой шкалы, о чем производилась отметка в ежедневных дневниках. Средние суммарные показатели ПМС-дневников после 1, 2, 3 и 6-го циклов в сравнении с исходными данными, представленные в таблицах/графиках, указывают на то, что в процессе лечения частота жалоб и проявлений предменструального синдрома достоверно уменьшилась: средний суммарный показатель перед началом лечения варьировал от 63,2 до 84,3 балла и в среднем составил 73,6 ± 7,3 балла. Через месяц лечения этот показатель составил в среднем 64,5 ± 6,4 балла, через 2 мес. лечения снизился до 52,3 ± 6,5 балла, к окончанию курса лечения снизился более чем в 2 раза и в среднем составил 31,9 ± 4,2 балла (рис. 1).
1. O’Brien PM et al. Towards a consensus on diagnostic criteria, measurement and trial design of the premenstrual disorders: the ISPMD Montreal consensus Arch.Womens.Ment.Health. 2011. 14(1). 13-21.
2. Lobo RA, Stanczyk FZ. New knowledge in the physiology of hormonal contraceptives. Am.J.Obstet.Gynecol. 1994. 170(5 Pt 2). 1499-1507.
3. Freeman EW, Sondheimer SJ. Premenstrual dysphoric dis¬order: recognition and treatment. Primary Care Companion. J.Clin. Psychiatry. 2003. 5. 30-39
4. Finocchi C, Ferrari M. Female reproductive steroids and neuronal excitability Neurol Sci. 2011. 32. S31-35.
5. Andréen L et al. Sex steroid induced negative mood may be explained by the paradoxical effect mediated by GABAA modulators. Psychoneuroendocrinology. 2009. 34(8). 1121-1132.
6. Halbreich U et al. Premenstrual changes and changes in gonadal hormones Acta Psychiatr Scand. 1986. 74(6). 576-586.
7. Аганезова Н.В. Ассоциация функциональных вариантов генов транспортеров серотонина и дофамина с психовегетативными нарушениями у больных с предменструальным синдромом. VII Всероссийская научно-практическая конференция с международным участием «Молекулярная диагностика– 2010». Сборник трудов. Под ред. академика РАМН В.И. Покровского. 2010. III, 13. 4-5.
8. Mishell DR Jr. YAZ and the novel progestin drospirenone J.Reprod.Med. 2008. 53(9 Suppl). 721-728.
9. Usman SB. et al. Hormonal management of premenstrual syndrome. Best. Pract. Res. Clin. Obstet. Gynaecol. 2008. 22(2). 251-260.
10. Балан В.Е., Ильина Л.М. Современный взгляд на патогенез и принципы лечения предменструального синдрома Гинекология. 2013. 15., 6. 7-10.
11. Прилепская В.Н., Межевитинова Е.А. Предменструальный синдром Гинекология. 2005. 7, 4. 210-214.
12. Rapkin AJ et al. Oral contraceptives and neuroactive steroids Pharmacol.Biochem.Behav. 2006. 84(4). 628-634.
13. Sangthawan M, Taneepanichskul S. A comparative study of monophasic oral contraceptives containing either drospirenone 3 mg or levonorgestrel 150 microg on premenstrual symptoms Contraception. 2005 Jan. 71(1). 1-7.
14. Oelkers W. Drospirenone, a progestogen with antimineralocorticoid properties: a short review Mol.Cell.Endocrinol. 2004. 31. 217(1-2). 255-261.
15. Parsey KS, Pong A. An open-label, multicenter study to evaluate Yasmin, a low-dose combination oral contraceptive containing drospirenone, a new progestogen. Contraception. 2000 Feb. 61(2). 105-111. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition. Washington, DC: American Psychiatric Press. 1994.
16. Pearlstein TB et al. Treatment of premenstrual dysphoric disorder with a new drospirenone-containing oral contraceptive formulation. Contraception. 2005. 72(6). 414-421.
17. Yonkers KA. et al. Efficacy of a new low-dose oral contraceptive with drospirenone in premenstrual dysphoric disorder Obstet.Gynecol. 2005. 106(3). 492-501.
18. Marr J. et al. Ethinyl estradiol 20μg/drospirenone 3mg 24/4 oral contraceptive for the treatment of functional impairment in women with premenstrual dysphoric disorder Int. J. Gynaecol Obstet. 2011. 113(2). 103-107.
19. Pinkerton JV. The menstrual cycle–mood disorder tandem: Screening, diagnosis, and treatment. OBG Management. 2011. 23. 12. 24-29.
20. Oinonen K, Mazmanian D. To what extent do oral contraceptives influence mood and affect? J.Affect.Disord.2002. 70(3). 229–240.
21. Рациональная фармакотерапия в акушерстве, гинекологии и неонатологии = Rationale for drug therapy in obstetrics, gynecology and neonatology: в 2 т.: руководство для практикующих врачей / под ред. В.Н. Серова, Г.Т. Сухих. 2-е изд., испр. и доп. М.: Литтерра, 2010.
Источник
