Двс синдром при септическом шоке
Сепсис. ДВС синдром при сепсисе
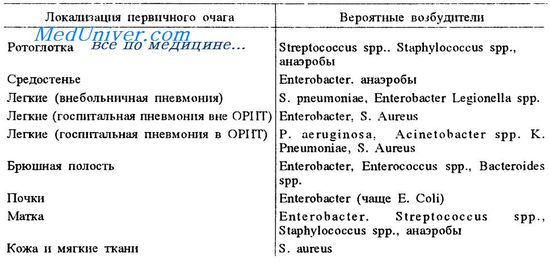
Активация при сепсисе системы гемостаза обусловлена эндото-ксемией и бактериальными липополисахаридами. Центральным медиатором сепсиса является фактор некроза опухоли (TNF—tumor necrosis factor), который вырабатывается в ответ на поступление эндотоксина. Вторичный медиатор — интерлейкин-1, концентрация которого резко возрастает после поступления в сосудистое русло TNF. Вслед за выработкой этих провоспалительных медиаторов происходит повышение уровня интерлейкина-6, который активизирует синтез в печени белков острой фазы.
Полисахариды грампозитивных бактерий также могут посредством цитокинов активизировать систему гемостаза, что резко увеличивает риск ДВС.
Иногда ДВС индуцируется фулминантной вирусной инфекцией. Тяжело протекающие инфекции сопровождаются обычно лейкоцитозом. Нейтрофильные лейкоциты вырабатывают ряд субстанций (в том числе нейтрофильную эластазу), которые вызывают дефицит AT III, а гепаринотерапия усугубляет этот процесс.
Следует иметь в виду, что применение бактерицидных антибиотиков увеличивает риск возникновения септического шока вследствие массивного поступления в русло эндотоксинов из разрушенных бактерий. Молниеносные формы сепсиса возникают на фоне иммуносупрессивнои терапии. Смертность при септическом шоке достигает 40 %. Септический шок, рефракторный к терапии, быстро, в течение нескольких часов приводит к полиорганной недостаточности и ДВС-синдрому.
В ряде случаев не удается установить возбудителя инфекции в гемокультуре больных сепсисом. Концепция системного воспалительного ответа предполагает наличие сепсиса при отсутствии (невозможности определения) возбудителя в крови в случаях выраженной характерной клиники:
• фебрильная температура (> 38 °С) или гипотермия (> 35,5 °С встречается у 10 % больных);
• тахикардия;
• тахипноэ, гипервентиляция с респираторным алкалозом. Для лабораторных показателей характерно:
• лейкоцитоз > 15 000 /мм3 или лейкопения > 3500 /мм3;
• сдвиг лейкоцитарной формулы влево, токсическая зернистость;
• изменения коагуляции — снижение числа тромбоцитов более чем на 30 % за 24 ч, снижение AT III;
• метаболические сдвиги — гиперлактатемия, гипергликемия, гипофосфатемия.
Для сепсиса характерен дефицит системы естественных антикоагулянтов, причем снижение AT III происходит ранее основных клинических проявлений сепсиса. При снижении содержания AT III ниже 60 % смертность резко возрастает.
Причины сепсиса

Количество тромбоцитов при сепсисе снижается вследствие тромбоцитопении потребления — тромбоциты связываются с фибрином, адгезируют к поврежденному эндотелию, секвестрируются в легких и печени. Тромбоцитопатия — снижение агрегирующих свойств тромбоцитов — может быть вызвана длительным применением антибиотиков.
Лечение сепсиса, септического шока и ДВС-синдрома должно носить комплексный характер и основываться на следующих принципах:
1. Хирургическое лечение очага инфекции (санация и дренирование).
2. Антибиотикотерапия, основанная на идентификации возбудителя и определении его чувствительности к соответствующей группе антибиотиков.
3. Адекватная оксигенация — необходима ранняя ИВЛ в различных режимах.
4. Инфузионная терапия — высока опасность гипергидратации, особенно в условиях тканевой гипоксии и повышения капиллярной проницаемости. Трансфузия эритроцитов не только повышает кислородтранспортную функцию крови, но и обеспечивает эффективность трансфузионной терапии. Критическим для септических больных считается содержание гемоглобина менее 70—80 г/л. Предпочтительна трансфузия свежезаготовленной эритроцитной массы.
5. Применение катехоламинов. Содержание фактора некроза опухоли (TNF) при сепсисе значительно возрастает (TNF — медиатор, обладающий выраженным кардиодепрессйвным действием).
6. Препараты AT III.
В 1985 году В. Blauhut опубликовал результат клинических исследований по применению препарата AT III (кубернина HS). У пациентов с клиникой септического шока и ДВС, которым был назначен кубернин HS, отмечено ускоренное восстановление показателей коагуляции, хотя и не было отмечено снижение смертности.
Некоторые исследователи рекомендуют поддерживать содержание AT III на уровне 140 %, это возможно при введении препарата в суммарной дозе 18 000 ЕД. Содержание AT III не должно снижаться менее 80 %.
7. Фибринолитические препараты. Установлено, что у погибших от сепсиса больных отмечалась выраженная активация коагуляции и еще более выраженное угнетение фибринолиза, что позволило предположить, что назначение фибринолитических препаратов приведет к коррекции гемостаза. Применение препаратов в экспериментах на животных с эндотоксемией повышает выживаемость и препятствует развитию легочной недостаточности.
8. Адекватное энтеральное и парентеральное питание. Рекомендуется ранний переход на энтеральное питание, которое препятствует развитию пареза желудочно-кишечного тракта и уменьшает интестинальную атрофию. В питательные смеси для энтерального питания вводятся специальные добавки: омега-3 жирные кислоты, аргинин, глутамин, рыбий жир. Раннее энтеральное питание с вышеуказанными пищевыми добавками оказывает благоприятное влияние на иммунный статус больных, и получило название «иммунного питания».
9. Поливалентные иммуноглобулины используются для нейтрализации эндотоксинов. Отмечено снижение смертности при их применении у кардиохирургических больных.
10. Методы экстракорпоральной детоксикации: гемофильтрация, плазмаферез.
– Вернуться в оглавление раздела “Хирургия”
Оглавление темы “Осложнения в трансфузиологии. Трансфузии при ДВС синдроме”:
1. Синдром иммунологической альтерации. Гипотензивные реакции при трансфузиях
2. Реакции при переливании кровезаменителей. Пирогенные и токсические реакции
3. Поздние токсические реакции в трансфузиологии. Клиника поздних токсических реакций
4. Системные отеки в трансфузиологии. Диссеминированное внутрисосудистое свертывание
5. Профилактика ДВС синдрома. Антикоагулянтная терапия при ДВС синдроме
6. Низкомолекулярные гепарины при ДВС синдроме. Заместительная терапия ДВС синдрома
7. Переливание красной крови при ДВС синдроме. Поливалентные ингибиторы протеаз в лечении ДВС синдрома
8. Антифибринолизные препараты при ДВС синдроме. Дезагреганты в лечении ДВС синдрома
9. Фибринолитики при ДВС синдроме. Экстракорпоральная детоксикация в лечении ДВС синдрома
10. Сепсис. ДВС синдром при сепсисе
Источник
ДВС-синдром наблюдается при многих заболеваниях и всех терминальных состояниях. Он характеризуется рассеянным внутрисосудистым свертыванием и агрегацией клеток крови, активацией и истощением компонентов свертывающей и фибринолитической систем (в том числе физиологических антикоагулянтов), нарушением микроциркуляции в органах с их дистрофией и дисфункцией, выраженной наклонностью к тромбозам и кровоточивости. Микротромбообразование и блокада микроциркуляции могут распространиться на всю систему кровообращения с преобладанием процесса в органах-мишенях (или шокорганах – легких, почках, печени, головном мозге, желудке и кишечнике, надпочечниках и др.) либо в отдельных органах и частях тела (региональные формы). Процесс может быть острым (часто молниеносным), подострым, хроническим и рецидивирующим с периодами обострения и стихания.
Признаки
Клиническая картина складывается из признаков основного (фонового) заболевания, обусловившего развитие внутрисосудистого свертывания крови, и самого ДВС-синдрома. Последний в своем развитии проходит следующие стадии:
- I – гиперкоагуляции и тромбообразования;
- II – переход от гипер- к гипокоагупяции с разнонаправленными сдвигами разных параметров свертываемости крови;
- III – глубокой гипокоагуляции (вплоть до полной несвертываемости крови и выраженной тромбоцитопении);
- IV – обратного развития ДВС-синдрома.
При остром ДВС-синдроме первая кратковременная фаза часто просматривается. Для ее выявления следует обращать внимание на легкое тромбирование пунктируемых вен и игл при заборе крови на анализы, очень быстрое свертывание крови в пробирках (несмотря на смешивание ее с цитратом), появление немотивированных тромбозов и признаков органной недостаточности (например, снижение диуреза вследствие нарушения микроциркуляции в почках как ранний признак развивающейся почечной недостаточности). Чаще острый ДВС-синдром впервые обнаруживают в момент появления множественных геморрагии в местах инъекций, пальпации, ниже места наложения манжеты для измерения АД, в отлогих частях тела; при длительном и нередко повторном кровотечении из мест прокола кожи на пальцах или в области локтевого сгиба, резком усилении кровоточивости диффузного типа из операционных ран; при кровотечениях из матки (во время родов, после аборта и др.) без видимых локальных причин, кровоточивости серозных оболочек, плохой свертываемости вытекающей крови (малые, быстро лизирующиеся сгустки, полная несвертываемость). Часто одновременно возникают носовые и желудочно-кишечные кровотечения, появляются признаки нарушения микроциркуляции в органах – легких (внезапно развивающееся частое неэффективное дыхание, цианоз, хрипы), почках (падение диуреза, белок и эритроциты в моче), мозге (заторможенность, загруженность), надпочечнике (повторные падения АД), печени (боль в правом предреберье, гипербилирубинемия, желтуха). Могут преобладать то одни, то другие органные нарушения.
Лабораторные признаки – разнонаправленные сдвиги в свертывающей системе крови, переходящие в глубокую гипокоагуляцию (замедление свертываемости крови и плазмы в парциальном тромбопластиновом тесте, аутокоагуляционном тесте, на тромбоэластограмме, удлинение тромбинового и протромбинового времени, снижение уровня плазменных факторов свертывания крови (включая фибриноген); повышенная спонтанная агрегация тромбоцитов (хлопья в плазме) в сочетании с тромбоцитопенией; повышенное содержание в крови разрушенных (фрагментированных) эритроцитов; положительные результаты одного или нескольких паракоагуляционных тестов, выявляющих циркуляцию в крови активного тромбина и растворимых комплексов фибрин-мономе-ров (РФМК)- этанолового, протаминсульфатного, бета-нафтолового, ортофенантролинового. Вследствие интенсивного фибринолиза повышается содержание в плазме продуктов ферментной деградации фибрина (ПДФ), определяемых иммунологически или по тесту склеивания стафилококков (ТСС). В результате интенсивного внутрисосудистого свертывания крови и фибринолиза в циркуляции снижается содержание не только факторов свертывания крови и тромбоцитов, но и важнейших антикоагулянтов – антитромбина III (кофактор гепарина), белков С и S, а также плазминогена (профибринолизина) и его активаторов (плазменного прекалликреина, высокомолекулярного кининогена и др.).
В связи с блокадой микроциркуляции и гипоксией органов выявляются нарушения газового состава крови, кислотно-щелочного равновесия, позднее нарастает содержание в плазме креатинина, мочевины (острая почечная недостаточность), билирубина (гемолиз, поражение печени).
Таким образом, острый ДВС-синдром – тяжелая катастрофа организма, ставящая его на грань между жизнью и смертью, характеризующаяся тяжелыми фазовыми нарушениями в системе гемостаза, тромбозами и геморрагиями, нарушением микроциркуляции и тяжелыми метаболическими нарушениями в органах с выраженной их дисфункцией, протеолизом, интоксикацией, развитием или углублением явлений шока (гемокоагуляционно-гиповопемическсй природы).
Подострый ДВС-синдром характерен более длительный, чем при остром ДВС-синдроме, начальный период гиперкоагуляции – бессимптомный либо проявляющийся тромбозами и нарушениями микроциркуляции в органах (загруженность, беспокойство, чувство безотчетного страха, снижение диуреза, отеки, белок и цилиндры в моче).
При хроническом ДВС-синдроме на фоне признаков основного заболевания отмечается выраженная гиперкоагупяция крови (быстрое свертывание в венах – спонтанное и при их проколе; иглах, пробирках), гиперфибриногенемия, наклонность к тромбозам, положительные паракоагуляционные тесты (этаноловый, протаминсульфатный и др.). Время кровотечения по Дьюку и Борхгревинку часто укорочено, содержание в крови тромбоцитов нормальное или повышенное. Часто выявляется их спонтанная гиперагрегация – мелкие хлопья в плазме. При ряде форм отмечается повышение гематокрита, высокий уровень гемоглобина и эритроцитов, замедление СОЭ. В некоторых случаях манифестируют немотивированные множественные тромбозы вен, в том числе при нераспознанном раке разной локализации (синдром Труссо), при иммунных васкулитах, коллагенозах и др. В других случаях легко появляются геморрагии, петехии, синяки, кровотечения из носа и десен и т.д. (в сочетании с тромбозами и без них).
Описание
Острый ДВС-синдром сопутствует тяжелым инфекционно-септическим заболеваниям (в том числе при абортах, во время родов, у новорожденных – более 50% всех случаев), всем видам шока, деструктивным процессам в органах, тяжелым травмам и травматичным хирургическим вмешательствам, острому внутрисосудистому гемолизу (в том числе при несовместимых гемотрансфузиях), акушерской патологии (предлежание и ранняя отслойка плаценты, эмболия околоплодными водами, особенно инфицированными, ручное отделение плаценты, гипотонические кровотечения, массаж матки при ее атонии), массивным гемотрансфузиям (опасность возрастает при использовании крови более 5 дней хранения), острым отравлениям (кислоты, щелочи, змеиные яды и др.), иногда острым аллергическим реакциям и всем терминальным состояниям. Патогенез синдрома в большинстве случаев связан с массивным поступлением из тканей в кровь стимуляторов свертывания крови (тканевого тромбопластина и др.) и активаторов агрегации тромбоцитов, повреждением на большой площади эндотелия сосудов (бактериальными эндотоксинами, иммунными комплексами, компонентами комплемента, продуктами клеточного и белкового распада). При инфекционно-септических процессах стимуляторы свертывания крови и ферменты, повреждающие стенки микрососудов, интенсивно продуцируются также макрофагами (моноцитами) и нейтрофилами; секретируемая последними эластаза играет важную роль в формировании легочного дистресссиндрома (шокового легкого).
Подострый ДВС-синдром, сменяющийся в терминальной фазе острым, наблюдается при более легком течении всех перечисленных выше заболеваний, а также при поздних токсикозах беременности, внутриутробной гибели плода, лейкозах, иммунокомплексных болезнях (подострые формы геморрагического васкулита), темолитикоуремическом синдроме (может возникнуть и острый ДВС-синдром).
Хронический ДВС-синдром часто осложняет злокачественные новообразования (рак легкого, почек, предстательной железы, печени и др.), хронические лейкозы, все формы сгущения крови (эритремии, эритроцитозы), гипертромбоцитозы, хроническую сердечную и легочно-сердечную недостаточность, хрониосепсис, васкулиты, гигантские гемангиомы (синдром Казабаха-Мерритта). К хроническому ДВС-синдрому ведет также массивный контакт крови (особенно повторяющийся) с чужеродной поверхностью – гемодиализ при хронической почечной недостаточности, использование аппаратов экстракорпорального кровообращения.
Патогенетически особой формой, связанной со снижением антиагрегационного потенциала сосудистой стенки и крови, является тромботическая тромбоцитопеническая пурпура (болезнь Мошкович).
Схематично патогенез ДВС-синдрома может быть представлен следующей последовательностью патологических нарушений: активация системы, гемостаза со сменой фаз гипер-и гипокоагупяции – внутрисосудистое свертывание крови, агрегация тромбоцитов и эритроцитов – микротромбирование сосудов и блокада микроциркуляции в органах с их дисфункцией и дистрофией – истощение компонентов свертывающей системы крови и фибринолиза, физиологических антикоагулянтов (антитромбина III, протеинов С и S), снижение содержания тромбоцитов в крови (тромбоцитопения потребления). Существенно сказывается токсическое влияние продуктов белкового распада, скапливающихся в большом количестве как в крови, так и в органах в результате резкой активации протеопитических систем (свертывающей, калликреинкининовой, фибринолитической, комплемента и др.), нарушения кровоснабжения, гипоксии и некротических изменений в тканях, частого ослабления дезинтоксикационной и выделительной функции печени и почек. Этот протеолитический взрыв с накоплением в крови и внесосудистом пространстве токсических продуктов белкового распада послужил основанием для разработки и использования ряда новых эффективных способов лечения ДВС-синдрома – плазмафереза и трансфузий свежей нативной или свежезамороженной плазмы, введения в высоких доз антипротеаз, использования методов экстракорпорального очищения крови и т. д.
Диагностика
Ранняя диагностика носит ситуационный характер и базируется на выявлении тех заболеваний и воздействий, при которых закономерно развивается ДВС-синдром (инфекционно-септические процессы, все виды шока и тяжелой гиповолемии, острый внутрисосудистый гемолиз, ряд видов акушерской патологии и т. д. ). Во всех этих случаях необходима ранняя профилактическая терапия ДВС-синдрома до развития выраженных клинических и лабораторных его признаков. При наличии причинных факторов, вызывающих ДВС-синдром, развитие последнего становится несомненным при появлении геморрагии разной локализации, признаков острой дыхательной недостаточности (тахипноэ, удушье, цианоз), острой почечной или гепаторенальной недостаточности, усилении и рецидивировании явлений шока, разнонаправленных нарушений различных параметров свертываемости крови, перехода гиперкоагуляции в глубокую гипокоагуляцию в сочетании с агрегацией в плазме клеток крови (муть, хлопья) и тромбоцитопенией. Тип кровоточивости смешанный. Дополнительно ДВС-синдром документируется положительными паракоагуляционными тестами (этаноловым, протаминсульфатным, бета-нафтоловым, орто-фенантролиновым), выявлением повышенного содержания в плазме ПДФ (экспресс-метод – тест склеивания стафилококков), выявлением в сыворотке после свертывания заблокированного фибриногена при добавлении к ней яда змеи песчаной эфы (образование в сыворотке второго сгустка). Все эти тесты быстро выполнимы, но терапию не следует откладывать до их выполнения.
Диагностика подострого ДВС-синдрома основывается на выявлении сочетания симптомов основного заболевания с тромбозами и (или) геморрагиями разной локализации (синяки, особенно на местах инъекций, тромбозы в местах венепункций) и признаками нарушения микроциркуляции в органах. При исследовании крови выявляют смену фаз гипер- и гипокоагуляции, разнонаправленные сдвиги коагуляционных тестов, гипер- или умеренную гипофибриногенемию, нередко гипертромбоцитоз. Паракоагуляционные тесты (этаноловый, протаминсульфатный и др.) стабильно положительные; ПДФ в плазме повышены.
Лечение
Лечение острого ДВС-синдрома должно быть направлено в первую очередь на быструю ликвидацию его причины. Без рано начатой успешной этиотропной терапии нельзя рассчитывать на спасение жизни больного. Больные нуждаются в немедленном направлении или переводе в реанимационное отделение, обязательном привлечении к лечебному процессу реаниматологов-трансфузиологов и специалистов по патологии системы гемостаза. Основными патогенетическими методами лечения являются противошоковые мероприятия, внутривенное капельное введение гепарина, струйные трансфузии свежей нативной или свежезамороженной плазмы при необходимости с плазмозаменой, борьба с кровопотерей и глубокой анемизацией (кровезаменители, свежецитратная кровь, эритровзвесь), острыми нарушениями дыхания (раннее подключение искусственной вентиляции легких) и кислотно-щелочного равновесия, острой почечной или гепаторенальной недостаточностью.
Гепарин следует вводить внутривенно капельно, в некоторых случаях в сочетании с подкожными инъекциями его в клетчатку передней брюшной стенки ниже пупочной линии. Внутримышечные инъекции не рекомендуются из-за разной скорости резорбции препарата (что затрудняет его дозирование), легкого образования в условиях развития ДВС-синдрома обширных, инфицирующихся гематом. Доза гепарина варьирует в зависимости от формы и фазы ДВС-синдрома.
При наличии в крови больного белков острой фазы (например, при острых инфекционно-септических процессах, массивной деструкции тканей, ожогах) дозы гепарина, наоборот, должны быть наивысшими, поскольку эти белки связывают гепарин и препятствуют его антикоагулянтному действию. Недостаточный эффект гепарина может быть связан с блокадой и снижением содержания в плазме больного его плазменного кофактора – антитромбина III. Поэтому часто существенное повышение эффективности лечения достигают не наращиванием доз гепарина, а ранним подключением струйных трансфузий свежей нативной или свежезамороженной плазмы. Такие трансфузии показаны во всех стадиях ДВС-синдрома, они возмещают недостаток всех компонентов свертывающей и фибринолитической систем, в том числе антитромбина III и белков С и S (истощение которых при ДВС-синдроме идет особенно интенсивно – в несколько раз быстрее, чем всех прокоагулянтов), позволяют ввести в кровоток полный набор естественных антипротеаз и факторов, восстанавливающих антиагрегационную активность крови и тромборезистентность эндотелия.
В ряде случаев (особенно при инфекционно-токсических формах ДВС-синдрома) трансфузии свежезамороженной или свежей нативной плазмы проводят после сеансов плазмафереза (только после стабилизации гемодинамики!). При ДВС-синдроме инфекционно-септической природы и развитии легочного дистресс-синдрома показан плазмацитаферез, поскольку в патогенезе этих форм существенную роль играют лейкоциты, одни из которых начинают продуцировать тканевый тромбопластин (мононуклеары), а другие – эстеразы, вызывающие интерстициальный отек легких (нейтрофилы). Эти методы плазмотерапии и плазмозамены значительно повышают эффективность лечения ДВС-синдрома и вызывающих его заболеваний, снижают в несколько раз летальность, что позволяет считать их основным способом терапии больных с этим нарушением гемостаза. При значительной анемизации к этой терапии присоединяют трансфузии свежей консервированной крови (суточной или до 3 дней хранения), эритроцитной массы и эритроцитарной взвеси. Не следует стремиться к быстрой и полной нормализации показателей красной крови, так как умеренная гемодилюция необходима для восстановления нормальной микроциркуляции в органах. Следует помнить, что чрезмерно обильные гемотрансфузии (особенно консервированной крови более 3 дней хранения) усугубляют ДВС-синдром (синдром массивных трансфузий), в связи с чем при трансфузионной терапии необходимы определенная сдержанность, строгий учет количества перелитой крови, ее компонентов и кровезаменителей, а также кровопотери, потери организмом жидкости, диуреза. Следует помнить, что острый ДВС-синдром легко осложняется отеком легких, поэтому значительные перегрузки системы кровообращения при синдроме опасны.
В III стадии ДВС-синдрома и при выраженном протеолизе в тканях (гангрена легкого, некротический панкреатит, острая дистрофия печени и др. ) плазмаферез и струйные трансфузии свежезамороженной плазмы или других антипротеаз. На поздних этапах развития ДВС-синдрома и при его разновидностях, протекающих на фоне гипоплазий и дисплазий костного мозга (лучевая, цитотоксическая болезни, лейкозы, апластические анемии) для купирования кровотечений необходимо также производить трансфузии концентратов тромбоцитов.
Важным звеном комплексной терапии является применение дезагрегантов и препаратов, улучшающих микроциркуляцию в органах. Важный компонент терапии – раннее подключение искусственной вентиляции легких. Выведению больного из шока способствует применение антиопиоидов.
Переход в гипокоагуляционную и геморрагическую фазу происходит либо постепенно, либо внезапно (нередко с трансформацией в острый ДВС-синдром). Нередки (особенно при инфекционно-септических, неопластических формах) повторные смены фаз гипер- и гипокоагуляции.
Лечение подострого ДВС-синдрома присоединение к терапии основного заболевания капельных внутривенных и подкожных введений гепарина, дезагрегантов. Быстрое купирование или ослабление процесса часто достигается лишь при проведении плазмафереза с заменой частично свежей, нативной или свежезамороженной плазмой, частично – кровезамещающими растворами и альбумином. Процедуру ведут под прикрытием малых доз гепарина.
Лечение хронического ДВС-синдрома такое же, как и при подострой форме. При полиглобулии и сгущении крови – кровопускания, пиявки, цитаферез (удаление эритроцитов, тромбоцитов и их агрегатов), гемодилюция. При гипертромбоцитозе – дезагреганты.
© Большая Медицинская Энциклопедия
Источник
