Генетические синдромы связанные с диабетом
Статья из монографии “Сахарный диабет: от ребёнка до взрослого”.
Синдром Дауна – трисомия по 21 паре хромосом. Внешний вид больного ребенка: плоское лицо, монголоидный разрез глаз, эпикант, открытый рот, короткий нос, плоская переносица, страбизм, брахицефалия, плоский затылок, диспластические уши, зубные аномалии, короткая шея, брахимезофалангия, клинодактилия 5–го пальца кисти, мышечная гипотония, поперечная ладонная складка, умственная отсталость.
Синдром Кляйнфельтера – полисомия по Х–хромосоме у лиц мужского пола. Данный синдром проявляется у мужчин и мальчиков–подростков в виде евнухоидных пропорций тела, гинекомастии, недоразвития гонад, иногда – ожирения. Данная генетическая патология является самой распространенной причиной мужского гипогонадизма и бесплодия.
Синдром Тернера – аномалия или отсутствие одной Х–хромосомы у лиц женского пола. В периоде новорожденности отмечается лимфатический отек конечностей, диагностируют пороки сердца. Пороки развития скелета и внутренних органов обнаруживают в более старшем возрасте. Для данной генетической патологии характерны низкорослость, дисгенезия или полное отсутствие гонад, короткая шея с крыловидными кожными складками, низкая линия роста волос на затылке, бочкообразная грудная клетка, О–образное искривление рук, Х–образное искривление ног.
Синдром Вольфрама, или синдром DIDMOAD (Diabetes Insipidus – диабет, Diabetes Mellitus – сахарный диабет, Optic Atrophy – атрофия зрительного нерва, Deafness – глухота), – прогрессирующее нейродегенеративное заболевание с аутосомно–рецессивным типом наследования и манифестацией до 16–летнего возраста. Особенно часто встречается среди народностей, у которых отмечаются близкородственные браки.
Сахарный диабет (СД) и атрофия зрительного нерва развиваются в первую декаду жизни, во вторую декаду – нейросенсорная тугоухость и несахарный диабет. В третьей и четвертой декадах жизни нередко развиваются другие клинические проявления: психические изменения, атония мочевыводящих путей и дилатация мочевыводящего тракта, атаксия. Мутация гена WFS1 синдрома Вольфрама, кодирующего полипептид вольфрамин, обнаруживается у 90% пациентов с клиническими проявлениями данного синдрома.
Синдром Роджерса – сочетание сахарного диабета, мегалобластной анемии, рефрактерной к витамину В12 и фолиевой кислоте, нейросенсорной глухоты. В патогенезе имеет место нарушение обмена тиамина (витамина В1). Данный синдром является результатом мутации гена SLC19A2. Сахарный диабет развивается вследствие инсулиновой недостаточности, иногда чувствителен к назначению тиамина, но в дальнейшем все же требуется назначение инсулина. Глухота при назначении тиамина не имеет своего обратного развития.
Атаксия Фридрейха – редкое наследственное заболевание, характеризующееся потерей произвольных мышечных движений (атаксией) и кардиомегалией. Данная патология встречается в равной степени у мальчиков и девочек. Заболевание имеет аутосомно–рецессивный тип наследования и связано с поломкой гена фратаксина, локализованного на 9 хромосоме. Фратаксин находится в митохондриях, но до настоящего времени окончательно функция его не установлена.
Хорея Геттингтона – нейродегенеративное наследственное заболевание, приводящее к деменции. Ген, ответственный за данное заболевание, локализован на 4 хромосоме и представляет собой триплет, кодирующий синтез протеина – хунтингтина.
Синдром Лоренса–Муна–Бидля (рис. 4.3). Классическими клиническими проявлениями синдрома являются задержка умственного развития, пигментный ретинит, гипогонадизм, аномалии развития глаз, почек. Иногда имеет место полидактилия. Для заболевания характерен аутосомно–рецессивный тип наследования. У мальчиков данный синдром встречается в 2 раза чаще. Основные симптомы заболевания проявляются в первые 2–3 года жизни. Зрительные нарушения могут приводить к слепоте уже к 8 годам. По данным магнитно–резонансной томографии (МРТ) головного мозга у больных с синдромом Лоренса–Муна–Бидля наблюдается симптом «пустого» турецкого седла.
Рис. 4.3. Синдром Лоренса-Муна-Бидля
Миотоническая дистрофия относится к группе наследственных нервно–мышечных заболеваний вследствие нарушений медиаторного обмена. Болезнь начинается с затруднения расслабления мышц, с последующим нарастанием мышечной атрофии (слабости), выпадением сухожильных рефлексов, исхуданием, кахексией или ожирением. Очень часто наблюдается бесплодие, инфантилизм. Имеет место выпадение волос, катаракта, умеренная психическая недостаточность. Болезнь может манифестировать в различном возрасте, но чаще – в раннем пубертатном. Причина данного заболевания – патология гена, локализованного в 19 хромосоме и кодирующего фермент киназу скелетной мускулатуры.
Порфирия (пурпурный, греч.) – группа заболеваний, связанная с патологией синтеза гема. Пурпурная окраска мочи, характерная для данной патологии, послужила поводом для использования этого термина. Гем является не только центральной кислородсвязывающей частью гемоглобина, но и активной частью жизненно важных энзимов цитохромов (Р 450 и его предшественников). Гены, ответственные за синтез энзимов, расположены в различных хромосомах и при их мутациях патология имеет различный (аутосомно–рецессивный или аутосомно–доминантный) тип наследования.
Носители патологического гена, как правило, не имеют клинических проявлений. Часто в клинической картине пациентов с порфирией имеются патология ЖКТ, гепатиты, повышенная фотосенсибилизация. Иногда у больных отмечаются судороги, мышечная слабость.
Синдром Прадера–Вилли характеризуется умственной отсталостью, мышечной гипотонией, низкорослостью, эмоциональной лабильностью и нарушением аппетита с формированием ожирения. Данный синдром является результатом отсутствия сегмента 11–13 в длинном плече 15 хромосомы либо его делеции (у 70–80% больных). Клинические проявления зависят от возраста. В раннем возрасте отмечаются низкая двигательная активность и мышечная гипотония. Затем появляется недостаточность психического и физического развития. Значительная прибавка в весе отмечается в возрасте от 1 года до 6 лет. Характерными проявлениями этого синдрома являются маленькие стопы и кисти, миндалевидные глаза, «тентовидная» верхняя губа, гипогонадизм. У пациентов может наблюдаться синдактилия.
Из монографии «Сахарный диабет: от ребенка до взрослого»
Сенаторова А.С., Караченцев Ю.И., Кравчун Н.А., Казаков А.В., Рига Е.А., Макеева Н.И., Чайченко Т.В.
ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского АМН Украины»
Харьковский национальный медицинский университет
Харьковская медицинская академия последипломного образования МЗ Украины
Источник
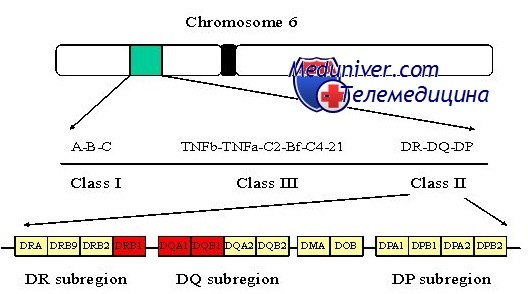
Генетика сахарного диабета I типа. Особенности наследованияСуществуют два основных типа сахарного диабета: I тип (инсулинзависимый — ИЗСД) и II тип (инсулиннезависимый — ИНСД), составляющие 10 и 88% всех случаев соответственно. Они отличаются типичным возрастом начала, конкордантностью однояйцовых близнецов и ассоциацией с конкретными аллелями главного комплекса гистосовместимости (МНС — major histocompatibility complex). Семейное накопление наблюдают при обоих типах сахарного диабета, но в одной семье обычно присутствует только I или II тип. Сахарный диабет I типа встречается в белой популяции с частотой около 1 на 500 (0,2%), в африканских и азиатских популяциях — реже. Обычно его обнаруживают в детстве или юности, и он вызван аутоиммунным поражением b-клеток поджелудочной железы, вырабатывающих инсулин. У преобладающего большинства больных детей уже в раннем детстве, задолго до развития явных проявлений болезни, вырабатываются многочисленные аутоантитела против ряда эндогенных белков, включая инсулин. Ассоциация главного комплекса гистосовместимости при сахарном диабете I типаПри I типе сахарного диабета существует подтверждение роли генетических факторов: конкордантность однояйцовых близнецов приблизительно 40%, что далеко превышает 5% конкордантности у разнояйцовых. Риск диабета I типа для сибсов больного пробанда около 7%, что дает показатель наследуемости hs = 7% / 0,2% =- 35. Давно известно, что локус МНС — основной генетический фактор при сахарном диабете, так как около 95% всех пациентов с сахарным диабетом I типа (по сравнению с примерно 50% в нормальной популяции) — гетерозиготные носители аллелей HLA-DR3 или HLA-DR4 в локусе HLA класса II в МНС [HLA — человеческие лейкоцитарные антигены (human leucocyte antigens)]. Первое исследование, показавшее ассоциацию HLA-DR3 и HLA-DR4 с сахарным диабетом I типа при использовании стандартных методов проверки достоверности различия между разными аллелями HLA, проводили методом иммунологических реакций in vitro. Позже этот метод заменили прямым определением ДНК-последовательности разных аллелей. Секвенирование локуса гистосовместимости у огромного количества больных обнаружило, что «аллели» DR3 и DR4 — не просто аллели.
Как DR3, так и DR4 могут быть подразделены на десятки аллелей, располагающихся в локусе, теперь называющемся DRB1, и определяемых на уровне последовательности ДНК. Кроме того, стало ясным, что ассоциация между определенными аллелями DRB1 и сахарным диабетом I типа частично вызвана аллелем в другом локусе класса II, DQB1, располагающимся примерно в 80 килобазах от DRB1, вместе формирующих общий гаплотип (вследствие неравновесного сцепления; см. главу 10) друг с другом. DQB1 кодирует b-цепь, одну из цепей, формирующих димер белка класса II DQ. Оказывается, что присутствие аспарагиновой кислоты (Asp) в 57 позиции b-цепи DQ тесно связано с устойчивостью к сахарному диабету I типа, тогда как другие аминокислоты в этом положении (аланин, валин или серии) определяют восприимчивость. Около 90% пациентов с сахарным диабетом I типа гомозиготны по аллелям DQB1, не кодирующим аспарагиновую кислоту в 57 положении. Раз молекула DQ, и конкретно 57 позиция р-цепи критична для связи антигена и пептида и Т-клеточного ответа, похоже, что различия в присоединении антигена, определяемые конкретной аминокислотой в 57 положении р-цепи DQ, непосредственно содействуют аутоиммунному ответу, уничтожающему инсулин-продуцирующие клетки поджелудочной железы. Тем не менее также важны другие локусы и аллели в МНС, что видно из того, что некоторые пациенты с сахарным диабетом I типа имеют в данной позиции b-цепи DQ аспарагиновую кислоту. Гены, отличающиеся от локусов главного комплекса гистосовместимости класса II при сахарном диабете I типаГаплотип МНС отвечает только за часть генетического вклада в риск сахарного диабета I типа у сибсов пробанда. Семейные исследования показывают, что даже когда сибсы имеют те же гаплотипы МНС класса II, риск болезни составляет приблизительно 17%, что значительно ниже показателя конкордантности у однояйцовых близнецов, равного примерно 40%. Таким образом, в геноме должны быть другие гены, также предрасполагающие к развитию сахарного диабета I типа и различающиеся у однояйцовых близнецов и сибсов, имеющих аналогичные условия окружающей среды. Кроме МНС, предполагают изменения еще в более чем десятке локусов, увеличивающих восприимчивость к сахарному диабету I типа, но надежно подтверждены только три из них. Это вариабельность числа тандемных повторов в промоторе гена инсулина и простой нуклеотидный полиморфизм в гене иммунного регулятора CTLA4 и в гене PTPN22, кодирующем протеин-фосфатазу. Идентификация других генов восприимчивости для сахарного диабета I типа как в пределах, так и за пределами МНС — объект интенсивного исследования. В настоящее время природа факторов негенетического риска при сахарном диабете I типа в основном неизвестна. Генетические факторы сами по себе, тем не менее, не вызывают сахарный диабет I типа, поскольку показатель конкордантности у однояйцовых близнецов составляет не 100%, а только около 40%. До получения более полной картины участия генетических и негенетических факторов в развитии сахарного диабета I типа консультирование по оценке риска остается эмпирическим. – Также рекомендуем “Генетика болезни Альцгеймера. Особенности наследования” Оглавление темы “Генетика заболеваний”:
|
Источник
MODY-диабет
Повышенный уровень глюкозы в крови, выявленный в юном и молодом возрасте, требует тщательного изучения причин. У молодых и так может проявляться MODY-диабет, который вызывают мутации, отвечающие за развитие и работу поджелудочной железы. В результате нарушается выработка инсулина в островках Лангерганса.
Определить MODY-диабет можно с помощью скрининга, разработанного шведскими учеными.
Молекулярно-диагностическое тестирование
Что такое MODY-диабет и чем он опасен
Существует 2 основных типа болезни:
- 1 тип. В этом случае поджелудочная железа вырабатывает мало инсулина, что приводит к нарушению усвояемости сахара. Больным назначают инъекции инсулина. Такая форма диабета, в основном, возникает в юном возрасте, поэтому ее называют юношеской.
- 2 тип. В этом случае инсулина вырабатывается достаточно или даже слишком много. Однако ткани организма не могут его усваивать. Это состояние называется инсулинорезистентностью. Диабет 2 типа считается возрастным, поскольку возникает ближе к 50 годам. При его лечении применяют противодиабетические препараты в таблетках.
Диабет 1 типа
Диабет 2 типа
MODY-диабет, в отличие от них, возникает из-за генетических нарушений. Хромосомные мутации могут поражать саму железу и нарушать разные этапы выработки инсулина.
Существует несколько видов MODY-диабета:
- MODY-1. – При этой форме заболевания повреждаются вещества, участвующие в обмене и распределении поступающих углеводов. Впервые диагностируется в раннем детстве, иногда даже у новорожденных. Может иметь тяжелое течение.
- MODY-2. В этом случае страдает фермент, который выводит инсулин в кровь. Гормона вырабатывается достаточно, но он не может покинуть ткани железы. Довольно легкая и мягкая форма, которую можно контролировать в течение всей жизни.
- MODY-3. У больных нарушаются функция клеток, вырабатывающих инсулин Форма диабета похожа на первый тип болезни, быстро прогрессирует и приводит к тяжелым осложнениям.
- MODY-4. В этом случае генетические аномалии нарушают развитие железы. В результате недоразвитый орган не может нормально вырабатывать гормоны. У больных наблюдаются нарушения работы пищеварительного тракта, вызванные недостатком выработки панкреатических ферментов.
- MODY-5. При этой форме болезни кроме поджелудочной железы поражаются ещё и почки. У больных быстро возникает почечная недостаточность.
- MODY-6. Генетическая аномалия нарушает развитие структур головного мозга, отвечающих за работу поджелудочной железы. Кроме диабета, у больных часто наблюдаются неврологические нарушения.
- MODY-7. В этом случае из-за генетического сбоя снижается активность поджелудочной железы. Этот тип диабета развивается очень поздно и имеет доброкачественное течение.
- MODY-8. При этой форме болезни дефектный ген вызывает жировое перерождение органов, в том числе, поджелудочной железы. На теле больных появляются многочисленные жировики (липомы).
- MODY-9. Генетические дефекты нарушают развитие клеток, которые продуцируют инсулин. Болезнь имеет тяжелое течение. Нарушение переработки углеводов приводит к кетоацидозу – скоплению в крови ацетона, образовавшегося из-за высокого уровня сахара. У больных часто развивается диабетическая кома.
- MODY-10. В этом случае не вырабатывается проинсулин — предшественник инсулина, также вырабатываемый островками Лангерганса поджелудочной железы. Заболевание может приводить к гибели клеток железы.
- MODY-11. При этой форме болезни дефектные гены нарушают весь обмен веществ. Характерно сочетание диабета с ожирением.
- MODY-12. и -13 в этом случае нарушается чувствительность калиевых каналов поджелудочной железы. Орган не получает достаточное количество электролитов, что отрицательно влияет на его функцию. Может проявиться в любом возрасте, но чаще всего — в юности.
Таблица 1. Клинические и молекулярно-генетические характеристики различных типов MODY-диабета
| MODY ген | Расположение генов в хромосоме | Частота (% от MODY) | Патофизиология | Другие характеристики | Лечение |
| HNF4A | 20q13 | 5 | Дисфункция β-клеток | Неонатальный гиперинсулинемия, низкий уровень триглицеридов | Чувствительны к препаратам сульфонилмочевины |
| GCK | 7p13 | 15-20 | Дисфункция β-клеток (нарушение чувствительности к глюкозе) | Гипергликемия натощак с рождения | Диета |
| HNF1A | 12q24 | 30-50 | Дисфункция β-клеток | Глюкозурия | Чувствительны к препаратам сульфонилмочевины |
| PDX1/IPF1 | 13q12 | <1 | Дисфункция β-клеток | Гомозиготные: агенезия поджелудочной железы | Диета или пероральные сахароснижающие препараты или инсулин |
| HNF1B | 17q12 | 5 | Дисфункция β-клеток | Аномалия развития почек, половых органов, гипоплазия поджелудочной железы | Инсулин |
| NEUROD1 | 2q31 | <1 | Дисфункция β-клеток | Проявляется во взрослом возрасте | Пероральные сахароснижающие препараты или инсулин |
| KLF11 | 2p25 | <1 | Дисфункция β-клеток | Клинически схож с СД2 | Пероральные сахароснижающие препараты или инсулин |
| CEL | 9q34 | <1 | Нарушение эндокринной и экзокринной функции поджелудочной железы | Экзокринная недостаточность, липоматоз поджелудочной железы | Пероральные сахароснижающие препараты или инсулин |
| РАХ4 | 7q32 | <1 | Дисфункция β-клеток | Возможен кетоацидоз | Диета или пероральные сахароснижающие препараты или инсулин |
| lNS | 11p15 | <1 | Мутация гена инсулина | Может манифестировать как перманентный неонатальный СД | Пероральные сахароснижающие препараты или инсулин |
| ВLК | 8p23 | <1 | Дефект секреции инсулина | Избыточный вес, относительный дефект секреции инсулина | Диета или пероральные сахароснижающие препараты или инсулин |
| ABCC8 | 11p15 | <1 | Дисфункция АТФ- чувствительного калиевого канала | Гомозиготные: перманентный неонатальный сахарный диабет; гетерозигот: транзиторный неонатальный сахарный диабет | Пероральные сахароснижающие препараты (сульфонилмочевина) |
| KCNJ11 | 11p15 | <1 | Дисфункция АТФ- чувствительного калиевого канала | Гомозиготные: неонатальный сахарный диабет | Диета или пероральные сахароснижающие препараты или инсулин |
Такое большое разнообразие форм и времени проявления – от младенчества до 30-40 лет усложняет диагностику болезни. Даже опытному врачу-эндокринологу тяжело сразу определить одну из многочисленных форм MODY-диабета. Для этого потребуется комплексное обследование всего организма, проведение анализов на гормоны, УЗИ брюшной полости и длительное наблюдение.
Больным MODY- диабетом зачастую неправильно ставят диагноз
Результаты пятилетнего наблюдения за 4000 больными с диагнозом «диабет» Университетской больнице Скане в Швеции, выявили, что примерно в 4% случаев первых проявлений диабета у детей и молодых людей приходится именно на MODY- диабет. Хуже всего, что большинство пациентов лечат неправильно, как при первом и во втором типе болезни.
Для выявления этого заболевания шведские ученые применили скрининг на четыре вида островковых аутоантител: антител GAD (GADA), антигена IA-2A, транспортера цинка 8A (ZnT8A) и аутоантител к инсулину (IAA). При отсутствии реакции на все виды антител и уровень сахара, превышающий 5,5 ммоль/л, можно заподозрить MODY- диабет. Таким больным рекомендуется сделать анализы на генетику, которые выявят «дефектные» гены, вызывающие эту болезнь.
Такой подход позволит избежать ситуации, когда больные годами колют инсулин или пьют препараты, которые не могут снизить уровень сахара. Обследование на генетику также покажет шанс передачи болезни детям пациента.
Поделиться ссылкой:
Еще статьи
Источник
