Генетический анализ при синдроме бругада

Синдром Бругада – генетически обусловленное кардиологическое состояние, характеризующееся различными нарушениями работы сердца, которые приводят к резкому повышению риска развития внезапной сердечной смерти. Симптомами этого состояния являются приступы пароксизмальной тахикардии, обмороки, фибрилляции предсердий и жизнеугрожающие фибрилляции желудочков, чаще всего возникающие во время сна. Диагностика синдрома Бругада производится на основании характерного симптомокомплекса, электрокардиографических данных и изучения наследственного анамнеза, некоторые формы патологии определяются молекулярно-генетическими методами. Специфического лечения заболевания не существует, применяют антиаритмическую терапию, используют разнообразные кардиостимуляторы.
Общие сведения
Синдром Бругада – группа генетических нарушений, приводящих к изменению ионной проницаемости мембран кардиомиоцитов, вследствие чего возникают патологии ритма и проводимости, создающие повышенный риск внезапной сердечной смерти. Впервые такое состояние было описано в 1992 году двумя братьями – бельгийскими кардиологами испанского происхождения Хосе и Педро Бругада, обратившими внимание на взаимосвязь определенных электрокардиологических проявлений и нарушений сердечного ритма. В настоящее время установлено, что синдром Бругада является наследственным состоянием с предположительно аутосомно-доминантным механизмом передачи, удалось выявить несколько генов, мутации которых способны вызывать это заболевание. По некоторым данным, практически половина всех случаев внезапной сердечной смерти в мире обусловлены именно этой патологией. Распространенность синдрома Бругада различается в разных регионах планеты – в странах Америки и Европы она составляет примерно 1:10 000, тогда как в африканских и азиатских государствах это заболевание встречается чаще – 5-8 случаев на 10 000 населения. Синдром Бругада примерно в 8 раз чаще поражает мужчин, чем женщин, проявления патологии возникают в разном возрасте, но чаще всего выраженная симптоматика наблюдается в 30-45 лет.
Синдром Бругада
Причины и классификация синдрома Бругада
Причина развития нарушений при синдроме Бругада заключается в патологической работе ионных каналов кардиомиоцитов, в основном натриевых и кальциевых. Их дефект, в свою очередь, обусловлен мутациями генов, кодирующих белки ионных каналов. Методами современной генетики удалось достоверно идентифицировать 6 основных генов, поражение которых приводит к развитию синдрома Бругада, в отношении еще нескольких существует подозрение, но отсутствует необходимая доказательная база. На этой основе построена классификация данного состояния, включающая в себя 6 форм заболевания (BrS):
- BrS-1 – наиболее распространенный и хорошо изученный вариант синдрома Бругада. Обусловлен мутацией гена SCN5A, расположенного на 3 хромосоме. Продуктом экспрессии данного гена является альфа-субъединица натриевого канала 5 типа, широко представленного в миокарде. Помимо синдрома Бругада мутации данного гена становятся причиной большого количества наследственных кардиологических патологий – семейной фибрилляции предсердий, синдрома слабости синусового узла 1 типа и ряда других.
- BrS-2 – данная разновидность синдрома Бругада вызывается дефектами гена GPD1L, который локализован на 3 хромосоме. Он кодирует один из компонентов глицерол-3-фосфат дегидрогеназы, принимающей активное участие в работе натриевых каналов кардиомиоцитов.
- BrS-3 – этот тип синдрома Бругада обусловлен дефектом гена CACNA1C, расположенного на 12 хромосоме. Продуктом его экспрессии является альфа-субъединица кальциевого канала L-типа, также присутствующего в кардиомиоцитах.
- BrS-4 – как и в предыдущем случае, причиной развития синдрома Бругада 4 типа является поражение потенциал-зависимых кальциевых каналов L-типа. Оно обусловлено мутацией гена CACNB2, расположенного на 10 хромосоме и кодирующего бета-2-субъединицу вышеуказанных ионных каналов.
- BrS-5 – распространенная разновидность синдрома Бругада, обусловленная мутацией гена SCN4B, локализованного на 11 хромосоме. Он кодирует белок одного из малых натриевых каналов кардиомиоцитов.
- BrS-6 – вызывается дефектом гена SCN1B, расположенного на 19 хромосоме. Во многом этот вариант синдрома Бругада схож с первым типом заболевания, поскольку в этом случае тоже поражаются натриевые каналы 5 типа. Ген SCN1B кодирует бета-1-субъединицу этого ионного канала.
Кроме того, в развитии синдрома Бругада подозреваются мутации генов KCNE3, SCN10A, HEY2 и некоторых других. Однако на сегодняшний день достоверно доказать их роль в возникновении данного заболевания не удается, поэтому пока количество генетических вариантов синдрома Бругада ограничено шестью. Наследование всех форм данной патологии неясно, лишь у 25% больных определяются признаки аутосомно-доминантной передачи. Предположительно имеет место доминантный тип наследования с неполной пенетрантностью либо влияние спонтанных мутаций. Также непонятны причины того, почему синдром Бругада чаше поражает мужчин, нежели женщин – возможно, выраженность проявлений заболевания находится в зависимости от гормонального фона больного.
Патогенез нарушений при любой форме синдрома Бругада примерно одинаков – из-за изменения проницаемости мембраны кардиомиоцитов для ионов натрия происходит нарушение трансмембранного потенциала и взаимосвязанных с ним характеристик возбудимых тканей: возбудимости, сократимости, передачи возбуждения окружающим клеткам. В результате возникают блокады проводящих путей сердца (пучков Гиса), тахиаритмии, усиливающиеся при повышении вагусных воздействий (во время сна). Степень выраженности симптомов при синдроме Бругада зависит от доли пораженных натриевых каналов. Усиливать проявления болезни могут некоторые лекарственные вещества, способны ингибировать ионные каналы сердца.
Симптомы синдрома Бругада
Возраст появления первых признаков синдрома Бругада сильно отличается у разных больных – были зарегистрированы случаи этой патологии как у детей 3-4 лет, так и у лиц старческого возраста. Одним из первых проявлений патологии становятся изменения на электрокардиограмме при полном отсутствии других клинических симптомов, поэтому данное заболевание нередко выявляется случайно. В большинстве случаев выраженная клиника синдрома Бругада возникает в возрасте 30-45 лет, этому предшествует бессимптомный период продолжительностью 10-12 лет, в течение которого единственным признаком патологии являются изменения на ЭКГ.
Обычно больные синдромом Бругада жалуются на беспричинное головокружение, обмороки, частые приступы тахикардии, особенно в ночное время или в период дневного отдыха. Иногда отмечается аномальная реакция на прием некоторых лекарственных средств – антигистаминных препаратов первого поколения, бета-адреноблокаторов, ваготонических средств. Их применение при синдроме Бругада может сопровождаться усилением побочных явлений, а также сердцебиениями, обмороками, падением артериального давления и другими негативными проявлениями. Никаких других симптомов при этом заболевании не выявляется, чем объясняется редкое обращение пациентов к кардиологу или другим специалистам – в ряде случаев проявления синдрома Бругада достаточно редкие и слабовыраженные. Тем не менее, это не снижает риск внезапной сердечной смерти, обусловленной данной патологией.
Диагностика синдрома Бругада
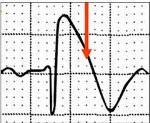
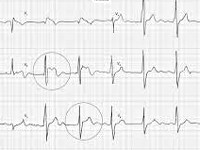
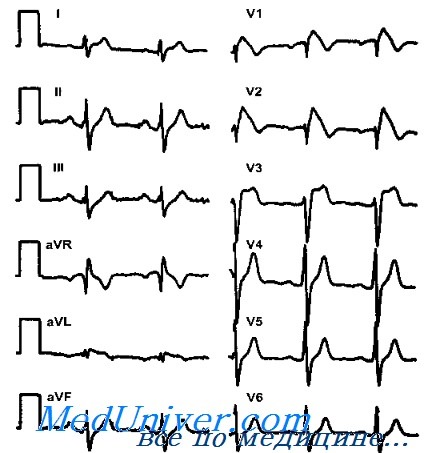
Для определения синдрома Бругада используют электрокардиографические методики, изучение наследственного анамнеза пациента, молекулярно-генетический анализ. Заподозрить наличие этого заболевания можно при наличии синкопальных явлений (головокружений, обмороков) неясного происхождения, жалоб на внезапные приступы тахиаритмий. Изменения на электрокардиограмме при синдроме Бругада могут определяться на фоне полного отсутствия клинических симптомов заболевания. При этом кардиологи выделяют три основных типа изменений на ЭКГ, незначительно отличающихся между собой. Типичная картина электрокардиограммы при синдроме Бругада сводится к элевации (подъему) сегмента ST над изоэлектрической линией и отрицательному зубцу Т на правых грудных отведениях (V1-V3). Также могут определяться признаки блокады правой ножки пучка Гиса, при холтеровском мониторировании выявляются приступы пароксизмальной тахикардии или фибрилляции предсердий.
Как правило, наследственный анамнез больных синдромом Бругада отягощен – среди родственников или предков имеются случаи летальных исходов от сердечной недостаточности, смерти во сне или внезапной сердечной смерти. Этот факт, а также наличие вышеперечисленных симптомов и изменений на ЭКГ дает основания для проведения молекулярно-генетической диагностики. В настоящее время врачи-генетики в подавляющем большинстве клиник и лабораторий производят определение синдрома Бругада, вызванного только мутациями генов SCN5A и SCN4B (1 и 5 типы патологии), в отношении остальных форм методы генетической диагностики пока не разработаны. Дифференцировать это состояние следует с реакцией организма на прием некоторых лекарственных средств, хроническим миокардитом и другими кардиологическими патологиями.
Лечение и профилактика синдрома Бругада
Специфических методов лечения синдрома Бругада на сегодняшний момент не существует, поэтому ограничиваются только борьбой с проявлениями этого заболевания, а также профилактикой жизнеугрожающих приступов тахиаритмии и фибрилляций. Наиболее широко при этом состоянии применяется амиодарон, несколько реже используются дизопирамид и хинидин. Однако медикаментозная терапия при синдроме Бругада в ряде случаев является малоэффективной, единственным надежным средством профилактики аритмии и внезапной сердечной смерти в этом случае становится имплантация кардиовертера-дефибриллятора. Только этот прибор способен оценивать работу миокарда больного и при патологических и жизнеугрожающих изменениях сердечного ритма приводить ее в норму посредством электрического разряда.
Многие традиционные антиаритмические препараты при синдроме Бругада противопоказаны, так как они угнетают деятельность натриевых каналов кардиомиоцитов и усиливают проявления патологии. К средствам, запрещенным при этом заболевании, относят аймалин, пропафенон, прокаинамид. Поэтому больным синдромом Бругада следует обязательно сообщать специалистам об имеющемся диагнозе, чтобы избежать назначения неверного антиаритмического средства. При наличии подобного заболевания у родственников или случаях внезапной сердечной смерти в роду следует регулярно производить ЭКГ-исследование для как можно более ранней диагностики этого состояния.
Прогноз синдрома Бругада
Прогноз синдрома Бругада неопределенный, так как степень выраженности симптомов заболевания очень вариабельна и находится в зависимости от ряда факторов. При наличии только электрокардиографических проявлений патологии без выраженных клинических симптомов прогноз относительно благоприятный. Если синдром Бругада сопровождается потерями сознания и приступами аритмии – без установки кардиовертера-дефибриллятора риск внезапной сердечной смерти возрастает во много раз. При применении данного прибора прогноз несколько улучшается, поскольку устройство может круглосуточно корректировать патологические изменения сердечного ритма.
Источник
Синдром Brugada. Генетические основы синдрома Бругада
В 1992 г. Brugada P. и Brugada R. описали пациентов с подъемом сегмента ST в правых прекорлиальных отведениях (V1-V3) (в отсутствие острого коронарного синдрома), с блокадой правой ножки пучка Гиса, со склонностью к желудочковым тахиаритмиям при структурно нормальном сердце. Сообщалось о семейном наследовании по аутосомно-доминантному типу, предполагая генетическое происхождение болезни. Эта болезнь в настоящее время носит название «синдром Brugada». Частота ее распространения неизвестна, но болезнь чаще встречается в дальневосточных странах.
Типичная аритмия при синдроме Brugada — быстрая полиморфная ЖТ, которая часто переходит в ФЖ; задокументирован также переход в фибрилляцию предсердий. Несмотря на то что синдром Brugada — генетически обусловленное заболевание, клинические проявления (обморок или остановка сердца) в детском возрасте редки и появляются в третьей и четвертой декадах жизни в соотношениях 8 : 1 (мужчины/женщины). Причины таких возрастных и тендерных различий неизвестны. Сердечные события развиваются во время сна или в покое.
Лихорадка, трициклические антидепрессанты и употребление кокаина могут быть пусковыми механизмами сердечных событий у некоторых пациентов.
Диагноз синдрома Brugada затруднен из-за преходящих изменений па электрокардиограмме. Скрытые формы могут быть обнаружены во время пробы с антиаритмиками класса 1С: аймалином (1 мг/кг), флекаинидом (2 мг/кг) или прокаинамидом (15 мг/кг). Автономная модуляция нервной системы может изменить проявления синдрома: внутривенное введение изопротеренола уменьшает ЭКГ-признаки синдрома Brugada, а анетилхолина увеличивает.
Эта особенность согласуется с тем, что сердечные события при синдроме Brugada наступают главным образом и покое или во время сна. Диагностические критерии синдрома Brugada уточнялись в течение нескольких лет. Выли установлены три типа ЭКГ, однако диагностическим критерием считается только «выпуклая» элевация сегмента ST (тип I). Опасные для жизни сердечные события могут развиться у пациентов с ЭКГ типа «спинка седла» (тип II) с генетически подтвержденным диагнозом.
Генетические основы синдрома Бругада
Первый ген был идентифицирован в 1998 г. как сердечный теп ионного канала натрия (SCN5A). Этот же теп ответственен за генетический вариант LQT3. Хотя синдром Brugada и LQT3 вызваны мутациями в одном и том же гене, существует противоположный эффект этих мутации на ионный ноток натрия: «потеря функции» при синдроме Brugada и усиление функции при LQT3.
Интересно, что о пересечении фенотипов между LQT3 и синдромом Brugada сообщили независимые исследователи, которые подчеркнули функциональную сложность сердечной «болезни ионного канала». Недавно была обнаружена связь мутации SCN5A с ДКМП, что предполагает возникновение структурных нарушений сердца как прямого следствия генетически измененных электрофизиологических свойств кардиомиоцитов. Особенно это относится к пациентам с синдромом Brugada, поскольку наличие структурных нарушений является частью фенотипа.
Было высказано предположение, что вирусная инфекция может служить частью пускового механизма, который сопровождает развитие структурных нарушении у пациентов с синдромом Brugada с мутацией SCN5A или без нее.
В связи с этим при клиническом ведении пациентов необходимо осторожно оценивать ЭКГ у всех пациентов с синдромом Brugada.
Недавно о втором генетическом варианте синдрома Brugada сообщили на примере одной большой семьи с мутацией гена GPD1-L, кодирующего белок, похожий на глицерол-3-фосфат-дсгидрогеназу-1. Функция этого белка в сердце полностью не изучена, по предварительные экспериментальные данные показывают, что мутация гена GPD1-L. уменьшает экспрессию ионного потока натрия.
К сожалению, мутация SCN5A только на 20-25% обусловливает синдром Brugada, подтвержденный клинически, а мутация гена GPD1-L — около 1% случаев синдрома Brugada, о чем свидетельствуют преварительные данные (Priori S.G., Napolitano С, личное сообщение).
Несмотря на то что клиническое значение генетического тестирования при синдроме Brugada ограничено, в случаях, когда оно доступно, эта информация полезна для идентификации «немых носителей» и для доклинической диагностики у членов семьи пробанда.
Учебное видео ЭКГ при синдроме Бругада
При проблемах с просмотром скачайте видео со страницы Здесь
– Также рекомендуем “Прогноз синдрома Бругада. Катехоламинергическая полиморфная желудочковая тахикардия (KПЖТ)”
Оглавление темы “Наследственные нарушения ритма и поражения миокарда”:
1. Генетика синдрома удлиненного интервала QT. Лечение синдрома удлиненного интервала QT
2. Фенотип синдрома удлиненного интервала QT. Риск развития синдрома удлиненного интервала QT
3. Синдром Brugada. Генетические основы синдрома Бругада
4. Прогноз синдрома Бругада. Катехоламинергическая полиморфная желудочковая тахикардия (KПЖТ)
5. Аутосомно-доминантная форма катехоламинергической полиморфной желудочковой тахикардии. Аутосомно-рецессивная KПЖТ
6. Синдром короткого интервала QT. Клиника синдрома короткого интервала QT
7. Генетические болезни миокарда. Наследственные причины кардиомиопатий
8. Гипертрофия миокарда. Мутация саркомеров при гипертрофической кардиомиопатии (ГКМП)
9. Мутация белков толстых филаментов миокарда. Альфа-изоформа МНС предсердий и желудочков сердца
10. Предрасположенность к аритмиям при ГКМП. Титин при гипертрофической кардиомиопатии
Источник
Синдром Бругада — это редкое заболевание сердца, характеризующееся желудочковой тахиаритмией и повышенным риском внезапной сердечной смерти.
Клинические проявления синдрома Бругада могут наблюдаться в любом возрасте, но обычно дебют заболевания приходится на зрелый возраст. Типичный пациент с СБ — здоровый мужчина 35-40 лет, не имеющий в анамнезе заболеваний сердца или каких-либо признаков сердечно-сосудистой недостаточности.
Для синдрома Бругада характерны такие проявления, как затруднение дыхания, обмороки, желудочковая тахиаритмия (фибрилляция желудочков) и снижение коронарного кровоснабжения.
Распространенность СБ во всем мире составляет ~5 случаев на десять тысяч человек, но в странах Юго-Восточной Азии заболеваемость намного выше: до 10 случаев на десять тысяч человек. У мужчин этот синдром диагностируют до 8 раз чаще.
Причины возникновения
25-30% случаев синдрома Бругада связаны с мутациями в гене SCN5A, которые влияют на структуру и функцию натриевых каналов, вследствие чего снижается содержание натрия в кардиомиоцитах (мышечных клетках сердца) и нарушается проводимость сердца.
На данный момент в научной литературе описаны более 200 мутаций 18 различных генов, также ассоциированных с синдромом Бругада. Но роль, которую они играют в возникновении этого редкого заболевания, еще предстоит определить. Большая часть мутаций наследуется от родителей к детям (по аутосомно-доминантному типу). Ребенок, чей родитель является носителем мутационного гена, имеет 50% шанс унаследовать СБ.
Приобретенная (негенетическая) форма СБ (65-70%) ассоциируются с некоторыми лекарствами (блокаторами натриевых каналов); высоким уровнем калия или кальция в крови; низким уровнем калия; лихорадкой. В некоторых случаях причину развития синдрома установить не удается.
Согласно статистике, от 12 до 20% всех случаев внезапной смерти обусловлены синдромом Бругада.
Симптомы
Обычно клинические проявления синдрома Бругада возникают в покое — во время сна или отдыха — и включают затруднение дыхания, обмороки, судороги, желудочковую тахиаритмию и остановку сердца. Внезапная остановка сердца может являться начальным симптомом СБ примерно у трети пациентов.
Нередко синдром Бругада протекает без явных признаков или симптомов (аритмии, затруднения дыхания, потери сознания). Риск внезапного и полного прекращения сердечной деятельности у таких пациентов значительно ниже.
Диагностика
Врач проводит подробный опрос пациента, изучает семейную историю (включая семейную историю внезапной сердечной смерти). Физикальный осмотр, как правило, не выявляет никаких отклонений, поэтому пациенту назначается ЭКГ — в некоторых случаях с использованием лекарственных препаратов (блокаторов кальциевых каналов), которые помогают определить характерные признаки синдрома Бругада. Дополнительно, для дифференциальной диагностики, могут назначаться другие инструментальные исследования сердца, суточное мониторирование ЭКГ (холтер).
Лабораторная диагностика может включать генетическое исследование на мутацию в гене SCN5A, анализ на уровень кальция и калия, анализы на уровень МВ-креатинкиназы и тропонина (для исключения других диагнозов).
Дифференциальный диагноз
Чаще всего синдром Бругада дифференцируют (различают) со следующими заболеваниями:
- синдром Романо — Уорда — врожденный синдром удлиненного интервала QT 3 типа, также обусловленный мутациями в гене SCN5A (существует мнение, что LQT3 и синдром Бругада могут быть разными типами одного и того же расстройства);
- аритмогенная кардимиопатия (АКМП);
- мышечная дистрофия Дюшенна;
- другие заболевания и расстройства: острый миокардит, гиперкалиемия, гиперкальциемия.
Лечение синдрома Бругада
Лекарственных препаратов, воздействующих на причину развития синдрома Бругада, не существует. Пациентам с высоким риском желудочковой тахиаритмии и внезапной остановки сердца предлагается имплантация кардиовертер-дефибриллятора. Использование антиаритмических препаратов спорно: с одной стороны, такие препараты, как хинидин, способны снижать количество эпизодов желудочковой тахиаритмии, с другой стороны, известны случаи, когда их применение у пациентов с СБ было связано с возникновением фатальной аритмии.
Рекомендации по терапии для пациентов с бессимптомным течением заболевания противоречивы: наблюдение до появления симптомов (хотя начальным симптомом может являться остановка сердца), изучение семейной истории, электрофизиологическое исследование сердца с целью определения показаний к установке кардиовертер-дефибриллятора. Генетическое тестирование рекомендуется не только пациентам с СБ, но и их родственникам. Также пациентам предлагается симптоматическое и поддерживающее лечение.
Особенности и преимущества лечения синдрома Бругада в клинике Рассвет
Кардиологи Рассвета занимаются диагностикой и лечением всех заболеваний, связанных с поражением сердца и сосудов, в том числе — редких болезней и синдромов.
Наши специалисты проводят оценку индивидуального риска сердечно-сосудистых событий, основанную на доказательных методах и математических расчетах. Такой подход позволяет предсказать риск коронарной катастрофы, вовремя принять меры профилактики, изменить образ жизни и сохранить здоровье сердца на долгие годы.
В распоряжении кардиологов Рассвета современное медицинское оборудование, позволяющее точно диагностировать не только типичные заболевания сердца и сосудов, но и редкие болезни и синдромы, которые остаются «медицинской загадкой» для большинства специалистов других медицинских учреждений.
Наши пациенты могут быть уверены в том, что в Рассвете им поставят правильный диагноз, подберут эффективное лечение типичного или редкого заболевания, предложат индивидуальную схему симптоматической и поддерживающей терапии, если лекарства, воздействующего на причину редкой болезни, не существует.
Источник
