Гипоксическо ишемическая энцефалопатия синдром двигательных нарушений
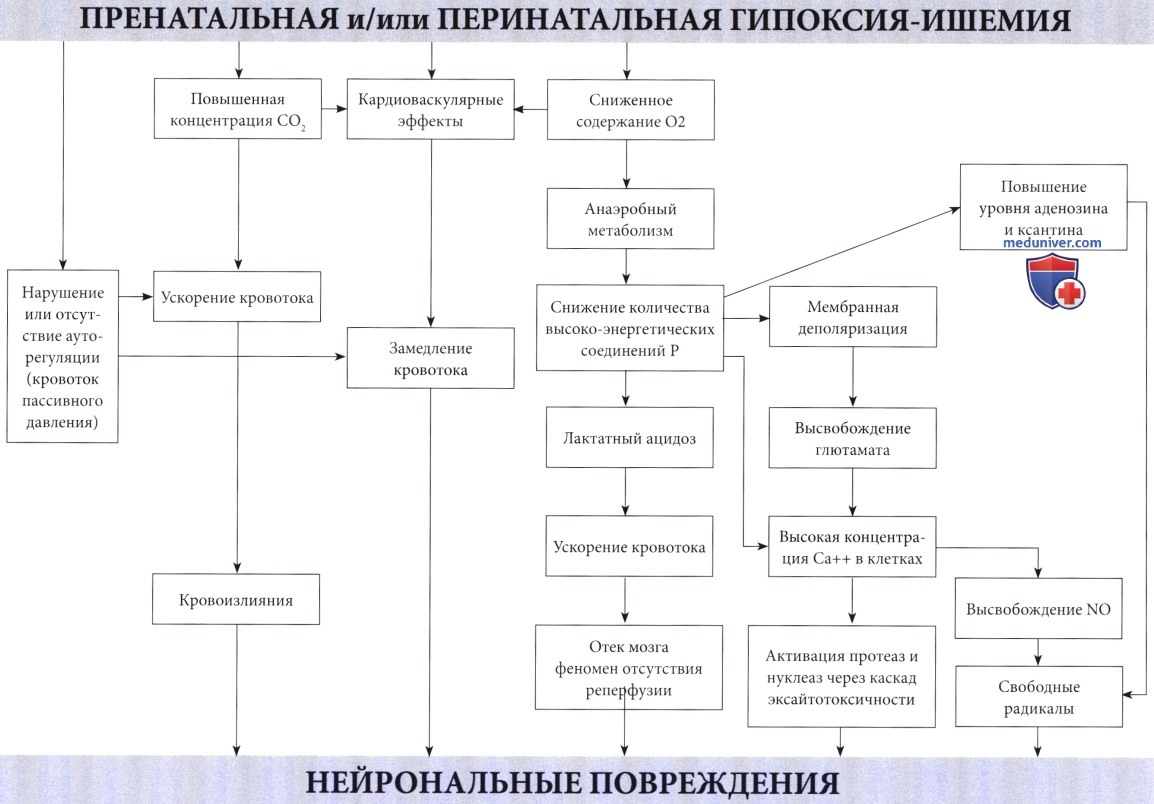
Гипоксически-ишемическая энцефалопатия у новорожденного (ГИЭ, неонатальная энцефалопатия) – причины, патогенезГипоксически-ишемическая энцефалопатия (ГИЭ) встречается примерно у 1-6 из 1000 живорожденных и является самой важной проблемой неонатальной неврологии (Levene et al., 1985, Volpe, 2001, Ferriero, 2004). Гипоксически-ишемическая энцефалопатия (ГИЭ) относится к серьезным состояниям, при котором 15-20% пострадавших детей умирает в течение неонатального периода, а у 25% развиваются стойкие неврологические последствия (Volpe, 2008). Более двадцати лет назад было отмечено завышенное значение перинатальной гипоксии в этиологии задержки умственного развития и церебрального паралича (Freeman и Nelson, 1988, Вах и Nelson, 1993). Badawi et al. (1998) обнаружили, что многие новорожденные подвергались антенатальным факторам риска, таким как лечение материнского бесплодия или заболеваний щитовидной железы, тогда как другие имели и анте-, и интранатальные факторы риска. Хотя не исключается возможность наличия пренатальных факторов риска, вероятно повышающих чувствительность ребенка к проблемам родового периода, в проспективном исследовании результатов MPT Cowan et al. (2003) было отмечено, что у большинства новорожденных (n=351) с неонатальной энцефалопатией повреждение мозга возникало в момент рождения или незадолго до этого. Определение гипоксически-ишемической энцефалопатии (ГИЭ) сложное и роль асфиксии в родах трудно точно установить, так что и сам термин ставится под сомнение; вместо него предлагается неопределенное понятие «неонатальная энцефалопатия» (Nelson и Leviton, 1991, Leviton и Nelson, 1992, Badawi et al, 1998). Диагноз ГИЭ не должен устанавливаться без серьезной клинической основы и тщательного анализа альтернативных вариантов, потому что они могут играть роль в терапии и этиологии. Патофизиология. Недостаточное поступление кислорода, вызывающее развитие гипоксической-ишемической энцефалопатии (ГИЭ), может возникнуть по двум механизмам: гипоксемия, т.е. ограниченный доступ кислорода в кровь; и ишемия, т.е. сниженная перфузия головного мозга. В большинстве случаев оба механизма связаны с асфиксией в виде гипоксии, сопровождающейся гиперкарбией (Altman et al., 1993). Обычно присутствующий при гипоксии ацидоз в значительной степени связан с повышенным образованием лактата. Преобразование глюкозы в молочную кислоту менее эффективно, чем окисление в цикле Кребса и митохондриальной системе транспорта электронов. В результате окисления каждой молекулы глюкозы, переработанной в анаэробных условиях, образуется только две молекулы аденозина дифосфата (АДФ) по сравнению с 38 молекулами при аэробных условиях. Несмотря на значительное повышение скорости гликолиза и усиление мозгового кровотока из-за ацидоза и гиперкапнии (Laptook et al., 1988), потребности ткани мозга в кислороде не могут быть удовлетворены. Повышенная скорость гликолиза приводит к падению уровня глюкозы в мозге. Предупреждение этого состояния предварительным введением глюкозы повышает выработку АТФ и улучшает выживаемость (Vannucci и Yager, 1992). Однако избыточный уровень глюкозы в то же время приводит к повышенному образованию лактата, вредного для мозговой ткани взрослого, но, по-видимому, полезного для ЦНС новорожденного (Hattori и Wasterlain, 1990). В итоге, в результате нехватки кислорода в клетках мозга снижается количество фосфокреатина и АТФ, конечных акцепторов электронов. Эти изменения были продемонстрированы у новорожденных с использованием фосфорной МРС (магнитно-резонансная спектроскопия) (Younkin et al., 1988, Laptook et al., 1989). Падение уровня высокоэнергетических соединений фосфата наблюдалось даже при стабилизации кардиопульмональной функции (Hope et al., 1984). В экспериментах на животных снижение уровня АТФ более чем на 30% происходило за 6 минут (Raichle, 1983). Также было отмечено накопление лактата, сохранявшееся в течение длительного периода времени (Groenendaal et al, 1994, Robertson et al., 1999).
В действительности, нарушению мозговой функции предшествует сбой в энергетическом метаболизме (см. Volpe, 2001). При угрозе перебоев организм отвечает угнетением нейрональной активности по неопределенному механизму, но при длительной гипоксии этого недостаточно. Однако мозг новорожденного чрезвычайно устойчив к гипоксии. При экспериментах на плодах обезьян потребовалось снижение сатурации кислорода на 90% в течение не менее 25 минут, чтобы вызвать повреждение ткани мозга. В результате, любой, достаточно тяжелый для повреждения мозга эпизод асфиксии вызывает нарушения и других органов, особенно сердца, и при таких условиях ишемия постоянна. Ишемия оказывает влияние, подобное асфиксии (Painter, 1989). Процесс гликолиза ускоряется, но поглощению глюкозы препятствует нарушение кровотока, соответственно запасы высокоэнергетических фосфатов истощаются, и накапливается лактат. Влияние гиперлактатемии многопланово. Первоначально оно благотворно, поскольку повышает приток крови к мозгу, но затем становится вредным, так как хотя бы отчасти влияет на отек мозга, который в свою очередь может сдавить капиллярное русло и вызвать ишемию (Myers, 1972). В то же время он нарушает ауторегуляцию церебрального кровообращения, приводя к мозговому кровотоку пассивного давления (Lou, 1988), что делает мозг более чувствительным к изменениям системного давления крови. Сочетание отека мозга и системной недостаточности кровообращения, вероятно, играет существенную роль в происхождении гипоксического повреждения ЦНС. Гипоксия обычно повышает долю сердечного выброса, предназначенную для головного мозга. По мере усиления степени гипоксии наблюдается уменьшение сердечного выброса с последующей неспособностью поддерживать артериальное давление на необходимом уровне. Но показатели частоты сердечных сокращений и артериального давления остаются неизменными до тех пор, пока артериальная сатурация не снизится более, чем на 65%, а затем также линейно снижаются. Это снижение может поддерживаться на протяжении часов без развития энцефалопатии, если содержание кислорода в артериальной крови не упадет более, чем на 85% (Fenichel, 1997). Механизм отека мозга и гипоксического повреждения у плодов до конца неясен. Levene et al. (1989) выявили хорошую корреляцию между высокой скоростью мозгового кровотока—предположительно отражающей церебральную гиперемию, которая, в свою очередь, может отвечать за повышение внутричерепного давления — и неблагоприятным течением. Lupton et al. (1988) показали, что отек в большей степени является следствием, чем причиной, нейрональных некрозов, объясняя, таким образом, ограниченную эффективность противоотечного лечения новорожденных с ГИЭ (Levene et al., 1987). Не было замечено различий в степени внутричерепной гипертензии у детей с ГИЭ в группе выживших и умерших (Goitein et al, 1983). Последние данные подтверждают основную роль апоптоза в развитии гипоксически-ишемического повреждения мозга новорожденных, возможно, даже большую, чем некроз после повреждения. Во время неонатального поражения мозга токсичность возбуждающих медиаторов, оксидативный стресс и воспаление способствуют ускоренной гибели клеток, главным образом, посредством апоптоза или некроза, что зависит от области поражения и тяжести повреждения. В настоящее время известно, что ГИЭ состоит из двух последовательных стадий, с окончательным повреждением с отсрочкой на несколько часов во время второй из них, определяемой как вторичная недостаточность энергии. Тем не менее, профилактика возможна, как только появляется терапевтическое окно. Механизмы повреждения и некроза клеток при гипоксии и ишемии не просто итог энергетической недостаточности. Это вторичные пусковые факторы каскада разрушительных событий при достижении критического уровня дефицита энергии. Такие события происходят в течение нескольких часов. Избыточная мембранная деполяризация и высвобождение возбуждающих аминокислотных нейротрансмиттеров, в первую очередь глютамата (Lipton и Rosenberg, 1994), приводит к массивному входу кальция через NMDA и АМРА мембранные рецепторы (Morley et al., 1994) и к накоплению кальция в цитозоле. Кальций, в свою очередь, активирует различные липазы, протеазы и нуклеазы с последующим разрушением основных клеточных белков. Свободные радикалы прямо или косвенно вызваны повышенным уровнем кальция в цитозоле (McCord, 1985) и оксида азота (Dawson et al., 1992), играющего главную роль в их образовании. Этот каскад возбуждающих медиаторов в конечном счете приводит к повреждению мембраны, разрушению цитоскелета и, наконец, к дезинтеграции клетки. Теоретически существует возможность предотвращения многих процессов, поэтому проводились исследования с различными средствами, в том числе блокаторами кальциевых каналов (Miller, 1993, Palmer и Vanucci, 1993); антагонистами возбуждающих аминокислот (Hattori et al., 1989), особенно магнезией (Marret et al., 1995, Nelson и Grether, 1995); ингибиторами синтеза оксида азота (Dawson et al., 1992); акцепторами свободных радикалов (Palmer и Vannucci, 1993) и веществами, подавляющими образование свободных радикалов типа аллопуринола (Palmer et al., 1990, van Bel et al., 1998, Benders et al., 2006). – Также рекомендуем “Нейропатология при гипоксически-ишемической энцефалопатии у новорожденного (ГИЭ, неонатальной энцефалопатии)” Редактор: Искандер Милевски. Дата публикации: 25.11.2018 |
Источник
Нарушения работы головного мозга, вызванные длительной недопоставкой кислорода, входят в симптомокомплекс, называемый гипоксически-ишемической энцефалопатией (ГИЭ). Мозговые отклонения могут быть следствием комы, инсульта, длительной искусственной вентиляцией легких. В основном, перечисленные причины относятся к взрослым пациентам, но чаще ГИЭ наблюдаются у новорожденных.
Общие понятия
Энцефалопатией принято называть органические (необратимые) поражения головного мозга, обусловленные дистрофическими изменениями мозговой ткани. При этом наблюдаются нарушения функций головного мозга – от относительно легких до грубых. В клинической практике выделяют несколько форм энцефалопатий в зависимости от причин, их вызвавших.
Постгипоксическая энцефалопатия (ПЭ) развивается на фоне длительной гипоксии – недостаточной поставки кислорода к нейронам мозга вследствие нарушенного кровоснабжения. Перинатальная ПЭ – нарушения мозговых функций у новорожденных, обусловленных гипоксией во время беременности матери, а также в процессе родов. Причинами ППЭ могут быть также:
- обвитие шеи новорожденного пуповиной;
- недоношенность ребенка;
- высокая масса тела ребенка при рождении.
Перинатальная гипоксически-ишемическая энцефалопатия
Перинатальная ГИЭ является осложнением патологии протекания беременности и родов. Развитию патологии могут способствовать:
- тяжелые осложнения беременности – преэклампсия и эклампсия;
- проблемы с плацентой: предлежание либо преждевременная отслойка;
- многоплодие;
- возраст матери более 35 лет (особенно при первых родах);
- хроническая интоксикация беременной (вдыхание токсических веществ при неблагоприятных условиях труда, курение);
- заболевания матери вирусной или бактериальной этиологии во время беременности, а также хронические инфекции и заболевания внутренних органов;
- нарушения функционирования сердечнососудистой системы плода;
- инфицирование околоплодных вод.
Наиболее частыми причинами ПГИЭ являются родовые травмы и неправильное ведение кесарева сечения. Они приводят к повреждению сосудов головного мозга новорожденного.
Симптомы и синдромы энцефалопатии гипоксического генеза у новорожденных:

- Слабая реакция на световые, звуковые, тактильные раздражения.
- Вздрагивания, подергивания конечностями.
- Возбужденное состояние, частый беспричинный плач.
- Поверхностный и беспокойный сон с частыми пробуждениями.
- Неестественно частые срыгивания.
- Судорожные припадки.
- Увеличенные размеры головы в целом и большого родничка, в частности (гидроцефалия).
- Снижение вплоть до полного угнетения основных рефлексов – сосательного и глотательного.
- Ослабление мышечного тонуса – возможно появление лицевой асимметрии, косоглазия.
- Снижение либо полное отсутствие активности.
- Коматозное состояние с полным отсутствием основных рефлексов и ответа на болевые раздражители. Такое тяжелое состояние сопровождается снижением артериального давления, нарушением сердечной и дыхательной деятельности.
В зависимости от тяжести проявлений заболевания гипоксическая энцефалопатия подразделяется на 3 степени либо стадии:
- Легкая степень, или компенсаторная стадия. Проявляется повышенной возбудимостью, но иногда – неопасным угнетением нервной системы. Лечение начинают проводить в родильном доме. После выписки ребенок наблюдается у невролога детской поликлиники.
- Среднетяжелая степень, или субкомпенсаторная стадия. Характерна угнетением центральной нервной системы с появлением судорог, гидроцефалии и внутричерепной гипертензии. Лечение начинается в родильном доме, затем ребенка переводят в стационар до стабилизации состояния.
- Тяжелая степень или терминальная стадия. Прекращается снабжение мозга кислородом, происходит угнетение ЦНС до прекоматозного или коматозного состояния. Лечение проводится только в условиях реанимации.
Лечение
В острый период заболевания ребенок получает лечение в отделении патологии со специально созданными условиями. Проводится оксигенотерапия, при необходимости – питание через зонд. Мониторируются все жизненные показатели. При необходимости проводят спинномозговые пункции. Медикаменты назначаются в зависимости от проявления преобладающих симптомов. Для улучшения метаболизма в нейронах головного и спинного мозга проводят инфузионную терапию – введение физиологических растворов хлорида натрия, декстрозы с добавлением микроэлементов и витаминов (калия, магния, кальция, аскорбиновой кислоты).
Для снижения гипертензионного синдрома применяется дегидратация препаратом Маннитол. Для купирования и профилактики судорог применяются сильнодействующие противосудорожные средства (Фенобарбитал, Диазепам). Для улучшения циркуляции крови в головном мозге назначаются ноотропы (Кортексин, Ноотропил, Актовегин, Кавинтон).
Восстановительный период
При улучшении самочувствия ребенка переводят на дневной стационар либо амбулаторное лечение. Медикаментозное лечение сочетается с физиотерапевтическими процедурами, массажем, лечебной физкультурой, плаванием в бассейне. Если в дальнейшем у ребенка наблюдаются нарушения речевой функции, проводятся логопедические уроки со специалистом.
Последствия
Самыми грозными осложнениями ПГИЭ являются развитие эпилепсии, гидроцефалии и детского церебрального паралича. Поэтому следует все силы направить на строгое соблюдение рекомендаций врача.
Добавить комментарий
Источник
Асфиксия при родах и гипоксическая ишемическая энцефалопатия (ГИЭ) у новорожденных: диагностика, лечение, прогнозАсфиксия при родах характеризуется критическим снижением оксигенации плода в матке в процессе родов, что приводит к лактоацидозу и способствует развитию тяжёлого состояния новорождённого ребёнка, вызванного задержкой инициации дыхания. Она остаётся важной причиной повреждения головного мозга, приводящего к инвалидности или смерти, поэтому предотвращение асфиксии считают одной из ключевых целей современной акушерской помощи. При фетальной КТГ могут выявляться изменения, однако этот метод исследования не подходит для определения тяжести асфиксии, если только она не глубокая. Нормальная КТГ даёт достоверный прогноз отсутствия асфиксических проблем у новорождённого. Анализ фетальной или пуповинной крови позволяет выявить метаболический ацидоз, однако с их помощью также не удаётся достоверно спрогнозировать исход для новорождённого, если у него нет тяжёлого ацидоза. Низкие показатели по шкале Апгар на 1-й и 5-й минутах, отражающие задержку инициации дыхания и нарушение кровообращения при рождении, также слабо прогнозируют исход, однако если сохраняется низкое значение этого показателя (5 или меньше) в первые 10 мин после рождения, риск длительной обездвиженности или смертности составляет приблизительно 50%. Термином «гипоксическая ишемическая энцефалопатия» описывают клинические проявления поражения головного мозга у младенцев, рождённых в срок, возникающие немедленно или в течение 48 ч после асфиксии, как антенатальной, так и постнатальной. Её подразделяют по степени тяжести. • Лёгкая — младенец раздражительный, избыточно реагирует на стимуляцию, глаза его широко раскрыты, могут быть гипервентиляция, нарушенное кормление. • Умеренная — у младенца отмечают значительные нарушения мышечного тонуса и движений, он не может принимать пищу, иногда возникают судороги. • Тяжёлая — отсутствуют нормальные спонтанные движения или реакция на боль, тонус мышц конечностей варьирует от гипотонии до гипертонии, наблюдают продолжительные судороги, рефрактерные к терапии, отмечают мультиорганные нарушения.
Лечение гипоксической ишемической энцефалопатии у новорожденныхКвалифицированная реанимация и стабилизация факторов риска способствуют уменьшению поражения вследствие асфиксии. Детям с гипоксической ишемической энцефалопатией иногда требуются дополнительные лечебные мероприятия. Рандомизированные клинические исследования показали, что умеренная гипотермия (охлаждение на 3-4 °С) может снизить повреждение мозга, если начата в первые 6 ч после рождения. Прогноз гипоксической ишемической энцефалопатии у новорожденныхПри лёгкой степени гипоксической ишемической энцефалопатии можно ожидать полного восстановления. У младенцев, перенёсших умеренную гипоксическую ишемическую энцефалопатию, но полностью восстановившихся по данным клинического обследования, которые нормально питаются в первые 7 дней жизни, долгосрочный прогноз благоприятный, однако если клинические изменения сохраняются спустя 10 дней, полное восстановление маловероятно. При тяжёлой гипоксической ишемической энцефалопатии уровень смертности составляет 30-40%, а более 80% выживших младенцев имеют неврологические нарушения и нарушения развития, особенно церебральный паралич. Если при МРТ на 4-14-й день у младенцев, рождённых в срок, отмечают двусторонние нарушения в базальных ганглиях и таламусе, а также демиелинизацию в задней ножке внутренней капсулы, существует высокий риск развития церебрального паралича. В связи с потенциальными медико-юридическими вопросами в отношении термина «асфиксия при рождении» было предложено, что младенцам с отсутствием дыхания при рождении или развитием судорог или других патологических неврологических проявлений обязательно проводить обследование в целях выявления возможной неонатальной энцефалопатии. Диагноз гипоксической ишемической энцефалопатии (ГИЭ) можно поставить только в случаях, если: – Также рекомендуем “Родовые травмы у новорожденных: признаки, диагностика” Оглавление темы “Особенности недоношенных новорожденных”:
|
Источник

