Хронический миеломоноцитарный лейкоз код мкб
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Дифференциальная диагностика
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Хронический миелолейкоз.
Хронический миелолейкоз
Описание
Хронический миелобластный лейкоз (ХМЛ, хронический миелолейкоз, хронический миелоидный лейкоз) — форма лейкоза, которая характеризуется усиленным и нерегулируемым ростом преимущественно миелоидных клеток в костном мозге с их накоплением в крови. ХМЛ — гемопоэтическое клоновое заболевание, основным проявлением которого является пролиферация зрелых гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников; вариант миелопролиферативного заболевания, ассоциированный с характерной хромосомной транслокацией (филадельфийской хромосомой). В настоящее время основным способом лечения хронического миелолейкоза является таргетная (целевая) терапия иматинибом и другими препаратами, значительно улучшившая показатели выживаемости.
Симптомы
Заболевание часто протекает бессимптомно, выявляясь при рутинном клиническом анализе крови. ХМЛ может проявляться недомоганием, субфебрильной лихорадкой, подагрой, повышенной восприимчивостью к инфекциям, анемией, тромбоцитопенией с кровоточивостью (хотя также может наблюдаться повышенное содержание тромбоцитов). Также отмечается спленомегалия.
ХМЛ часто разделяют на три фазы на основании клинических характеристик и лабораторных данных. В отсутствие лечения, ХМЛ обычно начинается с хронической фазы, в течение нескольких лет прогрессирует в фазу акселерации и, в конечном счёте, развивается бластный криз. Бластный криз — терминальная фаза ХМЛ, клинически подобная острому лейкозу. Одним из факторов прогресии от хронической фазы к бластному кризу является приобретение новых хромосомных аномалий (в дополнение к Филадельфийской хромосоме). Некоторые пациенты к моменту постановки диагноза могут находиться уже в фазе акселерации или в бластном кризе.
Около 85 % пациентов с ХМЛ к моменту постановки диагноза находятся в хронической фазе. В течение этой фазы клинические проявления обычно отсутствуют или имеются «лёгкие» симптомы, такие как недомогание или чувство переполнения живота. Продолжительность хронической фазы различна и зависит от того, насколько рано было диагностировано заболевание, а также от проведённого лечения. В конечном счёте, при отсутствии эффективного лечения, заболевание переходит в фазу акселерации.
Фаза акселерации.
Диагностические критерии перехода в фазу акселерации могут различаться: наиболее широко используются критерии, установленные исследователями онкологического центра Андерсона при Техасском университете, Сокалом с соавторами, а также Всемирной организацией здравоохранения. Критерии ВОЗ, вероятно, наиболее широко распространены, и отличают фазу акселлерации следующим:
• 10-19 % миелобластов в крови или костном мозге.
• >20 % базофилов в крови или костном мозге.
• <100,000 тромбоцитов, вне связи с терапией.
• >1,000,000, вне зависимости от терапии.
• Цитогенетическая эволюция с развитием новых аномалий в добавление к Филадельфийской хромосоме.
• Прогрессирование спленомегалии или увеличение числа лейкоцитов, вне зависимости от терапии.
Фаза акселерации предполагается при наличии любого из указанных критериев. Фаза акселерации указывает на прогрессию заболевания и ожидаемый бластный криз.
Бластный криз.
Бластный криз — финальная стадия развития ХМЛ, протекающая подобно острому лейкозу, с быстрой прогрессией и непродолжительной выживаемостью. Бластный криз диагностируется на основе одного из следующих признаков у пациента с ХМЛ:
• >20 % миелобластов или лимфобластов в крови или костном мозге.
• Крупные группы бластов в костном мозге при биопсии.
• Развитие хлоромы (солидного фокуса лейкемии вне костного мозга).
Ассоциированные симптомы: Базофилия. Высокая температура тела. Изменение аппетита. Изменение веса. Истощение. Лейкоцитоз. Ломота в суставах. Моноцитоз. Лихорадка. Недомогание. Нейтрофилез. Общая потливость. Потеря веса. Общая слабость. Тромбоцитоз. Увеличение СОЭ. Эозинофилия.
Хронический миелолейкоз
Дифференциальная диагностика
ХМЛ следует дифференцировать от лейкемоидной реакции, при которой мазок крови может имееть схожую картину.
Причины
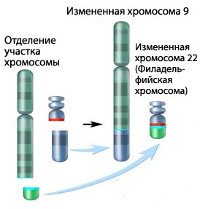
ХМЛ стал первым злокачественным заболеванием с выявленной генетической аномалией, хромосомной транслокацией, которая проявляется патологической Филадельфийской хромосомой. Эта хромосомная патология получила своё название, так как была впервые открыта и описана в 1960 году учёными из Филадельфии, Пенсильвания, США: Питером Ноуеллом (Пенсильванский университет) и Дэвидом Хангерфордом (университет Темпл).
При этой транслокации, части из 9ой и 22ой хромосом меняются местами. В результате, к части BCR-гена из хромосомы 22 прикрепляется ABL-ген из хромосомы 9. Этот аномальный «слившийся» ген генерирует белок p210, или, иногда, p185. Так как abl имеет область, добавляющую фосфатную группу к тирозиновому остатку (тирозин-киназа), продукт аномального гена также является тирозин-киназой.
Белок BCR-ABL взаимодействует с частью клеточного рецептора к ИЛ-3 (CD123-антигеном). Транскрипция BCR-ABL работает непрерывно и не нуждается в активации другими белками. С другой стороны, сам BCR-ABL активирует белковый каскад, контролирующий клеточный цикл, ускоряя деление клеток. Более того, белок BCR-ABL подавляет репарацию ДНК, вызывая неустойчивость генома и делая клетку более восприимчивой к дальнейшим генетическим аномалиям. Активность BCR-ABL — патофизиологическая причина хронического миелолейкоза. С улучшением понимания природы BCR-ABL белка и его действия в качестве тирозин-киназы, была разработана таргетная (целевая) терапия, позволяющая специфически ингибировать активность BCR-ABL белка. Эти ингибиторы тирозин-киназы могут способствовать полной ремиссии ХМЛ, что ещё раз подтверждает ведущую роль bcr-abl в развитии заболевания.
Лечение
Лечение при хроническом миелолейкозе начинают после установления диагноза и обычно проводят амбулаторно.
При отсутствии симптомов хронического миелолейкоза на фоне стабильного лейкоцитоза, не превышающего 40-50- 109/л, применяют гидроксимочевину или бусульфан до достижения содержания лейкоцитов в крови 20*109/л.
По мере прогрессирования хронического миелолейкоза показаны гидроксимочевина (гидрэа, литалир), а-ИФН. При значительной спленомегалии проводят облучение селезёнки.
При выраженной симптоматике хронического миелолейкоза используют комбинации препаратов, применяемых при острых лейкозах: винкристин и преднизолон, цитарабин (цитозар) и даунорубицин (рубомицина гидрохлорид). В начале терминальной стадии иногда эффективен митобронитол (миелобромол).
В настоящее время для терапии хронического миелолейкоза предложен новый препарат — блокатор мутантной тирозинкиназы (р210) — Гливека (STI-571). При бластном кризе ХМЛ и при Ph-позитивных ОЛЛ дозу увеличивают. Применение препарата приводит к полной ремиссии заболевания без эрадикации опухолевого клона.
Трансплантация стволовых клеток крови или красного костного мозга, проводимая больным моложе 50 лет в I стадии заболевания, в 70% случаев приводит к выздоровлению.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Хронический миелолейкоз (хронический гранулоцитарный лейкоз, хронический миелогенный лейкоз, хронический миелоидный лейкоз) развивается, когда в результате злокачественной трансформации и клональной миелопролиферации плюрипотентных стволовых клеток начинается значительная гиперпродукция незрелых гранулоцитов.
Заболевание изначально протекает бессимптомно. Прегрессирование хронического миелолейкоза протекает скрыто с неспецифической, «доброкачественной» стадией заболевания (недомогание, отсутствие аппетита, потеря веса), постепенно переходящей в фазу акселерации и властный криз с более выраженными симптомами болезни, такими какспленомегалия, бледность, кровоточивость, склонность к подкожным кровоизлияниям, лихорадка, лимфаденопатия и изменения кожи. Для установления диагноза необходимо исследование мазка периферической крови, аспирата костного мозга и определение филадельфийской хромосомы. Применение иматиниба значительно улучшило ответ на лечение и выживаемость больных. Способность иматиниба вызывать излечение в настоящее время изучается. Также для лечения применяются миелосупрессивные препараты (например, гидроксимочевина), трансплантация стволовых клеток, интерферон а.
Хронический миелолейкоз составляет приблизительно 15 % от всех лейкозов у взрослых. Он встречается в любом возрасте, но редко развивается до 10 лет, медиана возраста на момент постановки диагноза составляет 45-55 лет. Он одинаково распространен у мужчин и женщин.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Код по МКБ-10
C92.1 Хронический миелоидный лейкоз
Патофизиология хронического миелолейкоза
Большинство случаев хронического миелолейкоза, по-видимому, индуцируется транслокацией, известной как филадельфийская хромосома, которая обнаруживается у 95 % больных. Она представляет собой реципрокную транслокацию t (9;22), при которой часть хромосомы 9, содержащая онкоген с-аbl, транслоцируется на хромосому 22 и соединяется с геном BCR. Объединенный ген ABL-BCR играет важную роль в патогенезе хронического миелолейкоза и приводит к продукции специфической тирозинкиназы.Хронический миелолейкоз возникает вследствие гиперпродукции гранулоцитов аномальной плюрипотентной гемопоэтической клеткой сначала в костном мозге, а затем и экстрамедуллярно (например, в печени, селезенке). Хотя доминирует продукция гранулоцитов, неопластический клон включает в себя и эритроциты, мегакариоциты, моноциты и даже некоторые Т- и В-лимфоциты. Нормальные стволовые клетки сохраняются и могут проявлять активность после лекарственного угнетения клона хронического миелолейкоза.
Хронический миелолейкоз сначала проявляется неактивной, хронической фазой, которая может продолжаться от нескольких месяцев до нескольких лет. В некоторых случаях затем развивается фаза акселерации, манифестирующая отсутствием эффекта от терапии, увеличением анемии и прогрессирующей тромбоцитопенией, за которой следует терминальная фаза, бластный криз, когда бластные опухолевые клетки развиваются в экстрамедуллярных зонах (например, костях, центральной нервной системе, лимфатических узлах, коже). Прогрессирование заболевания, как и при остром лейкозе, приводит к стремительному развитию осложнений, включая сепсис и кровоизлияния. У некоторых больных хроническая фаза непосредственно переходит в фазу бластного криза.
Симптомы хронического миелолейкоза
Заболевание вначале часто протекает скрытно с постепенным развитием неспецифических симптомов (например, утомляемость, слабость, анорексия, снижение массы тела, лихорадка, ночные поты, ощущение полноты в животе), что может способствовать началу обследования. Для начала болезни не характерны бледность, кровоточивость, легко образующиеся подкожные кровоизлияния и лимфаденопатия, но широко распространена умеренная или выраженная спленомегалия (встречается у 60-70 % больных). С прогрессированием заболевания спленомегалия может нарастать, появляется бледность и кровоточивость. Лихорадка, заметная лимфаденопатия и кожная сыпь являются грозными предвестниками.
Диагностика хронического миелолейкоза
Хронический миелолейкоз часто диагностируется на основании общего клинического анализа крови, проведенного случайно или при обследовании по поводу спленомегалии. Уровень гранулоцитов повышен, обычно составляет менее 50 000/мкл у бессимптомных больных, и 200 000-1 000 000/мкл у пациентов с проявлениями симптомов болезни; количество тромбоцитов нормально или несколько повышено; уровень гемоглобина обычно более 100 г/л.
Мазок периферической крови может помочь в дифференциальной диагностике хронического миелолейкоза от лейкоцитоза другой этиологии. При хроническом миелолейкозе в мазке преимущественно незрелые гранулоциты, абсолютная эозинофилия и базофилия, хотя у больных с уровнем лейкоцитов менее 50 000/мкл количество незрелых гранулоцитов может быть небольшим. Лейкоцитоз у больных с миелофиброзом обычно сопровождается наличием содержащих ядра эритроцитов, каплевидных эритроцитов, анемией и тромбоцитопенией. Лейкемоидные миелоидные реакции, вызванные раком или инфекциями, редко сопровождаются абсолютной эозинофилией и базофилией.
Уровень щелочной фосфатазы при хроническом миелолейкозе обычно низкий и повышен при лейкемоидных реакциях. Исследование костного мозга необходимо выполнить для оценки кариотипа, клеточности (как правило, повышенной) и степени выраженности миелофиброза.
Диагноз подтверждается при обнаружении Ph-хромосомы при цитогенетическом или молекулярном анализе, хотя у 5 % больных она отсутствует.
В ходе фазы акселерации обычно развиваются анемия и тромбоцитопения. Может повышаться уровень базофилов и нарушаться созревание гранулоцитов. Возрастает доля незрелых клеток и уровень щелочной фосфатазы лейкоцитов. В костном мозге может развиваться миелофиброз, и при микроскопии могут отмечаться сидеробласты. Эволюция неопластического клона может сопровождаться развитием новых аномальных кариотипов, часто определяется дополнительная хромосома 8 или изохромосома 17.
Дальнейшее прогрессирование может привести к развитию бластного криза с появлением миелобластов (у 60 % больных), лимфобластов (30 %) и мегакариобластов (10 %). У 80 % больных определяются дополнительные хромосомные аномалии.
[12], [13], [14], [15]
Какие анализы необходимы?
Лечение хронического миелолейкоза
За исключением некоторых случаев, при которых успешно используется трансплантация стволовых клеток, лечение не приводит к выздоровлению, однако выживаемость может быть продлена при лечении иматинибом.
Иматиниб ингибирует специфическую тирозинкиназу, синтезируемую геном BCR-ABL Препарат высокоэффективен для достижения полной клинической и цитогенетической ремиссии при Ph-позитивном хроническом миелолейкозе и превосходит по эффективности другие режимы (например, интерферон ± цитозина арабинозид). Иматиниб также превосходит другие виды терапии в фазе акселерации и бластного криза. Комбинации химиотерапии с иматинибом при бластном кризе характеризуются более высоким ответом, чем каждый подход к лечению в отдельности. Лечение обладает прекрасной переносимостью. Высокий уровень продолжительности полной ремиссии при терапии иматинибом позволяет надеяться на возможность излечения данного заболевания.
Более старые режимы химиотерапии применяются для лечения BCR-ABL-негативных больных с рецидивами после лечения иматинибом и пациентов с властным кризом. Основными препаратами являются бусульфан, гидроксимочевина и интерферон. Терапию гидроксимочевины легче всего контролировать, и она характеризуется лишь небольшим количеством побочных эффектов. Начальная доза обычно от 500 до 1000 мг перорально 2 раза в сутки. Контроль общего клинического анализа крови производится раз в 1 или 2 недели с соответствующей корректировкой дозы. Бусульфан часто вызывает непредсказуемую общую миелосупрессию, интерферон вызывает гриппоподобный синдром, часто плохо переносимый больными. Основное достоинство этих препаратов – уменьшение спленомегалии и аденопатии и контроль опухолевой нагрузки, приводящий к снижению вероятности развития массивного лизиса опухоли и подагры. Ни один из этих препаратов не увеличивает медиану выживаемости более 1 года в сравнении с не получавшими лечения больными. Таким образом, уменьшение симптомов заболевания является главной целью терапии, и лечение не продолжается при наличии выраженной токсичности.
Хотя облучение селезенки используется редко, этот метод может быть полезен в случаях рефрактерного хронического миелолейкоза или в терминальных стадиях заболевания у больных с выраженной спленомегалией. Общая доза обычно колеблется от 6 до 10 Гр с разделением на фракции от 0,25 до 2 Гр/сутки. Лечение должно начинаться с очень низких доз и тщательно контролироваться по уровню лейкоцитов крови. Эффективность обычно невысока.
Спленэктомия может облегчить абдоминальный дискомфорт, снизить тромбоцитопению и уменьшить потребность в гемотрансфузиях в тех случаях, когда спленомегалию не удается контролировать химиотерапией или лучевой терапией. Спленэктомия играет важную роль в хронической фазе хронического миелолейкоза.
Прогноз при хроническом миелолейкозе
До применения иматиниба от 5 до 10 % больных погибали в течение 2 лет с момента установления диагноза; 10-15 % больных погибали каждый следующий год. Медиана продолжительности жизни составляла от 4 до 7 лет. Большинство больных погибают во время бластного криза или в фазу акселерации. Медиана выживаемости после развития бластного криза составляет от 3 до 6 месяцев, но может увеличиваться до 12 месяцев при достижении ремиссии.
При Ph-негативном хроническом миелолейкозе и хроническом миеломоноцитарном лейкозе менее благоприятный прогноз, чем при Ph-позитивном хроническом миелолейкозе. По клиническим особенностям они схожи с миелодиспластическим синдромом.
Источник
MKБ 10 или международная классификация всех заболеваний 10 созыва имеет в себе практически все короткие обозначения известных патологий, в том числе и онкологических. Лейкоз коротко по МКБ 10 имеет две точные кодировки:
- С91 — Лимфоидная форма.
- С92 — Миелоидная форма или миелолейкоз.
Но также нужно учитывать и характер заболевания. Для обозначения используют подгруппу, которая пишется после точки.
Лимфолейкоз
| Кодировка | Лимфоидный лейкоз |
| C 91.0 | Острый лимфобластный лейкоз при Т или В клеток предшественников. |
| C 91.1 | Лимфоплазматическая форма, Синдром Рихтера. |
| C 91.2 | Подострый лимфоцитарный (в данной время код не используется) |
| C 91.3 | Пролимфоцитарный В-клеточный |
| C 91.4 | Волосатоклеточный и лейкемический ретикулоэндотелиоз |
| C 91.5 | Т-клеточная лимфома или лейкемия взрослых с параметром HTLV-1-ассоциированная. Варианты: Тлеющий, острый, лимфоматоидный, тлеющий. |
| C 91.6 | Пролимфоцитарный T-клеточный |
| C 91.7 | Хронический из больших зернистых лимфоцитов. |
| C 91.8 | Зрелый B-клеточный (Беркитта) |
| C 91.9 | Неутонченная форма. |
Миелолейкоз
Включает в себя гранулоцитарный и миелогенный.
| Коды | Миелоидный лейкоз |
| C 92.0 | Острый миелобластный лейкоз (ОМЛ) с низким показателем дифференцировки, а также форма с созреванием. (AML1/ETO, AML M0, AML M1, AML M2, AML с t (8 ; 21), AML ( без FAB классификации ) БДУ) |
| С 92.1 | Хроническая форма (ХМЛ) [CML], BCR/ABL-положительный. Филадельфийская хромосома (Ph1) положительная. t (9 : 22) (q34 ;q11). С бластным кризом. Исключения: неклассифицированное миелопролиферативное заболевание; атипичный, BCR / ABL-отрицательный; Хронический миеломоноцитарный лейкоз. |
| C 92.2 | Атипичный хронический, BCR/ABL-отрицательный. |
| С 92.3 | Миелоидная саркома в которой новообразование состоит из незрелыз атипичных мелеоилных клеточек. Также в нее входит гранулоцитарная саркома и хлорома. |
| C 92.4 | Острый промиелоцитарный лейкоз [PML] с параметрами: AML M3 и AML M3 с t (15 ; 17). |
| С 92.5 | Острый миеломоноцитарный с параметрами AML M4 и AML M4 Eo с inv (16) or t(16;16) |
| C 92.6 | С 11q23-аномалией и с вариацией MLL хромосомы. |
| С 92.7 | Другие формы. Исключение — гиперэозинофильный синдром или хронический эозинофильный. |
| C 92.8 | С многолинейной дисплазией. |
| С 92.9 | Неутонченные формы. |
Причины
Напомним, что точной причины из-за чего происходит развитие рака крови не известно. Именно поэтому врачам, так сложно бороться с этим недугом и предотвращать его. Но есть ряд факторов, которые могут увеличивать шанс возникновения онкологии красной жидкости.
- Повышенная радиация
- Экология.
- Плохое питание.
- Ожирение.
- Чрезмерное употребление лекарственных средств.
- Лишний вес.
- Курение, алкоголь.
- Вредная работа, связанная с пестицидами и химическими реагентами, которые могут влиять на кроветворную функцию.
Симптомы и аномалии
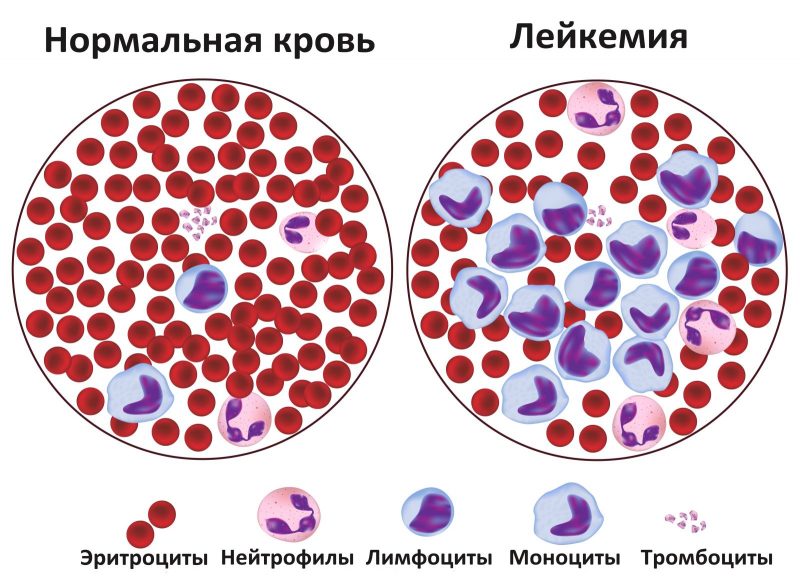
- Анемия возникает в результате угнетения эритроцитов из-за чего кислород до здоровых клеток доходит не в полном объеме.
- Сильные и частые головные боли. Начинается с 3 стадии, когда возникает интоксикация из-за злокачественной опухоли. Также может быть результатом запущенной анемии.
- Постоянная простуда и инфекционные и вирусные заболевания с продолжительным периодом. Бывает, когда здоровые лейкоциты заменяются на атипичные. Они не выполняют свою функцию и организм становится менее защищенным.
- Боль в суставах и ломка.
- Слабость, утомляемость, сонливость.
- Систематическая субфебрильная температура без причины.
- Изменение запаха, вкусов.
- Потеря веса и аппетита.
- Долгие кровотечения при снижении количество тромбоцитов в крови.
- Болезненность воспаление лимфатических узлов по всему телу.
Диагностика
Точный диагноз можно поставить, только после проведения тщательного обследования и сдачи определенного перечня анализов. Чаще всего людей ловят на аномальных показателях при биохимическом и общем анализе крови.
Для более точного диагноза делают пункцию костного мозга из тазовой кости. Позже клетки отправляют на биопсию. Также врач-онколог проводит полный осмотри тела: МРТ, УЗИ, КТ, рентген, для выявления метастазов.
Лечение, терапия и прогноз
Основным типом лечения используется химиотерапия, когда в кровь вводят химические яды, которые направлены на уничтожение аномальных клеток крови. Опасность и малоэффективность данного типа лечения в том, что также уничтожаются и здоровые клетки крови, коих и так мало.
При выявлении первичного очага, врач может назначить химию для полного уничтожения костного мозга в данной зоне. После проведения процедуры также могут проводить и облучение для уничтожения остатков раковых клеток. В процессе происходит пересадка стволовых клеток от донора.
(1 оценок, среднее: 5,00 из 5)
Загрузка…
Источник
