Ивл при респираторном дистресс синдроме
Читать медицинскую статью, новость, лекцию по медицине: «ИВЛ при синдроме острого повреждения легких (СОПЛ) и остром респираторном дистресс-синдроме (ОРДС)» размещена 22-10-2011, 10:53, посмотрело: 5 112

ОРДС развивается у 25% больных с сепсисом и 8,7% пациентов, находящихся на ИВЛ. Летальность при этом патологическом состоянии составляет приблизительно 35%, хотя к смерти обычно приводит полиорганная недостаточность, нежели непосредственно нарушения дыхания.
Продолжает нарастать количество клинических и экспериментальных данных, подтверждающих роль тактики проведения ИВЛ при СОПЛ и ОРДС. Считается, что к развитию вентилятор-индуцированного повреждения легких (ВИПЛ) приводит воздействие физиологического дыхательного объема на раскрытые (не спавшиеся) альвеолы. Использование стандартного дыхательного объема, составляющего 10-12 мл/кг, неизбежно вызывает перерастяжение участвующих в газообмене зон легочной паренхимы. Проведенные рандомизированные контролированные исследования показали, что снижение летальности может быть достигнуто только за счет ограничения дыхательного объема [2]. Происходящее во время ИВЛ многократное раскрытие и спадение альвеол может послужить источником возникновения значительных повреждающих сил, «разрывающих» альвеолярные эпителиальные клетки. Указанные данные стимулировали выработку так называемой стратегии «защиты легких» во время искусственной вентиляции легких, направленную на предупреждение их дальнейшего повреждения [3].
Защита легких при искусственной вентиляции легких на фоне синдроме острого повреждения лёгких (СОПЛ) и остром респираторном дистресс-синдроме (ОРДС)
Стратегия защиты легких включает следующие элементы:
- Концентрация кислорода во вдыхаемой смеси. Проведение ИВЛ с высоким FiO2 сопровождается развитием абсорбционных ателектазов и кроме того, возможно, оказывает токсический эффект на легочную ткань. Общепринято подбирать FiO2 до достижения уровня артериальной сатурации 90%. Однако, у пациентов, вентилируемых с низким дыхательным объемом, требуется более высокая концентрация кислорода в дыхательной смеси, чем у больных, в случае которых был использован стандартный дыхательный объем (56 и 51%, соответственно [2]).
- Объем/давление в конце вдоха. Проведение ИВЛ с более низким, по сравнению с обычно используемым дыхательным объемом, приводит к снижению смертности у пациентов с ОРДС и увеличению количества дней, проведенных без ИВЛ. В данной группе тяжело больных принято проведение ИВЛ с дыхательным объемом 6 мл/кг и давлением в конце вдоха около 25 см H2O. Соответственно, достижение адекватной сатурации артериальной крови требует повышения частоты дыхания. Применение низких дыхательных объемов может нарушать альвеолярную вентиляцию и приводить к развитию «допустимой» гиперкапнии, которая, тем не менее, признается менее опасной, чем вентилятор-индуцированное поражение легких, при условии, что у пациента нет глубокого респираторного ацидоза (pH поддерживается на уровне выше 7,25). К нежелательным эффектам гиперкапнии относятся рост внутричерепного давления, нарушения сократимости миокарда и повышение потребности в седативных препаратах.
- Объем/давление в конце выдоха (PEEP). Создание положительного давления в конце выдоха (ПДКВ/ PEEP) может устранить и предупредить процесс циклического спадения-раскрытия альвеол. Этот эффект реализуется за счет подавления возникновения сил «растяжения» альвеолярного эпителия (теория «open lung» – «открытого легкого»). К сожалению, применение ПДКВ может сопровождаться депрессией кровообращения и повышать риск баротравмы. Оптимальный уровень ПДКВ в контексте предупреждения вентилятор-индуцированного поражения легких все еще остается предметом споров. Очевидно, что большинство клиницистов приняли тактику, в соответствии с которой оптимальным считается наименьший уровень ПДКВ, позволяющий поддерживать приемлемую SaO2 на фоне ограниченной FiO2. Применение низких дыхательных объемов обуславливает необходимость более высокого уровня ПДКВ [2] (9,4 см H2O при низком ДО и 8,4 см H2O при традиционном). Непрерывность приложения ПДКВ имеет ключевое значение: даже один вдох без положительного давления в конце выдоха может привести к коллапсу расправившихся альвеол.
- Режим ИВЛ. В случае ИВЛ, контролированной по давлению (PCV), целевое давление в дыхательных путях является одной из установок режима и может быть настроено с позиций профилактики баротравмы легких. В этой ситуации ДО зависит от комплайнса и сопротивления дыхательной системы. Ухудшение на фоне ИВЛ по давлению комплайнса или сопротивления или уменьшении продолжительности вдоха приводит к снижению ДО. Возникающее как следствие этого снижение альвеолярной вентиляции может вызывать тяжелую гиперкапнию и ацидоз. В случае проведения ИВЛ с инверсированным соотношением времени вдох:выдох (IRV) продолжительность вдоха увеличивается, а выдоха – уменьшается. Возникающее на фоне IRV вовлечение в вентиляцию ранее незадействованных участков легочной ткани, снижение шунтирования крови, а также повышение среднего давления в дыхательных путях приводит к улучшению оксигенации. Уменьшение продолжительности выдоха может сопровождаться возникновением внутреннего ПДКВ (auto-PEEP). Снижение частоты дыхания позволяет увеличить продолжительность вдоха ценой ухудшения альвеолярной вентиляции.
- Положение ничком (prone). Известно, что положение пациента с ОРДС на животе («ничком») приводит к быстрому улучшению оксигенации. Это связано с улучшением регионарного распределения вентиляции, которое влечет за собой снижение фракции шунта. Влияние данного приема на выживаемость больных пока не доказано.
- Тщательно проведенные клинические исследования таких новых методов респираторной поддержки при ОРДС, как частичная жидкостная вентиляция и высокочастотная ИВЛ дали разочаровывающие результаты. Применение этих высокотехнологичных методик требует значительных затрат и, таким образом, не может быть рекомендовано для клинического использования до тех пор, пока не будет продемонстрировано их положительное влияние на исход лечения.
Медицинская литература:
- Brower RG, Fressler HE. Mechanical ventilation in acute lung injury and acute respiratory distress syndrome. Clinics in Chest Medicine 2000; 21: 491510
- The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and acute respiratory distress syndrome. New England Journal of Medicine 2000; 342:1301-1308
- Finey JF, Evans TW. Mechanical ventilation in acute respiratory distress syndrome. Current Opinion in Anesthesiology 14:165-171
Автор(ы): Lothr
Понравилась медицинская статья, новость, лекция по медицине из категории
«Медицинские статьи / Анестезиология, реанимация, интенсивная терапия»:
ИВЛ при синдроме острого повреждения легких (СОПЛ) и остром респираторном дистресс-синдроме (ОРДС)
поделись в:
| HTML-cсылка |
| BB-cсылка |
| Прямая ссылка |
Категория: Медицинские статьи / Анестезиология, реанимация, интенсивная терапия
Уважаемый посетитель, Вы зашли на сайт как незарегистрированный пользователь.
Мы рекомендуем Вам зарегистрироваться либо войти на сайт под своим именем.
Источник
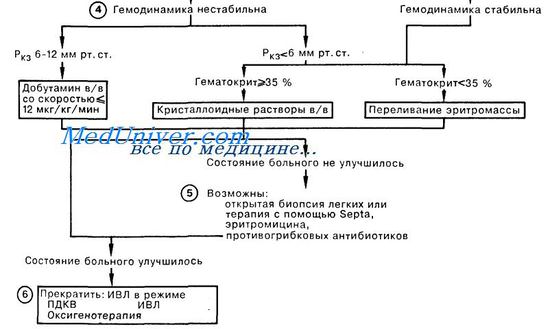
Длительность ИВЛ при респираторном дистресс-синдроме. Сурфактант при лечении дистресс синдрома легких.Известно, что длительная ИВЛ даже при вентиляционных расстройствах сама по себе стимулирует задержку жидкости в легких, угнетает диурез. Поскольку при РДС всегда есть элементы мильтиорганной дисфункции, в том числе и поражение почек, то становится ясным, что для обеспечения адекватного водного баланса требуется регулярное введение диуретиков (40-60 мг лазикса). Выведение избыточной жрщкости из организма помогает купировать и отек легких. Кроме того, почти закономерным осложнением длительной ИВЛ является пневмония, которая развивается не только вследствие микробной инсеминации дыхательных путей, но и при развитии синдрома системной воспалительной реакции (септического шока) с выделением таких цитокинов, как интерлейкины 6 и 8 (IL-6, IL-8). При этом отмечено, что повышение их уровня наступает еще за 3-4 дня до развития пневмонии. Присоедршение пневмонии на фоне РДС трудно диагностировать, поскольку такие ее признаки, как лейкоцитоз, высокая температура pi рентгенологические проявления (инфильтрации легких), уже имеются при РДС и без инфекции. В связи с разработкой методов получения синтетических или полусинтетических сурфактантов в последние годы вновь усилился интерес к возможности их использования в терапии РДС. И действительно, ингаляция сурфактанта способствует улучшению газообменной функции легких. Однако такой эффект не всегда бывает стойким. Так, Baudouin S.V. (1997) использовал синтетический препарат сурфактанта (дипальмитоил-фосфатидилхолин 13,5 мг/л) у 364 больных с РДС. Группу сравнения составили 361 больной, сопоставимых по возрасту и степени тяжести по шкале APACHE III (пo 70,5% этих пациентов в обеих группах). Однако какого-либо влияния на частоту выживания, длительность ИВЛ и нахождения в отделении интенсивной терапии или состояние физиологических функций легких не было обнаружено. Использование сурфактанта у новорожденных обеспечивало более быстрое снижение FiO2 до 40% и сокращение продолжительности ИВЛ, однако увеличения выживаемости к 7 и 28 дням также не было достигнуто [Шаламов В. Ю. и др., 1999]. Это и понятно, поскольку описанные выше исследования показали, что сурфактант разрушается вследствие проникновения в альвеолу циркулирующих в крови токсичных продуктов. Поэтому, сколько бы сурфактанта не добавлять в легкие, но если не удалить токсичные вещества из крови, вновь введенный сурфактант будет так же разрушаться, как и собственный. Кроме того, следует признать, что, прекрасно справляясь с вентиляционной дыхательной недостаточностью, при паренхиматозной дыхательной недостаточности, характерной для РДС, ИВЛ не в состоянии адекватно корригировать гипоксемию. Эти факты заставили зарубежных ученых еще в семидесятые годы обратиться к использованию экстракорпорального газообмена с помощью мембранных оксигенаторов, которые к тому времени стали производиться с целью улучшения результатов операций на открытом сердце. В экспериментах на животных оказалось возможным и безопасным поддерживать газообмен продолжительностью до трех недель с помощью мембранных оксигенаторов. Это дало основание использовать их для вспомогательной экстракорпоральной мембранной оксигенации (ЭКМО) при острой паренхиматозной дыхательной недостаточности. Первые результаты лечения дистресс синдрома легких с помощью ЭКМО в зарубежных клиниках были достаточно обнадеживающими. Действительно, сразу после подключения мембранных оксигенаторов восстанавливался газообмен, стабилизировалось состояние больных. Однако обратной динамики патологических изменений в легких в заметных масштабах не отмечалось. После окончания процедуры вновь прогрессировали воспалительные и деструктивные процессы. Благополучного исхода удавалось достигнуть лишь в 20-30%, чаще у детей. Тем не менее, последние годы эффективность ЭКМО возросла до 47-60% [Bartlett R. Н. et al., 1996; Kolla S. et al., 1997]. G. J. Peek и соавт. (1997) подвели семилетний итог применения ЭКМО у 50 больных с дистресс синдромом легких с общей выживаемостью 66%. С помощью чрескожной катетеризации удавалось достичь скоростей вено-венозной перфузии до 120 мл/кг/мин и обеспечивать экстракорпоральный газообмен в течение в среднем 207 часов. В этот период больному требовалось перелить до 19 доз донорской крови, значительные объемы донорской плазмы, концентраты тромбоцитов, обеспечивать парентеральное питание, круглосуточный мониторинг и обслуживание высококвалифицированными специалистами, что требовало немалых финансовых затрат, намного превышающих 100000 $. Применение ЭКМО для лечения дыхательных расстройств новорожденных также требовалось не менее 50000 долларов. Учитывая такие сложности и трудоемкость самих операций ЭКМО, они не получили широкого распространения. Однако экстракорпоральная мембранная оксигенация заняла определенное место среди методов лечения РДС, рекомендуемых упомянутой выше Согласительной Комиссией. Неотложная помощь при отеке легких – респираторном дистресс синдроме взрослых (РДСВ)
– Также рекомендуем “Современные методы лечения дистресс синдрома легких.” Оглавление темы “Лечение респираторного дистресс синдрома легких.”: |
Источник
Показания
Для начальной стадии ОРДС характерны гипоксемия и повышенная работа дыхания. Вентиляционная поддержка требуется для того, чтобы устранить гипоксемию с помощью ПДКВ, обеспечить высокий уровень ¥щ и уменьшить работу дыхания (табл. 13-1). При неспособности пациента обеспечить достаточный объем дыхания возникает задержка двуокиси углерода. На этой стадии показанием к ИВЛ является острая вентиляционная недостаточность. При ОРДС обычно не рекомендуется использовать ней н ваз и иную вентиляцию или дыхание в режиме СРАР через маску.
Параметры вентиляции
Существует два основных подхода к проведению ИВЛ при ОРДС. Стратегия «открытых легких» подразумевает выбор ИВЛ, управляемой по давлению, и сосредоточение усилий на поддержании низкого давления плато на фоне мониторинга дыхательного объема, а также применение методов рекрутирования альвеол и высокого ПДКВ. Протокол ARDSnet предусматривает поддержание низкого дыхательного объема, контроль давления плато и выбор уровня ПДКВ в зависимости от требуемой Fi02.
В идеальном случае больной способен сам запускать аппаратный вдох. Это способствует рекрутированию альвеол в задних участках легких, увеличению венозного возврата и уменьшает потребность в седации. Некоторые клиницисты выступали за применение у больных с ОРДС методов.вентиляционной поддержки, позволяющих сохранять спонтанное дыхание, но данное предложение нуждается в дополнительной проверке. На ранней стадии ОРД С, а также в фазе выздоровления оказывается целесообразным применение поддержки вдохов давлением. Если же состояние больного ухудшается, то триггерные методы ИВЛ могут привести к ухудшению газообмена и к нестабильности гемодинамики — особенно если развивается де-синхронизация больного с респиратором. Таким образом, на определенных этапах
Показания к ИВЛ у больных с ОРДС
- Повышение работы дыхания
- Нарушение оксигенации
- Угрожающая дыхательная недостаточность
Острая дыхательная недостаточность респираторной терапии возникает необходимость в фармакологическом обеспечении ИВЛ. Однако тотальной миорелаксации следует избегать, за исключением тяжелых случаев.
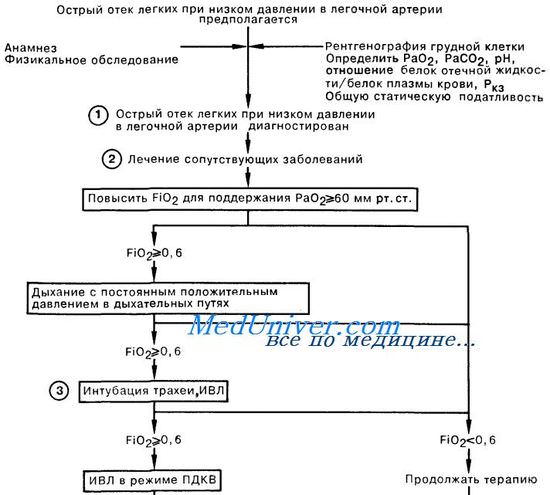
Стратегия защиты легких имеет целью обеспечение определенного уровня внут^ рилегочного давления при ИВЛ, управляемой по давлению . Обычно выбирают величину дыхательного объема 4-8 мл/кг при поддержании пикового альвеолярного давления 25-30 см вод. ст. Может потребоваться и пермиссивная гиперкапния. Частоту дыхания задают высокой — до 35 в 1 мин. Величину ПДКВ устанавливают на уровне 10-20 см вод. ст. для обеспечения рекрутирования альвеол, хотя в фиброзной стадии ОРДС требуется более низкая величина ПДКВ. Приемы рекрутирования проводят до начала применения ПДКВ. Обычно вначале устанавливают более высокую величину ПДКВ, чем требуется, а потом ее уменьшают до минимального уровня, обеспечивай nun о рекрутирование альвеол. Уровень Fio2 выбирают перед тем, как приступить к титрованию величины ПДКВ, чтобы добиться желаемых уровней Sp,,. и Га… (табл. 13-3). Высокое альвеолярное давление опаснее высокой Гц,,, a Fio} до 0,60 обычно можно использовать без всяких опасений. Если» несмотря на проведение приемов рекрутирования и применение ПДКВ, сохраняется стойкая гипоксемия, можно подумать о повороте больного на живот. Данный прием позволяет достичь кратковременного улучшения оксигенации, но его влияние на исход лечения неизвестно. В табл. 13-5 приведена последовательность действий» направленных на поддержание адекватной оксигенации, при проведении ИВЛ в соответствии с принципом открытых легких.
Принципиальной особенностью подхода, сформулированного в ARDSnet, является ограничение дыхательного объема при ИВЛ, управляемой по объему. Уменьшение дыхательного объема с 10-12 до 6 мл/кг сопровождалось повышением выживаемости пациентов на 22 %. Другими словами, использование данного подхода к лечению позволяет дополнительно спасти одного больного из двенадцати. Протокол ARDSnet применим к лечению больных как с ОПЛ, так и с ОРДС. В острой фазе применяют управляемую по объему CMV (А/С).
При целевой величине дыхательного объема 6 мл/кг обычно его удается поддерживать в пределах 4-8 мл/кг. Дыхательный объем устанавливают, исходя из должной массы тела (ДМТ). которую рассчитывают, измерив рост больного (от макушки до пяток в положении лежа). Целевое давление плато равно 25-30 см вод. ст. Целевое значение Paj должно составлять 55-80 мм рт. ст (Spz — 88-95 %). ПДКВ устанавливают на таком уровне.чтобы в комбинации с Fi02 оно обеспечивало целевые значения Раоз и SpD2. Целевым уровнем рН является 7,30-7,45, а частота дыхания может быть увеличена до 35 в 1 мин, чтобы добиться поддержания рН в указанных пределах.

Алгоритм вентиляционной поддержки при ОРДС по протоколу «открытых легких»
Рекомендации по обеспечению оксигенации при ОРДС, основанные на стратегии защиты легких
- Стартовые параметры
- – Установить Roj =1
- – Установить ПДКВ = 10 см вод. ст.
- Выполнить маневр рекрутирования альвеол
- Установить ПДКВ = 20 см вод. ст.
- Уменьшать F02 до уровня, при котором Spo2 составляет 90-95 %
- Уменьшить ПДКВ до самого низкого уровня, позволяющего сохранить Spo2 на уровне 90-95 %
- Дальнейшие действия
- Отрегулировать ПДКВ так, чтобы обеспечить поддержание альвеол в рекрутированном состоянии
- При необходимости отрегулировать Fio2
- Рассмотреть целесообразность поворота больного на живот (в положение ничком)
- Регулярно проверять давление плато
Источник