Как лечит синдром истощения яичников
Преждевременное угасание функции яичников – это форма первичной недостаточности яичников. Патологическое состояние характеризуется нарушением менструального цикла (прекращением месячных) и очень часто диагностируется как преждевременная менопауза.
Преждевременное нарушение работы яичников – обратимый процесс, он эффективно поддается лечению. Симптомы угасания функции яичников появляются чаще всего у женщин в возрасте 40 лет. Наиболее характерны: приливы, ночная потливость и головные боли.
Что такое преждевременное угасание функции яичников
Еще в первой половине XX века заметили, что некоторые молодые женщины в возрасте около 40 лет перестают носить менструации. Такое состояние определили как преждевременную менопаузу. В ходе исследования на протяжении многих лет было замечено, что в моче у женщин с ранним наступлением менопаузы наблюдается повышенный уровень гонадотропинов (гормонов, отвечающих за правильное функционирование половой системы).
В настоящее время это заболевание определяется как преждевременное угасание яичников (от англ. premature ovarian failure – POF). Оно проявляется задержкой менструации у женщин до сорока лет. Является одним из видов первичной недостаточности яичников.
 Задержка менструации
Задержка менструации
Предположить развитие преждевременного угасания яичников может появление ранних приливов до появления нарушений менструального цикла. Преждевременное прекращение работы яичников возникает у женщин на четвертом десятилетии жизни. Этим заболеванием страдает 1 на 100 женщин в возрастном диапазоне от 30 до 39 лет.
Гораздо меньшая заболеваемость 1 на 1000 встречается у женщин в возрасте до 30 лет. Гормональные нарушения подтверждаются данными лабораторных исследований. Определяется повышенный уровень содержания гонадотропинов в моче и снижение концентрации эстрадиола. Преждевременное угасание яичников, в отличие от менопаузы, состояние обратимое.
Необходимо пройти курс лечения. Эффективность терапии подтверждается случаями возобновления функции яичников у женщин после курсового применения лекарственных препаратов.
Причины развития патологии – преждевременного угасания работы яичников
Нарушение нормальной работы яичников могут происходить в результате действия разнообразных факторов на организм женщины. Некоторые вызывают ускоренную атрофию фолликулов яичников. Другой механизм воздействия заключается в уменьшении количества фолликулов, внутри которых находятся яйцеклетки.
К наиболее часто встречающимся причинам преждевременного угасания работы яичников, относят следующие:
- Генетические факторы, связанные с повреждением Х-хромосомы (примером может быть синдром Шерешевского-Тернера, который характеризуется моносомией по Х-хромосоме (ХО), то есть наличием только одной Х-хромосомы);
- Аутоиммунные заболевания, такие как сахарный диабет первого типа, гипофункция надпочечников или/и щитовидной железы, кроме того, системная красная волчанка, ревматоидный артрит, витилиго и язвенная болезнь Крона;
- Инфекционные заболевания, такие как малярия, оспа, воспаление придатков после перенесенного эпидемического паротита;
- Бактериальные и вирусные инфекции;
- Воспаление яичников (оофорит),
- Действие лучевой терапии и химиотерапии.
Факторы риска развития заболевания
Причина развития патологии у большого количества женщин не установлена. Прекращение длительного приема пероральных средств для контрацепции может привести к преждевременному прекращению работы яичников. В некоторых случаях заболевание может развиться непосредственно после беременности.
В результате проведенных исследований, доказано наличие факторов риска развития данного заболевания:
- высокий уровень глюкозы в крови;
- возраст;
- курение.
Симптомы преждевременного старения яичников
Прекращение работы яичников приводит дефициту эстрогенов и развитию гормонального дисбаланса. Это отражается на работе всех систем организма. Развитие заболевания характеризуется следующими симптомами:
- ночная потливость;
- приливы;
- частые перемены настроения;
- головные боли и головокружения;
- повышенная предрасположенность к развитию заболеваний сердечно-сосудистой системы и сахарному диабету второго типа;
- увеличение массы тела;
- увядание, старение кожи;
- атрофические изменения органов мочеполовой системы.

Приливы

Увеличение массы тела
Вышеперечисленные симптомы очень похожи на признаки климактерического периода, важно не путать эти состояния и поставить правильный диагноз.
Последствия преждевременного угасания функции яичников
Прежде всего, дефицит содержания эстрогенов в организме приводит к остеопении. Остеопения – это снижение минеральной плотности костной ткани. Впоследствии развивается остеопороз – прогрессирующее системное метаболическое заболевание, поражающее соединительные ткани. Предрасположенность к хрупкости костей и переломам связана не только с заболеванием, но и с приемом препаратов, малоподвижным образом жизни, курением.
 Остеопороз
Остеопороз
Нарушение работы яичников приводит к отсутствию овуляции, что ставит под угрозу детородную функцию женщины. Поскольку в последнее время наблюдается тенденция к поздним родам, многие именно после 35 лет решают завести ребенка. Нарушение работы яичников – не приговор. При правильной постановке диагноза и терапии заболевания сохраняется возможность нормального течения беременности и родов.
Диагностика и лечение преждевременного угасания яичников
Диагноз яичниковая недостаточность (гипофункция яичников) ставится на основании клинической картины заболевания, результатов исследований на содержание гормонов, гинекологического и общего медицинского осмотра пациентки. Проводится ультразвуковое исследование при котором определяются размеры яичников, наличие или отсутствие фолликулов, общее состояние половых органов.
Схема лечения устанавливается индивидуально с учетом симптомов заболевания, результатов анализов и наличия сопутствующей патологии. Основой лечения преждевременного угасания работы яичников является прием гормональных лекарственных средств в рамках так называемой ЗГТ – заместительной гормональной терапии. ЗГТ подразумевает введение в организм гормонов, которые вырабатываются в результате работы яичников. Лечение должно проводиться строго под контролем врача.
 Гормональные лекарственные средства
Гормональные лекарственные средства
Следует строго соблюдать рекомендации по лечению сопутствующих заболеваний, которые также могут быть причиной нарушения работы яичников. Особенно таких как: гипотиреоз, гипофункция коры надпочечников, системная красная волчанка, язвенная болезнь Крона, сахарный диабет первого типа. Необходима комплексная терапия заболевания.
Специалисты рекомендуют принимать комплекс витаминов и минеральных веществ, а также препараты, содержащие мелатонин. Мелатонин улучшает работу иммунной системы, замедляет процессы старения, регулирует функции эндокринной системы, артериальное давление, периодичность сна. Кроме того, предполагается. что мелатонин предотвращает депрессию, восстанавливает фертильность и менструальный цикл.
Следует обратить внимание на психическое состояние женщины. Снижение настроения может быть связано как с опасениями за свое здоровье, так и с желанием молодых женщин завести детей. При необходимости нужно назначить соответствующее лечение.
После проведения адекватной терапии заболевания, работа и секреторные функции яичников восстанавливаются. У молодых женщин есть все шансы на рождение здорового ребенка с применением экстракорпорального оплодотворения.
После лечения необходимо регулярное наблюдение у личного гинеколога. Женщине рекомендуется отказаться от вредных привычек, перейти на правильный режим сна-бодрствования, подключить умеренную физическую активность. Изменив свой образ жизни в пользу правильного питания и отказа от стимуляторов, можно существенным образом улучшить функционирование эндокринной и репродуктивной системы.
ОНЛАЙН-ЗАПИСЬ в клинику ДИАНА
Вы можете записаться по бесплатному номеру телефона 8-800-707-15-60 или заполнить контактную форму. В этом случае мы свяжемся с вами сами.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
Поделиться ссылкой:
Источник
В статье представлены результаты оригинального исследования, посвященного лечению преждевременной недостаточности яичников у женщин репродуктивного возраста с воспалительными заболеваниями органов малого таза.
Преждевременная недостаточность яичников (ПНЯ) представляет собой патологический симптомокомплекс, включающий вторичную аменорею, бесплодие, высокие уровни гонадотропинов, низкий уровень эстрогенов и вегетативно-сосудистые нарушения у женщин до 40 лет [1]. При этом до развития ПНЯ у пациенток были сформированы менструальная и репродуктивная функции. Частота ПНЯ в популяции составляет 1,5%, а в структуре вторичной аменореи — до 10% [2–4]. Существует ряд теорий, объясняющих причины преждевременной недостаточности яичников: пре- и постпубертатная деструкция ооцитов, хромосомные аномалии, аутоиммунные расстройства и др. Точная природа преждевременного нарушения функции яичников неясна [5].
ПНЯ может быть обусловлена рядом факторов: генетическими дефектами, наследственной предрасположенностью (ферментопатиями), травматическими (в т. ч. при хирургических вмешательствах), лучевыми, химическими повреждениями, приемом антимитотических и цитотоксических препаратов, аутоиммунными нарушениями, действием инфекционно-токсических агентов при воспалительных процессах, психогенных факторов внешней среды, а также нарушениями структуры гонадотропинов и/или их действия [6–8]. Хронический сальпингоофорит (ХСО) является преобладающей нозологической формой воспалительных заболеваний внутренних половых органов и составляет 65–68% всех гинекологических заболеваний [9]. Морфологические и функциональные изменения в органах репродуктивной системы при воспалении активируют патологическую афферентацию центральных регулирующих отделов гипоталамо-гипофизарно-яичниковой системы. В результате этих изменений происходит снижение эндокринной функции яичников, при котором нередко нарушается процесс овуляции, снижается продукция эстрогенов и прогестерона, а эпизоды обострения ХСО способствуют нарушению микроциркуляторных процессов в яичнике. Клинически эти нарушения проявляются синдромом ПНЯ [10] (нарушением менструальной функции, бесплодием, высокими уровнями фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), низким уровнем эстрадиола, симптомами дефицита эстрогенов: приливами жара, потливостью, бессонницей, раздражительностью, снижением памяти, трудоспособности, может развиться остеопения, повышение атерогенных фракций липидов и снижение ЛПВП).
Цель исследования: оценка эффективности комплекса низкомолекулярных водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота (polypeptides of pineal gland — PPG), и менопаузальной гормональной терапии в лечении соматических и вегетативных нарушений у женщин с нейровегетативными расстройствами на фоне преждевременной овариальной недостаточности и ХСО.
Материал и методы
Под нашим наблюдением находились 45 пациенток репродуктивного возраста, разделенных на 2 группы. Группу сравнения составили 25 пациенток, лечение которых включало менопаузальную гормональную терапию (МГТ) препаратом Фемостон® 2 (дидрогестерон + эстрадиол) по 1 таблетке в день в циклическом режиме. Основную группу составили 20 женщин, которым, помимо МГТ, с 16–17-го дня первого цикла приема Фемостона 2 внутримышечно вводили комплекс низкомолекулярных водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота (Пинеамин®). Содержимое флакона перед инъекцией растворяли в 1–2 мл 0,9% раствора натрия хлорида и вводили однократно ежедневно в дозе 10 мг в течение 10 дней. В зависимости от выраженности нейровегетативных проявлений и уровня ФСГ некоторым пациенткам курс повторяли через 3 мес. Выбор препарата Пинеамин® обусловлен тем, что он способен восстановить функциональную плотность пинеалоцитов эпифиза, тем самым увеличивая продукцию эндогенного мелатонина. Эндогенный мелатонин играет значительную роль в регуляции функции репродуктивной системы, а именно в активации расположенных в гипоталамусе нейронов, синтезирующих гонадотропин-ингибирующий гормон (GnIH), и тормозящем действии GnIH на синтез кисспептина (KISS) в одноименных нейронах, входящих в группу KNDy-нейронов гипоталамуса [2].
В различных исследованиях описан опыт применения препарата Пинеамин® у женщин в менопаузе [2, 3]. И принимая во внимание, что симптоматика ПНЯ схожа с ранней менопаузой, а наличие ХСО усугубляет патологическую передачу нервных импульсов от периферических нейронов к центральным, усиливая проявление нейровегетативных расстройств, мы применили его у женщин репродуктивного возраста.
Критерии включения в исследование:
бесплодие I или II степени; первичная недостаточность яичников; нарушение менструального цикла в виде вторичной аменореи;
наличие вегетососудистых нарушений;
ХСО в стадии ремиссии с проходимостью маточных труб, подтвержденной данными МСГ/гистеросонографии и/или лапароскопии с хромосальпингоскопией;
нормальный кариотип пациенток;
информированное согласие пациенток на участие в исследовании.
Выраженность вегетососудистых нарушений у пациенток (приливы, головные боли, колебания АД, перепады настроения, раздражительность, сердцебиение в покое и т. д.) оценивали по менопаузальному индексу Куппермана (МИК). Особенности вегетативной реактивности обследуемых женщин изучали по данным анализа электроэнцефалограммы (ЭЭГ) с помощью программно-аппаратного комплекса «Нейрон-спектр» («Нейрософт», Россия) с оценкой частотно-амплитудных показателей основных ритмов ЭЭГ (альфа-, бета-, тета- и дельта-ритма) в состоянии спокойного, расслабленного бодрствования. Определяли уровни ФСГ и эстрадиола в периферической крови. Для оценки объема яичников и обедненности фолликулярного аппарата выполняли УЗИ органов малого таза на аппарате GE LOGIQ E9 (General Electrik, США) (датчик вагинальный: I–C5–9d, частота 3,6–9,0 Мгр; датчик абдоминальный: С1–6D, частота 1,7–6,0 Мгр).
Полученные данные сопоставлены с аналогичными показателями 27 здоровых женщин-добровольцев репродуктивного возраста (в первую фазу менструального цикла) группы контроля. Обследование проводили перед началом и через 6 мес. после начала лечения.
В статистической обработке полученных результатов использовали методы вариационной статистики, параметрического и непараметрического анализа. Различия сравниваемых показателей между группами оценивали с помощью программного обеспечения «EXCEL 2010» при доверительной вероятности 95% (р<0,05).
Результаты и обсуждение
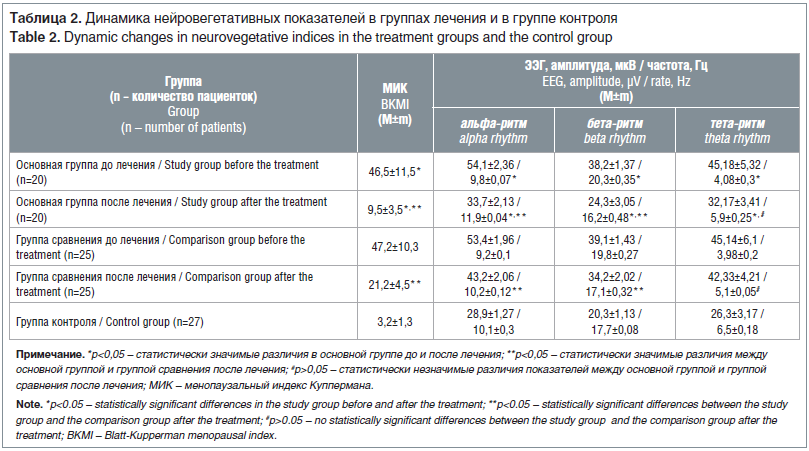
Все обследованные пациентки были сопоставимы по возрасту: 35±1,8 года в основной группе и 36±1,3 года в группе сравнения (средний возраст 35,5±1,6 года). Выраженность вегетососудистых симптомов, определяемая по МИК, в исследуемых группах также достоверно не отличалась и составила более 40 баллов. На ЭЭГ в 95% случаев отмечался высокоамплитудный гиперсинхронный альфа-ритм с низкой частотой. В основной группе показатели бета-ритма достигали высоких цифр и в 1,78 раза превышали значения у здоровых пациенток (р<0,05). В передних отделах головного мозга выявлялось незначительное усиление тета-ритма. Средние амплитуда и частота тета-колебаний были в 1,7 раза выше, чем показатели в группе контроля. При исследовании реакции на открывание глаз уменьшения амплитуды и частоты альфа-ритма не было выявлено в 92,5% случаев. Это свидетельствовало о нарушении регуляторного взаимодействия коры головного мозга и подкорковых центров (табл. 1).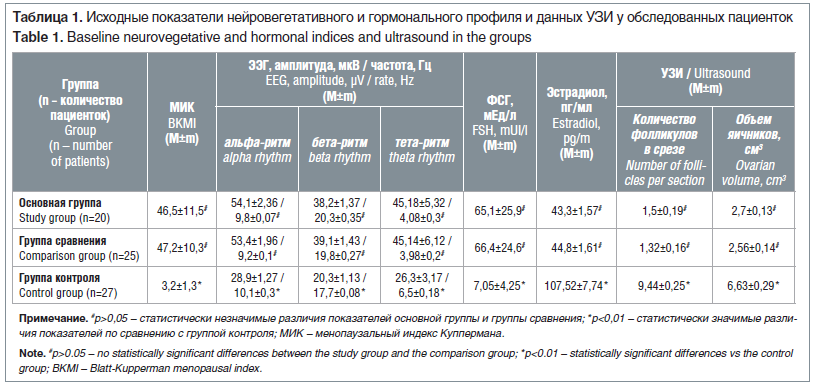
Из представленных в таблице данных видно, что значения ФСГ в основной группе были высокими и в 9 раз превышали показатели здоровых женщин контрольной группы, а уровни эстрадиола были в 1,7 раза ниже, чем показатели в контрольной группе (р<0,05). Изменения гормонального фона, характерные для ПНЯ, подтверждались и данными УЗИ, визуализировались единичные фолликулы (примерно в 6 раз меньше, чем в группе контроля), и наблюдалось снижение объема яичников в 2,5 раза относительно здоровых обследованных (р<0,05).
После курса проведенной комбинированной терапии все пациентки основной группы отмечали купирование приливов, головных болей, колебаний АД, сердцебиений в покое, а в группе сравнения данная симптоматика сохранялась у 6 (24%) пациенток. Сохраняющиеся перепады настроения и раздражительность в основной группе отмечали 2 (10%) пациентки, что в 3,2 раза меньше, чем в группе сравнения — 8 (32%) (р<0,05). Использование МГТ и низкомолекулярных водорастворимых полипептидных фракций, выделенных из эпифиза крупного рогатого скота, обусловило достоверное снижение МИК у всех обследованных (p<0,05), но в основной группе МИК оказался в 2,2 раза ниже, чем в группе сравнения (табл. 2).
Через 6 мес. лечения отмечалось восстановление биоэлектрической активности головного мозга у 93% пациенток. Амплитуда альфа-волн в основной группе уменьшилась в 1,6 раза, а частота увеличилась в 1,3 раза (р<0,05), что было в 1,3 раза меньше, чем у пациенток группы сравнения, и приближалось к показателям здоровых женщин (р<0,05). Произошла нормализация бета-ритма и выравнивание амплитуды тета-колебаний (р<0,05), причем данные пациенток основной группы при отсутствии достоверных отличий (p>0,05) были в 1,3 раза меньше, чем показатели в группе сравнения. При проведении реакции на открывание-закрывание глаз у 69,8% пациенток группы сравнения уменьшались амплитуда и частота альфа-ритма, что на 15,4% меньше, чем у пациенток основной группы — 85,2% (р<0,05). Выявленные изменения показателей биоэлектрической активности головного мозга указывали на восстановление регуляторного взаимодействия центральных и подкорковых структур головного мозга.
Оценка уровней гормонального профиля у пациенток с ПНЯ после окончания лечения выявила снижение концентрации ФСГ в основной группе в 7,2 раза и в группе сравнения в 5,6 раза, причем показатели в основной группе превышали норму всего в 1,2 раза против 1,7 раза в группе сравнения (р<0,05) (табл. 3).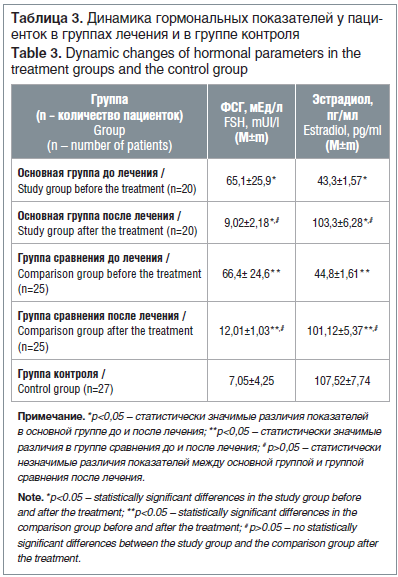
Достоверных различий в уровнях ФСГ и эстрадиола у пациенток основной группы и группы сравнения после проведенного лечения не выявлено, однако уровни эстрадиола в исследуемых группах повысились в 2,3 раза и приближались к показателям здоровых женщин (р<0,05).
Данные УЗИ органов малого таза через 6 мес. от начала лечения выявили увеличение количества примордиальных фолликулов в основной группе в 4,9 раза, а в группе сравнения в 2,6 раза, причем в основной группе данный показатель в 2,1 раза превышал показатели в группе сравнения и приближался к показателям здоровых женщин (р<0,05) (табл. 4).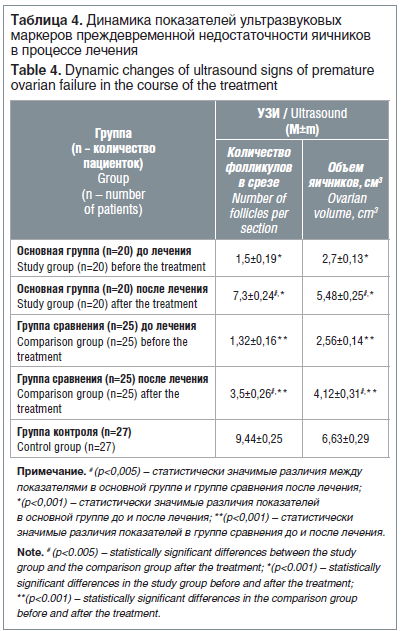
Объем яичниковой ткани в результате различных вариантов лечения достоверно увеличивался в обеих группах, однако в основной группе он был в 1,3 раза больше, чем в группе сравнения, и всего лишь в 1,2 раза меньше, чем у здоровых женщин, против 1,6 в группе сравнения (р<0,05). Оценка объема и фолликулярного аппарата яичников показала, что на фоне комбинированного медикаментозного лечения у пациенток с ПНЯ и ХСО происходит увеличение размеров яичников и появляется количество фолликулов, достаточное как для регуляции менструального цикла, так и для возможности наступления беременности с собственными яйцеклетками в протоколах ЭКО.
Отдаленные результаты исследования показали, что у пациенток и основной группы, и группы сравнения восстанавливался менструальный цикл, но в программах ЭКО в группе сравнения отмечался менее выраженный эффект (из 10 вступивших в ЭКО перенос эмбрионов, полученных из своих яйцеклеток, осуществлен только у 2 пациенток). В основной же группе у 2 пациенток наступили спонтанные беременности, которые закончились родами в срок, а из 7 пациенток, вступивших в протокол ЭКО, у 6 беременность наступила с собственными яйцеклетками.
Заключение
Таким образом, результаты проведенного исследования показали, что комбинированное применение МГТ (Фемостон® 2) и комплекса PPG (Пинеамин®) у пациенток с ПНЯ и ХСО привело к выраженному клиническому эффекту в виде уменьшения соматических и вегетативных нарушений, что обусловило достоверное снижение МИК в 4,9 раза. На фоне устранения вегетативной дисфункции и изменений биоэлектрической активности головного мозга наблюдалось более быстрое восстановление функции вегетативной и центральной нервной системы у 93% пациенток. Восстановление передачи нервных импульсов от периферических нейронов к центральным, снижение активности синтезирующих GnIH нейронов, расположенных в гипоталамусе, за счет повышения секреции эндогенного мелатонина на фоне МГТ привело к снижению уровней ФСГ с превышением нормы всего в 1,2 раза и повышению уровней эстрадиола в 2,3 раза относительно показателей здоровых женщин. Выравнивание гормонального фона оказало влияние на фолликулогенез и механизмы его стимуляции, что характеризовалось усилением процесса рекрутинга примордиальных фолликулов в 4,9 раза. Это способствовало наступлению беременности как спонтанной, так и в протоколах ЭКО. Полученные результаты исследования позволяют рекомендовать применение комбинации препаратов Фемостон® 2 и Пинеамин® в комплексном лечении преждевременной недостаточности яичников на фоне ХСО.
Сведения об авторах:
1Бурова Наталья Александровна — к.м.н., доцент кафедры акушерства и гинекологии, заведующая учебной частью;
2Селезнева Татьяна Александровна — к.м.н., врач акушер-
гинеколог высшей категории, главный врач;
1,2Аболонина Оксана Викторовна — к.м.н., врач акушер-гинеколог, репродуктолог, ассистент кафедры акушерства и гинекологии.
1ФГБОУ ВО ВолгГМУ Минздрава России. 400131, Россия, г. Волгоград, пл. Павших Борцов, д. 1.
2ООО «ЛДК «ВитаНова». 400137, Россия, г. Волгоград, бульвар 30-летия Победы, д. 32б.
Контактная информация: Бурова Наталья Александровна, e-mail: natalia-burova@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 10.01.2019.
About the authors:
1Natalia A. Burova — MD, PhD, Associate Professor of the Department of Obstetrics and Gynecology;
2Tatiana A. Selezneva — MD, PhD, obstetrician-gynecologist Chief physician;
1,2Oksana V. Abolonina — MD, PhD, obstetrician-gynecologist, reproductologist, Assistant of Obstetrics and Gynecology Department.
1Volgograd State Medical University. 1, Pavshikh Bortsov square, Volgograd, 400131, Russian Federation.
2LLC “Healthcare Clinic “VitaNova”. 32B, Bul’var 30-letiya Pobedy, Volgograd, 400137, Russian Federation.
Contact information: Natalia A. Burova, e-mail: natalia-burova@yandex.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 10.01.2019.
Источник
