Клинические рекомендации хронический болевой синдром у взрослых
В данной статье отражены ключевые положения, определенные в клинических рекомендациях по ведению хронического болевого синдрома при оказании паллиативной медицинской помощи, разработанные и утвержденные в 2016 году несколькими профессиональными сообществами.
Международная организация по изучению боли (IASP) определяет боль, как неприятное сенсорное или эмоциональное переживание, связанное с фактическим или потенциальным повреждением тканей или описываемое в терминах такого повреждения [1]. Боль может быть симптомом различных заболеваний; по данным разных исследований, боль испытывают 41–77% пациентов, имеющих сердечно-сосудистые заболеваниях, 47–50% пациентов, имеющих почечную недостаточность, 67% – ХОБЛ, 63–80% – ВИЧ, 67% – цирроз печени, 43% – рассеянный склероз, 82% – болезнь Паркинсона, 47% – болезнь Альцгеймера и другие деменции, 89% – ревматоидный артрит, 64% – сахарный диабет, 90% – мультирезистентный туберкулез, 84% – онкологические заболевания [2]. Хронический болевой синдром (ХБС) не исполняет защитной функции и не несет никакой биологической целесообразности.
ДИАГНОСТИКА БОЛЕВОГО СИНДРОМА
Любое восприятие боли, которую ощущает пациент, субъективно, поэтому не существует «прибора» для объективного ее измерения. Регулярная оценка интенсивности боли имеет важное значение в терапии болевого синдрома (БС).
Основные принципы оценки БС:
- оценка интенсивности боли должна проводиться медицинским работником при каждом визите и осмотре пациента;
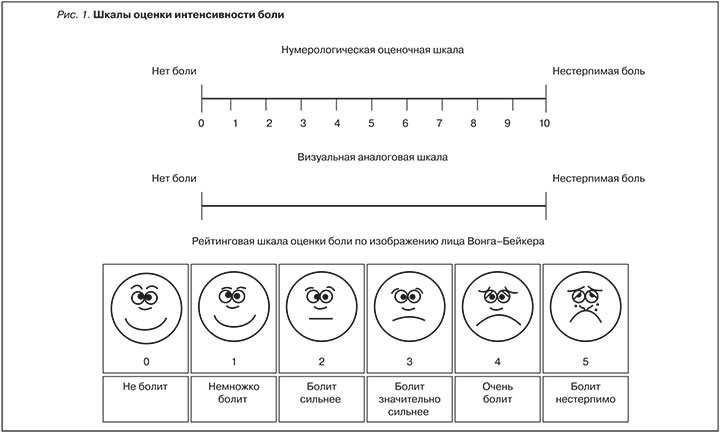
- интенсивность боли оценивается по оценочным шкалам (рис. 1), больному предлагается отметить свое восприятие боли в баллах или процентах;
- для более точного диагноза оценку интенсивности боли у пациента проводят раздельно – при движении и в покое.
Для оценки ХБС используют критерии, отражаемые в дневнике осмотра:
- число, локализация и характер очагов боли;
- длительность предшествующего болевого анамнеза;
- применение анальгетиков;
- эффективность предшествующей терапии (что ослабляет или усиливает боль);
- влияние боли на активность, сон, прием пищи и пр.
Сопоставив полученные сведения с клинической картиной и данными обследования, определяется интенсивность боли (слабая, умеренная, сильная). Оценка боли у лиц с когнитивными нарушениями основана на схожих принципах оценки боли у детей. Основой являются поведенческие реакции и возможность отвлечь или утешить, причем степень выраженности проявлений оценивается в динамике.
ОБЩИЕ ПРИНЦИПЫ ТЕРАПИИ ХРОНИЧЕСКОГО БОЛЕВОГО СИНДРОМА
Лекарственная терапия проводится в соответствии с основными принципами, провозглашенными Всемирной организацией здравоохранения (ВОЗ):
- «Через рот» – означает, что максимально следует исключить все инъекционные формы анальгетиков.
- «По часам» – анальгетики следует назначать регулярно по схеме, в соответствии с длительностью эффекта препарата, не дожидаясь развития боли.
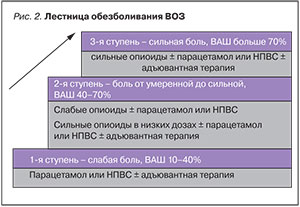
- «По восходящей» – подбор препаратов для обезболивания осуществляется от неопиоидных анальгетиков при слабой боли, слабыми опиоидами при умеренной боли и сильными опиоидными анальгетиками при сильной боли, по мере нарастания интенсивности боли, в соответствии с «лестницей обезболивания ВОЗ» (рис. 2).
- «Индивидуальный подход» – предполагает необходимость «индивидуального» подбора наиболее эффективного анальгетика в нужной дозе с наименьшими побочными эффектами.
- «С вниманием к деталям» – предполагает учет особенностей пациента и проведение мониторинга его состояния.
ТЕРАПИЯ ХРОНИЧЕСКОГО БОЛЕВОГО СИНДРОМА ПРИ ОКАЗАНИИ ПАЛЛИАТИВНОЙ МЕДИЦИНСКОЙ ПОМОЩИ
1-я ступень обезболивания
Интенсивность боли оценивается пациентом, как слабая, в пределах от 0 до 4 баллов по НОШ (ВАШ).
Рекомендация 1. На 1-й ступени фармакотерапии боли следует использовать неопиоидные анальгетики, при необходимости дополнительно назначать адъювантные анальгетики [3, 4].
2-я ступень обезболивания
Интенсивность боли оценивается пациентом, как умеренная, в пределах от 40 до 70% по НОШ (ВАШ), а адекватный ее контроль не достигается регулярным приемом парацетамола, НПВС и адъювантных анальгетиков.

Рекомендация 2. На 2-й ступени фармакотерапии боли использовать слабые опиоиды (трамадол, кодеин), при необходимости дополнительно назначать неопиоидные и адъювантные анальгетики [4, 5].
Рекомендация 3. Для терапии умеренной боли следует применять лекарственный препарат пропионилфенилэтоксиэтилпиперидин в защечных таблетках [6–8].
Рекомендация 4. При умеренно выраженной боли в качестве альтернативы трамадолу и кодеину возможно применять опиоиды 3-й ступени в низких дозах [9, 10].
С учетом зарегистрированных в РФ препаратов на 2-й ступени можно использовать:
- 1. морфин в таблетках или в капсулах продленного действия. Начальная доза составляет 10 мг 1–2 раза/сут (максимально до 30 мг/сут) [11–13];
- 2. оксикодон + налоксон в таблетках продленного действия. Стандартная начальная доза составляет 5/2,5 мг 1–2 раза/сут (максимально до 20 мг/сут). Налоксон, содержащийся в препарате, позволяет нивелировать побочные эффекты оксикодона в отношении риска развития запоров [14];
- 3. фентанил в трансдермальной форме (трансдермальная терапевтическая система – ТТС). Для терапии умеренной боли рекомендуется использовать в дозе до 12,5 мкг/ч [15].
Рекомендация 5. В качестве альтернативы пероральным опиоидам следует применять ТТС фентанила и бупренорфина без предпочтительного применения какого-либо из двух препаратов [9, 15, 16].
Рекомендация 6. В случае невозможности применения пероральных форм препаратов и использования ТТС следует назначать парентеральное введение морфина [4, 9, 17].
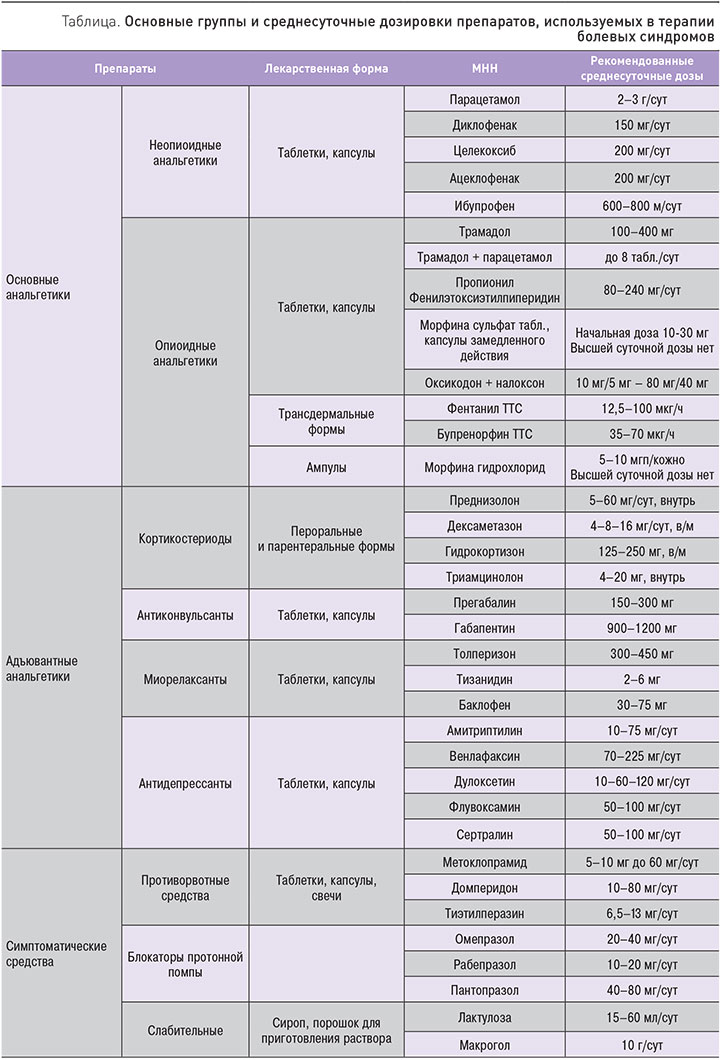
В качестве адъювантных анальгетиков на 2-й ступени применяют препараты 1-й ступени, а также кортикостероиды (дексаметазон, преднизолон, триамцинолон), спазмолитики (дротаверин, папаверин), миорелаксанты (толперизон, тизанидин, баклофен), антиконвульсанты (прегабалин, габапентин), антидепрессанты (амитриптилин, дулоксетин, сертралин). К препаратам 2-й ступени необходимо назначить терапию, уменьшающую побочные эффекты применяемых препаратов. В первую очередь это: противорвотные средства (метоклопрамид, домперидон, тиэтилперазин), блокаторы протонной помпы (омепразол, рабепразол, пантопразол), слабительные (лактулоза, макрогол).
 Основные группы и среднесуточные дозировки используемых препаратов представлены в таблице.
Основные группы и среднесуточные дозировки используемых препаратов представлены в таблице.
3-я ступень обезболивания
Интенсивность боли оценивается пациентом как сильная, в пределах от 70 до 100% по НОШ (ВАШ), а адекватный ее контроль не достигается регулярным приемом препаратов 2-й ступени и адъювантных анальгетиков.
Рекомендация 7. На 3-й ступени фармакотерапии боли следует использовать сильные опиоиды, при необходимости дополнительно назначать неопиоидные и адъювантные анальгетики [9, 18].
К сильным опиоидам, зарегистрированым в РФ для терапии ХБС, относят морфин (в таблетках, капсулах, растворе), оксикодон + налоксон (в таблетках), фентанил (ТТС – пластырь) и бупренорфин (ТТС). У пациентов без нарушения функции глотания и явлений умеренной и выраженной почечной и печеночной недостаточности, с учетом их пожелания, терапию сильной боли начинают с таблетированных форм лекарственных препаратов (морфин и оксикодон + налоксон) [9]. В случае, если прием таблетированных форм невозможен, терапию начинают с ТТС фентанила или бупренорфина.
Рекомендация 8. Как альтернативу пероральным препаратам при нарушении функции глотания, тошноте и рвоте, почечной и печеночной недостаточности, отказе пациента от таблетированных форм, в случае наличия у пациента сильной боли постоянного характера, когда произведен подбор адекватной обезболивающей суточной дозы опиоидными препаратами короткого действия, следует использовать ТТС [19].
Рекомендация 9. Следует с осторожностью применять опиоиды у пациентов с печеночной и почечной недостаточностью [9, 13, 20, 21].
Морфин метаболизируется в печени с образованием активных метаболитов, которые выводятся преимущественно почками – 85%, с желчью – 10%. Из-за особенностей элиминации следует снижать его дозу у пациентов с нарушением кишечного пассажа (при запорах), умеренной почечной и печеночной недостаточностью. Фентанил, в отличие от морфина, имеет неактивные метаболиты и является преимущественным для пациентов со средней и тяжелой степенью выраженности почечной и печеночной недостаточности.
Рекомендация 10. Следует назначать морфин парентерально пациентам, которым невозможно по различным причинам обеспечить адекватное обезболивание неинвазивными анальгетиками [4, 9, 16, 19].
Подкожный путь введения является эффективным в качестве альтернативного метода у пациентов, неспособных принимать опиоиды пероральным или трансдермальным способами. Внутривенные инфузии применяются в том случае, когда подкожное введение препарата противопоказано. Внутримышечный путь введения препаратов следует избегать.
Рекомендация 11. При переходе с одного опиоида на другой, осуществляемом из-за недостаточного обезболивания и/или избыточных побочных эффектов, использовать начальную дозировку нового препарата ниже, чем дозировку, рассчитанную по таблицам соответствия доз опиоидов по анальгезирующему эффекту [4, 16]. При смене опиоидов следует обеспечить безопасность приема препарата в отношении передозировки. Риски, связанные со сменой препаратов, являются управляемыми, если использовать таблицу эквивалентных доз.
Рекомендация 12. Не рекомендуется чередование опиоидов без необходимости [9, 21]. Менять опиоидный анальгетик и/или путь его введения следует только при недостаточном обезболивающем эффекте на фоне высоких доз препарата и/или при развитии непереносимых побочных эффектов.
Рекомендация 13. Не рекомендуется использовать тримеперидин (таблетки, раствор) для длительной терапии боли [22]. Тримеперидин подвергается биотрансформации с образованием нейротоксичного Н-деметилированного метаболита, который стимулирует ЦНС (возможны тремор, подергивания мышц, гиперрефлексия, судороги). Метаболит имеет период полураспада 15–20 ч, поэтому может наблюдаться кумулятивный эффект.
Титрование дозы и терапия «прорывов боли»
Рекомендация 14. При подборе необходимой дозы базового обезболивания с применением препаратов в пролонгированных формах проводить ее титрование препаратами короткого действия [9, 12, 23]. Для титрования дозы возможно использовать раствор морфина для подкожного или внутривенного введения, в эквивалентной дозе 1/12 от пероральной суточной дозы. При подборе необходимой дозы базового обезболивания с применением пероральных препаратов морфина и оксикодон + налоксон следует увеличивать разовую дозу на 5–15% (1/6) от суточной дозы [12].
Рекомендация 15. Для экстренной терапии резкого, спонтанного или эпизодически возникающего приступа боли на фоне приема препаратов в пролонгированных формах («прорыв боли») назначать препараты быстрого действия («препарат спасения») [3, 5, 9, 11, 24]. Для купирования прорывной боли на фоне применения ТТС фентанила не используется трамадол.
Рекомендация 16. Следует использовать для контроля предсказуемых эпизодов прорывной боли, за 20–30 мин до провоцирующего воздействия, опиоиды с немедленным высвобождением и коротким действием [4, 13].
Лечение осложнений опиоидной терапии
Рекомендация 17. Дополнительно к опиоидам назначать слабительные средства как сопроводительную терапию [4, 16].
Рекомендация 18. Применять дофаминергические препараты (например, галоперидол) и препараты с дофаминергическими дополнительными действиями (например, метоклопрамид) для лечения тошноты и рвоты, связанных с приемом опиоидов [4, 19, 25]. Длительность назначения антиэметиков на фоне опиоидной терапии около 2 нед. Если тошнота сохраняется, необходимо назначить или скорректировать дозировку противорвотных средств или сменить опиоид.
Рекомендация 19. Пациентам с умеренными или тяжелыми явлениями со стороны ЦНС (когнитивные расстройства, сонливость), связанными с применением опиоидов, снижать их дозировки, если БС контролируется достаточно, или менять опиоидный препарат, если БС не контролируется [26, 27].
Обезболивание в последние часы жизни
Рекомендация 20. Не рекомендуется снижать подобранную дозу опиоидов из-за пониженного уровня артериального давления или спутанности сознания (если они не являются следствием применения неверно подобранной дозы).
Рекомендация 21. Следует сохранять прием опиоидов даже при отсутствии сознания, применяя титрование дозы до эффективной.
Рекомендация 22. Отменять опиоиды следует путем постепенного снижения дозы препарата [26, 27]. При необходимости снижения дозы анальгетика уменьшать ее следует не более чем на 50% в течение суток, чтобы избежать прорыва БС, для профилактики синдрома отмены и не причинить страдания пациенту.
Рекомендация 23. Оценивать уровень и динамику других тягостных симптомов, которые могут усиливать страдания пациента [26, 27].
Рекомендация 24. При рефрактерности БС решить вопрос возможной медикаментозной седации [26, 27]. Вопрос седации обсуждается с пациентом и/или его законным представителем и решается на заседании врачебной комиссии. В некоторых клинических случаях медикаментозная седация является единственным методом, способным обеспечить адекватное обезболивание и облегчение страданий пациента.
В данной статье отражены ключевые положения, определенные в клинических рекомендациях по ведению ХБС при оказании паллиативной медицинской помощи, разработанные и утвержденные в 2016 г. несколькими профессиональными сообществами. Основными разработчиками рекомендаций явились Ассоциация профессиональных участников хосписной помощи, Ассоциация междисциплинарной медицины, Общество специалистов доказательной медицины и Российское научное медицинское общество терапевтов.
- IASP //www.iasp-pain.org.
- Worldwide palliative care alliance (WPCA); World Health Organization 2015.-https://www.who.int/nmh/Global_Atlas_of_Palliative_Care.pdf
- Jost L., Roila F., ESMO Guidelines Working Group. Management of cancer pain: ESMO Clinical Practice Guidelines. Ann. Oncol. 2010;21(5):257–60.
- Обезболивание при раке и паллиативное лечение: доклад комитета экспертов ВОЗ. Женева, 1992. 76 с. URL: https://www.who.int/iris/handle/10665/89602.
- Caraceni A., Hanks G., Kaasa S., Bennett M.I., Brunelli C., Cherny N., Dale O., De Conno F., Fallon M., Hanna M., Haugen D.F., Juhl G., King S., Klepstad P., Laugsand E.A., Maltoni M., Mercadante S., Nabal M., Pigni A., Radbruch L., Reid C., Sjogren P., Stone P.C., Tassinari D., Zeppetella G. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol. 2012;13:58–68.
- Glossary of globalization, trade and health terms of the World Health Organization. https://who.int/trade/glossary/en/.
- Clinical pain management. Cancer pain. Edited by N. Sykes, M.I. Bennett, C. Yuan. 2nd edition. Hodder Arnold, UK London: 2008. 443 p.
- Fisch M.J., Burton A.W. Cancer pain management. The McGraw-Hill C. 2006. 319 p.
- Lussier D., Portenoy R.K. Adjuvant analgesic drugs. In: Bruera E., Higginson I.J., Ripamonti C., von Gunten C., editors. Textbook of palliative medicine. London: Edward Arnold Publishers. 2006:402–14.
- Новиков Г.А. Основы паллиативной помощи онкологическим больным с хронической болью: дис. … д-ра мед. наук. М.: 1994. 224 с.
- Абузарова Г.Р. Просидол в лечении хронического болевого синдрома у онкологических больных: дис. … канд. мед. наук. М.: 2001. 124 с.
- Инструкция к препарату пропионилфенилэтоксиэтилпиперидин на официальном сайте Государственного реестра лекарственных средств https://grls.rosminzdrav.ru/
- Davies A.N., Dickman A., Reid C., Stevens A.M., Zeppetella G. The management of cancer-related breakthrough pain: recommendations of a task group of the Science Committee of the Association for palliative medicine of Great Britain and Ireland. Eur. J. Pain. 2009;13:331–8.
- Hanks G.W., Conno F., Cherny N., Hanna M., Kalso E., McQuay H.J., Mercadante S., Meynadier J., Poulain P., Ripamonti C., Radbruch L., Casas J.R., Sawe J., Twycross R.G., Ventafridda V. Morphine and alternative opioids in cancer pain: The EAPC recommendations. Br. J. Cancer. 2001;84:587–93.
- Инструкция к препарату морфин сульфат на официальном сайте Государственный реестр лекарственных средств https://grls.rosminzdrav.ru/
- Инструкция к препарату таргин (оксикодон+налоксон) на официальном сайте Государственный реестр лекарственных средств https://grls.rosminzdrav.ru/
- Пчелинцев М.В. Проблемы применения сильных опиоидов при хронической боли в России. Возможные пути их решения. Русский врач. 2013;5:19–22.
- National Institute for Health and Clinical Effectiveness (NICE). Guide to the Methods of Technology Appraisal
- Инструкция к препарату ТТС фентанила на официальном сайте Государственный реестр лекарственных средств https://grls.rosminzdrav.ru/
- Caraceni A., Cherny N., Fainsinger R., Kaasa S., Poulain P., Radbruch L., De Conno F. The Steering Committee of the EAPC Research Network. Pain measurement tools and methods in clinical research in palliative care: recommendations of an expert working group of the European Association of Palliative Care. J. Pain Symptom Manage. 2002;3;239–55.
- Moore R.A., Mc. Quay H.J. Prevalence of opioid adverse events in chronic nonmalignant pain: systematic review of randomised trials of oral opioids. Arthritis Res. Ther. 2005;7(5):1046–51.
- Morita T., Takigawa C., Onishi H., Tajima T., Tani K., Matsubara T., Miyoshi I., Ikenaga M., Akechi T., Uchitomi Y. Opioid rotation from morphine to fentanyl in delirious cancer patients: an open-label trial. J. Pain Symptom Manage. 2005;30(1):96–103.
- Freye E., Levy J.V., Braun D. Effervescent morphine results in faster relief of breakthrough pain in patients compared to immediate release morphine sulfate tablet. Pain Practice. 2007;7:324–31.
- Cancer Pain. Assessment and management: edited by Bruera E.D., Potenoy R.K. 2nd edition. Cambridge Uniersity Press, 2010. 643 p.
- Kurz A., Sessler D.I. Opioid-induced bowel dysfunction: pathophysiology and potential new therapies. Drugs. 2003;63(7):649–71.
- Swarm R.A., Paice J. et al. National comprehensive cancer network NCCN Clinical practice Guidelines in oncology, 2014. https://utah.pure.elsevier.com/en/publications/adult-cancer-pain-clinical-practice-guidelines-in-oncology.
- Oscar A.L.C. Cancer pain: pharmacological, interventional, and palliative approaches. Saunders Elsevier. Philadelphia. USA. 2006. 591 p.
Диана Владимировна Невзорова, к.м.н., главный врач ГКУЗ «Хоспис № 1 им. В.В. Миллионщиковой ДЗМ», главный внештатный специалист по паллиативной помощи ДЗМ. Адрес: 119048, г. Москва, ул. Доватора,
д. 10. Тел.: (499) 245-59-69. E-mail: gyn_nevzorova@mail.ru
Гузель Рафаиловна Абузарова, д.м.н., руководитель Центра паллиативной помощи онкологическим больным ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена», профессор кафедры онкологии и радиотерапии ИПО ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова». Адрес: 125284, г. Москва, 2-й Боткинский пр., д. 3. E-mail: abuzarova_mnioi@bk.ru
Источник
Год утверждения: 2016 (пересмотр каждые 3 года)
Профессиональные ассоциации:
Ассоциация профессиональных участников хосписной помощи
Ассоциация междисциплинарной медицины
Общество специалистов доказательной медицины
Российское научное медицинское общество терапевтов
Оглавление
1. Краткая информация
2. Диагностика
3. Лечение
4. Реабилитация
1. Краткая информация
1.1 Определение
Боль – неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения (Международная ассоциация по изучению боли IASP)
1.2. Этиология и патогенез
Хронический болевой – самостоятельное заболевание, не несущее защитной функции и не имеющее биологической целесообразности, ведущее к дезадаптации с различными нарушениями функций ЦНС.
Клиническая картина зависит от локализации очага поражения, конституции, психики и порога болевой чувствительности больного и его болевого опыта.
Основная причина возникновения хронического болевого синдрома – длительная постоянная боль.
Боль, вызванная злокачественным опухолевым процессом, специфична – это сочетание боли от сдавления (висцеральная), повреждения нервных структур (невропатическая) и повышенная восприимчивость к сенсорным раздражителям из-за выделения опухолью специфических алгогенов.
Ноцицептивная соматическая боль возникает в результате повреждения ткани или воздействия болезненного агента. Хорошо локализована, приходящая или постоянная, описываемая как тупая или острая, давящая, пульсирующая, дергающая, сверлящая, грызущая, распирающая и пр.
Ноцицептивная висцеральная боль возникает при повреждении симпатически иннервируемых органов. Плохо локализована, разлитого характера – тупая с приступами обострения, сжимающая, схваткообразная, тянущая, изнуряющая и пр.
Нейропатическая боль – результат повреждения нервной системы или патологического процесса в соматосенсорной системе. Сопровождает тяжелые ноцицептивные болевые синдромы, может быть самостоятельной после операции или химиотерапии, вирусном повреждении нерва, тяжелых формах диабета.
Нейропатическую боль сложно распознать:
- пациент описывает необычную: жгучую, стреляющую, “как будто бьет током” боль или странные ощущения;
- кожа рядом с местом локализации изменяет чувствительность от гипо- до гиперестезии.
Дисфункциональная боль – боль при отсутствии активации ноцицепторов и видимого органического повреждения. Главное отличие от других видов боли – при традиционном обследовании не удается выявить её причину. Типична при фибромиалгии, головная боль напряжения и психогенные боли.
1.3 Эпидемиология
Хроническая/персистирующая боль как результат:
1. Хронических заболеваний;
2. Заболеваний, опасных для жизни (ЗНО, ВИЧ).
Частота боли при различных процессах (по ВОЗ):
- Онкологические 35–96%: на начальных стадиях 35–50%, при прогрессировании – 75%, в терминальной стадии – 95–100%.
- Сердечно-сосудистые 41–77%;
- Почечная недостаточность 47–50%;
- ХОБЛ 34–77%;
- ВИЧ/СПИД 63–80%;
- Цирроз печени 67%;
- Рассеянный склероз 43%;
- Болезнь Паркинсона 82%;
- Болезнь Альцгеймера и другие деменции 47%;
- Ревматоидный артрит 89%;
- Сахарный диабет 64%;
- Мультирезистентный туберкулез 90%.
1.4 Кодирование по МКБ 10
Боль, не классифицированная в других рубриках (R52):
R52.1 – постоянная некупирующаяся боль;
R52.2 – другая постоянная боль.
1.5 Классификация
По механизму: ноцицептивная – соматическая (поверхностная / глубокая) или висцеральная; нейропатическая – периферическая или центральная.
По продолжительности: острая или хроническая («персистирующая»).
По этиологии: онкологическая или неонкологическая.
По локализации: головная, в спине, мышечно-фасциальная, ревматическая, скелетная, неврологическая, сосудистая и т.д.
2. Диагностика
Восприятие боли субъективно, нет метода объективного её измерения.
Необходимо выяснить:
1. число и локализацию очагов боли;
2. длительность предшествующего болевого анамнеза;
3. эффективность предшествующей терапии боли;
4. применяемые анальгетики;
5. влияние боли на физическую активность;
6. влияние боли на продолжительность ночного сна;
7. влияние боли на возможность приема пищи и прочее.
Цель оценки боли – понимание ощущений пациента и определение влияющих на боль факторов.
При оценке определяется:
- тип боли (ноцицептивная, нейропатическая, диссоциативная, смешанная),
- интенсивность (слабая, умеренная, сильная),
- продолжительность (острая или хроническая),
- локализация,
- эффективность лечения.
Оценка боли проводится при каждом визите и осмотре больного отдельно в движении и в покое.
Для оценки интенсивности боли и эффективности лечения применяются специальные шкалы НОШ или ВАШ в %.
Степень интенсивности боли:
- слабая – 0 – 40%,
- умеренная – 40% – 70%,
- сильная – 70% – 100%.
Оценка боли у пациентов с когнитивными нарушениями:
- по поведенческой реакции и возможности отвлечь или утешить аналогично оценке боли у детей;
- изменение поведения пациента расценивается как возможное проявление боли при спутанности сознания;
- при тяжёлых нарушениях для определения причины дискомфорта учитывают мнение нескольких лиц, осуществляющих уход за пациентом;
- при умеренных и тяжёлых когнитивных нарушениях для скрининга и мониторинга состояния используют инструменты оценки боли, дискомфорта, поведения и эффективности вмешательства.
Дополнительно следует учитывать и оценивать такие компоненты боли как психологические и физические страдания.
3. Лечение
3.1 Консервативная терапия
«3-ступенчатая лестница обезболивания» ВОЗ учитывает оценку интенсивности боли пациентом, разделяя анальгетики на неопиоидные и опиоидные (слабые и сильные), основные и альтернативные препараты.
ВОЗ включила опиоидные анальгетики в 3-х ступенчатую схему терапии неонкологической боли, если физиотерапия, массажи и другие анальгетики не обеспечивают контроля боли и качество жизни больного.
Основной принцип фармакотерапии онкологической боли – «дозы анальгетика подбираются, начиная с высоких доз слабых препаратов, переходя к низким дозам более сильных».
Не обязателен последовательный переход от ступени к ступени: пациент с тяжёлым болевым синдромом сразу может нуждаться в сильных опиоидных анальгетиках.
Переход на следующую ступень определяется усилением боли, недостаточным ответом на терапию и побочными эффектами.
Принципы опиоидной терапии:
Рекомендуется неинвазивное введение, следует исключить инъекции.
- Трансдермальный способ (ТТС) предпочтителен при постоянной и длительной умеренной и сильной боли при уже подобранной эффективной суточной дозе, так как действие пластыря отсрочено.
- При необходимости быстрой стабилизации боли – внутривенное введение.
- Внутримышечный способ не применяется для постоянного обезболивания, только подкожно или перорально.
- Спинальное (эпидурально и интратекально) – при интенсивной боли или при плохом ответе на рутинную системную терапию опиоидами.
Препарат вводят регулярно через определенные интервалы времени с учётом периода полувыведения или «по часам», не дожидаясь усиления боли.
Дозировка обезболивающего препарата «по восходящей», от высоких доз слабых к низким дозам сильных анальгетиков.
Препарат применяется «индивидуально» – с учётом индивидуальных реакций организма и особенностей физического состояния. Не существует единой дозы и комбинации препаратов универсальных для всех.
Препарат применяется «с вниманием к деталям»: регулярная оценка эффективности, лечение побочных эффектов.
3.1.1 Общие принципы терапии хронической боли при оказании паллиативной медицинской помощи
3.1.1.1 Ступень 1. Неопиоидные анальгетики +/- вспомогательная терапия
Интенсивность боли оценивается пациентом, как слабая, в пределах от 0 до 40% по НОШ, (ВАШ).
На 1-ой ступени фармакотерапии боли используют неопиоидные анальгетики, при необходимости дополнительно адъювантные анальгетики.
Необходимо учитывать присущую всем неопиоидным анальгетикам гепатотоксичность и нефротоксичность, гастротоксичность неселективных НПВС, риски со стороны ССС на фоне селективных НПВС.
Предпочтительны НПВС с коротким периодом полувыведения, высокоэффективные и с наименьшими побочными эффектами, а также высокоселективные НПВС, особенно у пациентов с высоким риском ЖКТ-осложнений.
Целесообразна сопроводительная адъювантная и симптоматическая терапия: ИПП, кортикостероиды, спазмолитики, бензодиазепины, антигистаминные, антиконвульсанты и др.
3.1.1.2 Ступень 2. Слабые опиоидные + неопиоидные анальгетики +/- вспомогательная терапия
Интенсивность боли оценивается пациентом, как умеренная, в пределах от 40% до 70% по НОШ, (ВАШ), не контролируется регулярным приемом парацетамола, НПВС и адъювантных анальгетиков.
В качестве адъювантных анальгетиков дополнительно применяют препараты 1-й ступени, кортикостероиды, спазмолитики, миорелаксанты, антиконвульсанты, антидепрессанты.
Дополнительно к препаратам 2-й ступени целесообразно назначение уменьшающих побочные эффекты препаратов: ИПП, бензодиазепины, слабительные, противорвотные, антигистаминные и др.
На 2-й ступени используют слабые опиоиды (трамадол, кодеин), при необходимости дополнительно неопиоидные и адъювантные анальгетики.
При умеренной боли защечные таблетки 20-120 мг/сут пропионилфенилэтоксиэтилпиперидина (просидол).
(Просидол)
Действие пропионилфенилэтоксиэтилпиперидина (просидол):
- Спазмолитическое выраженное,
- Сосудорасширяющее,
- Противокашлевое умеренное,
- Ортостатическая гипотония в первые дни.
Начальная разовая доза 10–20 мг (по ½-1 таб) в последствии может быть повышена до 30–40 мг.
Альтернатива трамадолу и кодеину – опиоиды 3–й ступени в низких дозах: морфин, оксикодон, фентанил, бупренорфин.
1. Морфин в таблетках или капсулах продленного действия. Стандартная начальная доза 10 мг 1-2 раза в сутки (максимально до 30мг/сут). Содержимое капсулы можно растворять в жидкой пище. Доза 10 мг предназначена для титрования суточной дозы.
2. Оксикодон+налоксон (таргин) в таблетках продленного действия. Стандартная начальная доза 5мг/2,5мг 1-2 раза в сутки (максимально до 20 мг/сут). Доза 5 мг/2,5мг предназначена для подбора суточной дозы.
3. Фентанил в ТТС в дозе до 12,5 мкг/ч. Пластырь действует 72 часа и предпочтителен при умеренной и тяжелой почечной и печеночной недостаточностей.
Альтернатива пероральным опиоидам – трансдермальная форма фентанила и бупренорфина.
При невозможности применения пероральных форм и ТТС назначают парентеральный морфин.
Введение морфина дробное по 3 – 5 мг 2 – 4 раза в сутки, суммарно до 10 мг/сут, возможно использование продленной подкожной или внутривенной инфузии.
Возможно использование Кодеин+Морфина гидрохлорид+Носкапин+Папаверина гидрохлорид+Тебаин (омнопон) с учетом индивидуальной переносимости компонентов.
Тримепередин в таблетках и растворе не используется при хронической боли.
3.1.1.3 Ступень 3. Сильные опиоидные + неопиоидные анальгетики +/- вспомогательная терапия
Интенсивность боли оценивается пациентом, как сильная, в пределах от 70% до 100% по НОШ, (ВАШ), не контролируется регулярным приемом препаратов 2-ой ступени и адъювантных анальгетиков.
Используются сильные опиоиды, при необходимости дополнительно неопиоидные и адъювантные анальгетики.
К сильным опиоидам относят:
- морфин,
- оксикодон+налоксон (таргин),
- фентанил,
- бепренорфин.
Пролонгированные формы:
- морфин в капсулах и таблетках,
- оксикодон+налоксон в таблетках,
- ТТС фентанила,
- ТТС бупренорфина (транстек),
- бупренорфин+налоксон (бупраксон) сублингвальный (только при остром болевом синдроме).
Предпочтительно при отсутствии умеренной и тяжелой почечной и печеночной недостаточности начинать с таблетированных форм морфина и оксикодон+налоксона.
При невозможности перорального приёма, тошноте и рвоте, непереносимости морфина или оксикодон+налоксон начинают с ТТС фентанил и бупренорфин.
В рандомизированных исследований не выявлено достоверных различий в эффективности препаратов для трансдермального применения с другими опиоидами, но ТТС реже способствуют запорам. ТТС не показаны при выраженной кахексии, повышенном потоотделении и нарушениями целостности кожных покровов.
С осторожностью опиоидные анальгетики используются при печеночной и почечной недостаточности.
У пациентов с нарушением кишечного пассажа (запор), умеренной почечной и печеночной недостаточностью доза морфина снижается, либо используется фентанил.
При невозможности адекватного обезболивания неинвазивными препаратами рекомендуется морфин парентерально. Преимущественный путь введения – подкожно, для быстрого обезболивания и при противопоказаниях к подкожному введению – внутривенно.
В отдельных случаях применяются подкожные и внутривенные инфузии.
При переходе с перорального морфина на подкожное и внутривенное введение, следует учитывать соотношение неинвазивной анальгезирующей активности к инвазивной как 2-3 к одному.
При переходе с одного опиоидного анальгетика на другой из-за недостаточной анальгезии и/или избыточных побочных эффектов начальная дозировка нового препарата ниже предлагаемой расчётными таблицами.
С осторожностью применяются частичные или полные антагонисты опиоидных рецепторов, (бупренорфин) на фоне иных опиоидных анальгетиков из-за вероятности острого развития синдрома отмены.
Не рекомендуется чередование опиоидных анальгетиков без необходимости. Меняется анальгетик или путь введения только при недостаточном эффекте на фоне высоких доз и/или развитии непереносимых побочных эффектов.
3.1.1.4 Титрование дозы и терапия «прорывов боли»
Пример расчёта:
Дважды в сутки пациент получает 60 мг пролонгированного морфина продленного действия, суточная доза 120 мг.
Для терапии «прорыва боли» рекомендуется пероральный морфин в разовой дозе 1/6 суточной – 20 мг или парентеральный 1% морфин в разовой дозе 1/12- 1/18 от общей суточной дозы.
При отсутствии быстродействующего перорального морфина разовая доза парентерального 1% морфина будет 2-3 раза меньше перорального, то есть 6-10 мг.
При 4-кратном использовании морфина для терапии «прорыва боли» повышают дозу морфина продленного действия (базовую терапию).
Пропионилфенилэтоксиэтилпиперидин (просидол) для терапии «прорывной боли» не используется из-за низкого обезболивающего потенциал – 1/3 от потенциала морфина.
Рекомендуется при подборе необходимой дозы базового обезболивания препаратами пролонгированных форм, проводить ее титрование препаратами короткого действия.
Тримеперидин не применяется для длительной терапии боли ввиду кратковременности действия – 4 часа. При пероральном применении эффективность снижается в 2–3 раза.
Для экстренной терапии резкого, спонтанно или эпизодически возникающего приступа боли на фоне препаратов пролонгированных форм (прорыв боли) назначают препараты быстрого действия («препарат спасения»).
Среднее время купирования прорыва – 15 мин после введения морфина быстрого действия.
Для контроля предсказуемых эпизодов прорывной боли за 20-30 мин до провоцирующего воздействия – опиоиды с немедленным высвобождением и коротким действием.
Прорывы слабой боли (1-я ступень) на фоне терапии неопиоидными анальгетиками контролируют адъювантными и симптоматическими средствами.
Прорывы боли умеренной силы (2-я ступень) на фоне пролонгированных опиоидов (трамадол, морфин, оксикодон+налоксон, фентанил) можно контролировать:
- дополнительным назначением трамадола до 400 мг/сут суммарно,
- пропионилфенилэтоксиэтилпиперидин защечно или под язык,
- введением НПВС и других препаратов 1-й ступени,
- адъювантными и симптоматическими средствами.
Прорывы сильной боли (3-я ступень) на фоне пролонгированных сильных опиоидов (ТТС фентанила, морфина или оксикодон+налоксон продленного действия в таблетках или капсулах) лечат:
- пропионилфенилэтоксиэтилпиперидин от 10 до 20–40 мг защечно или под язык;
- морфин (или Кодеин + Морфин + Носкапин + Папаверин + Тебаин) по 5–10 мг в/в, в/м, п/к.
3.1.2 Лечение осложнений опиоидной терапии
На всё время обезболивания назначают слабительные средства осмотические (лактулоза, макрогол), стимулирующие толстый (сеннозиды А и В, бисакодил, натрия пикосульфат) и тонкий кишечник (касторовое, вазелиновое масло), периодически – клизмы, т.к. толерантность к этому осложнению не развивается.
В первые 2 недели возможна рвота, назначаются дофаминергические препараты (галоперидол, метоклопрамид). При сохранении рвоты дольше 2 недель – коррекция дозы антиэметика, при отсутствии положительн?
