Код мкб миелобластный лейкоз
Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
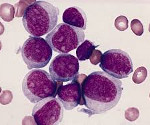
При остром миелобластном лейкозе злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долгоживущих клеток-предшественников миелоидного ряда вызывает появление бластных клеток в циркулирующей крови, замещение нормального костного мозга злокачественными клетками.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Код по МКБ-10
C92.0 Острый миелоидный лейкоз
Симптомы и диагностика острого миелобластного лейкоза
Симптомы включают утомляемость, бледность, лихорадку, инфекции, кровоточивость, легко образующиеся подкожные кровоизлияния; симптомы лейкозной инфильтрации имеются только у 5 % больных (часто в виде кожных проявлений). Для установления диагноза необходимо исследование мазка периферической крови и костного мозга. Лечение включает индукционную химиотерапию для достижения ремиссии и пост-ремиссионную терапию (с трансплантацией стволовых клеток или без нее) с целью профилактики рецидива.
Заболеваемость острым миелобластным лейкозом повышается с возрастом, это наиболее распространенный лейкоз у взрослых с медианой возраста развития заболевания, равного 50 годам. Острый миелобластный лейкоз может развиваться как вторичное онкологическое заболевание после проведения химиотерапии или лучевой терапии при различных видах рака.
Острый миелобластный лейкоз включает ряд подтипов, которые отличаются друг от друга по морфологии, иммунофенотипу и цитохимии. На основании преобладающего типа клеток описано 5 классов острого миелобластного лейкоза: миелоидный, миелоидномоноцитарный, моноцитарный, эритроидный и мегакариоцитарный.
Острый промиелоцитарный лейкоз является особенно важным подтипом и составляет 10-15 % всех случаев острого миелобластного лейкоза. Он встречается у наиболее молодой группы больных (медиана возраста 31 год) и преимущественно в конкретной этнической группе (латиноамериканцы). Этот вариант часто дебютирует нарушениями свертываемости крови.
Лечение острого миелобластного лейкоза
Целью начальной терапии острого миелобластного лейкоза является достижения ремиссии, и, в отличие от острого лимфобластного лейкоза, при остром миелолейкозе ответ достигается при использовании меньшего количества препаратов. Базисный режим индукции ремиссии включает продолжительную внутривенную инфузию цитарабина или цитарабин в высоких дозах в течение 5-7 дней; на протяжении этого времени в течение 3 дней внутривенно вводят даунорубицин или идарубицин. Некоторые режимы включают 6-тиогуанин, этопозид, винкристин и преднизолон, но эффективность данных лечебных схем неясна. Лечение обычно приводит к выраженной миелосупрессии, инфекционным осложнениям и кровоточивости; до восстановления костного мозга обычно проходит длительное время. В течение этого периода жизненно важна тщательная профилактическая и поддерживающая терапия.
При остром промиелоцитарном лейкозе (ОПЛ) и некоторых других вариантах острого миелобластного лейкоза на момент постановки диагноза может присутствовать диссеминированное внутрисосудистое свертывание (ДВС), усугубляемое в результате высвобождения лейкозными клетками прокоагулянтов. При остром промиелоцитарном лейкозе с транслокацией t (15; 17) применение АТ-РА (трансретиноевая кислота) способствует дифференцировке бластных клеток и коррекции диссеминированного внутрисосудистого свертывания в течение 2-5 дней; в сочетании с даунорубицином или идарубицином этот режим может индуцировать ремиссию у 80-90 % больных с долговременной выживаемостью 65-70 %. Триоксид мышьяка также эффективен при остром промиелоцитарном лейкозе.
После достижения ремиссии проводится фаза интенсификации этими или другими препаратами; режимы с применением цитарабина в высоких дозах могут увеличивать длительность ремиссии, особенно у больных до 60 лет. Профилактика поражения центральной нервной системы обычно не проводится, так как при достаточной системной терапии поражение центральной нервной системы является редким осложнением. У больных, получивших интенсивное лечение, не было продемонстрировано преимуществ поддерживающей терапии, но в других ситуациях она может быть полезна. Экстрамедуллярное поражение в качестве изолированного рецидива встречается редко.
Прогноз при остром миелобластном лейкозе
Частота индукции ремиссии составляет от 50 до 85 %. Долговременная выживаемость без заболевания достигается у 20-40 % всех больных и у 40-50 % молодых больных, лечение которых включало трансплантацию стволовых клеток.
Прогностические факторы помогают определить протокол лечения и его интенсивность; больные с явно неблагоприятными прогностическими факторами обычно получают более интенсивное лечение, потому что потенциальное преимущество такого лечения предположительно оправдывает более высокую токсичность протокола. Наиболее важным прогностическим фактором является кариотип лейкозных клеток; неблагоприятными кариотипами являются t (15; 17), t (8;21), inv16(p13; q22). Другими неблагоприятными прогностическими факторами являются более старший возраст, миелодиспластическая фаза в анамнезе, вторичный лейкоз, высокий лейкоцитоз, отсутствие палочек Ауэра. Использование только классификаций FAB или ВОЗ не позволяет предсказать ответ на лечение.
[12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23]
Источник
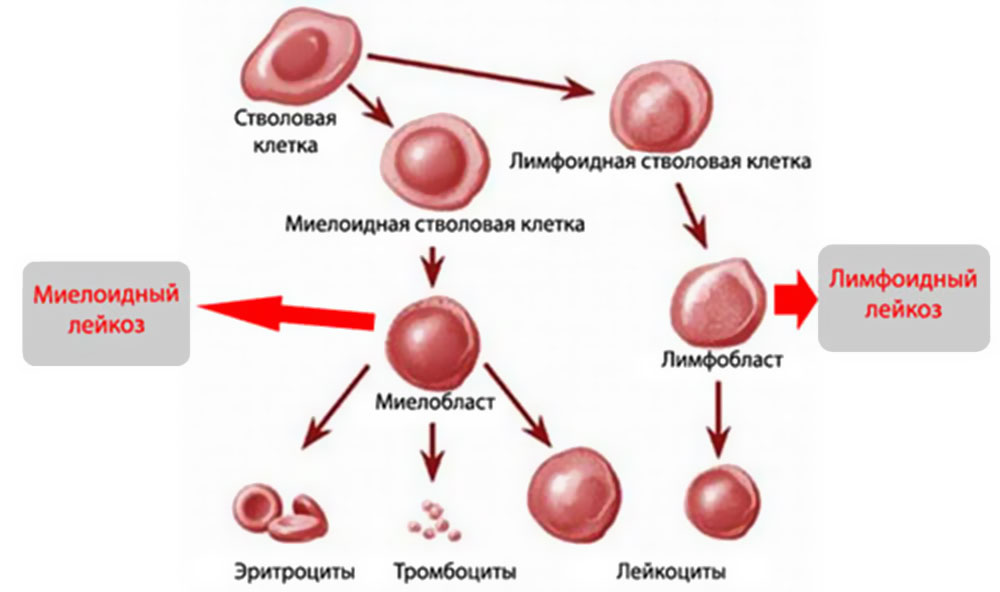
MKБ 10 или международная классификация всех заболеваний 10 созыва имеет в себе практически все короткие обозначения известных патологий, в том числе и онкологических. Лейкоз коротко по МКБ 10 имеет две точные кодировки:
- С91 — Лимфоидная форма.
- С92 — Миелоидная форма или миелолейкоз.
Но также нужно учитывать и характер заболевания. Для обозначения используют подгруппу, которая пишется после точки.
Лимфолейкоз
| Кодировка | Лимфоидный лейкоз |
| C 91.0 | Острый лимфобластный лейкоз при Т или В клеток предшественников. |
| C 91.1 | Лимфоплазматическая форма, Синдром Рихтера. |
| C 91.2 | Подострый лимфоцитарный (в данной время код не используется) |
| C 91.3 | Пролимфоцитарный В-клеточный |
| C 91.4 | Волосатоклеточный и лейкемический ретикулоэндотелиоз |
| C 91.5 | Т-клеточная лимфома или лейкемия взрослых с параметром HTLV-1-ассоциированная. Варианты: Тлеющий, острый, лимфоматоидный, тлеющий. |
| C 91.6 | Пролимфоцитарный T-клеточный |
| C 91.7 | Хронический из больших зернистых лимфоцитов. |
| C 91.8 | Зрелый B-клеточный (Беркитта) |
| C 91.9 | Неутонченная форма. |
Миелолейкоз
Включает в себя гранулоцитарный и миелогенный.
| Коды | Миелоидный лейкоз |
| C 92.0 | Острый миелобластный лейкоз (ОМЛ) с низким показателем дифференцировки, а также форма с созреванием. (AML1/ETO, AML M0, AML M1, AML M2, AML с t (8 ; 21), AML ( без FAB классификации ) БДУ) |
| С 92.1 | Хроническая форма (ХМЛ) [CML], BCR/ABL-положительный. Филадельфийская хромосома (Ph1) положительная. t (9 : 22) (q34 ;q11). С бластным кризом. Исключения: неклассифицированное миелопролиферативное заболевание; атипичный, BCR / ABL-отрицательный; Хронический миеломоноцитарный лейкоз. |
| C 92.2 | Атипичный хронический, BCR/ABL-отрицательный. |
| С 92.3 | Миелоидная саркома в которой новообразование состоит из незрелыз атипичных мелеоилных клеточек. Также в нее входит гранулоцитарная саркома и хлорома. |
| C 92.4 | Острый промиелоцитарный лейкоз [PML] с параметрами: AML M3 и AML M3 с t (15 ; 17). |
| С 92.5 | Острый миеломоноцитарный с параметрами AML M4 и AML M4 Eo с inv (16) or t(16;16) |
| C 92.6 | С 11q23-аномалией и с вариацией MLL хромосомы. |
| С 92.7 | Другие формы. Исключение — гиперэозинофильный синдром или хронический эозинофильный. |
| C 92.8 | С многолинейной дисплазией. |
| С 92.9 | Неутонченные формы. |
Причины
Напомним, что точной причины из-за чего происходит развитие рака крови не известно. Именно поэтому врачам, так сложно бороться с этим недугом и предотвращать его. Но есть ряд факторов, которые могут увеличивать шанс возникновения онкологии красной жидкости.
- Повышенная радиация
- Экология.
- Плохое питание.
- Ожирение.
- Чрезмерное употребление лекарственных средств.
- Лишний вес.
- Курение, алкоголь.
- Вредная работа, связанная с пестицидами и химическими реагентами, которые могут влиять на кроветворную функцию.
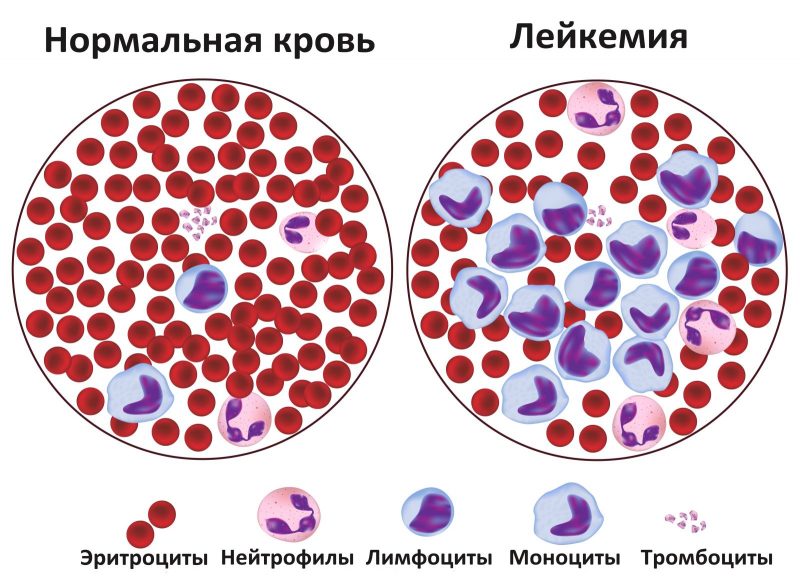
Симптомы и аномалии
- Анемия возникает в результате угнетения эритроцитов из-за чего кислород до здоровых клеток доходит не в полном объеме.
- Сильные и частые головные боли. Начинается с 3 стадии, когда возникает интоксикация из-за злокачественной опухоли. Также может быть результатом запущенной анемии.
- Постоянная простуда и инфекционные и вирусные заболевания с продолжительным периодом. Бывает, когда здоровые лейкоциты заменяются на атипичные. Они не выполняют свою функцию и организм становится менее защищенным.
- Боль в суставах и ломка.
- Слабость, утомляемость, сонливость.
- Систематическая субфебрильная температура без причины.
- Изменение запаха, вкусов.
- Потеря веса и аппетита.
- Долгие кровотечения при снижении количество тромбоцитов в крови.
- Болезненность воспаление лимфатических узлов по всему телу.
Диагностика
Точный диагноз можно поставить, только после проведения тщательного обследования и сдачи определенного перечня анализов. Чаще всего людей ловят на аномальных показателях при биохимическом и общем анализе крови.
Для более точного диагноза делают пункцию костного мозга из тазовой кости. Позже клетки отправляют на биопсию. Также врач-онколог проводит полный осмотри тела: МРТ, УЗИ, КТ, рентген, для выявления метастазов.
Лечение, терапия и прогноз
Основным типом лечения используется химиотерапия, когда в кровь вводят химические яды, которые направлены на уничтожение аномальных клеток крови. Опасность и малоэффективность данного типа лечения в том, что также уничтожаются и здоровые клетки крови, коих и так мало.
При выявлении первичного очага, врач может назначить химию для полного уничтожения костного мозга в данной зоне. После проведения процедуры также могут проводить и облучение для уничтожения остатков раковых клеток. В процессе происходит пересадка стволовых клеток от донора.
(1 оценок, среднее: 5,00 из 5)
Загрузка…
Источник
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Симптомы
- Дифференциальная диагностика
- Причины
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Хронический миелолейкоз.
Хронический миелолейкоз
Описание
Хронический миелобластный лейкоз (ХМЛ, хронический миелолейкоз, хронический миелоидный лейкоз) — форма лейкоза, которая характеризуется усиленным и нерегулируемым ростом преимущественно миелоидных клеток в костном мозге с их накоплением в крови. ХМЛ — гемопоэтическое клоновое заболевание, основным проявлением которого является пролиферация зрелых гранулоцитов (нейтрофилов, эозинофилов и базофилов) и их предшественников; вариант миелопролиферативного заболевания, ассоциированный с характерной хромосомной транслокацией (филадельфийской хромосомой). В настоящее время основным способом лечения хронического миелолейкоза является таргетная (целевая) терапия иматинибом и другими препаратами, значительно улучшившая показатели выживаемости.
Симптомы
Заболевание часто протекает бессимптомно, выявляясь при рутинном клиническом анализе крови. ХМЛ может проявляться недомоганием, субфебрильной лихорадкой, подагрой, повышенной восприимчивостью к инфекциям, анемией, тромбоцитопенией с кровоточивостью (хотя также может наблюдаться повышенное содержание тромбоцитов). Также отмечается спленомегалия.
ХМЛ часто разделяют на три фазы на основании клинических характеристик и лабораторных данных. В отсутствие лечения, ХМЛ обычно начинается с хронической фазы, в течение нескольких лет прогрессирует в фазу акселерации и, в конечном счёте, развивается бластный криз. Бластный криз — терминальная фаза ХМЛ, клинически подобная острому лейкозу. Одним из факторов прогресии от хронической фазы к бластному кризу является приобретение новых хромосомных аномалий (в дополнение к Филадельфийской хромосоме). Некоторые пациенты к моменту постановки диагноза могут находиться уже в фазе акселерации или в бластном кризе.
Около 85 % пациентов с ХМЛ к моменту постановки диагноза находятся в хронической фазе. В течение этой фазы клинические проявления обычно отсутствуют или имеются «лёгкие» симптомы, такие как недомогание или чувство переполнения живота. Продолжительность хронической фазы различна и зависит от того, насколько рано было диагностировано заболевание, а также от проведённого лечения. В конечном счёте, при отсутствии эффективного лечения, заболевание переходит в фазу акселерации.
Фаза акселерации.
Диагностические критерии перехода в фазу акселерации могут различаться: наиболее широко используются критерии, установленные исследователями онкологического центра Андерсона при Техасском университете, Сокалом с соавторами, а также Всемирной организацией здравоохранения. Критерии ВОЗ, вероятно, наиболее широко распространены, и отличают фазу акселлерации следующим:
• 10-19 % миелобластов в крови или костном мозге.
• >20 % базофилов в крови или костном мозге.
• <100,000 тромбоцитов, вне связи с терапией.
• >1,000,000, вне зависимости от терапии.
• Цитогенетическая эволюция с развитием новых аномалий в добавление к Филадельфийской хромосоме.
• Прогрессирование спленомегалии или увеличение числа лейкоцитов, вне зависимости от терапии.
Фаза акселерации предполагается при наличии любого из указанных критериев. Фаза акселерации указывает на прогрессию заболевания и ожидаемый бластный криз.
Бластный криз.
Бластный криз — финальная стадия развития ХМЛ, протекающая подобно острому лейкозу, с быстрой прогрессией и непродолжительной выживаемостью. Бластный криз диагностируется на основе одного из следующих признаков у пациента с ХМЛ:
• >20 % миелобластов или лимфобластов в крови или костном мозге.
• Крупные группы бластов в костном мозге при биопсии.
• Развитие хлоромы (солидного фокуса лейкемии вне костного мозга).
Ассоциированные симптомы: Базофилия. Высокая температура тела. Изменение аппетита. Изменение веса. Истощение. Лейкоцитоз. Ломота в суставах. Моноцитоз. Лихорадка. Недомогание. Нейтрофилез. Общая потливость. Потеря веса. Общая слабость. Тромбоцитоз. Увеличение СОЭ. Эозинофилия.
Хронический миелолейкоз
Дифференциальная диагностика
ХМЛ следует дифференцировать от лейкемоидной реакции, при которой мазок крови может имееть схожую картину.
Причины
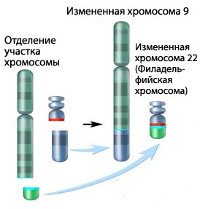
ХМЛ стал первым злокачественным заболеванием с выявленной генетической аномалией, хромосомной транслокацией, которая проявляется патологической Филадельфийской хромосомой. Эта хромосомная патология получила своё название, так как была впервые открыта и описана в 1960 году учёными из Филадельфии, Пенсильвания, США: Питером Ноуеллом (Пенсильванский университет) и Дэвидом Хангерфордом (университет Темпл).
При этой транслокации, части из 9ой и 22ой хромосом меняются местами. В результате, к части BCR-гена из хромосомы 22 прикрепляется ABL-ген из хромосомы 9. Этот аномальный «слившийся» ген генерирует белок p210, или, иногда, p185. Так как abl имеет область, добавляющую фосфатную группу к тирозиновому остатку (тирозин-киназа), продукт аномального гена также является тирозин-киназой.
Белок BCR-ABL взаимодействует с частью клеточного рецептора к ИЛ-3 (CD123-антигеном). Транскрипция BCR-ABL работает непрерывно и не нуждается в активации другими белками. С другой стороны, сам BCR-ABL активирует белковый каскад, контролирующий клеточный цикл, ускоряя деление клеток. Более того, белок BCR-ABL подавляет репарацию ДНК, вызывая неустойчивость генома и делая клетку более восприимчивой к дальнейшим генетическим аномалиям. Активность BCR-ABL — патофизиологическая причина хронического миелолейкоза. С улучшением понимания природы BCR-ABL белка и его действия в качестве тирозин-киназы, была разработана таргетная (целевая) терапия, позволяющая специфически ингибировать активность BCR-ABL белка. Эти ингибиторы тирозин-киназы могут способствовать полной ремиссии ХМЛ, что ещё раз подтверждает ведущую роль bcr-abl в развитии заболевания.
Лечение
Лечение при хроническом миелолейкозе начинают после установления диагноза и обычно проводят амбулаторно.
При отсутствии симптомов хронического миелолейкоза на фоне стабильного лейкоцитоза, не превышающего 40-50- 109/л, применяют гидроксимочевину или бусульфан до достижения содержания лейкоцитов в крови 20*109/л.
По мере прогрессирования хронического миелолейкоза показаны гидроксимочевина (гидрэа, литалир), а-ИФН. При значительной спленомегалии проводят облучение селезёнки.
При выраженной симптоматике хронического миелолейкоза используют комбинации препаратов, применяемых при острых лейкозах: винкристин и преднизолон, цитарабин (цитозар) и даунорубицин (рубомицина гидрохлорид). В начале терминальной стадии иногда эффективен митобронитол (миелобромол).
В настоящее время для терапии хронического миелолейкоза предложен новый препарат — блокатор мутантной тирозинкиназы (р210) — Гливека (STI-571). При бластном кризе ХМЛ и при Ph-позитивных ОЛЛ дозу увеличивают. Применение препарата приводит к полной ремиссии заболевания без эрадикации опухолевого клона.
Трансплантация стволовых клеток крови или красного костного мозга, проводимая больным моложе 50 лет в I стадии заболевания, в 70% случаев приводит к выздоровлению.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
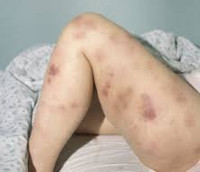
Острый миелоидный лейкоз
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
- ОМЛ с типичными генетическими изменениями.
- ОМЛ с изменениями, обусловленными дисплазией.
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний.
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна.
- Миелоидная саркома.
- Бластная плазмацитоидная дендритноклеточная опухоль.
- Другие виды острого миелоидного лейкоза.
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Источник
