Корешковый синдром после спинальной анестезии
International Journal of Obstetric Anesthesia (1995) 5, 32-35
Fenerty J., Sonner J., Sakura S., Drasner K.
Резюме
Настоящее сообщение – о транзиторных корешковых болях после интратекального введения 5% лидокаина на 7,5% декстрозе. Это препарат выбора во многих акушерских центрах, применяется в качестве однократной инъекции местного анестетика, что может приводить к транзиторной неврологической симптоматике, вследствие его токсичности. Многие пропагандируют разведение этого раствора анестетика перед субарахноидальным введением. Настоящее сообщение описывает случай, при котором транзиторные неврологические симптомы отмечены после интратекального введения раствора, содержащего почти 2% лидокаина. Схожесть настоящего случая с теми, о которых сообщалось ранее, предполагает обычную этиологию и также подтверждает, что риск не ограничивается применением 5% лидокаина с 7,5% глюкозой. Это подчеркивает необходимость проведения тщательно контролируемого проспективного исследования факторов, которые вызывают транзиторные неврологические нарушения после спинальной анестезии.
Введение
Исследования, проводимые в анестезиологической практике, подтверждают растущую популярность спинальной анестезии при операции кесарева сечения в течение последних десяти лет. Эта тенденция, вероятно, продолжится, так как современные условия предполагают, что спинальная анестезия обеспечивает лучшую защиту при более эффективной стоимости, чем эпидуральная анестезия при неосложненной плановой операции кесарева сечения. 5% лидокаин с 7,5% декстрозой является одним из наиболее часто используемых растворов при этой процедуре. Однако современное исследование Schneider с соавт. четырех случаев раздражения корешков после интратекального назначения этого раствора анестетика предполагает, что он может проявляться токсическими эффектами [1]. Этот интерес повышается в ответ на сообщение о шести дополнительных случаях [2] и предварительные результаты проспективного исследования [3]. Мы описали случай, при котором симптомы относились к транзиторному корешковому синдрому после применения растворов, содержащих 2% лидокаин, и провели обзор литературы по этой противоречивой теме в акушерской анестезиологической практике.
Описание случая
55-летний мужчина с массой тела 74 кг был подготовлен для проведения трансуретральной резекции опухоли мочевого пузыря в плановом порядке. Физикальный осмотр и лабораторные данные были без особенностей. В анамнезе имели место язвенная болезнь желудка (больной получал лечение фамотидином), курение, длительное течение мочекаменной болезни и аллергическая реакция на пенициллин. Ранее у пациента не было оперативных вмешательств, и не отмечено семейного анамнеза анестезиологических осложнений. После обсуждения выбора метода обезболивания больному была запланирована спинальная анестезия.
В операционной исходное АД и ЧСС составляли 150/90 мм рт. ст. и 84 удара в минуту соответственно. Пациента расположили в положении сидя. Поясничная область обработали йодсодержащим раствором, высушили, затем провели анестезию кожи 3 мл 1% раствора лидокаина на уровне L3-L4. С соблюдением правил асептики иглу Sprotte 24 G ввели в субарахноидальное пространство со второй попытки (при первой попытке было попадание в кость). Интратекальное расположение иглы было подтверждено свободным током цереброспинальной жидкости (ЦСЖ). В шприц, содержащий 2 мл 5% лидокаина с 7,5% декстрозой, добавили 0,2 мл адреналина 1:1000. ЦСЖ была взята до общего объема 5 мл за 20 секунд. Полученный раствор ввели за 10 секунд. Не сообщается о парестезии при введении иглы или применении анестетика. Больного расположили в горизонтальное положение на спине, был подтвержден чувствительный блок до уровня T6, и пациент затем был перемещен в литотомическое положение. Операция прошла без особенностей и длилась в течение 17 минут. 6 мг мидазолама и 50 мкг фентанила были введены внутривенно для получения седативного эффекта. Кроме того, 5 мг эфедрина ввели внутривенно после того как АД снизилось до 98/52 мм рт. ст. примерно через 10 минут после субарахноидального введения.
Ранний послеоперационный период протекал без особенностей. Больной был переведен из восстановительного отделения в обычную палату через 4 часа после полного восстановления. Через 2 часа он пожаловался на боль в ягодицах с иррадиацией в ноги, оценив ее по 10 – балльной шкале в 9 баллов. Осмотр анестезиологом не выявил никаких неврологических нарушений. Боль не облегчилась введением 4 мг морфина внутривенно, но снизилась при введении 60 мг кеторолака внутримышечно. В течение ночи, потребовалось дополнительное введение 30 мг кеторолака. Больной был выписан на следующее утро, он не ощущал боли и легко передвигался. Однако боль вернулась в течение дня после выписки и не купировалась пероральным приемом ибупрофена. Больной был повторно осмотрен по поводу боли в крестце с иррадиацией в ноги, частично облегчающейся при ходьбе. Вновь боль была облегчена внутримышечным введением кеторолака, и он вновь поступил в стационар для купирования боли. Обследование консультирующим неврологом, включая тест Lasegue, не выявило никаких отклонений. Пациент был выписан через 36 часов после повторного поступления. Через 2 недели боль вновь периодически появлялась, особенно после сна или длительного пребывания в положении сидя, но проходила при активности и без применения препаратов. Полное восстановление отмечено в течение 1 месяца.
Обсуждение
Клиническое течение у этого больного явно схоже с четырьмя случаями, описанными Schneider с соавт. [1]. В их исследовании боль в области ягодиц и нижней части спины с иррадиацией по дорсолатеральной поверхности бедер и икр началась через 1-20 часов после операции и полного восстановления. Боль наиболее часто характеризовалась как тупая, ноющая или схваткообразная, хотя один больной также описывал острую, иррадиирущую боль. Дизестезия отличалась в двух случаях, но в оставшихся двух неврологическое исследование было полностью в пределах нормы. Как и в представленном случае, два пациента отметили облегчение боли при активности и трое были успешно пролечены нестероидными противовоспалительными препаратами. Во всех четырех случаях симптомы прошли в течение 1 недели. После обзора множества возможных этиологических факторов Schneider с соавт. сделали вывод, что боль и нарушение чувствительности, вероятно, наступили вследствие прямого токсического эффекта местного анестетика. Они также установили, что растяжение caud equin, вызванное литотомическим положением, также повышает уязвимость нервных волокон корешков.
Впоследствии были описаны шесть подобных случаев [2], вновь после интратекального введения однократного болюса 5% лидокаина на 7,5% глюкозе. Первичные данные из проспективного исследования, выполненного Hampl с соавт. [3], также обеспечили доказательствами связи между введением лидокаина и транзиторной неврологической дисфункцией. Последняя наблюдалась более чем у 1/3 акушерских и гинекологических больных, получивших 5% лидокаин на 7,5% глюкозе, и только у 1/80 больных после бупивакаина, и у 1/14 после интратекально введения морфина, включая больных, которые подвергались операции в литотомическом положении.
В данном случае симптомы, схожие с признаками корешкового раздражения, появились после назначения раствора, содержащего 2% лидокаин. Хотя здесь было много этиологических факторов, обстоятельства и клиническое течение в настоящем случае не сочетались с инфекцией, травмой, ишемией, кровотечением или сдавлением нерва. Положение больного или случайное введение инфицированного препарата могло вызвать эти симптомы. Если бы это были родильницы, можно было бы рассматривать неврологические нарушения после родов и родоразрешения [6].
Схожесть со случаями, сообщенными Schneider с соавт. [1], и с данными Hampl с соавт. [3] предполагает, что прямой эффект анестетика был более вероятен. Кроме того, данный случай произошел в литотомическом положении, а ранее считалось [1], что растяжение caud equin может способствовать дисфункции, повышая уязвимость нервных волокон.
Интерес к тому, что местный анестетик может вызывать нейротоксическое повреждение корешков, вновь возник после сообщения о нескольких случаях синдрома caud equin после продленной спинальной анестезии, большинство из которых связаны с применением 5% лидокаина [4, 5]. Принято считать, что выраженные нарушения после продленной спинальной анестезии и эпизоды транзиторных корешковых болей и дизестезии после однократного введения местного анестетика отражают различные точки токсичности. Появление более значимой дисфункции при длительном методе сопровождает большее воздействие анестетика на нервные ткани сочетанием нарушенного распределения и повторяющегося применения анестетика [7, 8]. Если транзиторное нарушение и постоянное повреждение развивается по одному и тому же механизму, что является особенно значимым то транзиторная дисфункция может служить как заменитель клинической конечной точки более серьезного повреждения, обеспечивая неоценимый инструмент для оценки безопасности анестетического препарата и метода. Факторы, вызывающие транзиторную дисфункцию, должны быть исследованы с помощью модели нейротоксичности на животных.
Исследование неврологических нарушений, связанных с продленной спинальной анестезией, привело нас к выводам, что анестетики следует назначать в более эффективной меньшей концентрации [4]. Это мнение основывается на доказательствах, предполагающих, что нарушение является до некоторой степени зависимым от концентрации [9-11] и что концентрация, сейчас используемая для спинальной анестезии, превышает ту, что требуется для адекватного блока [12, 13]. Однако умеренное снижение концентрации явно не прерывает риска развития серьезных неврологических нарушений, о которых сообщается после случайного интратекального введения эпидуральной дозы 2% лидокаина [14, 15]. Кроме того, есть предварительные данные, полученные на животных и предполагающие, что функциональное повреждение может быть равным, когда такая же доза лидокаина назначается интратекально в виде 5% или 2% раствора [16]. Так как концентрация может быть снижена без потери эффективности [17, 18], отсутствует необходимость использовать концентрированный анестетик, такой как 5% лидокаин. Однако пределы такого риска токсичности интратекальной дозы анестетика могут быть снижены применением более низкой концентрации, что предстоит установить.
Возможно, что в данном случае разведение лидокаина в шприце было неадекватным и концентрация в действительности превысила 2%. С целью доказать данное предположение мы выполнили следующий простой эксперимент: 5 мл стеклянный шприц был частично заполнен 2 мл 5% лидокаина на 7,5% декстрозе и окрашен метиленовым синим красителем. К шприцу присоединена игла 24 G Sprotte и введена в пластмассовую модель субарахноидального пространства, содержащего искусственную ЦСЖ. 3 мл ЦСЖ было аспирировано за 20 секунд, затем иглу немедленно удалили и удерживали параллельно полу, пока содержимое вводилось последовательно в четыре кюветки. Введение провели за 10 секунд с постоянным давлением; была сделана попытка для приготовления примерно такого же объема кюветки. Концентрация лидокаина в каждой кюветке затем определили спектрофотометрическим методом со сравнением оптической плотности каждого образца на 675 нм по отношению к образцу неразбавленного 2% раствора. Рассчитанная концентрация лидокаина в четырех кюветках составляла 1,92, 2,03, 2,14 и 2,08% соответственно.
Мы представили случай, при котором транзиторная корешковая боль развилась после интратекального применения раствора, содержащего примерно 2% лидокаин. Клиническое течение у этого больного, очевидно, не соответствует состоянию, так как боль наступает в результате прямого воздействия раствора анестетика, либо одного, либо в сочетании с влиянием литотомического положения. Тем не менее схожесть с предыдущим случаем подразумевает обычную этиологию и предполагает, что риск не ограничивается применением 5% лидокаина на 7,5% глюкозе. Это подчеркивает необходимость тщательно контролируемого проспективного исследования факторов, которые влияют на транзиторные неврологические нарушения после спинальной анестезии.
Источник
В настоящее время спинальная анестезия (СА) вновь получила широкое распространение, что обусловлена ее простотой и доступностью, способностью надежно блокировать болевую импульсацию, вызывать релаксацию, предотвращать развитие многих нейровегетативных реакций во время операций. Вместе с тем, как и любому другому способу анестезии, СА присущи определенные недостатки. Основной целью настоящей работы являются изучение характера, частоты и причин осложнений и побочных эффектов метода, разработка мер их профилактики.
Материал и методы. Всего СА в качестве анестезиологического пособия во время хирургических вмешательств на органах брюшной полости, малого таза и нижних конечностях использована нами у 2603 больных в возрасте от 10 до 83 лет (1390 мужчин и 1213 женщин). Из них 2265 оперировано в плановом порядке, 338 — по экстренным показаниям. Обезболивание проводили при сохраненном самостоятельном дыхании. Для достижения хирургической стадии СА в 2095 случаях интратекально вводили местные анестетики в чистом виде (2—5 % раствор лидокаина или тримекаина в дозе 1 мг/кг), в 580—наркотические аналгетики (морфин 10—14 мкг/кг или фентанил 0,35—0,7 мкг/кг) в сочетании с 2% раствором лидокаина или тримекаина (1 мг/кг). У 2063 больных использовали изобарические, у 540 — гипербарические растворы местных анестетиков. В случаях интратекального введения наркотических аналгетиков последние из предоперационной подготовки исключали. С целью профилактики артериальной гипотонии 106 пациентам в премедикацию включали 0,5—1 мл 5 % раствора эфедрина; остальным больным непосредственно после интратекального введения обезболивающих препаратов осуществляли умеренную гиперволемическую гемодилюцию. Седативный эффект получали внутривенным введением седуксена (0,07—0,15 мг/кг) или оксибутирата натрия (30—40 мг/кг).
Осложнения и побочные эффекты СА фиксировали на всех этапах лечения больных в стационаре. У 54 больных в возрасте от 52 до 78 лет с патологией органов малого таза и нижних конечностей в предоперационном периоде изучали реакцию сердечно-сосудистой системы на проведение ортоклиностатических проб, используя при этом метод математического анализа ритма сердца [1]. Ретроспективно полученные результаты сопоставляли с гемодинамическими эффектами в ответ на интратекальное введение местно-анестезирующих препаратов.
Результаты исследования и их обсуждение. Из 2603 больных, оперированных под СА различных вариантов, у 2425 (93,2 %) обезболивание было вполне адекватным, у 123 (4,7 %) течение анестезии потребовало дополнительного использования наркотических препаратов и нейровегетативной защиты, у 55 (2,1 %) метод оказался несостоятельным. Недостаточная эффективность или несостоятельность СА были обусловлены тактическими просчетами и техническими погрешностями при выполнении метода.
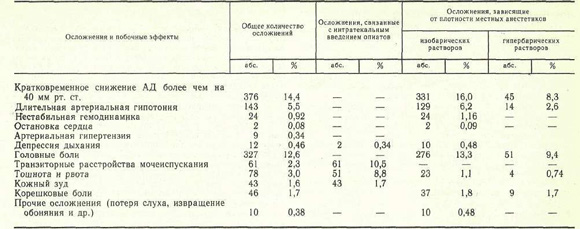
Осложнения и побочные эффекты СА зарегистрированы нами у 955 (36,7 %) больных, из них у 161 отмечены 2—3 осложнения одновременно, иногда на разных этапах лечения. Сведения об осложнениях и побочных эффектах при использовании различных вариантов СА представлены в таблице.
К осложнениям СА мы относим кратковременную или длительную артериальную гипотонию (снижение АД более чем на 40 мм рт. ст.), выраженную депрессию дыхания и кровообращения (высокий спинальный блок), неврологические последствия СА (головная боль, очаговые неврологические нарушения), а также раннюю и позднюю респираторную депрессию, связанную с интратекальным введением наркотических аналгетиков; побочными эффектами считаем тошноту и рвоту, транзиторные расстройства мочеиспускания, кожный зуд. Снижение АД в пределах 20—40 мм рт. ст. Общая характеристика осложнений и побочных эффектов СА мы рассматриваем как естественное проявление физиологического действия СА.
Общая характеристика осложнений и побочных эффектов СА

Во время оперативного вмешательства осложнения СА зарегистрированы у 552 (21,2 %) больных, причем при плановых операциях они наблюдались значительно реже (22 % ) , чем при оперативных вмешательствах, выполненных по экстренным показаниям (42 % ) . К наиболее частым интероперационным осложнениям СА следует отнести кратковременную или длительную артериальную гипотонию, причину которой мы склонны видеть в завышении дозы местноанестезирующих препаратов (свыше 1 мг/кг), форсированном их введении в спинномозговой канал, тактических ошибках, связанных с недооценкой анестезиологом плотности местных анестетиков, а также нераспознанной исходной гиповолемией различного происхождения.
Анализируя причины гемодинамических нарушений, мы обнаружили определенную зависимость частоты этого осложнения от уровня люмбальной пункции и возраста больных. Так, при пункции спинномозгового канала на уровне L4 — L5 артериальная гипотония зарегистрирована в 1,7 % случаев, Lз — L4 — в 18,1 %, L2 — L3 — в 44,7 %.
Обращает на себя внимание резкое увеличение количества гемодинамических нарушений (48,9 %) у лиц старше 50 лет, что, на наш взгляд, связано с повышением в этом возрасте числа сопутствующих заболеваний, а также возрастным снижением резервных возможностей организма. Изложенное выше подтверждают дооперационные исследования реакций сердечно-сосудистой системы на проведение классических проб с изменением положения тела. В случаях адекватной реакции с сохранением тонуса сосудов СА не сопровождалась артериальной гипотонией. При исходных неудовлетворительных адаптационных возможностях сердечно-сосудистой системы (скрытая сердечно-сосудистая недостаточность) выраженная и стойкая гипотензия в ответ на интратекальное введение местноанестезирующих препаратов была закономерным явлением и трудно поддавалась коррекции.
Высокий спинальный блок зарегистрирован в 10 (0,38 %) наблюдениях, проявлялся выраженной респираторной депрессией, стойкой и длительной артериальной гипотонией, прогрессирующей брадикардией. У 2 (0,08%) больных он осложнился остановкой кровообращения. Немедленно проведенные реанимационные мероприятия у 9 пациентов позволили восстановить адекватное кровообращение, дыхание, тонус периферических сосудов, а у 1 (0,04 %) больного они не дали эффекта. Причину этого грозного осложнения мы объясняем положением Фоулера на операционном столе после интратекального введения местноанестезирующих препаратов (изобарические растворы), что привело к постепенному распространению анестетика в краниальном направлении с последующей блокадой межреберных нервов, а также соответствующим симпатическим блоком.
Согласно нашим наблюдениям, сроки развития выраженных гемодинамических эффектов были различны. В 47 % случаев артериальная гипотония развивалась через 5—10 мин после интратекального введения местноанестезирующих препаратов, в 48,1 % —через 20—30 мин и только в 0,9 % — в более поздние сроки. Развитие артериальной гипотензии через 20—30 мин и в более поздние сроки можно объяснить фактом окончательной фиксации местноанестезирующих препаратов соответствующими структурами спинного мозга в течение 20 мин [3, 5]. Иначе говоря, местные анестетики, введенные в спинномозговой канал, при определенных условиях (соответствующий угол наклона операционного стола) способны еще в течение довольно длительного времени после развития хирургической стадии СА на нужном сегментарном уровне распространяться в краниальном направлении, блокируя все новые и новые спинальные сегменты. Поэтому для профилактики высокого спинального блока следует рекомендовать тщательный контроль (через каждые 1—2 мин) за уровнем АД, частотой пульса, уровнем блокады болевой чувствительности в течение первых 20—30 мин. Обращает на себя внимание значительное уменьшение числа случаев артериальной гипотензии при использовании гипербарических растворов (см. таблицу). Согласно нашим наблюдениям, СА гипербарическими и особенно вязкими растворами (на 8—10 % растворе глюкозы) в положении с умеренно, опущенным ножным концом стола на период фиксации анестезирующих препаратов позволяет блокировать строго ограниченное количество спинальных сегментов, а следовательно, и симпатических нервных стволов и сплетений.
Наиболее эффективным мероприятием по предупреждению артериальной гипотонии мы считаем переливание в течение 10—15 мин после интратекального введения обезболивающих препаратов коллоидно-кристаллоидных растворов в объеме 10—15 мл/кг с последующей инфузионно-трансфузионной терапией в умеренном темпе. Включение в премедикацию эфедрина и других вазопрессоров, на наш взгляд, не всегда оправдывает себя, а в ряде наблюдений провоцирует артериальную гипертензию, особенно у больных с сопутствующей артериальной гипертонией. Так, стойкая артериальная гипертензия зарегистрирована нами у 9 из 106 пациентов, получивших в премедикации эфедрин, что составило 8,5 %. Полагаем, что использование вазопрессоров оправдано только при резком снижении АД и неэффективности инфузионной терапии1.
Осложнение, связанное с интратекальным введением наркотических аналгетиков, зарегистрировано только у одного больного. Это была респираторная депрессия, связанная с ошибочным введением в спинномозговой канал 2 мл 0,005 % фентанила в сочетании с 2 % раствором лидокаина (1 мг/кг). Осложнение развилось через 10 мин, устранено вспомогательной ИВЛ в течение 20 мин. Исход благоприятный.
В ближайшем послеоперационном периоде осложнения и побочные эффекты СА отмечены у 451 (17,7 %) больного. К наиболее частым осложнениям следует отнести головные боли — у 327 (12,6%) больных: У 225 (78 %) пациентов они были умеренными и продолжались не более 1—2 дней. В 72 (22 %) наблюдениях зафиксированы стойкие и длительные головные боли (продолжительностью 3—5 дней и более). Как правило, это осложнение развивалось у лиц молодого и среднего возраста и значительно реже у пожилых людей и стариков (25,9 % ). Считают [3, 6], что патофизиологической основой головных болей являются прокол твердой мозговой оболочки и связанная с ним ликворея. Следуя этой точке зрения, легко объяснить вышеизложенный факт ранним активным поведением людей молодого возраста (переход в вертикальное положение), провоцирующим увеличение ликворного давления в спинномозговом канале, а следовательно, и большую потерю спинномозговой жидкости. Профилактические мероприятия — строгий постельный режим в течение 24 ч, положение на животе, внутривенное введение изотонических солевых растворов — позволили значительно снизить частоту постпункционных головных болей.
Другие неврологические осложнения в виде корешковых болей, явлений межостистого лигаментоза, преходящих нарушений обоняния и слуха были зарегистрированы у 56 (2,1 %) больных.
Поздняя респираторная депрессия отмечена у одного больного через 8 ч после интратекального введения 3 мг морфина (37 мкг/кг) в сочетании с 2 % раствором лидокаина (80 мг). Операция иссечения геморроидальных узлов и анестезия прошли без осложнений. В удовлетворительном состоянии со стабильными показателями гемодинамики и функции внешнего дыхания больной переведен в палату. Респираторная депрессия развилась внезапно, без каких-либо предвестников на фоне относительного благополучия и полного отсутствия боли. Осложнение проявилось в урежении дыхания до 4—5 в минуту, диффузном цианозе и потребовало ИВЛ в течение 8 ч. Исход благоприятный. Причину поздней респираторной депрессии мы склонны объяснить длительной задержкой наркотического аналгетика и его метаболитов в спинномозговой жидкости и мозговой ткани с последующим депрессивным воздействием на дыхательный центр. Превышение стандартной дозы морфина более чем в 3 раза способствовало развитию данного осложнения.
Побочные эффекты СА в виде тошноты и рвоты, транзиторной задержки мочеиспускания, кожного зуда в преобладающем большинстве случаев сопровождали интратекальное введение наркотических аналгетиков, чаще морфина (см. таблицу). Тошнота и рвота возникли у 78 (3 %) больных в ближайшие 2 ч после операции, преимущественно у женщин и ослабленных больных, а также в случаях завышения стандартных доз опиатов, введенных интратекально. Транзиторные расстройства мочеиспускания зарегистрированы у 61 (2,3%) больного и не требовали специального лечения. Кожный зуд отмечен у 43 (1,7 %) пациентов, исчезал самостоятельно или после введения антигистаминных препаратов. Механизмы развития перечисленных выше побочных эффектов подробно описаны в литературе [2—4].
Таким образом, СА при грамотном ее выполнении — достаточно безопасный метод обезболивания при условии пункции спинномозгового канала на уровне L2 — L5 Степень выраженности отрицательных гемодинамических эффектов зависит от зоны распространения спинального блока и резко увеличивается при «высокой» СА. Наиболее опасные осложнения СА — высокая спинальная блокада и поздняя респираторная депрессия. Большинство осложнений СА связаны с погрешностями в технике и методике ее выполнения, недооценкой значимости профилактических мероприятий, направленных на предупреждение артериальной гипертензии и высокого спинального блока. Анализ полученных данных позволил нам выделить группу повышенного риска, в которую входят лица пожилого и старческого возраста, больные с выраженной гиповолемией различной этиологии, неудовлетворительными компенсаторными возможностями сердечно-сосудистой системы (скрытая сердечнососудистая недостаточность).
ВЫВОДЫ
- При проведении СА следует неукоснительно соблюдать все существующие правила ее выполнения с обязательным учетом плотности вводимых интратекально препаратов.
- СА наиболее безопасна при операциях на органах малого таза и нижних конечностях. Использование СА при оперативных вмешательствах
на органах верхней части брюшной полости представляет реальную опасность из-за резкой артериальной гипотонии и респираторных
нарушений. - Оптимальная доза лидокаина (тримекаина) для интратекального введения составляет 1 мг/кг, морфина — 10 мкг/кг, фентанила — 0,35 мкг/кг.
- У лиц, относящихся к группе повышенного риска, от СА следует отказаться в пользу другого метода обезболивания.
ЛИТЕРАТУРА
- Рифтин А. Д., Гельцер Б. И., Григоренко Г. Ф. Распознавание функциональных состояний организма на основе кибернетического анализа сердечного ритма: Метод, разработка. — Владивосток, 1986.
- Хапий X. X., Давыдов С. Б. Современные методы регионарной анестезии: Осложнения, их профилактика и лечение: Обзор, инофрм.— М., 1988.
- Covino В. G. I/ Int. Anesth. Clin.— 1989.—Vol. 27, N 1.— P. 8—12.
- Duthie D. J., Nitnmo N. S. // Brit. J. Anaesth,— 1987.— Vol. 59, N 1.—P. 61—77.
- Francois Q., Cara M., Deleuze R., Poisvert M. Medecine L’urgence Anesthesia Reanimation Pares.— 1981.— Vol. 8.— P. 136—143.
- Lambert D. H. // Int. Anesth. Clin,—1989.—Vol. 27, N 1. P. 51—55.
1 В 1988 г. в журнале «Anesthesiology» № 1 A. Keats, анализируя случаи внезапной остановки сердца во время СА, пришел к выводу, что все они — результат артериальной гипотензии из-за резкой вазоплегии и применение вазопрессоров (адреналина), а не инфузионная терапия должно быть первоочередным жизнеспасительным мероприятием.— Прим. ред.
Источник
