Метаболический синдром и когнитивные нарушения

Одной из значимых причин развития когнитивных нарушений (КН) и деменции является метаболический синдром (МС). Указанные нарушения не всегда бывают следствием только структурного поражения головного мозга, их развитие может быть обусловлено метаболическими расстройствами, связанными с тяжелыми соматическими или эндокринными заболеваниями, или могут иметь место сочетания нескольких патологических факторов. В случае своевременной диагностики и лечения КН, связанные с метаболическими расстройствами, могут полностью или частично регрессировать.
Одной из значимых причин развития когнитивных нарушений (КН) и деменции является метаболический синдром (МС). Указанные нарушения не всегда бывают следствием только структурного поражения головного мозга, их развитие может быть обусловлено метаболическими расстройствами, связанными с тяжелыми соматическими или эндокринными заболеваниями, или могут иметь место сочетания нескольких патологических факторов. В случае своевременной диагностики и лечения КН, связанные с метаболическими расстройствами, могут полностью или частично регрессировать. Важно знать патогенетические основы развития самых распространенных и социально значимых состояний и заболеваний современности, в этой иерархии МС лидирует. Синдром Х В 1988 году американский ученый G. Reaven, объединив нарушения углеводного обмена, артериальную гипертензию и дислипидемию понятием «синдром Х», впервые высказал предположение о том, что объединяющей основой этих нарушений может быть инсулинорезистентность и компенсаторная гиперинсулинемия. В конце прошлого века метаболические нарушения и заболевания, развивающиеся у лиц с абдоминальным ожирением, объединили в понятие МС. Примерно 40% лиц старше 50 лет имеют признаки МС, который является важнейшим фактором риска сердечно-сосудистых и цереброваскулярных заболеваний. Распространенность в значительной степени зависит от возраста и пола: среди лиц старше 65 лет признаки метаболического синдрома выявляются примерно у 30% мужчин и 60% женщин. У 50% пациентов с артериальной гипертензией выявляются другие признаки метаболического синдрома. МС синдром представляет собой сочетание метаболических нарушений, в патогенезе которых важную роль играет инсулинорезистентность и которые являются факторами риска раннего развития атеросклероза и его сердечно-сосудистых осложнений. Согласно определению Международной федерации диабета основными клиническими проявлениями МС являются: абдоминальное ожирение; инсулинорезистентность и гиперинсулинемия; артериальная гипертензия; гипертриглицеридемия; повышение ХС ЛНП и снижение ХС ЛВП; нарушение толерантности к глюкозе и/или нарушенная гликемия натощак; нарушения системы гемостаза; хроническое сосудистое воспаление. На настоящий момент существуют 5 групп диагностических критериев МС. Отечественными учеными, экспертами ВНОК также были разработаны и опубликованы критерии МС (2009 г.). Основной критерий — это центральный тип ожирения и окружность талии более 80 см у женщин и более 94 см у мужчин. А дополнительные критерии — это артериальная гипертония (АД ? 130/85 мм рт. ст.), повышение уровня триглицеридов (? 1,7ммоль/л), снижение уровня ХС ЛПВП (<1,0 ммоль/л у мужчин; <1,2 ммоль/л у женщин), повышение уровня ХС ЛПНП > 3,0 ммоль/л, гипергликемия натощак (глюкоза в плазме крови натощак ? 6,1 ммоль/л), нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ?7,8 и ?11,1 ммоль/л). Существует связь между МС и депрессией В целом ряде исследований показано, что у пациентов с МС повышен риск развития КН, как предементных, так и достигающих степени деменции. При этом влияние инсулинорезистентности на когнитивные функции нельзя объяснить лишь пожилым возрастом больных или другими метаболическими процессами, связанными со старением. Awad и соавт. (2004) показали, что молодые люди с нарушением толерантности к глюкозе хуже выполняли тесты на логическую и ассоциативную память, независимо от уровня глюкозы в крови в момент тестирования. У лиц среднего возраста (30—59 лет) с нарушением толерантности к глюкозе также отмечено снижение показателей тестов, оценивающих нейродинамические и мнестические процессы по сравнению с возрастной нормой. Аналогичное когнитивное снижение было также отмечено у лиц среднего возраста, страдающих СД 2-го типа. Тем не менее с возрастом КН, связанные с инсулинорезистентностью, имеют тенденцию к нарастанию, даже в отсутствие СД 2-го типа, при этом преимущественно нарушается выполнение тестов на рабочую память, нейродинамические и регуляторные функции, слухоречевую память с немедленным и отсроченным воспроизведением, что в целом указывает на преобладание подкорково-лобного типа нейропсихологических нарушений. Зрительно-пространственные и речевые функции остаются относительно сохранными. Отмечена связь МС с развитием депрессии, что также может вносить вклад в развитие когнитивной дисфункции и согласуется с подкорково-лобным нейропсихологическим профилем. У пациентов с умеренным когнитивным расстройством, страдающих метаболическим синдромом, риск конверсии в деменцию повышается примерно в 2 раза. Мозговые мишени для метаболического синдрома Неблагоприятное влияние на деятельность мозга могут оказывать все основные клинические составляющие метаболического синдрома, прежде всего артериальная гипертензия, ожирение и гипергликемия. При комбинации нескольких факторов риск развития заболевания может существенно увеличиваться. Тем не менее с помощью регрессионного анализа показано, что степень когнитивного снижения в большей мере зависит от инсулинорезистентности, нежели от других компонентов метаболического синдрома. Когнитивный дефицит, наблюдаемый у пациентов с СД 2-го типа, также может быть отнесен прежде всего на счет инсулинорезистентности. Влияние инсулинорезистентности может быть опосредовано изменением уровня глюкозы в крови. Головной мозг крайне чувствителен к изменению уровня глюкозы, так как, составляя только 2% от общей массы тела, потребляет примерно 25% доступной глюкозы. При общей тенденции к гипергликемии при метаболическом синдроме уровень глюкозы вследствие его дизрегуляции становится более вариабельным, что не может не сказываться на работе мозга. Риск умеренных когнитивных нарушений повышается с увеличением уровня гликированного гемоглобина, как у больных с СД, так и у больных без СД. Гиппокамп и лобные доли можно считать основными мишенями для метаболического синдрома. Вероятно, это предопределяет высокую частоту нарушений памяти и регуляторных функций. Это может быть связано с более высокой потребностью в глюкозе, которая с возрастом имеет тенденцию к повышению, и предопределять особую уязвимость данных структур к дизрегуляции уровня глюкозы. Инсулинорезистентность и стойкое изменение системного уровня инсулина могут также непосредственно оказывать неблагоприятное влияние на функционирование мозга. Показано, что по нейропсихологическому профилю когнитивный дефицит при метаболическом синдроме без СД и с развившемся СД 2-го типа весьма схожи. Кроме того, при инсулинорезистентности нарушается функция инсулина в мозге, который в норме вовлечен в процессы обучения и консолидации следов памяти. Предполагают, что нарушение функции гиппокампа, по крайней мере частично, можно объяснить нарушением функции инсулиновых рецепторов. Более того, инсулин связан с регуляцией тонуса сосудов через влияние на продукцию оксида азота в эндотелиальных клетках. Гипергликемия и воспаление нарушают эффекты инсулина, что является фактором развития эндотелиальной дисфункции. Инсулинорезистентность и болезнь Альцгеймера Данные о влиянии инсулинорезистентности на риск возникновения и прогрессирование болезни Альцгеймера (БАл) противоречивы. В многочисленных исследованиях показана связь между СД 2-го типа, ожирением, артериальной гипертензией и повышением риска БАл в пожилом возрасте. Показано, что риск БАл у лиц с инсулинорезистентностью повышается в 1,3 раза. Недавно опубликованные результаты Роттердамского исследования показали, что риск БАл у больных с СД непосредственно связан с наличием инсулинорезистентности и уровнем инсулина в крови (но только в первые 3 года наблюдения). Основные направления лечения МС включают: снижение массы тела, препараты, повышающие чувствительность тканей к инсулину, гиполипидемические и антигипертензивные средства. Наличие когнитивного дефицита должно учитываться при планировании терапии: лечение в этом случае должно быть максимально упрощено и корригироваться поэтапно, чтобы обеспечить оптимальный результат. При уже развившемся когнитивном дефиците в программы лечения должны включаться средства, усиливающие когнитивные функции. В частности, у пациентов с деменцией, вызванной БАл или цереброваскулярной патологией, показано применение ингибиторов холинэстеразы и мемантина. У пациентов с умеренными КН препаратами выбора являются антипаркинсонические средства, агонисты дофаминовых рецепторов (АДР), в частности, проноран. Этот профиль характерен и для метаболического синдрома Эффективность АДР при умеренных КН была показана в целом ряде исследований, в том числе проводимых с двойным слепым плацебоконтролем. По данным D.Nagaraja, S. Jayashree (2001), 3-месячный курс лечения пронораном в дозе 50 мг/сут вызвал значительное улучшение когнитивных функций, оцениваемое по Шкале краткого исследования психического статуса (MMSE), у 63,3% пациентов с умеренным КН (средняя по группе оценка по MMSE увеличилась на 1,2 балла). В группе лиц, принимавших плацебо, улучшение было отмечено лишь в 26,7% случаев. Механизм действия АДР связан с активацией D2/D3-дофаминовых рецепторов в лимбической системе, лобной коре, зонах стриатума, регулирующих когнитивные процессы. В ряде исследований отмечено, что в основе когнитивной дисфункции при цереброваскулярной патологии может лежать дисфункция дофаминергических систем. Так, при сосудистой деменции снижается захват 18F-флуородопы и численность зон пресинаптического захвата дофамина в хвостатом ядре при том, что численность D2-рецепторов существенно не меняется. Со снижением активности дофаминергических систем мозга особенно тесно связаны снижение активности и концентрации внимания и другие проявления лобной дисфункции, сопровождающиеся вторичным расстройством памяти и аффективными нарушениями. Этот профиль когнитивных нарушений характерен и для метаболического синдрома. Аффективные нарушения, сцепленные с умеренным когнитивным дефектом лобного типа, относительно резистентны к традиционным антидепрессантам и могут лучше купироваться именно агонистами АДР. У пациентов с МС это особенно важно, так как традиционные антидепрессанты могут усугублять расстройства, свойственные данному синдрому. Формирование «когнитивного резерва» Таким образом, препараты из группы АДР уменьшают выраженность умеренного когнитивного расстройства и сопровождающих его аффективных расстройств. Более того, применение указанных лекарств, повышая мотивацию больных и их приверженность назначенной терапии, может способствовать осуществлению комплексных программ по лечению МС. Лечение пронораном сразу же начинают с эффективной дозы — 50 мг/сут. У большинства больных клинический эффект препарата становится очевидным к концу первого месяца лечения, однако у части пациентов положительная реакция проявляется в более поздние сроки — на 2-м или 3-м месяцах. Соответственно рекомендуемая продолжительность лечения должна быть не менее 3 месяцев. Однако если к началу 2-го месяца приема препарата эффект отсутствует, дозу препарата рекомендуется повысить до 100 мг/сут. Важной задачей предупреждения когнитивного снижения может быть формирование «когнитивного резерва». Решение этой задачи достигается не только применением средств, усиливающих когнитивные функции, но также адекватной умственной и физической нагрузкой, активной социальной деятельностью, методиками направленной нейропсихологической реабилитации.
Источник
Дата публикации 26 марта 2018Обновлено 19 июля 2019
Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне).[4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа.[5]
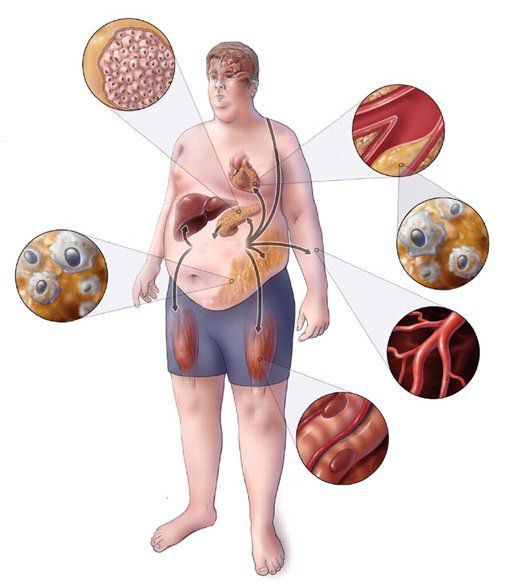
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям.[3][7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м2), классифицируются следующие типы массы тела (МТ):
- нормальная МТ — ИМТ ≥18,5 <25;
- избыточная МТ — ≥25 <30;
- ожирение I степени — ≥30 <35;
- ожирение II степени — ≥35 <40;
- ожирение III степени — ≥40.
ИМТ <18,5 характеризуется как дефицит массы тела.
Важную роль играет распределение жировой ткани. Различают два типа ожирения:
- гиноидный (по типу «груша»), когда избыточная жировая ткань распределяется преимущественно на бёдрах и ягодицах;
- андроидный (по типу «яблоко»; абдоминальное ожирение), с преимущественной локализацией жира в области верхней половины тела (живот, грудь, плечи, спина).

Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма <5,6) и в венозной плазме (норма <6,1) натощак в ммоль/л. Гипергликемией натощак считается показатель ≥5,6 <6,1 и ≥6,1; <7,0; сахарный диабет — ≥6,1 и ≥6,1 <7,0, соответственно. Через 2 часа после углеводной нагрузки (75 гр глюкозы или 125 гр сахара рафинада, растворённых в 200 мл воды) нормальный показатель концентрации глюкозы в капиллярной и венозной крови — <7,8 ммоль/л; НТГ — ≥7,8 <11,1 и сахарный диабет — ≥11,1.
Ещё один важный компонент метаболического синдрома — артериальная гипертензия, которая может носить вторичный характер. Нормальным считается систолическое артериальное давление (САД) 120-129 мм рт.ст и диастолическое артериальное давление (ДАД) 80-84 мм рт.ст. САД <120 и ДАД <80 называют оптимальным давлением, а САД 130-139 и ДАД 85-89 — высоким нормальным артериальным давлением. Различают три степени артериальной гипертензии:
- 1 ст. – САД 140-159, ДАД 90-99;
- 2 ст. – САД 160-179, ДАД 100-109;
- 3 ст. – САД ≥180, ДАД ≥110.
Повышение артериального давления характеризуется повышением риска сердечно-сосудистых событий.
Для метаболического синдрома характерны также изменения липидного обмена, которые классифицированы в таблице ниже (в ммоль/л).
| Параметры липидов | Риск низкий | Риск умеренный | Риск высокий | Риск очень высокий |
|---|---|---|---|---|
| ОХ | ≤5,5 | ≤5 | ≤4,5 | ≤4 |
| ХС-ЛПНП | ≤3,5 | ≤3 | ≤2,5 | ≤1,8 |
| ХС-ЛПВП | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 |
| Триглицериды | ≤1,7 | ≤1,7 | ≤1,7 | ≤1,7 |
| ХС не-ЛПВП | ≤4,3 | ≤3,8 | ≤3,3 | ≤2,6 |
| Примечание: ОХ — общий холестерин; ХС-ЛПНП — холестерин липопротеинов низкой плотности; ХС-ЛПВП — холестерин липопротеинов высокой плотности; ХС не-ЛПВП — холестерин, не связанный с липопротеинами высокой плотности. | ||||
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий.[17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП <1,0 у мужчин; <1,2 у женщин и повышение ХС ЛПНП >3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – <11,1.[8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение < 0,33).[12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность[14], рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия)[15], психотерапевтических методик и обучающих программ.[13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии.[10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности[1]. Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут).[11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.).[9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46%[6].
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
| АО+АГ+НТГ (СД) Умеренный ССР | АО+АГ+ДЛ Высокий ССР | АО+АГ+НТГ (СД)+ДЛ Высокий и очень высокий ССР | ||
|---|---|---|---|---|
| Д/ФН+АГП+ГГП | Д/ФН+АГП+ГЛП | Д/ФН+АГП+ГГП+ГЛП | ||
| Примечание ССР – сердечно-сосудистый риск; АГ – артериальная гипертензия; АО – абдоминальное ожирение; ДЛ – дислипидемия; НТГ – нарушение толерантности к глюкозе; СД – сахарный диабет; Д/ФН – диета/физическая нагрузка; АГП – антигипертензивный препарат; ГГП – гипогликемический препарат; ГЛП – гиполипидемический препарат. | ||||
Источник
