Миелома позвонка код по мкб 10
Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Множественная миелома (миеломатоз; плазмоклеточная миелома) является плазмоклеточной опухолью, которая продуцирует моноклональный иммуноглобулин, который внедряется и разрушает близлежащие кости.
Наиболее частыми проявлениями болезни являются боль в костях, почечная недостаточность, гиперкальциемия, анемия, рецидивирующие инфекции. Для диагностики необходимо наличие М-протеина (часто имеется в моче и отсутствует в сыворотке), деструктивных изменений в костях, определения легких цепей в моче, повышенного содержания плазматических клеток в костном мозге. Обычно требуется биопсия костного мозга. Специфическая терапия включает стандартную химиотерапию (обычно с алкилирующими препаратами, глюкокортикоидами, антрациклинами, талидомидом) и высокодозный мелфалан с аутологичной трансплантацией стволовых клеток периферической крови.
Заболеваемость множественной миеломой составляет от 2 до 4 на 100 000 населения. Соотношение мужчин и женщин составляет 6:1, большинство больных старше 40 лет. Заболеваемость чернокожих в 2 раза больше, чем белых. Этиология неизвестна, хотя определенную роль играют хромосомные и генетические факторы, облучение, химические соединения.
[1], [2], [3], [4], [5], [6]
Код по МКБ-10
C90 Множественная миелома и злокачественные плазмоклеточные новообразования
C90.0 Множественная миелома
Патофизиология множественнной миеломы
Плазмоклеточные опухоли (плазмоцитомы) продуцируют IgG примерно у 55 % и IgA примерно у 20 % больных множественной миеломой. У 40 % этих больных обнаруживается протеинурия Бенс-Джонса, которая представляет собой наличие свободных моноклональных к или X легких цепей в моче. У 15-20 % больных плазматические клетки секретируют только протеин Бенс-Джонса. Эти больные имеют более высокую частоту остеодеструкции, гиперкальциемии, почечной недостаточности и амилоидоза, по сравнению с другими больными, имеющими миелому. Миелома IgD встречается примерно в 1 % случаев.
Диффузный остеопороз или локальные деструкции костной ткани развиваются чаще в тазовых костях, позвоночнике, ребрах и черепе. Повреждения вызваны замещением костной ткани распространяющейся плазмоцитомой или активацией остеокластов цитокинами, которые секретируются злокачественными плазматическими клетками. Как правило, остеолитические повреждения носят множественный характер, но иногда обнаруживаются солитарные внутрикостные опухоли. Внекостные плазмоцитомы встречаются редко, но могут обнаруживаться в любых тканях, особенно тканях верхних дыхательных путей.
Обычно имеется гиперкальциемия и анемия. Часто встречается почечная недостаточность (миеломная почка), которая обусловлена заполнением почечных канальцев белковыми массами, атрофией эпителиальных клеток канальцев и развитием интерстициального фиброза.
Повышенная чувствительность к бактериальным инфекциям обусловлена снижением продукции нормального иммуноглобулина и других факторов. Вторичный амилоидоз встречается у 10 % больных с миеломой, наиболее часто у пациентов, имеющих протеинурию Бенс-Джонса.
Симптомы множественнной миеломы
Упорные боли в костях (особенно в позвоночнике и грудной клетке), почечная недостаточность, рецидивирующие бактериальные инфекции являются наиболее типичными проявлениями множественной миеломы. Часто встречаются патологические переломы. Деструкции тел позвонков могут приводить к компрессии спинного мозга и параплегии. Преобладающим симптомом часто является анемия, которая может служить единственной причиной для обследования больного, часть больных имеют проявления синдрома гипервязкости (см. ниже). Часто встречаются периферическая нейропатия, кистевой туннельный синдром, аномальная кровоточивость, симптомы гиперкальциемии (например, полиурия, полидипсия). Лимфаденопатия и гепатоспленомегалия нетипичны для больных с множественной миеломой.
Диагностика множественнной миеломы
Множественная миелома подозревается у больных старше 40 лет с наличием необъяснимых болей в костях (особенно ночью или во время отдыха), других типичных симптомов или наличием лабораторных отклонений, таких как повышенный уровень белка в крови и моче, гиперкальциемия, почечная недостаточность или анемия. Обследование состоит из определения стандартных показателей крови, электрофореза белков, рентгенологического обследования и исследования костного мозга.
Варианты проявлений множественной миеломы
Форма | Характеристика |
Экстрамедуллярная плазмоцитома | Плазмоцитомы обнаруживаются вне костного мозга |
Солитарная костная плазмоцитома | Единичный костный очаг плазмоцитомы, который обычно продуцирует М-протеин |
Остеосклеротическая миелома (POEMS синдром) | Полинейропатия (хроническая воспалительная полинейропатия), органомегалия (гепатомегалия, спленомегалия, лимфаденопатия), эндокринопатия (например, гинекомастия, атрофия яичек), М-протеин, изменения кожи (например, гиперпигментация, повышенный рост волос) |
Несекретирующая миелома | Отсутствие М-протеина в сыворотке и моче, наличие М-протеина в плазматических клетках |
Стандартные показатели крови включают общий анализ крови, СОЭ и биохимический анализ крови. Анемия имеется у 80 % больных, обычно нормоцитарно-нормохромная с формированием множества агглютинатов, включающих обычно от 3 до 12 эритроцитов.
Количество лейкоцитов и тромбоцитов обычно нормальное. Часто имеется повышение уровня мочевины, сывороточно креатинина и мочевой кислоты, СОЭ может превышать 100 мм/ч. Анионный интервал иногда низкий. Гиперкальциемия присутствует на момент постановки диагноза у 10 % больных.
Производится электрофорез белков сыворотки и в случае отсутствия определенного результата осуществляется электрофорез белков 24-часового концентрата мочи. У 80-90 % больных при электрофорезе белков сыворотки определяется М-протеин. У оставшихся 10-20 % больных обычно определяются свободные моноклональные легкие цепи (белок Бенс-Джонса) или IgD. У этих больных почти всегда определяется М-протеин при электрофорезе белков мочи. Электрофорез с иммунофиксацией идентифицирует класс иммуноглобулина М-протеина и часто определяет белок легкой цепи, если иммуноэлектрофорез белков сыворотки был ложноотрицательным. Электрофорез с иммунофиксацией рекомендуется выполнять в случаях, если электрофорез белков сыворотки был негативным при наличии веских оснований для подозрения на миелому.
Рентгенографическое обследование включает обзорные снимки костей скелета. В 80 % случаев имеется диффузный остеопороз или литические изменения костей округлой формы. Радионуклидное сканирование костей обычно не информативно. МРТ может обеспечить более детальную картину и рекомендуется при наличии болей и неврологических симптомов и отсутствии данных на обычной рентгенографии.
Выполняется также аспирация и биопсия костного мозга, при которых выявляются диффузное распределение или скопления плазматических клеток, что свидетельствует о наличии костномозговой опухоли. Поражение костного мозга обычно неравномерное и чаще определяется повышенное количество плазматических клеток с разной степенью созревания. Иногда количество плазматических клеток бывает нормальным. Морфология плазматических клеток не зависит от класса синтезируемого иммуноглобулина.
У больного, имеющего М-протеин в сыворотке крови, есть основания предполагать наличие миеломы при уровне протеинурии Бенс-Джонса больше 300 мг/24 ч, остеолитических повреждениях (без признаков метастатического рака или гранулематозного заболевания) и наличии повышенного содержания плазматических клеток в костном мозге.
[7], [8], [9], [10], [11], [12], [13], [14], [15]
Лечение множественнной миеломы
Больные нуждаются в серьезном поддерживающем лечении. Амбулаторная поддерживающая терапия помогает сохранить плотность костной ткани. Анальгетики и паллиативные дозы лучевой терапии (18-24 Гр) могут облегчить боль в костях. Однако лучевая терапия может препятствовать проведению курсовой химиотерапии. Все больные должны также получать бифосфонаты, которые уменьшают риск развития осложнений со стороны скелета, облегчают боль в костях и обладают антиопухолевой активностью.
Адекватная гидратация является профилактикой повреждения почек. Даже больные с длительной, массивной протеинурией Бенс-Джонса (10-30 г/сутки) могут сохранить функцию почек, если они поддерживают диурез более 2000 мл/ сутки. У больных с протеинурией Бенс-Джонса дегидратация, сопровождающая введение высокоосмолярного внутривенного контраста, может вызвать острую почечную недостаточность.
Для лечения гиперкальциемии используются обильная гидратация и бифосфонаты, иногда совместно с преднизолоном 60-80 мг внутрь в сутки. Хотя большинство больных не нуждаются в приеме аллопуринола, прием 300 мг в сутки показан при наличии почечной недостаточности или симптомов гиперурикемии.
Показано проведение профилактической вакцинации против пневмококковой инфекции и гриппа. Назначение антибиотиков производится при документированной бактериальной инфекции и не рекомендуется рутинное профилактическое назначение антибиотиков. Профилактическое введение внутривенного иммуноглобулина может снизить риск инфекционных осложнений, обычно назначается больным с частыми рецидивирующими инфекциями.
Рекомбинантный эритропоэтин (40 000 ЕД подкожно 3 раза в неделю) применяют у больных с анемией, не корригируемой химиотерапией. Если анемия приводит к нарушениям со стороны сердечно-сосудистой системы, используют трансфузии эритроцитной массы. При развитии синдрома гипервязкости проводится плазмаферез. Проведение химиотерапии показано для уменьшения сывороточного или мочевого М-протеина. Постцитостатическая нейтропения может способствовать развитию инфекционных осложнений.
Стандартная химиотерапия обычно состоит из курсов перорального мелфалана [0,15мг/(кг х сут) внутрь] и преднизолона (20 мг 3 раза в день) каждые 6 недель с оценкой ответа через 3-6 месяцев. Полихимиотерапия может проводиться с применением различных режимов с внутривенным введением препаратов. Эти режимы не улучшают долговременную выживаемость по сравнению с комбинацией мелфалана и преднизолона, но могут обеспечивать более быстрый ответ у больных с дисфункцией почек. Проведение аутологичной трансплантации гемопоэтических стволовых клеток показано больным моложе 70 лет с адекватной функцией сердца, печени, легких и почек со стабильным течением болезни или хорошим ответом после нескольких курсов стандартной химиотерапии. Этим больным проводится начальная химиотерапия винкристином, доксорубицином и дексаметазоном или дексаметазоном с талидомидом. При необходимости назначения миелоидного ростового фактора препараты, угнетающие функцию костного мозга, алкилирующие агенты и препараты нитрозомочевины не назначаются. Проведение аллогенной трансплантации с немиелоаблативными режимами кондиционирования (например, низкие дозы циклофосфомида и флударабина или лучевой терапии) у некоторых больных может улучшать выживаемость без признаков заболевания до 5-10 лет вследствие снижения токсичности и наличия иммунного аллогенного антимиеломного эффекта. Этот метод показан больным моложе 55 лет с хорошим физиологическим резервом. При рецидиве или рефрактерной миеломе применяются новые препараты (талидомид, иммуномодуляторные препараты, ингибиторы протеасом), эффективность этих препаратов в качестве терапии 1-й линии изучается.
Поддерживающая терапия проводится нехимиотерапевтическими препаратами, включая интерферон, которые обеспечивают продолжительный эффект, но имеют некоторые побочные действия. Применение глюкокортикоидов в качестве поддерживающей терапии изучается.
Прогноз при множественной миеломе
Множественная миелома непрерывно прогрессирует, медиана выживаемости при стандартной химиотерапии составляет около 3-4 лет, при высокодозной химиотерапии с трансплантацией стволовых клеток – около 4-5 лет. Лечение улучшает качество и длительность жизни у 60 % больных. Неблагоприятными прогностическими признаками на момент постановки диагноза являются высокий уровень М-протеина в сыворотке крови или моче, повышенный уровень сывороточного бета2-микроглобулина (> 6 мкг/мл), диффузные костные повреждения, гиперкальциемия, анемия и почечная недостаточность.
Источник
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Стандарты мед. помощи
Содержание
- Описание
- Причины
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Миеломная болезнь.
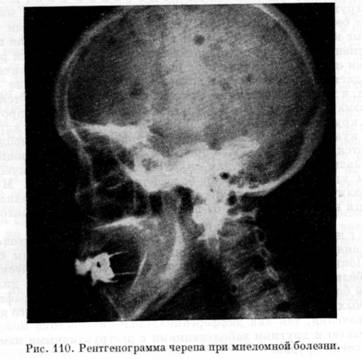
Рентгенограмма черепа при миеломе
Описание
Миеломная болезнь – это злокачественное новообразование системы крови, относящееся к группе парапротеинемических гемобластозов, возникающее в результате бесконтрольной пролиферации в костном мозге плазматических клеток, имеющих способность продуцировать большое количество моноклонального иммуноглобулина (IgG, IgA, IgD, IgE) или легких цепей каппа или лямбда.
Эпидемиология. Заболеваемость миеломной болезнью составляет примерно 40 случаев на миллион населения. Средний возраст пациентов на момент установления диагноза – 60-65 лет, около 2% больных старше 40 лет. Мужчины болеют чаще женщин.
Причины
Этиология миеломной болезни не известна. К потенциальным факторам риска относят контакт с радиоактивными веществами, пестицидами, бензолом, некоторыми органическими растворами.
Как правило, миелома проявляется множественными литическими опухолями в костях, остеопорозом и диффузным плазмоцитозом в костном мозге. Значительное количество патологического моноклонального иммуноглобулина (миеломные белки), который продуцируется плазматически клетками, циркулирует в плазме, вследствие чего может увеличиваться ее объем и общая вязкость крови. Миеломные белки взаимодействуют с факторами свертывания крови и, обволакивая тромбоциты, влияют на их функцию и усиливают кровоточивость.
Кроме миеломных белков, плазматические клетки имеют способность также производить различные цитотоксические факторы, например фактор, который активирует функцию остеокластов. Остеокласты обусловливают резорбцию костной ткани, в результате чего появляются боли в костях, патологические переломы и возникает гиперкальциемия. Следствием инфильтрации костного мозга плазматическими клетками являются анемия различной степени тяжести, лейкопения и / или тромбоцитопения. Уменьшение количества лейкоцитов и нарушения синтеза нормальных иммуноглобулинов может вызвать депрессию гуморального и в меньшей степени, клеточного иммунитета, что делает таких больных очень чувствительными ко многим инфекциям (преимущественно бактериальных).
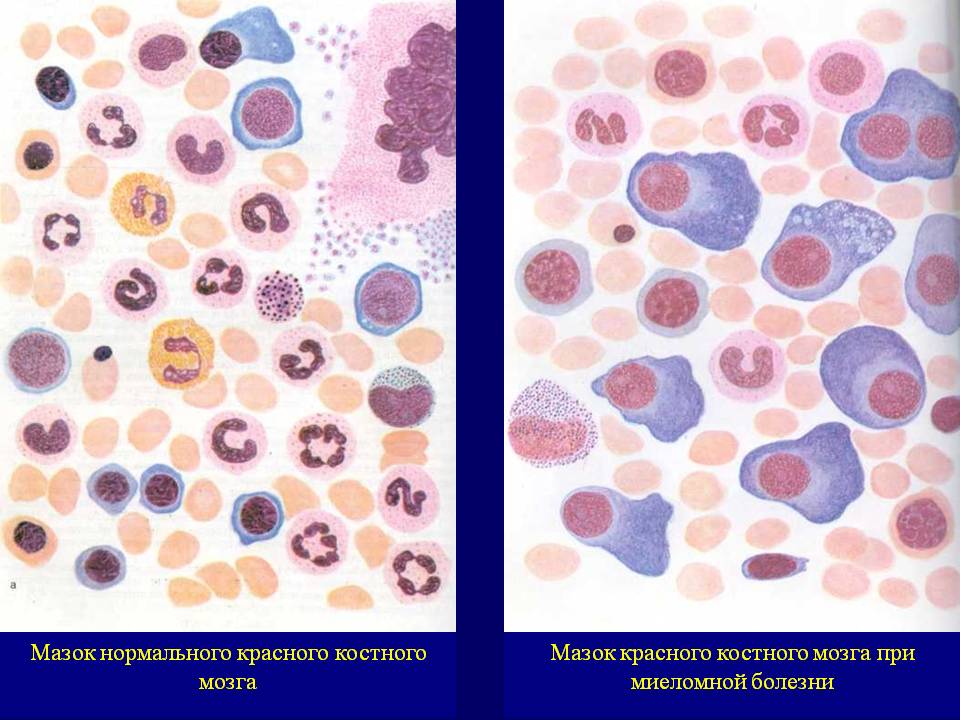
Клетки костного мозга при миеломной болезни
Симптомы
Клинические признаки заболевания достаточно разнообразны. Больные, как правило, жалуются на постоянные боли в костях, спине и пояснице, что сочетается с уменьшением роста и остеопорозом (особенно у мужчин и у женщин до периода менопаузы). Возможна компрессия спинного мозга и спинномозговых нервов с возникновением соответствующей неврологической симптоматики (парапарез и нарушение функции тазовых органов). Обычным явлением для пациентов являются патологические переломы.
Больные миеломной болезнью страдают от частых инфекционных осложнений (вызванных преимущественно Streptococcus pneumonie, Staphylococcus aureus, граммотрицательными микроорганизмами), чувствуют слабость, одышку, головокружение, связанные с анемией и опухолевой интоксикации, возможно наличие симптомов, характерных для почечной недостаточности. Следствием коагулопатии и тромбоцитопении могут быть проявления повышенной кровоточивости. У части пациентов наблюдается бессимптомное течение миеломы, и заболевания выявляется при исследовании анализа крови, которое проводится по другому поводу.
Ассоциированные симптомы: Боль в костях таза. Боль в шейном отделе позвоночника. Общая слабость. Гиперкальциемия. Гиперпротеинемия. Гиперфосфатемия. Гиперхолестеринемия. Полиурия. Протеинурия. Рвота. Слабость мышц (парез). Тошнота. Увеличение СОЭ.
Диагностика
В общем анализе крови может отмечаться эритроцитопения, лейкопения и тромбоцитопения. Особое диагностическое значение имеет увеличение СОЭ. При исследовании сыворотки крови нередко привлекает внимание выраженная протеинемия, которая возникает за счет увеличенной продукции плазматическими клетками моноклональних иммуноглобулинов определенного класса. В моче больных миеломной болезнью можно обнаружить протеинурию, часто положительную реакцию на белок Бенс-Джонса (отметим, что эта реакция не является патогномоничной для миеломы и может наблюдаться при других патологических состояний).
Рентгенологическое исследование костей скелета (грудной клетки, таза, черепа, плечевой и бедренной кости, позвоночника) позволяет обнаружить в них очаги резорбции костной ткани и остеопороза. Про это следует помнить, что специфических рентгенологических признаков, характерных для миеломной болезни, не существует. Отсутствие остеодеструкций не исключает заболевания, а их наличие считается недостаточной для подтверждения диагноза.
Для верификации диагноза миеломной болезни необходимо проведение стернальной пункции с последующим подсчетом миелограммы, позволяющий установить плазмоклеточных инфильтрацию костного мозга. Однако при множественно-очаговых формах заболевания, когда не наблюдается диффузного поражения костного мозга, миелограма может быть нормальной. При наличии других признаков миеломной болезни (остеодеструкиия, моноклональная имуноглобулинопатия) для подтверждения диагноза следует назначать повторные проколы грудины в разных местах, трепанобиопсию подвздошной кости, проводить пункции в местах костных опухолей, при спорных вопросах возможно проведение резекции пораженной кости (ребра, лопатки).
Диагноз миеломной болезни считается достоверным при совокупности следующих признаков:
1. Количество плазматических клеток в костном мозге> / = 10% и / или установлено присутствие солитарной плазмоцитомы, которая подтверждена с помощью биопсии.
2. Выявление моноклонального белка в плазме крови и / или моче (если моноклональный протеин не обнаружен, то количество плазматических клеток в костном мозге должна превышать 30%).
3. Уровень кальция в крови – на верхней границе нормы или выше, почечная недостаточность (креатинин> 20 мкмоль / л), анемия (гемоглобин менее 100 г / л), очаги деструкции в костях или остеопороз (если присутствует только остеопороз, то для подтверждения диагноза необходимо иметь более 30% плазматических клеток в костном мозге).

Повреждения ребер при миеломной болезни
Лечение
Лечение пациентов с миеломной болезнью заключается в проведении химиотерапии, направленной на борьбу с опухолевым клоном, и в коррекции осложнений, связанных с течением болезни (синдром анемии, синдром резорбции костной ткани, почечная недостаточность и ).
Следует отметить, что состояние пациентов, у которых отсутствуют клинические симптомы заболевания, нормальный уровень гемоглобина и кальция в плазме, нет нарушений в функции почек и синдрома резорбции костей, может оставаться стабильным в течение длительного времени ( тлеющая , или ленивая миелома) и не требовать специфического лечения. Таким больным, однако, необходимо проходить тщательный врачебный осмотр и исследование парапротеина в плазме и моче каждык 3 месяца.
Больным, у которых заболевание имеет выраженные клинические признаки или наблюдается прогрессирование заболевания, следует проводить курсы химиотерапии.
Чаще всего на первом этапе лечения пациентам назначается комбинация мелфалана с преднизолоном. Как правило, такая схема приемлема для пациентов пожилого возраста, которым не планируется проведение высокодозной терапии с аутотрансплантацией костного мозга. Мелфалан применяют в дозе 6-8 мг/м2 в сутки вместе с преднизолоном в дозе 40-60 мг / сут в течение 4-7 дней с 4-6-недельными интервалами. Лечение продолжается до достижения максимального ответа на лечение (всего 9-12 месяцев). Такая лечебная схема позволяет достичь уменьшения уровня парапротеина на 50% у 50% больных в течение нескольких месяцев. Продолжительность положительного эффекта от лечения равна 18-24 месяца, средняя продолжительность жизни пациентов, лечащихся по этой схемеувеличивается на 2-4 года. Продолжение химиотерапии после достижения стабильной фазы заболевания (фаза плато) не влияет на продолжительность ремиссии. Полные ремиссии достигаются редко. Следует учитывать, что мелфалан нужно применять с осторожностью у больных с почечной недостаточностью.
Достаточно широко используемых является протокол VAD. При лечении по этому протоколу используют винкристин и адриамицин в течение 4 дней непрерывной инфузией в сочетании с пероральным приемом дексаметазона в большой дозе. Taкоe лечение позволяет достичь значительного процента полных ремиссий (60-70% за короткий промежуток времени). Протокол VAD имеет незначением влияние на стволовые клетки и является идеальным режимом, применяется перед аутотрансплантацией. В то же время проведение такого лечения имеет значительные недостатки, связанные с необходимостью использования для инфузии химиопрепаратов центрального венозного катетера, что может обусловить возникновение катетер-ассоциированной инфекции и коагуляционных осложнений.
Пульсовая терапия дексаметазоном в дозе 40 мг в день в течение 4 дней с 4-дневным перерывом в лечении также считается достаточно эффективным методом лечения впервые выявленной миеломной болезни. Лечебный ответ составляет 40-50% и более, позитивный ответ наблюдается после нескольких циклов. Однако пульсовая терапия дексаметазоном имеет много побочных эффектов, аналогических тем, которые возникают при применении высоких доз глюкокортикостероидних гормонов (нарушение настроения, бессонница, раздражительность, нарушения внимания, задержка жидкости в организме, увеличение веса, стероидный диабет, гастроинтестинальные расстройства, инфекционные осложнения, слабость проксимальных мышц, снижение зрения, включая развитие катаракты).
В некоторых случаях пациентам назначается комбинированная полихимиотерапия (протоколы М2, АВСМ и ). Как правило, использования комбинации из нескольких химиопрепаратов не имеет значительных преимуществ перед указанными выше схемами, но повышает токсическое воздействие на организм пациентов.
Пациенты, которые не ответили положительно на терапию первой линии, рассматриваются как потенциальные кандидаты на проведение аутотрансплантации периферических стволовых клеток.
Высокодозной химиотерапии с последующей аутотрансплантацией считается одним из достаточно эффективных современных методов лечения миеломной болезни (полная ремиссия достигнута у 24-75% больных, частичная ремиссия – у 76-90%), однако этот метод окончательно не излечивает данную патологию (в более 90% больных в будущем подвергается рецидивам болезни). Средняя продолжительность жизни у больных после проведенной высокодозной терапии составляет 4-5 лет, безрецедивный период длится примерно 18-24 месяца. Смертность, связанная с процедурой трансплантации, низкая (около 1%). Аутотрансплантация не показана пациентам пожилого возраста (старше 70 лет) и тем, кто имеет серьезную сопутствующую патологию.
В наше время не существует четких рекомендаций о назначении терапии больным, которые достигли ремиссии. В рамках исследовательских протоколов с этой целью чаще всего применяют преднизолон, альфа-интерферон, ведется изучение эффективности использования талидомида.
Для эффективного лечения костных поражений при миеломной болезни чрезвычайно важным является назначение с самого начала адекватной химиотерапии и, при необходимости, облучения костей. Облучение костей назначается при компрессии спинного мозга, длительном сильном болевом синдроме, для лечения и предупрждения патологических переломов.
С целью ускорения процесса репарации костной ткани рекомендуется назначение бисфосфонатов – памидроната (Аредиа), золедроновой кислоты (Зомета), клодроната (Бонефос). Аредиа применяется внутривенно один раз в 3-4 недели в дозе 120 мг и считается самым безопасным препаратом для больных с нарушением функции почек. Одним из лучших препаратов среди представителей этой группы для коррекции гиперкальциемии является Зомета. Препарат применяется в дозе 4 мг в виде 15-минутной инфузии раз в 3 – 4 недели. Бонефос применяют в виде внутривенной 2-часовой инфузии в дозе 300 мг в день в течение 7 дней, как альтернативный метод лечения может использоваться пероральный прием препарата – 1600 мг в сутки.
Новым методом лечения деструкций позвоночника является применение кофопластики с введением жидкого цемента, что позволяет укрепить позвоночный столб и уменьшить болевой синдром. Больным, у которых не выявлено патологических переломов, рекомендуются умеренные физические нагрузки, особенно плавание и ходьба.
Для коррекции синдрома анемии, сопровождающего миеломной болезнью, применяют препараты железа, витамина В12 (в случаях сопутствующего дефицита этих элементов), проводят переливание эритроцитарной массы. Также для лечения анемии патогенетически обоснованным является назначение эритропоэтина (Эпрекс, Рекормон и ). На первом этапе при лечении эритропоэтинами применяется нагрузка дозой , когда препарат вводят в дозе 40 000 единиц в неделю. Если после 4 недель приема препарата в указанной дозе не произошло повышения гемоглобина, доза эритропоэтина повышается до 60 000 единиц. Терапия продолжается до тех пор, пока уровень гемоглобина не возрастет до 120 г/л, и прекращается при гемоглобине 140 г/л. Поддерживающая терапия эритропоэтином проводится трижды в неделю в дозе 10 000 единиц с повышением дозы в случае необходимости до 20 000 единиц.
Важной составляющей лечения пациентов с миеломной нефропатией является достаточная гидратация, переливания щелочных растворов и плазмафарез. У пациентов с почечной недостаточностью следует ограничить использование нефротоксических препаратов (внутривенные контрасты, аминогликозиды, ванкомидин, амфотерицин В, ацикловир, циклофосфамид, диуретики, бисфосфонаты – за исключением аредиа).
При проведении химиотерапии у больных с почечной недостатнистью преимущество в лечении следует предоставлять протоколам и дексаметазону в качестве монотерапии, поскольку они обеспечивают быстрый лечебный эффект без дополнительного токсического влияния на почки, как это можно наблюдать в случае с мелфаланом.
Причиной инфекционных осложнений у больных с впервые установленной миеломой, как правило, Streptococcus pneumoniae, Hemophilus inflrnse, Herpes zoster Установлено, что инфекционные осложнения чаще встречаются в первые 3 месяца от начала лечения и во время рецидива заболевания. В этот период больным миеломой возможно назначение антибиотиков и сульфаниламидов (например, бисептол) с целью профилактики инфекционных осложнений. Лечения бактериальной инфекции проводится по общим принципам рациональной антибиотикотерапии с учетом нефротоксичности отдельных препаратов.
Современная терапия способствует продлению жизни больных миеломой. Средняя продолжительность жизни при адекватном лечении составляет 50 месяцев.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
