Оперативное лечение синдрома диабетической стопы
В настоящее время в России и в мире многое достигнуто в лечении диабетической стопы: разработаны мультидисциплинарные подходы к лечению, увеличилось число специалистов, занимающихся уходом за стопой, доступны современные антибиотики и средства местного лечения. Однако, несмотря на эти достижения, количество ампутаций нижних конечностей у этих больных растет. Каждый час в мире 55 больных диабетом теряют нижнюю конечность.
Итак, синдром диабетической стопы объединяет патологические изменения периферической нервной системы, артериального русла, представляющие непосредственную угрозу развития язвенно-некротических процессов и гангрены стопы. Как видно из определения, в развитии синдрома диабетической стопы играют роль диабетическая нейропатия, макро- и микроангиопатия и остеоартропатия.
В настощее время выделяют нейропатическую форму диабетической стопы и нейроишемическую форму, которая представляет наибольшую трудность в лечении.
С точки зрения практического хирурга, в синдроме диабетической стопы следует различать 2 группы. Во-первых, диабетическая стопа без острой хирургической патологии, когда лечение может быть ограничено консервативной терапией (плантарная язва, инфицированная рана) и диабетическая стопа с острой хирургической патологией, требующая активной хирургической тактики (флегмона стопы, остеомиелит, гангрена). Основной же задачей хирурга является сохранение опорной функции стопы.
Принципы медикаментозной терапии синдрома диабетической стопы достаточно определены и унифицированы и включают в себя следующие моменты:
- сахароснижающую терапию;
- направленное антибактериальное лечение;
- двигательную разгрузку стопы;
- сосудистую терапию у больных с нейроишемической формой диабетической стопы (актовегин, вессел дуэ ф, вазапростан);
- местную терапию с применением интерактивных перевязочных средств и VAC-терапией раны;
- дезинтоксикационную терапию с учетом степени эндотоксикоза.
Ввиду того, что гнойный процесс любой локализации в условиях гипергликемии и инсулиновой недостаточности сопровождается прогрессирующим некрозом тканей, необходим контроль за уровнем гликемии с проведением рациональной сахароснижающей терапии.
Антибактериальное лечение включает антибиотики широкого спектра с учетом микрофлоры и чувствительности раневого отделяемого.
Консервативная сосудистая терапия проводится больным с нейроишемической формой диабетической стопы при невозможности произвести хирургическую коррекцию ишемии.
Местное лечение раны проводится с учетом фазы раневого процесса, степени экксудации раны, выраженности ишемии конечности. Возможно применение. В 1-ую фазу раневого процесса возможно применение йодофоров, альгинатов кальция, раневых сорбентов, во 2-ую фазу целесообразно использование гидрогелевых и гидрокаллоидных раневых покрытий.
В последнее время все чаще применяется вакуум-терапия гнойно-некротических ран при диабетической стопе. Лечение вакуумом – неинвазивная метиодика, направленная на заживление раны в условиях отрицательного давления на ее поверхности.
VAC-лечение способствует увеличению кровотока в стенках раны, обеспечению активного оттока раневого отделяемого, ускорению формирования грануляционной ткани и уменьшению объема раны. Особенно применение данного метода оправдано у пациентов с обширными ранами. Применение вакуум-терапии позволяет не только в кротчайшие сроки очистить рану, но и уменьшить ее размеры и подготовить к выполнению кожной пластики.
Хирургическое лечение проводится в комплексе с медикаментозной терапией диабетической стопы. Оперативное лечение направлено как на борьбу с гнойно-некротическим процессом, так и на борьбу с ишемией конечности у больных с нейроишемической формой диабетической стопы.
Оперативное лечение гнойно-неркотического процесса включает вскрытие и дренирование флегмоны стопы с последующим этапными некрэктомиями, секвестрэктомию, ампутацию и экзартикуляцию пальцев, резекцию суставов, высокие ампутации конечности на уровне голени и бедра при прогрессирующей гангрене стопы.
Локальные операции на стопе у больных с нейроишемической формой диабетической стопы возможно только после коррекции кровотока и купирования ишемии конечности. Оперативное лечение ишемии конечности включает:
- Шунтирующие операции, выполнение которых целесообразно при высокой окклюзии артериального русла в подвздошно-бедренном и бедренно-подкленном сегменте
- Эндоваскулярные вмешательства (балонная ангиопластика и стентирование), выполнение которых оправдано у больных с микроангиопатией и окллюзией артерий голени и стопы
Так, «золотым стадартом» лечения пациентов с парциальной диабетической гангреной стопы, является стентирование артерий голени с восстановлением кровотока на первом этапе и последующим выполнением локальной операции на стопе.
Финальным этапом многоэтапного хирургического лечения является кожная пластика раневого или язвенного дефекта стопы. Кожная пластика у больных с синдромом диабетической стопы подразделяется на:
А. Несвободную кожную пластику
- Пластика местными тканями
- Со смещением кожных лоскутов
- С помощью взаимоперемещения кожных лоскутов
- С использованием мягких тканей «утильного» пальца
- Метод дозированного тканевого растяжения
- Ротационные кожные лоскуты (индийская)
- Пластика тканями из удаленных частей тела на временной питающей ножке
Б. Свободную кожную пластику
- Свободная дерматомная пластика расщепленным кожным лоскутом (аутодермопластика)
- Пересадка комплекса мягких тканей на микрососудистых анастомозах
- Комбинированную кожную пластику:
- Комбинация нескольких видов несвободной кожной пластики местными тканями
- Комбинация пластики местными тканями со свободной кожной пластикой
Чаще всего выполняется аутодермопластика неперфорированным лоскутом, пластика местными тканями. Реже производят итальянскую пластику и пластику лоскутом на микрососудистых анастомозах. Выбор вида кожной пластики зависит от общего состояния больного, локализации дефекта, состояния окружающих тканей. Так при локализации раневого дефекта на подошвенной поверхности выполняют пластику местными тканями, а на тыльной поверхности – аутодермопластику. При обширных ранах стопы выполняют комбинированную пластику.
Выполнение кожной пластики является логическим завершением многоэтапного комплексного хирургического лечения больных с синдромом диабетической стопы, позволяющего в кратчайшие сроки восстановить функциональность стопы.
В заключении хотелось бы отметить, что как бы не были велики успехи хирургического лечения синдрома диабетической стопы, будущее данной проблемы видится не столько в улучшении способов лечения, сколько в действительной, активной профилактике гнойно-некротических процессов у больных с синдромом диабетической стопы.
dr-anikin.ru
Источник
Под инфицированностью подразумевается лабораторное определение вида микрофлоры и клинические проявления воспаления.
Степень ишемии определяется по Покровскому-Фонтейну в случае наличия стенозов и окклюзий магистральных артерий.
Особое внимание необходимо уделять пациентам с атероматозом (55-64% больных с диагнозом «СД»). Атероматоз (развитие атеросклеротической бляшки) повреждает артериальные сосуды различного калибра: стенозы и окклюзии сосудов. Течение атероматоза в основном тяжёлое и имеет несколько особенностей:
- Поражаются дистальные отделы ноги (задняя и передняя большеберцовая, а тыльная артерия стопы) симметрично артериям обеих ног и на разных уровнях. Причём эти нарушения проявляются у людей более раннего возраста, по сравнению с пациентами без сахарного диабета.
- Самостоятельно (т. е. без механического воздействия и травм или при незначительном воздействии) возникает некроз тканей и формируются трофические язвы. Это связано с тем, что в капиллярную сеть стопы через магистральные артерии кровь поступает в недостаточном количестве и при значительном нарушении микроциркуляции происходит некроз не только кожи, но и мышц, сухожилий. Результат — гангрена, причём чаще влажная чем сухая.
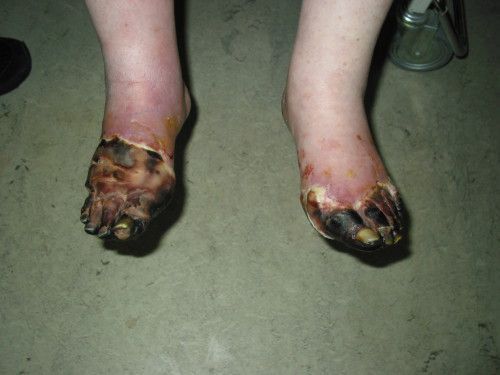
На фоне снижения чувствительности, боль от микротравм и потертостей не ощущается пациентом. Даже язва под сухим струпом на подошвенной поверхности стопы может остаться незамеченной длительное время. Дном язвы могут быть кости и сухожилия.
Самыми драматичным последствием СД и СДС является ампутация конечности на различных уровнях:
- малая ампутация — в пределах стопы;
- высокая ампутация — на уровне голени и бедра.
Также возможен летальный исход больного по причине гнойно-некротического процесса (сепсис или ТЭЛА).
Диагноз «СДС» устанавливается при первом хирургическом осмотре. Проводится дифференциальная диагностика между нейропатической и ишемической стопой.
Отсутствие боли в области язвы — один из характерных признаков нейропатической ДС.
Также необходимо отличать трофические расстройства от чувства онемения и зябкости: «носки», «чулки» до отсутствия всех видов чувствительности.
Для определения расстройства чувствительности, кроме градуированного камертона, можно использовать электронные инструменты: биотензиометр или нейротензиометр.
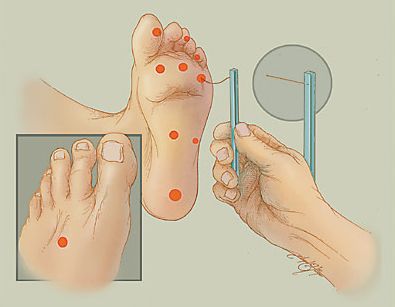
При триплексном сканировании артерий нижних конечностей выявляется:
- утолщение и кальциноз периферических артерий (синдром Менкеберга);
- изменение скорости кровотока — подтверждает ишемический характер СДС.
На практике достаточно описать вид тканей в области язвы на подошвенной поверхности стопы, головок плюсневых костей или ногтевых фаланг пальцев стоп.
Лечением диабетической стопы в большинстве случаев занимаются врачи-хирурги, однако также рекомендуются консультации таких врачей, как ортопед, травматолог, невролог, сосудистый хирург, дерматолог и подиатр.
На практике терапевт, эндокринолог или хирург устанавливает диагноз «Диабетическая стопа». На основании жалоб пациента, объективных и локальных данных врач назначает консультацию «узкого» специалиста и лечение.
Принципы лечения СДС:
- комплексный подход;
- отказ от самолечения;
- своевременное обращение к врачу — промедление в лечении может стать причиной ампутации или летального исхода пациента.
Недостаточно корригируемый уровень глюкозы в крови поддерживает высокую активность микроорганизмов в области язвенного дефекта, а углубление воспалительного процесса тканей в области язвы приводит к увеличению уровня глюкозы крови. Таким образом возникает «порочный круг» СДС: гипергликемия – инфекционный процесс – гипергликемия.
Постоянный контроль показателей крови и коррекция лечебных процедур более эффективны в стационарных условиях.
Пациентов с СДС в 80% случаев госпитализируют в хирургический стационар. Показаниями для этого служат:
- системные проявления инфекции (лихорадка, лейкоцитоз и др.);
- необходимость в коррекции глюкозы крови и ацидоза;
- клинические признаки ишемии;
- наличие глубокой и/или быстро прогрессирующей инфекции, некротического участка на стопе или гангрены;
- необходимость экстренного хирургического вмешательства или обследования;
- невозможность самостоятельного выполнения назначений врача или домашнего ухода.
Медикаментозное лечение
Существует несколько видов препаратов, применяемых при консервативном лечении СДС:
- инсулинотерапия;
- ангиопротекторы:
- замедляют образование фермента гиалуронидазы или подавляют активность ее производных;
- обладают антибрадикининовым свойством;
- способствуют угнетению агрегации тромбоцитов;
- активируют процесс образования мукополисахаридов в стенках капилляров;
- нормализуют проницаемость стенок сосудов;
- регулируют сосудистый тонус, восстановливают функции эндотелия, уменьшают оксидативный стресс и воспалительную реакцию;
- антиагреганты — ацетилсалициловая кислота («Аспирин», «Тромбо АСС», «КардиАСК», «Тромбопол») — подавляют активность циклооксигеназы, фермента, усиливающего реакции синтеза тромбоксана (фактора склеивания тромбоцитов);
- антидепрессанты и противосудорожные препараты;
- антибиотики — применяются на основании лабораторного анализа отделяемого из язвы и классификации инфекционных осложнений у пациентов с СДС по тяжести процесса.
- препараты, влияющие на обмен веществ — тиоктовая кислота и комплекс витаминов:
- ускоряют распространение импульсов по нервным волокнам;
- нормализуют кровообращение в тканях;
- избавляют от дефицита клеточных ферментов;
- выводят токсины из организма.
Эффективность всего комплекса медикаментозной терапии инфекции у пациентов с СДС по разным авторам составляет:[1][2][3][4]
- 80-90% при лёгкой и средней тяжести заболевания;
- 60-80% при тяжёлом течении.
Хирургическое лечение СДС
Оперативное вмешательство показано в следующих случаях:
- опасность распространения процесса от дистальных отделов конечности к проксимальным при условии неэффективной медикаментозной терапии;
- при ограничении положительного эффекта выраженной сухой гангреной части стопы или пальцев.
Хирург выбирает тактику проведения оперативного вмешательства исходя из клинической картины и формы инфицированности.
Физиотерапевтические методы лечения
Данный метод лечения предполагает ограниченное индивидуальное применение.
Физиотерапия часто проводится на стадии реабилитации после хирургического лечения. Она предполагает:
- нормализацию всех видов обмена веществ в организме и в тканях непосредственно;
- снижение уровня глюкозы в крови;
- нормализацию уровня иммунореактивного инсулина в крови;
- стимуляцию кровообращения и снижение воздействия антагонистов инсулина;
- снятие болей при ангиопатии и нейропатии.
К методам физиотерапии относятся:
- магнитотерапия — непосредственно влияет на обмен веществ при нейропатической форме ДС, так как магнитное поле обладает иммуно-стимулирующим, трофико-регуляторным и анестезирующим действием, укрепляя сосудистую стенку.
- УВЧ, теплотерапия;
- СМТ-терапия;
- светолечение;
- фонофорез.

Также лечение СДС предполагает:
- соблюдение специальной диеты;
- выполнение лечебной гимнастики;
- уход за кожей.
Неблагоприятному сценарию развития болезни способствуют следующие факторы:
- системные проявления инфекции;
- тяжёлые нарушения периферического кровотока в конечности;
- остеомиелит;
- некротические участки и гангрена;
- отсутствие квалифицированной хирургической помощи;
- распространение инфекции на более проксимальные отделы конечности.
Рецидивы в 20-30%, по большей части, характерны для пациентов с остеомиелитом.
Более 65% всех ампутаций проводится при диабетической стопе, однако своевременная профилактика и полноценное лечение может сберечь минимум 80% конечностей.
Своевременная диагностика и профилактика сахарного диабета за последнее десятилетие позволили уменьшить число ампутаций при СДС почти на 50%. Летальные исходы после ампутаций при СДС остаются на уровне 25-28%. Но при этом реальное количество больных СД в 3-4 раза выше, так как многие и не подозревают о том, что больны. Вероятность выявить таких больных во время предварительных и периодических медицинских осмотров очень велика.
Применяемая методика диспансеризации, неформальный подход к интерпретации анализов крови при периодических и предварительных медицинских осмотрах позволяет врачу-специалисту вовремя заподозрить нарушение углеводного обмена, а значит вовремя предотвратить развитие тяжёлых осложнений при сахарном диабете.
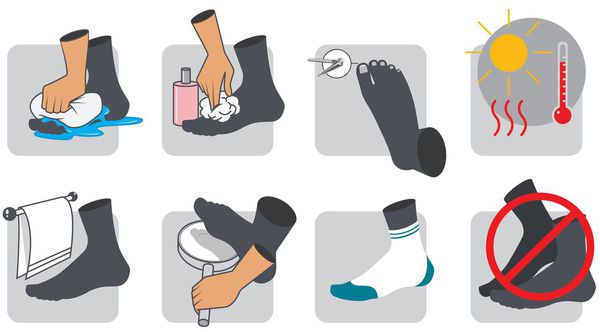
В качестве профилактики СДС, особенно людям с сахарным диабетом, необходимо:
- следить за уровнем сахара в крови;
- заниматься лечением СД;
- стараться не ходить босиком;
- носить ортопедическую обувь;
- не удалять появляющиеся мозоли;
- отказаться от вредных привычек (в частности, курения);
- избегать ожогов и переохлаждения стоп;
- ежедневно осматривать стопы для своевременного обнаружения трещин, шелушения и других признаков.
- Аметов А.С. Сахарный диабет 2 Типа: проблемы и решения. — М.: ГЭОТАР-Медиа, 2012.
- Майоров А.Ю., Суркова Е.В. Сахарный диабет1 Типа. — М.: Перспектива, 2007.
- Бреговский В.Г., Зайцев А.А. Поражение нижних конечностей при сахарном диабете. — М., 2004.
- Дедов И.И., Удовиченко О.В., Галстян Г.Р. Диабетическая стопа // Практическая медицина. — М., 2005.
- Славин Л.Е., Годжаев Б.Н., Анчикова Л.И. Синдром диабетической стопы // Практическая медицина. — 2008. -—№ 27. — С. 54-57.
- Wagner FW. A classification and treatment program for diabetic, neuropatic and dysvascular foot problems. // In The American Academy of Ortopaedic Surgeons instructional course lectures. — St. Louis. — Mosby Year Book. — 1979. — P. 143-165.
- Оболенский В.Н., Семенова Т.В., Леваль П.Ш., Плотникова А.А. Синдром диабетической стопы в клинической практике // Русский медицинский журнал. — 2010. — № 2. — С. 45.
- Armstrong DG, Lavery LA, Harkless LB: Validation of a diabetic wound classification system. Diabetes Care 21: 855-859,1998.
- Храмилин В.Н., Демидова И.Ю. Синдром диабетической стопы: Методическое пособие для самоподготовки слушателей циклов усовершенствования врачей. — М., 2004. — 54 с.
Источник
Среди осложнений сахарного диабета синдром диабетической стопы (СДС) занимает особое место. При всей универсальности патологии, связанной с нарушениями, вызванными диабетом, расстройства иннервации и кровоснабжения тканей стопы относятся к наиболее сложной проблеме. Эта категория больных, которых становится все больше и больше, вынуждена обращаться за помощью не только к терапевту, эндокринологу, но и к хирургу. И, как правило, это связано с появлением язвенно–некротических изменений на стопе, что свидетельствует о критической ишемии.
Успехи реконструктивной хирургии по ряду обстоятельств оказались гораздо скромнее ожидаемых при попытке восстановить проходимость артерий голени у больных с диабетической ангиопатией.
Мы поставили своей задачей изучить характер поражения дистальных артерий у больных с синдромом диабетической стопы в плане перспектив эндоваскулярной хирургии. Зная характер поражения периферических сосудов у таких больных, мы стремились разработать детали техники баллонной ангиопластики и стентирования. Проведено сравнение результатов лечения пациентов эндоваскулярными методами и традиционными методами у больных с синдромом диабетической стопы.
Материал и методы исследований
Под нашим наблюдением с 2006 по 2009 г. находились 102 пациента с сахарным диабетом (СД) 1 и 2 типов и синдромом диабетической стопы (СДС) в возрасте от 29 до 79 лет. У 54 пациентов в результате проведенной программы исследований выявлены показания к лечению эндоваскулярными методами. 48 пациентов методы эндоваскулярной хирургии применены не были. Обе группы были сопоставимы по основным демографическим параметрам, клиническим проявлениям СД и СДС. Мужчин было 69 (36 в 1–й и 33 во 2–й группе). В обеих группах сопутствующая медикаментозная терапия была комплексной и патогенетически обоснованной. Она включала коррекцию нарушений углеводного обмена, введение антиагрегантов (пентоксифиллин, дипиридамол) и введение Актовегина в дозе 1000 мг в сутки. Введение Актовегина начиналось за 5 дней до операции, в день операции и на следующий день доза увеличивалась до1500 мг, на 3–5–е сутки доза составляла 1000 мг в сутки.
Еще одну группу составили 98 пациентов, которые лечились по поводу сосудистых осложнений СДС с 2000 по 2005 г. Им проводились реконструктивные операции на сосудах нижних конечностях по поводу хронической артериальной недостаточности. Медикаментозное лечение этих больных не включало лечение Актовегином. По полу, возрасту, течению сахарного диабета и проявлениям артериальной недостаточности группы были идентичны.
Всем больным выполнялась диагностическая программа, включавшая исследования параметров гемостаза, реологических свойств крови, состояния регионарного кровотока в конечностях с использованием ультразвуковой допплерографии и дуплексного сканирования (ДС) артерий подвздошно-бедренно-берцового сегментов и стопы с расчетом лодыжечно-плечевого индекса (ЛПИ). Напряжение кислорода в I межпальцевом промежутке стопы определяли на кардиомониторе Solar во время ангиографии (АГ) до начала эндоваскулярного вмешательства (ангиографическая установка ANGIOSIGMA DAR 2400, SHIMADZU) в группе 1. Контрольное исследование проводилось на 3–и послеоперационные сутки.
Ниже приводим виды и количество эндоваскулярных вмешательств у 54 пациентов с СДС. Среди них у 25 была констатирована IIБ–III степень ишемии, у 29 – IV. Виды и количество эндоваскулярных вмешательств у 25 пациентов со IIБ–III степенью хронической недостаточности артериального кровообращения (ХАНК) приводим в таблице 1. У этих больных чрескожная баллонная транслюминальная ангиопластика (ЧБТА) и стентирование выполнялись на сегментах следующих артерий: поверхностной бедренной (ПБА), подколенной (ПкА), передней и задней большеберцовых (ПББА и ЗББА). При эндоваскулярных вмешательствах в основном мы использовали антеградный трансфеморальный доступ (48 больных), однако в 3 случаях был выбран контрлатеральный доступ. У 3 больных с патологической извитостью подвздошных артерий был применен трансаксиллярный доступ.
Из 29 больных с ишемией IV степени выполнить подобную операцию удалось у 27 (табл. 2).
У 35 были выполнены открытые реконструктивные операции: 25 пациентам со IIБ и III степенью ишемии и 10 – с IV степенью (табл. 3).
Ввиду отсутствия условий для реконструктивного вмешательства, комплексная консервативная терапия проведена 13 пациентам.
В обеих группах сопутствующая медикаментозная терапия была идентичной, комплексной и патогенетически обоснованной. Она включала коррекцию нарушений углеводного обмена, введение антиагрегантов и введение Актовегина в дозе 1000 мг в сутки. Введение Актовегина начиналось за 5 дней до операции, в день операции и на следующий день доза увеличивалась до1500 мг, на 3–5 сутки доза составляла 1000 мг в сутки.
Статистический анализ данных проводили с использованием программы STATISTICA 6.0 (StatSoft Inc., США).
Результаты исследований
Из 54 больных основной группы у 34 выявлены окклюзии ПБА и ПкА, у 20 – стенозы. При визуализации артерий подвздошно-бедренного и подколенного сегментов выраженных различий между ангиографическим и дуплексным исследованиями выявлено не было.
В артериях берцового сегмента, напротив, нами получены существенные различия между данными ДС и АГ. Так, у 9 пациентов с окклюзией ПБА или ПкА при ДС отмечалось отсутствие кровотока по ЗББА или ПББА. Однако при селективном введении контрастного препарата было получено контрастирование берцовых артерий у ряда больных.
Таким образом, из 68 артерий голени 34 пациентов с окклюзиями поверхностной бедренной и подколенной артерий в 18 (26%) случаях (у 9 больных) при ДС была ложно диагностирована окклюзия берцовых артерий.
Решающее значение в лечении рассматриваемых больных имеет наличие или отсутствие реальной окклюзии артерий голени (рис. 1 и 2).
Непосредственные результаты у больных обеих групп мы оценивали по модифицированной нами шкале R. Rutherford [13] (табл. 4). Суть изменений, внесенных в эту шкалу, состоит в замене показателя ЛПИ, неинформативного у лиц с СДС, на значения чрескожного напряжения кислорода (tcPO2). Нормальное значение tcP02 составляет 65 мм рт.ст., а значимое изменение – более 10 мм рт. ст. [1].
Приводим ближайшие результаты эндоваскулярных операций в группах больных с исходной степенью ишемии конечности IIБ–III. Восстановление магистрального кровотока достигнуто в 100% случаев. У всех 25 пациентов этот успех доказан ангиографически. Динамика степени ишемии после реваскуляризации показана в таблице 5.
Как видно из приведенных данных, у всех 25 больных наступило значительное улучшение, что выражалось в исчезновении боли в покое и значительном увеличении дистанции безболевой ходьбы, т.е. улучшилось качество жизни.
Что касается результатов открытых хирургических реконструкций у пациентов с такой же (IIБ–III) степенью ишемии, непосредственный положительный результат был достигнут также у всех у 25 пациентов (100%). Осложнения возникли у 2 больных, которым пришлось повторно выполнить тромбэктомию из зоны дистального анастомоза, после чего они были выписаны в удовлетворительном состоянии. У остальных пациентов ранний послеоперационный период протекал без осложнений.
Таким образом, в результате эндоваскулярных и открытых операций у больных с исходной степенью ишемии IIБ–III было достигнуто значительное и умеренное улучшение по шкале Rutherford (табл. 6).
Из 29 больных основной группы с ишемией IV степени путем баллонной ангиопластики магистральный кровоток удалось восстановить в 27 случаях (93 %). В раннем послеоперационном периоде одному пациенту с протяженной окклюзией (11 см) поверхностной бедренной артерии пришлось выполнить высокую ампутацию в связи с прогрессированием ишемии, несмотря на восстановление магистрального кровотока после ангиопластики. Таким образом, клиническое улучшение было достигнуто у 26 больных (89%). На рисунке 3 представлены фотографии стопы больной К. до и через 3 месяца после ангиопластики ПБА и ЗББА.
Реконструктивные сосудистые операции были выполнены у 10 пациентов с IV степенью ХАНК, у 13 пациентов, несмотря на отсутствие условий для реконструктивной операции, конечность была признана жизнеспособной и проводилась консервативная терапия.
Непосредственные результаты лечения всех пациентов с IV степенью ХАНК представлены в таблице 7.
Результаты лечения в отдаленном периоде (18 месяцев) изучены у пациентов обеих групп (102 пациента). Помимо клинического осмотра, ряду пациентов выполнялось ДС, определение tcPO2, в нескольких случаях потребовалась повторная ангиография.
Из 25 человек основной группы с исходной IIБ и III степенью ХАНК живы 23 пациента. Двум больным на 4 и 6–м месяце после вмешательства (стентирование ПБА) была выполнена тромбэктомия. В дальнейшем кровоток в конечности оставался магистральным в течение всего периода наблюдения. У 4 пациентов в сроки от 8 до 10 месяцев были обнаружены окклюзии в подколенной и берцовых артериях, проявляющиеся повышением класса ХАНК, снижением tcPO2 на 10 и более мм рт. ст. Еще у двух больных окклюзия возникла после баллонной ангиопластики подколенной артерии. Все нарушения артериальной проходимости были верифицированы во время ангиографии и подвергнуты эндоваскулярной коррекции с хорошим ангиографическим и клиническим эффектом.
У остальных 15 пациентов ухудшение состояния кровообращения по сравнению с ранним послеоперационным периодом не отмечалось.
В группе из 27 пациентов с IV степенью ХАНК через 18 месяцев живы 22. Все случаи смерти в отдаленном периоде были обусловлены другими осложнениями СД и не связаны с хирургическим вмешательством. Высокие ампутации в разные сроки отдаленного периода были выполнены 5 пациентам. Общее количество ампутаций, принимая в расчет 2 случая неудавшейся реваскуляризации, у пациентов с IV степенью ХАНК достигло 8 (36%).
В отдаленном периоде в группе сравнения у больных с II–Б и III степенью ХАНК первичная проходимость шунтов (без повторных вмешательств) составила 76%. В 6 случаях выполнены повторные вмешательства: тромбэктомия из шунта (3) и повторное шунтирование реверсированной аутовеной (3). В результате вторичная проходимость шунта составила 20%.
Первичная проходимость шунта в течение 18 месяцев у пациентов с IV степенью ХАНК составила 60%.
Пациентам, получавшим консервативную терапию, выполнены 3 высокие ампутации в разные сроки отдаленного периода.
При сравнении непосредственных результатов лечения в двух группах, одна из которых получала Актовегин в комплексной периоперационном лечении (102 пациента), а другая не получала (98 пациентов), мы установили повышение уровня чрескожного напряжения кислорода на 6–12 мм в процессе предоперационной подготовки и уменьшение клинических проявлений артериальной недостаточности в послеоперационном периоде (улучшение по шкале Rutherford).
Обсуждение
Стентирование поверхностной бедренной артерии, как и другие авторы [1-4,7,9], мы выполняли, если поражение не распространялось на подколенную артерию. При распространении поражения на подколенную артерии мы ограничивались только баллонной ангиопластикой всего бедренно-подколенного сегмента. В подколенной артерии мы принципиально ограничивались ангиопластикой, поскольку стентирование подколенной артерии чревато повреждением стента и дальнейшим тромбозом. При поражении артерий голени мы старались ограничиться оптимальной баллонной ангиопластикой, предложенной Graziani [8]. Суть этого метода заключается в медленном и продолжительном (в течение 180 с) раздувании баллона, покрывающего всю поврежденную интиму. Стентирование артерий голени выполняется только в случае возникновения диссекции. Такая техника значительно уменьшает риск рестеноза баллонированного сегмента.
Как показано выше, непосредственный успех эндоваскулярных операций составил 96%. Отдельные авторы [6,12,14] полагают, что шунтирующие операции на сосудах при СДС более эффективны в плане долговременных результатов, чем баллонная ангиопластика. Другие хирурги [6,7,9,12,13], напротив, считают целесообразным использование методов рентгеноангиохирургии у таких больных.
При сравнении результатов рентгенохирургических и открытых реваскуляризаций у наших пациентов с II–Б и III степенью ишемии различий по изучаемым критериям не выявлено. У 100% пациентов в обеих группах достигнуто значительное или умеренное улучшение кровотока в конечности. Вместе с тем следует подчеркнуть, что эндоваскулярные вмешательства легче переносятся пациентами, из–за отсутствия операционной травмы.
В отдаленном периоде в исследуемой группе больных с ишемией IIБ–III степени ампутаций не было. Первичная проходимость зоны стентирования сохранялась у 15 (65%). У остальных 8 пациентов (35%) с реокклюзией потребовалось повторное вмешательство, которое у всех было успешным.
В группе сравнения была выполнена 1 ампутация (4%). Первичная проходимость шунтов сохранялась у 19 больных (76%), повторная операция потребовалась 5 пациентам (20%).
Иные результаты были получены при сравнении категорий пациентов с IV степенью ХАНК. В исследуемой группе реваскуляризация была выполнена у 27 (93%) больных, непосредственный положительный результат получен у 26 (89%). Этот факт сам по себе подчеркивает имеющиеся возможности реваскуляризации у самых тяжелых категорий больных СД. Между тем в группе сравнения непосредственный положительный результат при той же тяжелой степени ишемии достигнут лишь у 12 больных– 52%.
Через 18 месяцев в исследуемой группе больных с исходной IV степенью ХАНК выполнено 5 ампутаций (20%). У 21 (80%) сохранялся магистральный кровоток в конечности. Однако в группе сравнения в течение этого срока конечность удалось сохранить только у 9 человек (39%).
Выводы
1. Ангиографическое исследование должно выполняться всем пациентам с сахарным диабетом, имеющим жалобы на боль в нижних конечностях, возникающую при ходьбе на расстояние менее 200 м. Тем более, это исследование должно выполняться при появлении язвенно–некротических дефектов на стопе.
2. Восстановление магистрального кровотока даже по одной из берцовых артерий приводит к редукции степени ишемии и заживлению язвенно–некротических дефектов.
3. Эффективность рентегенохирургических методов реваскуляризации у пациентов с II–Б–III степенью ишемии не уступает результатам открытых операций на сосудах. У пациентов с IV степенью ишемии результаты применения баллонной ангиопластики и стентирования лучше, чем после применения традиционных методов лечения этой категории больных.
4. Применение Актовегина в дозе 1000 мг в сутки в периоперационном периоде у больных сахарным диабетом способствует улучшению непосредственных результатов хирургического лечения.
Литература
1. Зеленов М,А., Ерошкин И.А., Жуков А.О., Коков Л.С., Светухин А.М., Покровский А.В. Баллонная ангиопластика и стентирование нижних конечностей больных сахарным диабетом. Диагностическая и интервенционная радиология. 2007; 1(4): 73–78.
2. Капутин М.Ю. Овчаренко Д.В., Сорока В.В. и соавт. Субинтимальная ангиопластика в лечении больных с критической ишемией нижних конечностей. Медицинский академический журнал. 2007; 6(3): 103–108.
3. Затевахин И.И., Шиповский В.Н., Золкин В.Н. Баллонная ангиопластика при ишемии нижних конечностей. М., Медицина. 2004; 159–163.
4. Шиповский В.Н.. Золкин В.Н., Магомедов Ш.Г. Баллонная ангиопластика артерий голени. 2008; 2(4): 55–62.
5. Adam D.J., Beard J.D., Clevelend T.T. Bypass versus angioplasty in severe ischemia of leg (BASIL): multicentre, randomized controlled trial. Lancet. 2005;366 (9501): 1925–1934.
6. Blair J.M., Gewertz B.L., Moosa H.,Lu C. T., Zarris , Percutaneous transluminal angioplasty versus surgery for limb–threatening ischemia. J. Vasc.Surgery. 1989; 9 (5):698–703.
7. Faglia E., Clerici G., Caminiti M., Quarantiello A., Curci V., Morabito A. predictive values of transcutaneus oxygene tension for above–the–ankle amputation in diabetic patients with critical limb ischemia. Eur. J. Vasc. Endovasc. Surg. 2007; 33:731–736.
8. Graziani L., Silvestro A., Bertone V., Manara E., Alicandry A., Parrinello G., Manganoni A., Percutaneous transluminal angioplasty is feasible and effective in patients on chronic dialysis with severe peripheral artery disease. Nephrol. Dial. Transplant. 2007; 22(4): 1144–1149.
9. Inter–Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur. J. Vasc. Endovasc. Surg. 2007; 33: Suppl. 1
10. Molloy K.J., Nasym A., London N.J., Naylor A.R., Bell P.R., Fishwick G., Bolia A., Thompson M.M. Percutaneous transluminal angioplasty in the treatment of critical limb ischemia. J. Endovasc. therapy. 2003; 10 (2): 298–303.
11. Nasr M.K., McCarthy R.J., Hardman J., Chalmers A., Horrocks M. The increasing role of percutaneous transluminal angioplasty in the primary management of critical limb ischemia. Eur. J. Vasc. Endovasc. Surg. 2002; 23 (5): 398–403.
12. Parson R.E., Suggs W.D, Lee J.J., Sanchez L.A., Lyon R.T., Veith F.J. Percutaneous transluminal angioplasty for the treatment of the limb threatening ischemia: do the results justify an attempt before bypass grafting? J. Vasc.Surgery. 1998; 28 (6): 1066–1071.
13. Rutherford R.B., Durham J. Percutaneous balloon angioplasty for arteriosclerosis obliterans: Long–term results. In Pearce W.H. (eds). Technologies in vascular Surgery. 1992; 32–345.
14. Treiman G.S, Treiman R.L., Ichikawa L., Van Allan R. ,Should percutaneous transluminal angioplasty be recommended for treatment of infrageniculate popliteal artery or tibioperoneal trunk stenosis? J. Vasc.Surgery. 1995; 22 (4): 457–463, 464–465.
Источник
