Острая полинейропатия синдром гийена барре
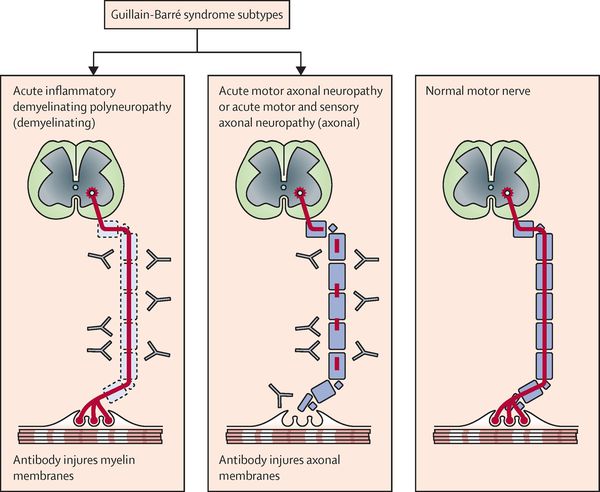
Синдром Гийена-Барре (СГБ) (острая воспалительная демиелинизирующая полинейропатия, синдром Гийена-Барре-Штроля, французский полиомиелит, восходящий паралич Ландри) – собирательный термин аутоиммунных заболеваний, характеризующихся острым демиелинизирующим поражением периферической нервной системы с развитием обратимой мышечной слабости и нарушением чувствительности. По МКБ -10 код диагноза – G61.0
Эпидемиология заболевания: 1-2 случая на 100000 населения, заболеванию подвержены люди всех возрастных категорий, однако чаще болезнь развивается в возрасте от 30 до 50 лет, мужчины страдают несколько чаще женщин.
Патогенез
Провоцирующим развитие болезни фактором является:
- бактериальная (кампилобактерия), вирусная (вирус Эпштейна-Барр, цитомегаловирус, вирус гриппа) или микоплазменная инфекция;
- ВИЧ-инфекция, СКВ, злокачественные новообразования, которые запускают аутоиммунный процесс, в результате чего активируется процесс воспаления с образованием иммунных комплексов, которые повреждают оболочки нерва или аксональный стержень.
- Патогенез
- Классификация
- Клиническая картина
- Диагностика
- Дифференциальный диагноз
- Лечение
- Прогноз заболевания
[/dt_sc_contents]
Классификация
СГБ с типичными клиническими проявлениями:
- Демиелинизирующая форма (около 90% случаев заболевания) – в основе заболевания острая демиелинизация корешков спинномозговых и черепно-мозговых нервов.
- Аксональная форма (встречается значительно реже) – характерно поражение аксонов нервов, течение заболевания значительно тяжелее. Она делится на 2 вида:
– острая моторная – отличительная особенность: страдают только двигательные волокна.
– острая моторно-сенсорная – сочетание поражения чувствительных и двигательных волокон.
СГБ с атипичной клинической картиной:
- Синдром Миллера-Фишера – вариант СГБ, характеризующийся триадой симптомов: офтальмоплегия (паралич мышц глаза), арефлексия (снижение, а затем выпадение рефлексов), атаксия мозжечкового типа (нарушение координации движения).
- Острая сенсорная полинейропатия – сочетание выраженных нарушений чувствительности и нарастающей сенситивной атаксии (нарушение походки и координации движений вследствие страдания мышечно-суставной чувствительности).
- Острая пандизавтономия – характеризуется вовлечением в процесс как симпатической, так и парасимпатической частей автономной нервной системы, вследствие чего возникает симптомокомплекс: ортостатическая гипотензия, нарушение моторики ЖКТ вплоть до гастропареза, нейрогенные нарушения мочеиспускания, нарушение аккомодации и зрачковых реакций, нарушение работы слюнных желез. Нарушение потоотделения и др.
- Острая краниальная полиневропатия – отличается вовлечением в процесс изолированно черепных нервов.
- Фаринго-цервико-брахиальная форма – характеризуется нарушением функции мышц глотки, рук и сгибателей шеи.
- Парапаретический париант – заболеванию подвергаются нижние конечности, а верхние остаются незатронутыми.
Клиническая картина
- Первыми клиническими проявлениями зачастую являются парестезии (онемение, «жжение», «покалывание») и боли в кистях и стопах, реже в области рта и языка.
- После этого присоединяется общее недомогание, субфебрильное повышение температуры.
- Далее проявляется прогрессирующая мышечная слабость (максимальная выраженность развивается к 4-5 неделе), которая имеет ряд особенностей:
– Симметрична, как и при других полинейропатиях.
– Восходящий характер (сначала страдают нижние конечности, затем в процесс вовлекаются верхние конечности).
– Вовлечение в патологический процесс мимической мускулатуры с двух сторон в 70%.
– Более редким, но вместе с тем более опасным является вовлечение глотательных и дыхательных мышц; также иногда возникают глазодвигательные нарушения.
- Ослабление рефлексов и полное их выпадение.
- Вегетативные нарушения (ортостатическая гипотензия, наджелудочковая тахиардия, похолодание и зябкость кистей и стоп, акроцианоз, повышенное потоотделение и гаперкератоз подошв).
- Резкое снижение вплоть до утраты вибрационной и проприоцептивной чувствительности.
Следует знать, что диагностическими критериями заболевания является симметричный прогрессирующий парез в конечностях в сочетании с арефлексией, появляющиеся к 4-5 недели заболевания (хотя нередко заболевание достигает пика своей тяжести уже ко 2-3 неделе).
В пользу синдрома Гийена-Барре в диагностическом поиске врача должны направить и такие признаки как: прогрессирование симптоматики до 4 недель, белково-клеточная диссоциация в ликворе, симметричность симптомов, наличие легких чувствительных нарушений, изменения по ЭМГ (но следует помнить, что это не облигатные признаки заболевания)
Фазы течения заболевания:
- Фаза прогрессирования обычно составляет 2-4 недели и характеризуется нарастанием указанных симптомов. Если данная фаза заняла временной промежуток от 4 до 8 недель, тогда полинейропатия носит название подострой воспалительной демиелинизирующей полинейропатии. Если же данная фаза составила более 8 недель, заболевание приобретает статус хронического.
- Фаза плато – составляет от 1 до 4 недель, и характеризуется стабилизацией состояния больного.
- Фаза восстановления чаще продолжается несколько недель, а иногда и месяцев и характеризуется регрессом симптоматики и восстановлением двигательной функции.
Диагностика

- Тщательный сбор анамнеза на предмет перенесенной инфекции, прививок.
- ЭМГ – не всегда является информативной, так как нередко на первых неделях в пределах нормы. Типичными изменениями являются:
– при острой воспалительной демиелинизирующей полинейропатии: снижение скорости проведения импульса по двигательным нервам, блок проведения проксимального типа, увеличение латентности F-волн.
– про острой сенсо-моторной аксональной полинейропатии: снижение амплитуды суммарных потенциалов действия двигательных мышц и сенсорных нервных волокон, признаки демиелизации максимум в 1 нерве.
– при острой моторной аксональной полинейропатии: снижение амплитуды суммарных потенциалов действия двигательных мышц, сенсорные волокна остаются интактными, демиелинизация также максимум в 1 нерве.
– при острой сенсорной полинейропатии: двигательные волокна не подвержены страданию, отмечается снижение амплитуды суммарных ПД сенсорных нервов.
- Исследование ликвора: белково-клеточная диссоциация. В первые дни, однако, ее не всегда удается обнаружить, потому исследование ликвора должно проводиться в динамике. При этом следует помнить, что возможны ложноположительные результаты при внутривенном введении иммуноглобулинов.
- МРТ головного мозга и позвоночника позволяет увидеть изменения в корешках, но в большей степени данный метод используют при дифференциальном диагнозе опухолей, ОНМК.
- Анализы крови: обнаружение антител в крови
– при острой воспалительной демиелинизирующей нейропатии – антитела неизвестны
– при острой моторной аксональной нейропатии – GM1+GM1b, GD1a
– при острой моторно-сенсорной аксональной нейропатии – GM1+GM1b, GD1a
– при острой сенсорной нейропатии – GD1b
– при синдроме Миллера-Фишера – GQ1b.
Дифференциальный диагноз
- Спинальная форма полиомиелита. В начале заболевания могут быть менингеальные знаки; затем развиваются асимметричные вялые парезы и параличи, снижение сухожильных рефлексов только на пораженной стороне, практически нет чувствительных и вегетативных нарушений. В настоящее время, учитывая вакцинацию против полиомиелита, заболевание встречается редко и диф. диагноз проводить с данным заболеванием приходится все реже.
- Опухоль спинного мозга. Общее с синдромом Гийена-Барре: клиническая картина и изменения в ЦСЖ. Отличия: развивается чаще постепенно, парез носит спастический характер, обнаруживаются пирамидные знаки.
- Полинейропатия при острой перемежающейся порфирии. Характеризуется началом с вегетативными нарушениями: боли в животе, запоры и диарея, учащенное сердцебиение, повышение АД. Также при данной патологии наблюдаются психические расстройства, такие как тревога, депрессия, в более тяжелых случаях – делирий и судорожный синдром. Полинейропатия носит своеобразный характер: первыми вовлекаются верхние конечности, начиная с проксимальных отделов; сухожильные рефлексы дольше остаются сохранными, а нарушения чувствительности возникают реже и более легкие по своей выраженности.
- Инсульт ствола головного мозга. Заболевание чаще манифестирует с жалоб со стороны головы: головные боли, головокружения, сопровождаемые тошнотой и рвотой, нарушение речи. Затем присоединяются альтернирующие синдромы, характеризующиеся поражением ЧМН на стороне патологического процесса и двигательными или чувствительными нарушениями конечностей и тела на противоположной стороне.
Лечение
Общетерапевтические мероприятия:
- Учитывая возможность развития дыхательной недостаточности, необходим контроль ЖЕЛ и ЧДД, возможен перевод пациента на ИВЛ.
- При нарушениях глотания с риском аспирации – установка назогастрального зонда.
- Необходимо выполнение ЭКГ в динамике, так как одним из осложнений болезни является срыв сердечного ритма. При этом врачу надо быть готовым к выполнению маневра Вальсавы, а также медикаментозной и электрокардиоверсии.
- При нарушениях мочеиспускания – выполняют катетеризацию мочевого пузыря.
Специальное лечение:
- Внутривенное введение иммуноглобулинов (ВВИГ) – метод выбора.
- Плазмаферез – долгое время занимал ведущее место в лечении болезни Гийена-Барре, однако учитывая соматическую отягощенность пациентов, данный метод несколько хуже предыдущего из-за более тяжелой переносимости ее.
Сочетание этих двух методов не дает большего терапевтического эффекта, чем монотерапия ВВИГ или методом плазмафереза.
Прогноз заболевания
У большинства пациентов исходе заболевания полное выздоровление (80% случаев), остаточные явления со снижением мышечной силы и нарушением ходьбы наблюдаются у 10-14% больных, около 5% пациентов умирают от таких осложнений как ТЭЛА, пневмония, аритмия. У небольшой части больных возможен рецидив, иногда с переходом в хроническую форму.
Источник
Дата публикации 26 февраля 2018Обновлено 23 июля 2019
Определение болезни. Причины заболевания
Синдром Гийена-Барре (ГБС) — острое аутоиммунное заболевание периферической нервной системы, характеризующееся мышечной слабостью. Это расстройство охватывает группу острых нарушений периферической нервной системы. Каждый вариант характеризуется особенностями патофизиологии и клинического распределения слабости в конечностях и черепных нервах.
У 70% пациентов с ГБС наблюдалось предшествующее инфекционное заболевание перед появлением неврологических симптомов.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы синдрома Гийена — Барре
Симптомы ОРВИ или расстройства желудочно-кишечного тракта отмечаются у 2/3 пациентов. Первыми симптомами ГБС являются парестезии пальцев конечностей, за которыми следует прогрессирующая слабость мышц нижних конечностей и нарушения походки. Болезнь прогрессирует в течение нескольких часов или дней, возникает слабость верхних конечностей и развиваются паралич черепных нервов. Параличи обычно симметричны и носят, конечно, периферический характер. У половины пациентов боль может быть первоначальной жалобой, что затрудняет диагноз. Атаксия и боль чаще встречаются у детей, чем у взрослых. Задержка мочи наблюдается у 10%-15% больных. Поражение вегетативных нервов проявляются головокружениями, гипертонией, чрезмерным потоотделением и тахикардией.
При объективном обследовании выявляется восходящая мышечная слабость, а также арефлексия. Сухожильные рефлексы нижних конечностей отсутствуют, но рефлексы верхней конечности могут вызываться. Мышечная слабость может задействовать и респираторные мышцы. Поражение черепных нервов отмечается в 35-50%, вегетативная нестабильность в 26%-50%, атаксия — в 23%, дизестезия — в 20% случаев.[1]
Наиболее распространенными признаками вегетативной дисфункции являются синусовая тахикардия или брадикардия и артериальная гипертония. У пациентов с тяжелой вегетативной дисфункцией наблюдаются изменения периферического вазомоторного тонуса с гипотензией и лабильностью артериального давления.
Нечастые варианты клинического течения болезни включают лихорадку в начале неврологических симптомов, тяжелую сенсорную недостаточность с болью (миалгии и артралгии, менингизм, корешковая боль), дисфункции сфинктеров.
Возможность ГБС должна рассматриваться у любого пациента с быстрым развитием острой нервно-мышечной слабости. На ранней стадии ГБС следует отличать от других заболеваний с прогрессирующей симметричной мышечной слабостью, включая поперечный миелит и миелопатию, острую токсическую или дифтеритическую полиневропатию, порфирию, миастению и нарушения электролитного обмена (например, гипокалиемия).
Патогенез синдрома Гийена — Барре
Нейрофизиологические процессы, лежащие в основе ГБС, подразделяются на несколько подтипов. Наиболее распространенные подтипы включают:
- острую воспалительную демиелинизирующую полирадикулопатию;
- острую двигательную аксональную невропатию;
- острую моторную и сенсорную аксональную нейропатию;
- синдром Миллера-Фишера, как вариант ГБС, характеризуется триадой признаков: офтальмоплегия, атаксия и арефлексия.
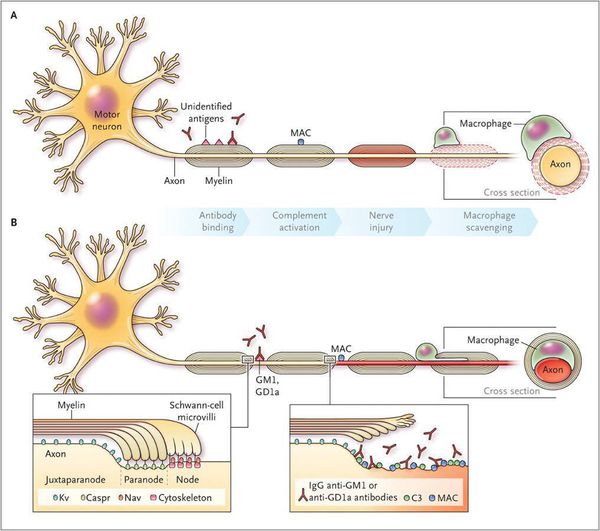
Считается, что ГБС развивается вследствие выработки антител против белка инфекционного агента, которые перекрестно реагируют с ганглиозидами нервных волокон человека. Аутоантитела связываются с миелиновыми антигенами и активируют комплемент, с формированием мембранно-атакующего комплекса на внешней поверхности клеток Шванна. Повреждение оболочек нервных стволов приводит к нарушениям проводимости и мышечной слабости (на поздней стадии может происходить и аксональная дегенерация). Демиелинизирующее поражение наблюдается по всей длине периферического нерва, включая нервные корешки.

Поражаются все типы нервов, в том числе вегетативные, моторные и сенсорные волокна. Вовлечение двигательных нервов происходит значительно чаще, чем сенсорных.
Осложнения синдрома Гийена — Барре
Пациенты с ГБС подвержены риску опасных для жизни респираторных осложнений и вегетативных нарушений.
Показания для перевода в отделение интенсивной терапии включают:
- быстрое прогрессирование моторной слабости с поражением респираторных мышц;
- вентиляционную дыхательную недостаточность;
- пневмонию;
- бульбарные расстройства;
- тяжелую вегетативную недостаточность.
Осложнения проводимого лечения, требующие интенсивной терапии, включают перегрузку жидкостью, анафилаксию на введение внутривенного иммуноглобулина или гемодинамические нарушения при проведении плазмафереза.
У 15%-25% детей с ГБС развивается декомпенсированная дыхательная недостаточность, которая требует механической вентиляции легких.[2] Респираторные нарушения чаще встречается у детей с быстрым прогрессированием заболевания, слабостью верхних конечностей, вегетативной дисфункцией и поражениями черепных нервов. Интубация трахеи может потребоваться у больных для защиты дыхательных путей, проведения механической вентиляции легких. При ГБС быстрое прогрессирование, двусторонний паралич лицевого нерва и вегетативная дисфункция предопределяют повышенную вероятность интубации. Необходимо планирование ранней интубации для минимизации риска осложнений и необходимости проведения экстренной интубации.
Вегетативная дисфункция повышает риск эндотрахеальной интубации. С другой стороны, дисавтономия может увеличить риск гемодинамических реакций на препараты, используемые для индукции анестезии во время интубации.
Признаки, указывающие на необходимость механической вентиляции легких:[4]
- вентиляционная дыхательная недостаточность;
- увеличение потребности в кислороде для поддержания SpO2 выше 92%;
- признаки альвеолярной гиповентиляции (PCO2 выше 50 мм. рт. ст.);
- быстрое снижение жизненной емкости на 50% по сравнению с исходным уровнем;
- невозможность кашля
Вегетативная дисфункция является основным фактором смертности при ГБС. Фатальный сердечно-сосудистый коллапс из-за вегетативной дисфункции наблюдается у 2%-10% тяжелобольных пациентов.[3] Мониторинг частоты сердечных сокращений, артериального давления и электрокардиограммы следует продолжать до тех пор, пока пациенты нуждаются в респираторной поддержке. Чрескожная кардиостимуляция может потребоваться при выраженной брадикардии. Гипотония корректируется восполнением объема циркулирующей крови (ОЦК), и, если пациент невосприимчив к восполнению ОЦК, применяются α-агонисты, такие как норадреналин, мезатон, адреналин.
При нестабильной гемодинамике непрерывная регистрация артериального и центрального венозного давления должна проводиться для контроля объема инфузионной терапии.
Артериальная гипертензия может возникать, но это осложнение не требует специального лечения, если оно не осложняется отеком легких, энцефалопатией или субарахноидальным кровоизлиянием.
Диагностика синдрома Гийена — Барре
Инструментальная диагностика
Люмбальная пункция
При люмбальной пункции результаты СМЖ обычно показывают повышенный уровень белка (> 45 мг/дл), без плеоцитоза (<10 клеток/мм3) (белково-клеточная диссоциация). Иногда уровень белка может оставаться нормальным, при умеренном повышении количества клеток (10-50 клеток/мм3). Цитоз выше, чем 50 клеток/мм3, свидетельствует против диагноза ГБС. В ряде случаев могут быть необходимы повторные люмбальные пункции для уточнения диагноза.
Нейрофункциональная диагностика
ЭНМГ (Электронейромиография) — единственный инструментальный метод диагностики, позволяющий подтвердить диагноз ГБС и уточнить характер патологических изменений (демиелинизирующий или аксональный) и их распространенность.[3]
Игольчатая электромиография характеризуется наличием признаков текущего денервационно-реиннервационного процесса при полинейропатии. Исследуют дистальные мышцы верхних и нижних конечностей (например, переднюю большеберцовую мышцу, общий разгибатель пальцев), а при необходимости и проксимальные мышцы (например, четырёхглавую мышцу бедра).
ЭНМГ-исследование у больных с ГБС зависит от клинических проявлений:
- при дистальных парезах исследуются длинные нервы на руках и ногах: не менее четырех двигательных и четырех чувствительных (двигательные и чувствительные порции срединного и локтевого нервов; малоберцовый, большеберцовый, поверхностный малоберцовый и икроножный нервы с одной стороны).
Оценка основных ЭНМГ- параметров:
- моторные ответы (дистальная латентность, амплитуда, форма и длительность), наличие блоков проведения и дисперсии ответов; анализируется скорость распространения возбуждения по моторным волокнам на дистальных и проксимальных участках.
- сенсорные ответы: амплитуда и скорость проведения возбуждения по сенсорным волокнам в дистальных отделах.
- поздних ЭНМГ-феноменов (F-волн): анализируются латентность, форма и амплитуда ответов, величина хронодисперсии, процент выпадений.
- при проксимальных парезах обязательным является исследование двух коротких нервов (подмышечного, мышечно-кожного, бедренного и др.) с оценкой параметров моторного ответа (латентности, амплитуды, формы).
Первые признаки денервационного процесса появляются через две-три недели после начала заболевания, признаки реиннервационного процесса — через месяц.
Лечение синдрома Гийена — Барре
Общее поддерживающее лечение и уход
Пациенты, требующие интенсивной терапии, требуют тщательного общего ухода. Запор наблюдается более чем в 50% случаев пациентов с ГБС в результате динамической непроходимости кишечника.
При боли применяют парацетамол. Катадолон и трамадол применяют при выраженном болевом синдроме. При нейропатической боли эффективны карбамазепин и габапентин.
В лечении ГБС предпринимаются различные виды иммуномодулирующей терапии.[1][2]
Внутривенный иммуноглобулин назначают в виде ежедневной инфузии (в дозе 0,4 гр/кг/день) в течение 5 дней в первые 2 недели болезни. Второй курс иммуноглобулина может потребоваться 5%-10% пациентов, при отрицательной динамике после первоначального улучшения. Механизм действия внутривенного иммуноглобулина, вероятно, многофакторный и, как полагают, включает модуляцию активации комплемента, нейтрализацию идиотипических антител, подавление воспалительных медиаторов (цитокины, хемокины).
Побочные эффекты иммуноглобулина включают головную боль, миалгию и артралгию, гриппоподобные симптомы, лихорадку. У пациентов с дефицитом IgA может развиться анафилаксия после первого курса внутривенного иммуноглобулина.
Плазмаферез способствует удалению антител, вовлеченных в патогенез ГБС. В течение каждого сеанса 40-50 мл/кг плазмы заменяют смесью 0,9% раствора хлорида натрия и альбумина. Проведение плазмафереза приводит к сокращению времени выздоровления и снижению потребности в искусственной вентиляции. Эти преимущества очевидны, если плазмаферез проводится в течение первых двух недель после начала болезни. Осложнения, связанные с плазмаферезом, включают гематому в области венопункции, пневмоторакс после катетеризации подключичной вены и сепсис. Плазмаферез противопоказан пациентам с тяжелой гемодинамической нестабильностью, кровотечением и сепсисом.
Комбинация плазмафереза и иммуноглобулина не показала клинических преимуществ.
Кортикостероиды не должны использоваться при лечении ГБС, т. к. не ускоряют выздоровление, не уменьшают вероятность ИВЛ и не влияют на долгосрочный результат.[2]
Прогноз. Профилактика
ГБС остается серьезным заболеванием, несмотря на улучшение результатов лечения. По сравнению со взрослыми, у детей чаще отмечается более благоприятное течение заболевания, с полным, а не частичным выздоровлением. Причинами неблагоприятного исхода при ГБС являются дыхательная недостаточность, осложнения искусственной вентиляции легких (пневмония, сепсис, острый респираторный дистресс-синдром и тромбоэмболические осложнения), остановка сердца, вторичная по отношению к дисавтономии.
Восстановление обычно начинается через две-четыре недели после прекращения прогрессирования симптомов. Среднее время от начала заболевания до полного выздоровления составляет 60 дней. Данные относительно долгосрочного исхода ГБС ограничены. 75% – 80% пациентов полностью выздоравливают. Около 20% пациентов не могут ходить через полгода.
Младшая возрастная группа (менее 9 лет), быстрое прогрессирование и максимальная мышечная слабость, потребность в искусственной вентиляции легких являются важными предикторами длительного двигательного дефицита.[4]
Источник
