Острый тромбоз синдром педжета шреттера
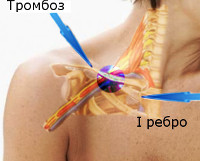
Синдром Педжета-Шреттера – это первичный тромбоз подключичной вены, связанный с интенсивной и повторяющейся нагрузкой на верхние конечности. Заболевание достаточно редкое, но характерное для физически активных молодых людей и ассоциированное с риском осложнений. Проявляется отеком, изменением кожной окраски, чувством распирания, болью, расширением подкожной венозной сети. Верификация диагноза проводится инструментальными методами – с помощью УЗДС, флебографии, МР- и КТ-ангиографии подключичной зоны. Лечение основано на сочетании консервативных и оперативных методик (антикоагулянты, селективный тромболизис, декомпрессионные техники).
Общие сведения
Синдром Педжета-Шреттера (тромбоз усилия или перенапряжения) назван в честь английского хирурга Д. Педжета, впервые подробно описавшего случай отека и синюшности верхней конечности (1875 г.), и австрийского отоларинголога Л. Шреттера, который в 1884 году высказал предположение о связи нарушений с повреждением вены на фоне мышечного напряжения. Заболевание составляет 30–40% спонтанных тромбозов подключично-подмышечного сегмента и 10–20% всех флеботромбозов верхних конечностей. Для общей популяции патология достаточно редкая – встречается у 1–2 человек на 100 тыс. населения в год. Обычно болеют молодые люди в возрасте от 20 до 30 лет (мужчины в 2–4 раза чаще), хотя зафиксированы случаи патологии даже у стариков и детей.

Синдром Педжета-Шреттера
Причины
Тромбоз перенапряжения обычно возникает при занятиях видами спорта, предполагающими постоянные и энергичные движения в плечевом поясе (с ретроверсией, гиперабдукцией, разгибанием руки) – борьбой и другими единоборствами, гимнастикой, плаванием. Ему подвержены баскетболисты, хоккеисты, игроки в бильярд. Аналогичная ситуация характерна для лиц, занимающихся физическим трудом (маляров, автослесарей, грузчиков, рабочих сталелитейных цехов). От 60% до 80% пациентов сообщают о наличии в анамнезе энергичных упражнений либо интенсивной мышечной работы.
Хотя заболевание имеет первичный характер, существуют определенные предпосылки для его развития. Доказана роль некоторых анатомических особенностей, способствующих повреждению (шейное ребро, врожденные спайки, гипертрофия сухожилий лестничных мышц, аномальное прикрепление реберно-ключичной связки). Они ограничивают подвижность подключичной вены, делая ее более восприимчивой к механической травматизации и сдавлению от физического усилия с участием плечевого пояса.
В отличие от флеботромбозов иной локализации (нижних конечностей, висцеральных), роль наследственных и приобретенных тромбофилий в развитии и прогрессировании синдрома Педжета-Шреттера остается неясной. Некоторые авторы описывают более высокую частоту мутаций фактора V Лейдена и протромбина, выявляя их у 2/3 пациентов с первичным поражением подключичного сегмента. Другие исследователи опровергают подобную связь, показывая, что встречаемость коагулопатий сопоставима с таковой в популяции.
Патогенез
Сужение венозного просвета опосредовано наружной компрессией гипертрофированной мускулатурой плечевого пояса (передней лестничной, подключичной, подлопаточной, большой грудной мышцами) с вовлечением костно-сухожильных образований, ограничивающих промежуток между сосудом и I ребром. Это создает чрезмерную нагрузку, приводящую к микротравме эндотелия с активацией коагуляционного каскада.
Морфологическую основу синдрома составляют нарушения в концевом отделе вены. Хроническая травматизация и гипоксия запускают гиперплазию интимы и синтез соединительнотканных волокон. Под влиянием фиброзных изменений сосудистая стенка становится ригидной, в ней развивается асептический флебит с пристеночным тромбообразованием.
Постоянная компрессия запускает патологический процесс в паравазальной клетчатке. Рыхлая соединительная ткань в окружении сосуда заменяется рубцовой. В результате вена становится менее подвижной, что лишь повышает риск дальнейшей травмы эндотелия. Стенка растягивается и повреждается всякий раз, когда изменяется диаметр реберно-ключичного пространства.
Прохождение циклов альтерации, локального воспаления, тромбирования и реканализации постепенно усиливает внутрисосудистые дефекты, ограничивая кровоток и приводя к стазу. Негативное воздействие сначала снижается благодаря образующимся коллатералям, но в дальнейшем пристеночные тромбы распространяются на смежные сегменты (подмышечный, плечевой).
Классификация
Тромбоз усилия в клинической флебологии относят к венозному варианту грудного компрессионного синдрома. Существует классификация по клиническому течению, согласно которой процесс проходит острую, подострую, хроническую стадии. Первая имеет несколько степеней тяжести, объективно различаемых по уровню венозной гипертензии в дистальных сегментах (в мм вод. ст.):
- Легкая (до 300 mm H2O). Внутрисосудистые нарушения носят ограниченный характер. Благодаря развитым коллатералям симптомы нарастают медленно и выражены слабо. Функция руки не страдает.
- Средняя (от 400 до 800 mm H2O). Присутствует распространенный флеботромбоз. Признаки венозной недостаточности сочетаются с артериальным спазмом. Нарушается функция верхней конечности.
- Тяжелая (до 1200–1300 mm H2O). Наблюдается переход тромботического процесса на подмышечную и плечевую зоны. Симптоматика резко выражена.
Давление в венах при хроническом течении патологии повышается умеренно. Перед острой стадией иногда наблюдается продромальный период, обусловленный постепенно прогрессирующим стенозом сосудистого просвета. Чем он короче, тем интенсивнее симптоматика флеботромбоза.
Симптомы
Заболевание развивается остро, на протяжении 24 часов после тяжелой физической нагрузки или движений с отведением и ротацией плеча наружу. Реже симптомы возникают без связи с какими-либо провоцирующими факторами. Обычно вовлекается правая (доминантная) конечность. Наиболее типичным признаком становится отек на стороне поражения с тенденцией к быстрому прогрессированию, нередко распространяющийся на верхнюю часть груди. После надавливания ямки не остается, что свидетельствует о венозном и лимфатическом застое со скоплением жидкости в подкожной клетчатке.
Асимметрия конечности в объеме и мышечной массе дополняется слабостью, чувством тяжести и напряжения, синюшностью (реже бледностью), повышением локальной температуры кожных покровов. Пациентов беспокоят ноющие боли различной интенсивности, отдающие в аксиллярную область. Сначала в локтевой ямке, а затем на плече, передневерхнем участке грудной стенки, у основания шеи заметны расширенные коллатерали (признак Уршеля). В аксиллярно-плечевой зоне может пальпироваться плотный болезненный тяж.
Несмотря на выраженные местные проявления, общее состояние не нарушается. Острые симптомы сохраняются в течение 1–3 недель, после чего процесс переходит в хроническую стадию. Пациенты отмечают чувство утомляемости и распирания в руке. Подкожные коллатерали становятся менее заметными, сохраняется умеренная плотность тканей.
Осложнения
Среди осложнений синдрома Педжета-Шреттера отмечают рецидивирующий тромбоз, эмболию легочной артерии, посттромботическую болезнь. Хотя некоторые исследования показывают более низкую частоту легочной эмболизации по сравнению с флеботромбозами нижней половины тела и катетер-ассоциированными поражениями, но вероятность опасного состояния все же представляется реальной и достаточно значимой. Распространенность посттромботической болезни при первичном процессе выше – до 46% случаев. Исключительно редко в остром периоде может возникнуть венозная гангрена.
Диагностика
Клинические признаки синдрома Педжета-Шреттера имеют сравнительно низкую специфичность. Лишь у половины пациентов при наличии явной симптоматики диагностируют флеботромбоз. В таких условиях исключительной важностью наделяются дополнительные методы:
- Ультразвуковое дуплексное сканирование вен. УЗДС признано лучшим способом начальной визуализации тромботических масс в подключичном сегменте. Обладая высокой чувствительностью (78–100%) и специфичностью (82–100%), позволяет дифференцировать свежий тромб от хронического, определить параметры кровотока в месте сужения, оценить процесс реканализации, выявить коллатерали. Трудности могут возникнуть при интимном расположении сосуда под ключицей, наличии фиброзно-измененных участков.
- МРТ и КТ с контрастированием сосудов. Магнитно-резонансная ангиография показывает высокую информативность при окклюзирующих тромбах, но плохо визуализирует пристеночные и «короткие» сгустки. КТ венография, помимо внутреннего просвета сосуда, дает представление об окружающих тканях, костных образованиях, ширине реберно-подключичного промежутка. Как методы второй линии, показаны при высокой клинической вероятности болезни и отрицательных результатах УЗДС.
- Традиционная флебография верхних конечностей. Используется в случаях, когда неинвазивная диагностика малоинформативна. Позволяет хорошо визуализировать подключично-подмышечную область, определив зоны компрессии и участки стеноза. Точность контрастной флебографии повышается выполнением пробы с наружной ротацией и отведением плеча. После верификации поражения диагностическая процедура может сразу перейти в лечебную, как часть мультимодальной стратегии, направленной на выполнение катетер-управляемого тромболизиса.
О нарушении венозного оттока удается косвенно судить по результатам флеботонометрии, лимфографии, кожной термометрии. Некоторые анатомические особенности костных структур видны на рентгенограмме грудной клетки. Коагулограмма показывает усиление свертывающей способности крови.
Диагностика синдрома Педжета-Шреттера осуществляется сосудистым хирургом (врачом-флебологом). Патологию необходимо дифференцировать с вторичными тромбозами, поверхностными тромбофлебитами, артериальной формой синдрома грудного выхода, лимфедемой. Отличать патологию приходится от окклюзии опухолями, распространенной флегмоны плеча, остеомиелита.
Лечение синдрома Педжета-Шреттера
Однозначного мнения в отношении стандартов лечения флеботромбоза, связанного с физическим усилием, нет. Относительная редкость патологии, недостаточная осведомленность, отсутствие больших рандомизированных испытаний не способствуют прояснению ситуации. Чаще всего ориентируются на комплексный подход, предполагающий использование нескольких методов коррекции:
- Консервативных. В острый период пораженной руке обеспечивают покой, придают несколько возвышенное положение (на косыночной повязке), проводят местные блокады. С целью предотвращения прогрессирования тромботических изменений назначают антикоагулянты – низкомолекулярные гепарины, пероральные средства. Но одна лишь консервативная стратегия не способна обеспечить полноценное устранение симптомов и предупредить осложнения.
- Оперативных. Как метод выбора в оперативном лечении синдрома Педжета-Шреттера используют комбинацию селективного тромболизиса и декомпрессионных техник. Катетер-управляемое растворение сгустка выполняется в первые 7 суток после манифестации патологии локальным введением альтеплазы, тенектеплазы, стрептокиназы. Декомпрессия выполняется путем резекции первого ребра, ключицы, сухожилия передней лестничной мышцы.
Есть данные об эффективности венолизиса (удаления рубцовых изменений с внешней стенки сосуда), периваскулярной симпатэктомии. При необходимости декомпрессионные манипуляции дополняются прямой тромбэктомией с пластикой передней стенки сосуда. Роль шунтирующих операций требует дальнейших исследований.
В раннем послеоперационном периоде, чтобы предотвратить тугоподвижность плеча, назначают пассивные движения, массаж. Спустя 4 недели добавляют силовые упражнения, направленные на укрепление мышц. К полной активности пациенты возвращаются через 3–4 месяца.
Прогноз и профилактика
Хотя полное выздоровление случается редко, но прогноз для жизни при синдроме Педжета-Шреттера относительно благоприятный. Затрагивая преимущественно молодых активных людей, прогрессирующий тромбоз нередко ведет к инвалидизации. Из-за неадекватной терапии до 15% случаев осложняются легочной эмболией. Однако своевременная и правильная лечебная тактика позволяет достичь восстановления кровотока с низким риском рецидивов. Мероприятий первичной профилактики не разработано, для предупреждения повторных эпизодов у лиц с высоким риском тромботических состояний рекомендуют длительную антикоагулянтную терапию.
Источник
Венозный тромбоз – острое заболевание глубоких магистральных венозных сосудов, обусловленное развитием тромба в их просвете. Тромбы вызывает острое нарушение кровотока по глубоким магистральным венам, в результате чего ниже повышается внутривенозное давление, резко нарушающее транскапиллярный обмен.
Синдромом Педжета-Шреттера – острый тромбоз проксимальных отделов подключичной вены с распространением его на подмышечную вену и вены плеча и нарушением венозного оттока в верхней конечности.
Синдром описан Peget, в 1875 г. и Schretter в 1884 г.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология. Тромбоз подключичных вен является довольно редкой патологией и возникает от разных причин. Развитию заболевания способствуют топографоанатомические особенности подключичной вены, расположенной в окружности костных и сухожильно-мышечных образований. Для представления о сути проблемы необходимо знакомство с анатомией подключичной вены и окружающих образований. Подключичная вена на уровне грудино-ключичного соединения с внутренней яремной веной образует плечеголовную вену. Подключичная вена начинается от первого ребра из подмышечной вены. В начале и в конце вена имеет клапаны. Идет в предлестничном пространстве, то есть кпереди от передней лестничной мышцы, которая отделяет её от одноименной артерии. Крупных притоков не имеет. При сильных напряжениях мускулатуры плечевого пояса, сочетающихся с движениями в плечевом суставе, уменьшаются размеры подключичного пространства и вена оказывается сдавленной между ключицей и I ребром. По большому счету, синдром Педжета-Шреттера является частным случаем синдрома торакального выхода. Иначе он называется апертурным синдромом или синдромом верхней апертуры грудной клетки, при котором возникает экстравазальное сдавление сосудисто-нервного пучка. Особенно благоприятные условия для нарушения оттока по подключичной вене, а следовательно, и тромбообразования возникают при высоком стоянии I ребра, гипертрофиях подключичной мышцы и мышечно-сухожильной части малой грудной мышцы.
Патофизиология. Основу патогенеза тромбообразования составляет триада Вирхова – нарушение эндотелия стенки вены, замедление кровотока и повышение свертываемости крови. В развитии тромбозов вен важную роль играет повреждение эндотелия сосудов на пораженной конечности, сопровождающееся выделением интерлейкинов, фактора агрегации тромбоцитов, который активирует тромбоциты и коагуляционный каскад. Поверхность эндотелия приобретает повышенную тромбогенность и адгезивность. В результате перечисленные факторы на фоне замедленного или турбулентного кровотока приводят к образованию тромба. Формированию тромба также способствует тканевый тромбопластин, который в избыточном количестве поступает из поврежденных тканей в кровеносное русло. Окклюзирующий тромб ведет к острому нарушению кровотока во всей конечности. Ниже значительно повышается внутривенозное давление, передающееся на микроциркуляторный аппарат. Флотирующий тромб (может быть в виде головки окклюзирующего тромба) фиксирован лишь в одной точке, плавает в просвете сосуда, не вызывая блокады кровотока. В момент физических напряжений возможен отрыв.
Классификация синдрома Педжета-Шреттера: в клинической классификации выделяют:
•острая стадия заболевания
– легкая форма – венозное давление не превышает 300 мм вод. ст.
– средняя форма – имеется венозная гипертензия в пределах от 400 до 800 мм вод. ст.
– тяжелая форма – венозное давление достигает 1200-1300 мм вод. ст.
•хроническая стадия заболевания
Гипертензия в венах конечности наиболее выражена в первые дни заболевания, а по мере развития коллатерального оттока крови и реканализации тромбированного участка вены она постепенно снижается. В хронической стадии заболевания в состоянии покоя гипертензия в венах больной конечности выражена умеренно, но недостаточность оттока крови отчетливо выявляется при мышечной нагрузке.
КЛИНИКА И ДИАГНОСТИКА
Синдром Педжета–Шреттера-Кристелли наблюдается преимущественно у людей в возрасте 20–40 лет с хорошо развитой мускулатурой, занимающихся спортом или тяжелым физическим трудом, часто поднимающими тяжести, с неправильной осанкой. Кроме того, наблюдается при патологии костей – добавочном шейном ребре, экзостозах (разрастаниях костной ткани) шейных позвонков, большой костной мозоли после перелома ключицы, сами переломы могут провоцировать острую или хроническую травматизацию подключичной вены в реберно-ключичном промежутке. Длительное сдавление вены наблюдается при вынужденном положении верхней конечности во время сна, когда голова лежит на плече. Причинами образования тромбов в подключичной вене называют несколько факторов. В российской флебологии приоритет признается за длительной постоянной травматизацией вены в реберно-ключичном промежутке. Развивается утолщение вены в этом месте, при постоянном нарушении трофики вены, нарушении питания через собственные сосуды, так называемые vasa vasorum. Создаются условия для турбулентного движения крови и изменения свойств эндотелия сосуда. При наличии производящего фактора – физической нагрузки в вене возникает тромбоз. В некоторых случаях, при детальном выяснении анамнеза часть больных вспоминает о периодически возникающей на протяжении последнего времени или даже нескольких лет тяжести в пораженной конечности при физической нагрузке и быстро наступающей утомляемости руки, мешающей выполнению обычной работы и порой бытовых обязанностей. Возможны также болезненные ощущения по ходу сосудистого пучка, появление темно-синей окраски кисти после напряжения конечности и неожиданное, особенно по утрам, припухание последней с парестезиями или смешанным чувством слабости и своеобразного томления и набрякшими поверхностными венами.
Основными клиническими признаками острого тромбоза подключичной вены являются: выраженный отек, цианоз, напряжение и расширение подкожных вен верхней конечности и плечевого пояса соответствующей стороны (чаще справа), боли. Появлению этих симптомов обычно предшествует значительная физическая нагрузка. В остром периоде окклюзии подключичной вены часто отмечаются резкие, стягивающие боли, ощущение выпирания, похолодания, покалывания и тяжести в шее, надключичной, подключичной и подмышечных областях (иррадиирующие по всей верхней конечности, как это наблюдается при невралгии плечевого сплетения), болезненность нервно-сосудистого пучка в подмышечной, подключичной области и плеча с положительным симптомом натяжения. Отмечаются гиперестезия с гипериатическим оттенком от ключицы до сосковой линии, переходящая в гипестезию в дистальной части верхней конечности, ограничение активных движений в ней из-за болей, гипотония мышц руки. Сухожильные и периостальные рефлексы вначале повышены, а в дальнейшем снижаются.
Отек характеризуется плотностью и отсутствием ямок при надавливании. Нередко он захватывает не только руку и плечевой пояс, но и переходит на верхнюю половину грудной клетки.
Расширение и напряжение подкожных вен в ранние сроки заболевания заметно лишь в области локтевой ямки. Впоследствии локализация расширенных вен соответствует границам распространения отека.
Цианоз кожных покровов наиболее выражен в области кисти и предплечья.
При распространении тромбоза на подкрыльцовую и плечевую вены течение заболевания становится тяжелым. Нарастающий отек тканей в ряде случаев ведет к сдавливанию артериальных стволов, вследствие чего ослабевает пульс на лучевой -артерии и снижается температура конечности. Нарушения артериального кровообращения иногда настолько значительны, что возникает опасность развития гангрены.
После стихания острых явлений наступает обратное развитие клинической картины. Однако у некоторых больных полного регресса симптомов заболевания не происходит, что позволяет выделить хроническую стадию синдрома. В хроническом периоде отмечается уменьшение болевого синдрома и отека руки, обнаруживаются гипотония мышц, парез руки (преимущественно кисти). Обнаруживается выраженная гипестезия в верхней части груди и на руке, усиливающаяся в дистальном направлении; сухожильные и периостальные рефлексы снижены или не вызываются. При повторных движениях руки неврологические симптомы усиливаются, и иногда выявляются ранее отсутствовавшие симптомы. В хроническом (и в остром) периодах в руках отмечаются вегетативно-сосудистые нарушения. Н. К. Боголепов полагает, что в острой стадии в основе патогенеза неврологической симптоматики лежат венозный застой, гипоксия, периваскулярный отек и увеличение концентрации СО2 в венозной крови. Д. И. Пронив (1966) в развитии клинического комплекса синдрома придает значение трансневральной, или реперкуссионной теории (синдромы поражения нервной системы при тромбозе подключичной вены детально описаны Н. К. Боголеповым и Ф. Т. Абдухакимовым в 1966 г.).
Диагностика острого тромбоза подключичной вены в большинстве случаев не представляет трудностей. Она основывается на указанных выше симптомах и на частой связи заболевания с физической нагрузкой.
При появлении сиптомов острого тромбоза подключичной вены как правило сразу же производят ультрозвуковую диагностику (ультразвуковую доплерогравию, дуплексное сканирование). Как правило, глубокие вены верхней конечности и шеи хорошо доступны для ультразвукового исследования. Некоторые сложности возникают при сканировании подключичной вены, поскольку достаточно большая глубина ее расположения и близость костно-суставных образований зачастую не позволяют осуществить компрессию сосуда датчиком. Поэтому в некоторых случаях приходится ориентироваться только на результаты цветового картирования кровотока. Помощь в определении тромботического поражения этой вены может оказать и отсутствие фазных движений ее стенок, несинхронных с пульсацией стенок артерии. При наличии признаков замедления кровотока в подключичной вене необходимо попытаться осмотреть наиболее проксимальный отдел ее, где локализуется клапан, который обычно является местом первичного тромбообразования, для исключения сегментарного тромбоза этого участка. Это можно осуществлять как из подключичного, так и из надключичного доступа.
Ценным методом исследования, позволяющим судить о локализации и распространенности тромбоза, о степени развития коллатеральных сосудов, является флебография, при которой контрастное вещество вводят в кубитальную вену или в одну из поверхностных вен тыльной поверхности кисти. Проведение флебографии целесообразно только тогда, когда предполагается лечение тромбоза с помощью тромболизиса. Тогда после серии снимков вены с контрастированием, в вену со стороны плеча вводится катетер, и через него в тромботические массы подается раствор фибринолитика.
В диагностике болезни помогает рентгенография, которая может позволить найти костные причины заболевания. На ультразвуковом исследовании, а в некоторых случаях при использовании компьютерной томографии и магниторезонансного исследования (ЯМР) – можно определить точную локализацию тромба и степень заинтересованности других вен.
ЛЕЧЕНИЕ
Лечение в основном консервативное. В случае отсутствия терапии через 2-3 недели после образования тромба, он начинает постепенно “растворяться”, а правильнее говорить – реканализовываться. По большей части удается добиться неплохих результатов при консервативном лечении острого тромбоза. Задачи консервативного лечения: прекращение тромбообразования, фиксация тромба к стенке, купирование спазма и воспалительного процесса, как правило, асептичного, воздействие на микроциркуляцию и тканевой обмен.
Следует отметить, что лечение тромбозов глубоких вен рук и верхнего плечевого пояса не отличаются от таковых при тромбозах ног. Так как они не осложняются тромбэмболиями, венозная сеть рук более развита и кровоток в них быстрее компенсируется, лечение менее интенсивное. Нет необходимости в строгом постельном режиме пациентов. Руке обеспечивается покой и приподнятое состояние.
По необходимости в лечении острого тромбоза используются антикоагулянты. Общие принципы лечения венозных тромбозов. Эффективны антикоагулянты прямого действия (непосредственно взаимодействующие с факторами свертывания крови). Начальная доза гепарина выбирается из расчета, что часть его свяжется протеинами плазмы. Сочетание гепарина с фибринолизином взаимоусиливает эффект. Оптимально соотношение 10 тыс. ЕД гепарина и 20 тыс. ЕД фибринолизина. Препараты вводятся капельно на изотоническом растворе с 400 мл реополиглюкина. Далее в соответствии с методикой дробного введения гепарин назначается внутримышечно под контролем времени свертывания крови. Считается, что хорошим терапевтическим эффектом является удлинение времени свертывания крови в 2-2,5 раза, снижение фибриногена А до 300 мг/%, исчезновение в плазме фибриногена Б, уменьшение протромбинового индекса до 35-40%. Ориентировочно можно руководствоваться правилом: при времени свертывания 5 минут вводится доза 10 тыс. ЕД гепарина, 10 минут – 5 тыс. ЕД, 15 минут и более – инъекция гепарина пропускается. Фибринолизин можно назначать 2 раза в сутки, не превышая при этом суточной дозы в 40 тыс. ЕД. Так как фибринолизин быстро инактивируется антиплазминами крови, его эффективность недостаточно высокая для полного растворения крови, однако и геморрагические осложнения реже, чем у стрептокиназ. Последние не получили применения при тромбозах магистральных вен из-за тяжести возможных осложнений. Гепаринотерапия проводится в течение 3-5 суток в зависимости от тяжести и распространенности тромботического процесса. В последующем осуществляется переход на медленнодействующие антикоагулянты по общепринятой схеме. Лечение фибринолизином может проводиться 3-5 суток. В качестве активатора фибринолиза применяется и никотиновая кислота в дозе 1 мг/кг массы больного в сутки, назначаемая параллельно с гепарином. Современным средством антикоагулянтной терапии являются низкомолекулярные гепарины. Их преимущества: постоянная биологическая доступность, более длительный полупериод существования, более низкий риск побочных эффектов (в том числе тромбоцитопении и остеопороза), возможность длительного лечения даже в домашних условиях. Введение фраксипарина проводится каждые 12 часов в течение 10 дней. Лечебная доза определяется массой тела: 0,1 мл на 10 кг массы. В случае появления передозировки и кровоточивости возможна нейтрализация протамином сульфат (из расчета 0,6 мл протамина нейтрализует 0,1 мл фраксипарина). Курс применения низкомолекулярных гепаринов составляет 5 – 10 дней с последующем переходом на непрямые антикоагулянты.
С первых же дней целесообразно назначение флавоноидов (детралекс, троксевазин, венорутон, гливенол, эскузан). Они воздействуют на метаболизм в венозной стенке и паравазальных тканях, обладают противовоспалительным и обезболивающим эффектом.
Важно назначение препаратов, направленных на нормализацию, а также улучшение притока крови купированием возникающего спазма. Это ксантинола никотинат, трентал, вводимые внутривенно в составе коктейля и внутримышечно. Традиционно применение миотропных спазмолитиков (но-шпа, папаверин, галидор). В остром периоде все препараты лучше вводить парэнтерально.
Местное лечение. На пораженную конечность накладываются компрессы с различными препаратами. Это может быть спиртовой раствор, гепариновая или гепароид-мазь, композиции с флавоноидами (троксевазиновая мазь). Хороший эффект наблюдается от примнения пиявок.
Показания к тромбэктомии возникают при угрозе развития венозной гангрены, выраженных регионарных гемодинамических нарушениях. При флебографии возможна баллонная ангиопластика вены и эндопротезирование. Чтобы устранить компрессию подключичной вены, одновременно производят вмешательства на мышцах, сухожилиях или костях.
Не всегда просвет вены восстанавливается до нормального, тогда болезнь плавно переходит в посттромбофлебитическую (хроническая стадия). При этом симптомы, присущие острому периоду становятся менее выраженными. В данном случае эндоваскулярные вмешательства дают как правило лучшие результаты, чем консервативное лечение. В хронической стадии заболевания выполняют реконструктивные сосудистые операции, направленные на создание дополнительных путей венозного оттока из верхней конечности путем анастомозирования подмышечной вены или дистального отрезка подключичной вены с наружной яремной веной. В качестве шунтов используют трансплантаты, выкроенные из большой подкожной вены бедра.
Также необходимо устранить факторы, приведшие к развитию болезни. Для этого проводят флеболиз, рассечение реберно-диафрагмальной связки, удаляют добавочное шейное ребро и другие экстравазальные образования, участвующие в сдавлении вены.
Прогноз для жизни при остром тромбозе подключичной вены благоприятный, но полного выздоровления можно и не достигнуть.
Источник
