Ожирение и метаболический синдром у мужчин state of art

Ожирение является одной из актуальнейших проблем современного здравоохранения. При этом растет и частота диагностики метаболического синдрома (МС) — комплекса метаболических, гормональных и клинических нарушений, тесно ассоциированных с сахарным диабетом (СД) 2-го типа и являющихся факторами риска развития сердечно-сосудистых заболеваний, в основе которого лежит инсулинорезистентность (ИР) и компенсаторная гиперинсулинемия (ГИ). На сегодняшний день в него включены: ИР, абдоминальное ожирение (АО), СД 2-го типа и другие нарушения толерантности к глюкозе, артериальная гипертензия, атерогенная дислипидемия, гиперурикемия, неалкогольная жировая болезнь печени (НАЖБП), нарушения фибринолитической активности крови, гиперандрогения и синдром поликистозных яичников у женщин, гипоандрогения у мужчин, гиперурикемия, микроальбуминурия, ночное обструктивное апноэ и пр., причем перечень патологических состояний, объединенных этим термином, неуклонно растет [1, 2]. В связи с тем, что клиническая манифестация компонентов симптомокомплекса имеет место уже в детском возрасте, МС признается актуальной педиатрической проблемой. По данным различных источников он диагностируется у 30–50% подростков с ожирением [3–6].
До настоящего времени единых критериев, позволяющих диагностировать МС в детском возрасте, не разработано. Одной из наиболее универсальных классификаций, предложенной для использования в педиатрической практике, является классификация Международной федерации диабета (International Diabetes Federation, IDF) (2007) [7]. Согласно ей МС диагностируется у подростков 10–16 лет при наличии АО (окружность талии (ОТ) ≥ 90 перцентили), в сочетании с не менее чем двумя из следующих признаков:
- уровень триглицеридов (ТГ) ≥ 1,7 ммоль/л;
- уровень холестерина липопротеидов высокой плотности (ХС ЛПВП) < 1,03 ммоль/л;
- повышение артериального давления (АД) ≥ 130/85 мм рт. ст.;
- повышение уровня глюкозы венозной плазмы натощак ≥ 5,6 ммоль/л или выявленный СД 2-го типа и/или другие нарушения углеводного обмена.
Так, по результатам исследования Т. А. Боковой [8] МС по критериям IDF (2007) диагностируется у 49% детей с ожирением, 77% из них — подростки 12–16 лет. У мальчиков МС регистрируется чаще, чем у девочек (61% и 39% соответственно). У 54% больных выявляется неполный вариант МС — сочетание АО с двумя дополнительными компонентами (повышение АД, и/или повышение глюкозы натощак, и/или повышение ТГ, и/или снижение ХС ЛПВП), тогда как у 33% детей регистрируется комбинация четырех, а у 13% детей — всех пяти компонентов МС.
На основании проведенной интегральной оценки факторов риска формирования МС в детском возрасте выделен ряд наиболее значимых генетических, физиологических и социально-экономических факторов [9] (табл.).
.gif)
Согласно представленным данным к наиболее значимым неуправляемым (трудноуправляемым) факторам риска МС относятся: абдоминальный (висцеральный) тип ожирения, ИР, гипергликемия, гипертриглицеридемия, а также снижение уровня ХС ЛПВП и гиперурикемия. Наиболее значимыми среди управляемых (условно управляемых) факторов являются: наличие у ребенка высокой степени ожирения (ИМТ более 30 кг/м2) и длительность заболевания 5 и более лет, низкий (менее 2500 г) вес при рождении, нарушение пищевого поведения, проявляющееся в виде «синдрома ночной еды», наличие заболеваний гепатобилиарной системы (НАЖБП, билиарный сладж, холестероз желчного пузыря), а также ожирение у обоих родителей или у матери, наличие СД 2-го типа или гипертонической болезни у матери, а также СД 2-го типа у бабушки по материнской линии.
Научный взгляд на патогенез МС до настоящего времени остается неоднозначным. Хотя и доказана тесная взаимосвязь между ожирением и ИР, вызывает споры вопрос, что из них первично [10, 11]. По мнению одних авторов, в основе развития гормонально-метаболических нарушений лежит наследственная предрасположенность к ИР. Согласно гипотезе V. Neel об «экономном генотипе» («thrifty» genotype), выдвинутой еще в 1962 г. [12], ИР — это эволюционно закрепленный механизм выживания в неблагоприятных условиях, когда периоды изобилия чередовались с периодами голода. Ее реализация в условиях избыточного питания и низкой физической активности способствует блокированию инсулиновых рецепторов, замедлению липолитических процессов и депонированию жировой тканью экзогенных жиров, что в конечном итоге приводит к ожирению. Другие авторы выдвигают на передний план висцеральное ожирение [13–15]. Адипоциты висцеральной жировой ткани наряду со свободными жирными кислотами, которые не только затрудняют связывание инсулина с рецепторами, но и нарушают передачу сигнала от рецептора в клетки, продуцируют адипоцитокины — фактор некроза опухоли (ФНО-α), тканевый фактор роста β1 (ТФР-β1), интерлейкин-6 (ИЛ-6), резистин, адипонектин, лептин, индуцибельную NO-синтазу и пр., которые также влияют на чувствительность тканей к инсулину и способствуют прогрессированию ИР.
Несмотря на то, что ожирение, артериальная гипертензия и нарушения углеводного обмена являются наиболее изученными заболеваниями, ассоциированными с МС у детей, в последние годы уделяется большое внимание исследованию функционального состояния органов пищеварения, в частности печени и поджелудочной железы, представляющих не менее важные патогенетические и клинические составляющие данного синдромокомплекса.
Доказано, что практически каждый компонент МС у взрослых сопровождается вторичным поражением печени по типу НАЖБП [1, 16, 17]. Если ее средняя распространенность в популяции составляет 10–40%, то среди людей с избыточной массой тела она достигает 74–100%. При этом у 20–47% обследованных диагностируется неалкогольный стеатогепатит (НАСГ). По данным отечественных и зарубежных авторов НАЖБП диагностируется и у 68–70% детей с ожирением и МС, причем в стадии НАСГ — в 22–27% случаев [18–20].
В современной литературе представлены данные о том, что у взрослых людей с избыточной массой тела с высокой частотой диагностируется аналогичное жировому гепатозу поражение поджелудочной железы — стеатоз поджелудочной железы (СПЖ) [21]. При этом показано, что и у абсолютного большинства детей с ожирением также выявляются характерные изменения поджелудочной железы, причем наиболее выраженные структурные и функциональные расстройства диагностируются у больных с МС [22, 23].
Следует отметить, что традиционно в педиатрической практике принято обращать внимание на биомедицинские аспекты заболевания — клинические и метаболические параметры, характеризующие состояние больного и отражающие результаты лечения. При этом хронические заболевания, к которым относится ожирение, как правило, ограничивают социальную адаптацию ребенка за счет нарушения личностно-средового воздействия и изменения системы отношений личности. Представлены единичные исследования, посвященные данной проблеме. Так, оценка качества жизни детей с ожирением, осложненным МС, проведенная с помощью одномоментного исследования (анкетирования) по опроснику SF-36 (MOS 36-item Short-Form Health Survey) [24], показала, что большинство подростков, несмотря на наличие отягощенного преморбидного фона, считают качество своей жизни высоким, а их жизненная активность и уровень психического здоровья при этом снижены умеренно, а основными факторами, оказывающими наибольшее влияние на различные сферы жизнедеятельности, являются физические проблемы, ограничивающие выполнение ежедневных обязанностей, и связанное с этим снижение социальной активности. Полученные данные рассматриваются с позиций важных критериев эффективности лечебно-профилактических мероприятий в детском возрасте, поскольку отношение ребенка к своей болезни влияет на ее течение и его приверженность к лечению. Недооценка тяжести состояния собственного здоровья, обусловленная отсутствием четкой клинической симптоматики развивающихся симптомов и их прогредиентным течением, затрудняет своевременную диагностику и снижает качество терапии.
Определенные сложности связаны с профилактикой и лечением заболеваний обменного характера в детском возрасте. Спектр лекарственных средств, используемых для коррекции нарушений липидного и углеводного обмена у детей, ограниченный. Кроме того, фармакологические препараты в большей степени используются как дополнение, а не альтернатива изменениям режима питания и физической активности. Основным подходом к лечению ожирения и МС является широкое использование немедикаментозных средств, направленных на уменьшение массы тела, изменение стереотипов питания, отказ от вредных привычек, повышение физической активности. Важными составляющими являются мотивация и поддержка не только со стороны врача-специалиста, но и со стороны близких — родителей, друзей и пр. Необходимо соблюдать принципы сбалансированного субкалорийного питания — диета должна содержать достаточное количество белков, микроэлементов и витаминов. Следует ограничить потребление жиров, преимущественно животного происхождения, легкоусваиваемых углеводов и поваренной соли. Рекомендуется 5-разовый прием пищи: на завтрак должно приходиться 25–30% суточного калоража, на обед — 35–40%, на ужин — 10–15%. Второй завтрак и полдник должны укладываться в 10%. Пищу дают в отварном, тушеном или запеченном виде. Рацион составляется с учетом «пищевой пирамиды»: чувство насыщения обеспечивают продукты, употребляемые без ограничения (нежирное мясо, рыба, свежие овощи и др.), потребность в сладком — ягоды, фрукты. Важно устранить привычку есть на ночь (прекращать прием пищи за 2 часа до сна) и «на ходу» — бутерброды, чипсы, сухарики и пр. Большое значение придается пищевым волокнам. Согласно рекомендациям Американской ассоциации диетологов (American Dietetic Association, АDА) необходимое потребление ребенком пищевых волокон должно составлять (в граммах): возраст ребенка + 5. Для снижения веса можно рекомендовать еженедельные разгрузочные дни, особенно коллективные (семейные), которые могут быть кефирными, творожными, мясоовощными, рыбоовощными. Строго противопоказано голодание, так как оно провоцирует стресс и усугубляет метаболические нарушения. Большое значение имеет лечебная физкультура. Рекомендуются танцы, плавание, водная аэробика, катание на велосипеде, лыжах, а также обычная утренняя зарядка, прогулки и туризм. Не показаны занятия тяжелой атлетикой, боксом, участия в кроссах и соревнованиях. Наиболее эффективными являются регулярные, длительные (не менее 1 часа) низкоинтенсивные, несиловые тренировки. Не утрачивают своего значения физиопроцедуры — контрастный душ, гидромассаж и пр. В качестве гипохолестеринемических средств у взрослых широко используются препараты различных фармакологических групп: статины, дериваты фиброевой кислоты, никотиновая кислота и ее производные и пр. Однако применение большинства препаратов этой группы ограничено возрастными рамками. С целью коррекции гипертриглицеридемии у детей возможно применение средств на основе α-липоевой кислоты, омега-3-полиненасыщенных жирных кислот. Для коррекции пищевого поведения возможно назначение в индивидуальном порядке детям старшего возраста ингибитора активности липазы (орлистат). Для повышения чувствительности к инсулину назначаются бигуаниды (метформин), которые снижают глюконеогенез, тормозят всасывание глюкозы в кишечнике, повышают чувствительность тканей к инсулину и снижают ИР. Патогенетически обосновано назначение гепатотропных средств, нормализующих функциональное состояние печени, — препаратов урсодезоксихолевой кислоты, расторопши, артишока, и средств, оказывающих положительное влияние на микробиоценоз кишечника (пищевые волокна, пре-, пробиотики). Широко применяются витаминно-минеральные комплексы с содержанием цинка, хрома, таурина и пр., антиоксиданты (витамин Е, коэнзим Q10 и др.), энерготропные средства (L-карнитин). Целесообразно проведение коррекции вегетативных нарушений, нормализации внутричерепного давления. Показан регулярный контроль АД. При выборе антигипертензивных средств преимущество следует отдавать ингибиторам АПФ, а также метаболически нейтральным тиазидным диуретикам.
Представлены результаты изучения эффективности комплекса лечебно-профилактических мероприятий, рассчитанного на 12 мес, который включал мотивационное обучение, различные способы медикаментозной и немедикаментозной коррекции [25]. Динамическое наблюдение за 51 больным, из которых 31 ребенок с ожирением, осложненным МС, и 20 детей с ожирением без МС, показало его эффективность в виде снижения и/или стабилизации массы тела, улучшения клинических и лабораторных показателей у 88% детей с МС и всех детей (100%) с ожирением без признаков МС. В то же время у всех детей с МС (100%) и 89% детей с ожирением без МС, не получавших комплексной терапии и не находящихся под медицинским наблюдением, положительная динамика отсутствовала, причем у 3 детей при обследовании через 12 мес выявлены характерные изменения гормонально-метаболического профиля, позволившие диагностировать МС.
В последние годы все чаще обсуждаются возможности хирургического лечения. Бывают особо тяжелые случаи течения заболевания (морбидное ожирение с ИМТ 35 кг/м2 и более или состояния, вызванные его осложнениями, угрожающими жизни), когда появляется необходимость оперативного вмешательства. Лечение ожирения при помощи бариатрических операций еще совершенствуется, но уже сейчас врачи практикуют более 40 видов вмешательств, помогающих устранить последствия ожирения, в том числе и у детей подросткового возраста.
Литература
- Лазебник Л. Б., Звенигородская Л. А. Метаболический синдром и органы пищеварения. М., 2009. 181 с.
- Метаболический синдром / Под ред. Г. Е. Ройтберга. М.: Медпресс-информ. 2007. 223 с.
- Бокова Т. А., Урсова Н. И. Медико-социальные аспекты метаболического синдрома у детей // Вестник всероссийского общества специалистов по медико-социальной экспертизе, реабилитации и реабилитационной индустрии. 2010; 1: 48–50.
- Леонтьева И. В. Метаболический синдром у детей и подростков: спорные вопросы // Педиатрия. 2010; 89 (2): 146–150.
- Щербакова М. Ю., Синицын П. А. Современные взгляды на диагностику, классификацию, принципы формирования группы риска и подходы к лечению детей с метаболическим синдромом // Педиатрия. 2010; 89 (3): 123–127.
- Ровда Ю. И., Миняйлова Н. Н., Казакова Л. М. Некоторые аспекты метаболического синдрома у детей и подростков // Педиатрия. 2010; 89 (4): 111–115.
- Zimmet P., Alberti G. М., Kaufman F., Tajima N., Silin M., Arslanian S., Wong G., Bennett P., Shaw J., Caprio S. The metabolic syndrome in children and adolescents: the IDF consensus // Diabetes Voice. 2007; 52 (4): 29–32.
- Бокова Т. А. Метаболический синдром как педиатрическая проблема // Consilium medicum. 2015; 2: 13–16.
- Бокова Т. А. Факторы риска формирования ожирения и метаболического синдрома у детей // Врач. 2016; 8: 5–7.
- Балыкова Л. А., Солдатов О. М. Метаболический синдром у детей и подростков // Педиатрия. 2010; 89 (3): 127–134.
- Метаболический синдром у детей и подростков / Под ред. Л. В. Козловой. М.: ГЭОТАР-Медиа, 2008. 96 с.
- Neel V. Diabetes mellitus: a «thrifty» genotype rendered detrimental by progress? // Am. J. Hum. Genet. 1962; 14: 352–362.
- Гурина А. Е., Микаелян Н. П., Кулаева И. О., Микаелян А. В. и др. Взаимосвязь между активностью инсулиновых рецепторов и АТФ крови на фоне дислипидемии у детей при сахарном диабете // Фундаментальные исследования. 2013; 12 (1): 30–34.
- Desruisseaux M. S., Nagajyothi О. А., Trujillo M. E. Adipocyte, adipose tissue, and infectious disease // Infection and Immunity. 2007; 75 (3): 1066–1078.
- Calcaterra V., Amici M. D., Klersy C., Torre C. et al. Adiponectin, IL-10 and metabolic syndrome in obese children and adolescents // Acta Biomed. 2009; 80: 117–123.
- Красильникова Е. И., Быстрова А. А. Синдром инсулинорезистентности и печень // Эффективная фармакотерапия. Гастроэнтерология. 2011; 2: 24–30.
- Цуканов В. Н., Тонких Ю. А., Каспаров Э. Р. Неалкогольная болезнь печени у взрослого населения России (распространенность и факторы риска) // Врач. 2010; 9: 1–4.
- Бокова Т. А. Функциональное состояние гепатобилиарной системы у детей с метаболическим синдромом // Экспериментальная и клиническая гастроэнтерология. 2016; 125 (1): 14–20.
- Бокова Т. А. Неалкогольная жировая болезнь печени и метаболический синдром у детей: клинико-патогенетические взаимосвязи // Лечащий Врач. 2014; 5: 64–69.
- Fu J. F., Shi H. B., Liu L. R. et al. Non-alcoholic fatty liver disease: An early mediator predicting metabolic syndrome in obese children? // World J. Gastroenterol. 2011; 14 (17): 735–742.
- Ивашкин В. Т. Стеатоз поджелудочной железы и его клиническое значение // Рос. журнал гастроэнтерологии, гепатологии, колопроктологии. 2006; 16 (4): 32–37.
- Алешина Е. И., Гурова М. М., Новикова В. П., Комиссарова М. Ю. и др. Состояние поджелудочной железы при метаболическом синдроме у детей // Лечащий Врач. 2011; 7: 36–41.
- Бокова Т. А., Лебедева А. В. Особенности морфофункционального состояния поджелудочной железы у детей с метаболическим синдромом // Экспериментальная и клиническая гастроэнтерология. 2012; 1: 23–27.
- Бокова Т. А. Качество жизни подростков с ожирением, осложненным метаболическим синдромом // Лечащий Врач. 2016; 6: 26–28.
- Бокова Т. А. Метаболический синдром у детей: особенности формирования и клинического течения, подходы к диагностике, профилактике и лечению. Автореф. дис. … д.м.н. М., 2014. 48 с.
- Желудочно-кишечный тракт и ожирение у детей / Под ред. Новиковой В. П., Гуровой М. М. СПб: СпецЛит, 2016. 302 с.
А. С. Кошурникова
Е. В. Лукина1
ГБУЗ МО МОНИКИ им. М. Ф. Владимирского, Москва
Контактная информация: bta2304@mail.ru
Источник
Дата публикации 26 марта 2018Обновлено 19 июля 2019
Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне).[4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа.[5]
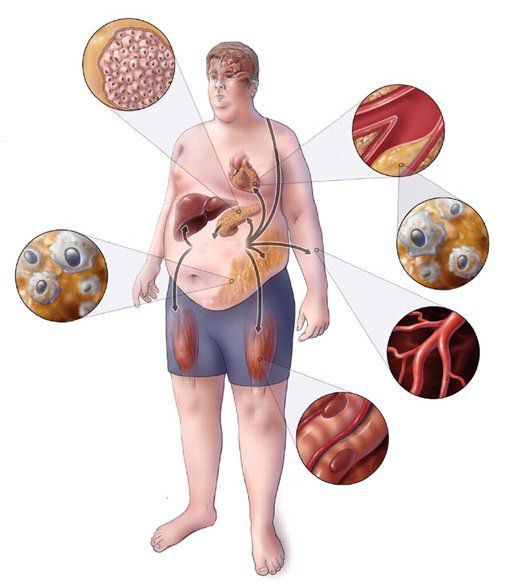
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям.[3][7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м2), классифицируются следующие типы массы тела (МТ):
- нормальная МТ — ИМТ ≥18,5 <25;
- избыточная МТ — ≥25 <30;
- ожирение I степени — ≥30 <35;
- ожирение II степени — ≥35 <40;
- ожирение III степени — ≥40.
ИМТ <18,5 характеризуется как дефицит массы тела.
Важную роль играет распределение жировой ткани. Различают два типа ожирения:
- гиноидный (по типу «груша»), когда избыточная жировая ткань распределяется преимущественно на бёдрах и ягодицах;
- андроидный (по типу «яблоко»; абдоминальное ожирение), с преимущественной локализацией жира в области верхней половины тела (живот, грудь, плечи, спина).

Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма <5,6) и в венозной плазме (норма <6,1) натощак в ммоль/л. Гипергликемией натощак считается показатель ≥5,6 <6,1 и ≥6,1; <7,0; сахарный диабет — ≥6,1 и ≥6,1 <7,0, соответственно. Через 2 часа после углеводной нагрузки (75 гр глюкозы или 125 гр сахара рафинада, растворённых в 200 мл воды) нормальный показатель концентрации глюкозы в капиллярной и венозной крови — <7,8 ммоль/л; НТГ — ≥7,8 <11,1 и сахарный диабет — ≥11,1.
Ещё один важный компонент метаболического синдрома — артериальная гипертензия, которая может носить вторичный характер. Нормальным считается систолическое артериальное давление (САД) 120-129 мм рт.ст и диастолическое артериальное давление (ДАД) 80-84 мм рт.ст. САД <120 и ДАД <80 называют оптимальным давлением, а САД 130-139 и ДАД 85-89 — высоким нормальным артериальным давлением. Различают три степени артериальной гипертензии:
- 1 ст. – САД 140-159, ДАД 90-99;
- 2 ст. – САД 160-179, ДАД 100-109;
- 3 ст. – САД ≥180, ДАД ≥110.
Повышение артериального давления характеризуется повышением риска сердечно-сосудистых событий.
Для метаболического синдрома характерны также изменения липидного обмена, которые классифицированы в таблице ниже (в ммоль/л).
| Параметры липидов | Риск низкий | Риск умеренный | Риск высокий | Риск очень высокий |
|---|---|---|---|---|
| ОХ | ≤5,5 | ≤5 | ≤4,5 | ≤4 |
| ХС-ЛПНП | ≤3,5 | ≤3 | ≤2,5 | ≤1,8 |
| ХС-ЛПВП | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 |
| Триглицериды | ≤1,7 | ≤1,7 | ≤1,7 | ≤1,7 |
| ХС не-ЛПВП | ≤4,3 | ≤3,8 | ≤3,3 | ≤2,6 |
| Примечание: ОХ — общий холестерин; ХС-ЛПНП — холестерин липопротеинов низкой плотности; ХС-ЛПВП — холестерин липопротеинов высокой плотности; ХС не-ЛПВП — холестерин, не связанный с липопротеинами высокой плотности. | ||||
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий.[17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП <1,0 у мужчин; <1,2 у женщин и повышение ХС ЛПНП >3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – <11,1.[8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение < 0,33).[12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность[14], рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия)[15], психотерапевтических методик и обучающих программ.[13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии.[10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности[1]. Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут).[11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.).[9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46%[6].
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
| АО+АГ+НТГ (СД) Умеренный ССР | АО+АГ+ДЛ Высокий ССР | АО+АГ+НТГ (СД)+ДЛ Высокий и очень высокий ССР | ||
|---|---|---|---|---|
| Д/ФН+АГП+ГГП | Д/ФН+АГП+ГЛП | Д/ФН+АГП+ГГП+ГЛП | ||
| Примечание ССР – сердечно-сосудистый риск; АГ – артериальная гипертензия; АО – абдоминальное ожирение; ДЛ – дислипидемия; НТГ – нарушение толерантности к глюкозе; СД – сахарный диабет; Д/ФН – диета/физическая нагрузка; АГП – антигипертензивный препарат; ГГП – гипогликемический препарат; ГЛП – гиполипидемический препарат. | ||||
Источник
