Паллиативной помощи при хроническом болевом синдроме

12 декабря 2019 г.
Просмотров: 1063
Паллиативная медицинская помощь (ПМП) является подходом, улучшающим качество жизни пациентов и их семей, столкнувшихся с проблемами, сопутствующими опасным для жизни заболеваниям. Она предотвращает и облегчает страдания путем ранней диагностики, правильной оценки и лечения боли и решения других проблем: физических, психосоциальных или духовных.
Когда требуется ПМП
ПМП необходима пациентам с прогрессирующими заболеваниями различного профиля:
- сердечно-сосудистой системы (38,5%),
- злокачественными новообразованиями (34%),
- хроническими респираторными (10,3%),
- синдроме приобретенного иммунодефицита (СПИД) (5,7%),
- сахарным диабетом (4,6%),
- при почечной недостаточности,
- хронических заболеваниях печени,
- рассеянном склерозе,
- болезни Паркинсона,
- ревматоидном артрите,
- неврологических заболеваниях,
- деменции, врожденных пороках,
- мультирезистентном туберкулезе.

В конце своей жизни большинство пациентов испытывают боль и множество других тяжелых симптомов, ухудшающих качество их жизни. В частности, при СПИДе и злокачественных новообразованиях, чаще всего, это хроническая сонливость, одышка и усталость. При хронической обструктивной болезни легких (ХОБЛ),заболеваниях сердца или почек более чем у 50% пациентов отмечаются боль, одышка и усталость.
Многочисленными исследованиями показано, что паллиативная медицинская помощь обеспечивает значительные и разнообразные преимущества для неизлечимых пациентов с серьезными и сложными проблемами со здоровьем, уменьшая физические, психологические, духовные страдания и улучшая качество их жизни.
Планирование противоболевой терапии при оказании паллиативной медицинской помощи
С целью обеспечения качественной ПМП нуждающимся в ней пациентам, важно поощрять их личный вклад в разработку плана собственного лечения. Исследования показали, что пациенты, участвующие в совместном принятии решений при лечении хронических заболеваний, улучшили свои показатели качества жизни. Врач обязан привлекать пациента к планированию лечения для лучшей осведомленности относительно его состояния и доступных вариантов паллиативной медицинской помощи, понимания, что для обезболивания будут использованы самые эффективные и безопасные методы. Именно акцент на персонализированный подход к выбору терапии является определяющим для адекватного контроля боли.
После составления плана лечения очень важно, чтобы принятая схема неукоснительно соблюдалась и постоянно контролировалась для успешного достижения цели как с точки зрения врача, так и пациента. Часто именно с этого начинается понимание, что, несмотря на предпринятые усилия, во многих случаях полное устранение боли невозможно. Необходимо постоянно оценивать и переоценивать эффективность обезболивания и любые проблемы, возникающие в ходе лечения. Такой подход гарантирует эффективность и безопасность противоболевой терапии и способствует активному участию пациента и семьи в лечебном процессе.
Лечение хронической боли при оказании паллиативной медицинской помощи
Методология лечения боли при оказании ПМП должна предусматривать несколько позиций:
- объяснение пациенту и его семье причин страдания,
- изменение образа жизни пациента,
- терапевтическое воздействие на ход болезни,
- повышение порога боли,
- воздействие на процессы проведения боли.
Основным методом лечения хронической боли у пациентов всех возрастных групп является системная фармакотерапия неопиоидными и опиоидными анальгетиками в сочетании с адъювантными препаратами, которая оказывается эффективной более чем в 80% случаев.
В то же время следует помнить, что залогом успеха в лечении хронической боли является комплексный подход, включающий, при необходимости, специальное лечение, а также различные инвазивные и нелекарственные методы, в том числе психологическую коррекцию и реабилитационные мероприятия. Например, у неизлечимых онкологических пациентов для купирования боли может с успехом применяться специальная противоопухолевая терапия (хирургическое лечение, лучевая терапия или химиотерапия) по соответствующим показаниям. При дополнении противоболевой терапии методами психологической коррекции пациенты быстрее и полноценнее справляются с контролем физической боли, осложнившей течение прогрессирующего патологического процесса.
Нелекарственные методы лечения боли должны приниматься во внимание с учетом сложности и многообразия патогенетических механизмов формирования хронической боли, и эффективности противоболевой фармакотерапии. В ряде случаев значительное облегчение пациенту может принести применение таких нелекарственных методов как тепло, холод, массаж, физические упражнения, ортопедические приспособления или иммобилизация. Такое воздействие часто позволяют разорвать порочный круг «боль — мышечное напряжение — нарушение кровообращения — боль».

Дополнительным усиливающим положительный эффект фактором является доверительное общение при проведении физиотерапии. Психологические и психосоциальные аспекты имеют определяющее значение у неизлечимых пациентов с психологически обусловленным рефлекторным напряжением мышц, приводящим к развитию болезненного дискомфорта вследствие усиления синтеза альгогенов и сенситизации ноцицепторов. В терапии подобной боли используется комплексный подход, сочетающий методы психотерапии, рефлексотерапии и лечебной физкультуры. При дополнении противоболевой терапии методами психологической коррекции пациенты быстрее и полноценнее справляются с контролем физической боли, осложнившей течение прогрессирующего хронического заболевания.
Некупируемая (резистентная) боль у неизлечимых пациентов
По статистике, примерно у 5% неизлечимых пациентов встречается хроническая боль, которую не удается контролировать доступными методами лечения. Наиболее частые причины некупируемой (резистентной) хронической боли — неадекватное или неправильное применение анальгетиков и игнорирование других причин страдания, которые могут провоцировать или усиливать боль.
Для облегчения хронической боли требуется назначение соответствующего препарата в адекватной дозе и по графику введения, определяемому его фармакологическими свойствами. Применяемые дозы анальгетиков могут отличаться от обычно используемых для контроля острой или послеоперационной боли.
Частыми причинами некупируемой (резистентной) боли являются нерешенные проблемы, относящиеся к другим причинам страдания — физическим, психологическим, социальным, культурным и духовным. Эти проблемы могут быть решены, если будет применен мультидисциплинарный подход.
Обезболивание в последние часы жизни
Оказание паллиативной медицинской помощи пациенту в последние дни и часы жизни имеет некоторые особенности, в первую очередь, в обезболивании.
Не рекомендуется снижать подобранную эффективную дозу опиоидного анальгетика из-за снижения уровня артериального давления или спутанности сознания, если они не являются прямым следствием неверного подбора дозы опиоидного анальгетика. При необходимости снижения дозы, ее следует уменьшать не более чем на 50% в течение суток, чтобы избежать прорыва боли и возможного развития синдрома отмены.
Помимо контроля боли, необходимо оценивать уровень и динамику других тягостных симптомов, которые могут усиливать страдания. К этим симптомам относятся пролежни, рвота, отечный синдром, запоры, задержка мочи, эпизоды возбуждения и др. В этой связи, даже при отсутствии сознания у пациента рекомендуется сохранять прием опиоидных анальгетиков, применяя титрование дозы.
Ряд исследований показали, что в силу разных причин у некоторых пациентов непосредственно перед смертью боль становится рефрактерной и не поддается эффективному лечению. В таких случаях дальнейшее применение стандартных подходов следует считать исчерпанным, поскольку это не способствует адекватному обезболиванию. При рефрактерности болевого синдрома, рекомендуется рассмотреть вопрос о возможности медикаментозной седации. Это должно быть обсуждено с пациентом и/или его законным представителем и закреплено решением врачебной комиссии. В некоторых клинических случаях медикаментозная седация является единственным методом, способным обеспечить облегчение страданий пациента. Наиболее часто используются нейролептики, бензодиазепины, барбитураты и пропофол. Вне зависимости от используемого препарата (или препаратов) его назначение в первую очередь требует определения дозы, обеспечивающей адекватное обезболивание, с последующим продолжением терапии для закрепления эффекта.
Оценка качества противоболевой терапии при оказании паллиативной медицинской помощи
Несмотря на значительные достижения в области анестезиологии, фармакологии и паллиативной медицины, адекватный контроль хронической боли не достигается, по разным оценкам, у 25 — 60% пациентов. Препятствия на пути к улучшению контроля боли возникают на разных уровнях (медицинский персонал, пациенты и члены их семей, система здравоохранения). Основным показателем качества ПМП и противоболевого лечения будет являться отсутствие боли у пациента.
В мировой практике при проведении клинического аудита качества лечения хронической боли применяются различные индикаторы. Например, при анализе амбулаторных карт доля пациентов, у которых оценка болевого синдрома проведена с определением его интенсивности, должна быть не менее 90%. Аналогичным образом, не ниже этого показателя должна быть доля пациентов, у которых при наличии болевого синдрома в медицинской документации есть указания о назначении противоболевой терапии.
Источник: Новиков Г.А., Вайсман М.А., Рудой С.В., Подкопаев Д. В. Паллиативная медицинская помощь пациентам с хронической болью // Паллиативная медицина и реабилитация. М., 2019. № 2 (апрель—июнь).
Источник
23 апреля 2019 г.
Просмотров: 1667
Согласно определению Международной ассоциации по изучению боли (IASP),к хронической относят боль, которая сохраняется более 3 месяцев. Это достаточно типичная ситуация для онкологического больного. При прогрессировании опухолевого процесса хроническая боль отягощает жизнь пациента и окружающих его людей, представляет серьезную медицинскую и социальную проблему. У онкологических пациентов болевые ощущения не являются временными или преходящими, в них нет биологической целесообразности, они не играют защитной роли. Возникшая у онкологического пациента боль ведет к дезадаптации, к ненормальному восприятию болевых импульсов и сопровождается различными нарушениями функции центральной нервной системы (ЦНС).
Клиническая картина болевого синдрома зависит от локализации очага поражения, патогенетического типа боли, индивидуального порога болевой чувствительности, предшествующего болевого опыта.
Этиология
Выделяют следующие основные причины хронической боли у онкологических больных:
- боль, вызванная самой опухолью (поражение костей, мягких тканей, кожи, внутренних органов, органов пищеварительной системы, окклюзия сосудов и др.);
- боль при осложнениях опухолевого процесса (патологический перелом, некроз, изъязвление, воспаление, инфицирование тканей и органов, тромбозы);
- боль при паранеопластических синдромах (артро-, нейро- и миопатии);
- боль как следствие астенизации (пролежни, трофические язвы, запор);
- боль, обусловленная противоопухолевым лечением:
- при осложнениях хирургического лечения рака (фантомная боль, боли при спайках, рубцах, отеках);
- при осложнениях химиотерапии (мукозиты, полинейропатия, генерализованная миалгия, асептический некроз, артралгии);
- при реакциях и осложнениях лучевой терапии (поражение кожи и слизистых оболочек, костей, фиброз, неврит, плексит, миелопатия и др.).
Типы боли и механизм их развития
Выделяют три патогенетических типа боли: ноцицептивный, нейропатический и психогенный. При ноцицептивном типе боли происходит раздражение специфических периферических болевых рецепторов (ноцицепторов),которые расположены во всех органах и тканях: в коже, слизистых оболочках, стенках полых органов, капсулах паренхиматозных органов, в костях и надкостнице.
Повреждения, сопровождающие опухоли, приводят к деструкции клеточных мембран, в результате этого запускается цепь гистохимических реакций с высвобождением тканевых альгогенов, к числу которых в настоящее время относят более 30 различных субстанций. Важнейшими из них принято считать простагландин Е2 (ПГЕ2),гистамин, серотонин и другие биоактивные вещества. В патологическом очаге также активны альгогены, поступающие из плазмы. К ним относятся брадикинин и каллидин. Как плазменные, так и тканевые альгогены взаимодействуют с соответствующими структурами на поверхности болевых рецепторов,резко повышая их чувствительность.
Особенность формирования ноцицептивной боли при онкологическом процессе — способность болевых рецепторов активироваться не только при взаимодействии с воспалительными альгогенами, но и при воздействии на них специфических опухолевых факторов, что способствует усилению потока болевых импульсов. При этом ноцицепторы взаимодействуют как с продуктами метаболизма опухолевых клеток, так и с факторами повреждения или воспаления тканей. На ноцицепторы при онкологической боли воздействуют внеклеточные ионы водорода Н+, эндотелин 1, интерлейкины разных типов и фактор некроза опухоли.
В результате этих разнообразных и частых воздействий генерируются болевые импульсы. По афферентным нервным волокнам болевой импульс поступает в задние рога спинного мозга, откуда по спиноталамическому тракту — в вышележащие отделы ЦНС, ядра таламуса. В дальнейшем вся сенсорная болевая информация поступает в нейроны серого вещества проекционных зон коры больших полушарий, где происходят ее обобщение, обработка и анализ (перцепция),после чего организм осознает боль и степень опасности произошедшего повреждения.
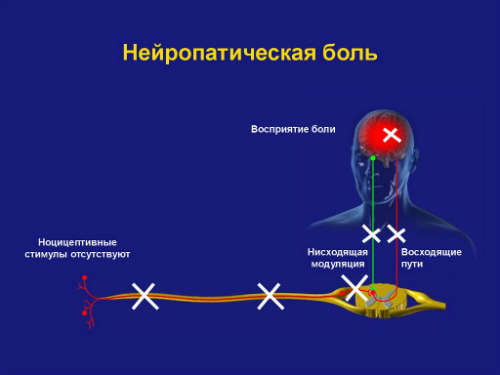
Нейропатическая боль имеет принципиальное отличие от ноцицептивной в механизмах формирования. Нейропатическая боль у онкологических пациентов может возникать как результат повреждений на разных уровнях нервной системы — от периферических нервов до нейронов коры головного мозга.
При повреждении головного или спинного мозга развивается центральная нейропатическая боль. При повреждениях структур периферической нервной системы (корешков спинномозговых нервов, нервных сплетений, периферических нервов) развивается периферическая нейропатическая боль.
Нейропатическая боль у онкологических пациентов часто гетерогенна, так как может иметь одновременно несколько причин, например, компрессия нервов (79%),деафферентационное повреждение нервов (16%),симпатически усиленная боль (5%). Симпатически усиленная боль — каузалгия, которая проявляется локальной вазодилатацией, гипертермией, повышенным потоотделением, трофическими расстройствами, извращенными сенсорными реакциями.
Опухоли, неудержимо разрастаясь в объеме, способны сдавливать структуры периферической нервной системы либо прорастать непосредственно в нервные сплетения, корешки и ветви периферических нервов, вызывая боль, нарушая сенсорную и моторную функции. Длительно существующая опухолевая компрессия, как и инфильтрация нервных структур, приводит к повреждению волокон нерва, вызывая дегенеративные изменения и деафферентацию (централизацию) боли.
Нейропатическая боль у онкологического больного может сопровождаться разнообразной неврологической симптоматикой, в которой присутствуют симптомы усиления чувствительности: жгучая или простреливающая боль высокой интенсивности, гиперестезия, гипералгезия, боль в ответ на неболевое раздражение (аллодиния),симптомы выпадения или ослабления сенсорных ощущений.
Психогенная боль возникает в ответ на индивидуальное эмоционально значимое переживание (депрессия, стресс, страх, истерия, бред, боли, галлюцинации и т.п.). Эти эмоциональные проявления могут вызывать изменения в симпато-адреналовой системе, системе выработки гипофизарных гормонов, что ведет к дисбалансу в работе висцеральных систем.
Лекарственная терапия хронической онкологической боли
Основным методом симптоматического лечения хронической боли онкологического генеза является системная фармакотерапия. Принципы медикаментозного лечения хронической боли включают следующие основные положения:
- подход к назначению лечения должен быть индивидуализированным;
- выбор препарата осуществляется в зависимости от патофизиологического типа и ее интенсивности;
- лечение осуществляется «по восходящей» в соответствии с «анальгетической лестницей ВОЗ»;
- преимущество отдается неинвазивным путям введения препаратов (пероральному и трансдермальному) и соответствующим лекарственным формам анальгетиков;
- препараты следует назначать в фиксированное время суток, «по часам», а не «по требованию»;
- препараты следует назначать в адекватных дозах;
- необходимо предотвращать развитие нежелательных эффектов и бороться с ними при их возникновении.
При лечении ноцицептивной боли ВОЗ рекомендует трехступенчатую схему использования анальгетиков («анальгетическую лестницу ВОЗ»). На первой ступени обезболивания, при наличии слабой боли, назначают препараты неопиоидного ряда, ненаркотические анальгетики (парацетамол,метамизол) или НПВП. При усилении боли и недостаточной эффективности ненаркотических анальгетиков и НПВП к ним добавляют сначала слабые (трамадол, кодеин, дигидрокодеин),а затем сильные опиоиды (бупренорфин, морфин, оксикодон, фентанил). Также при наличии тех или иных симптомов или при развитии нежелательных явлений от применения анальгетиков в терапию включаются адъювантные средства.
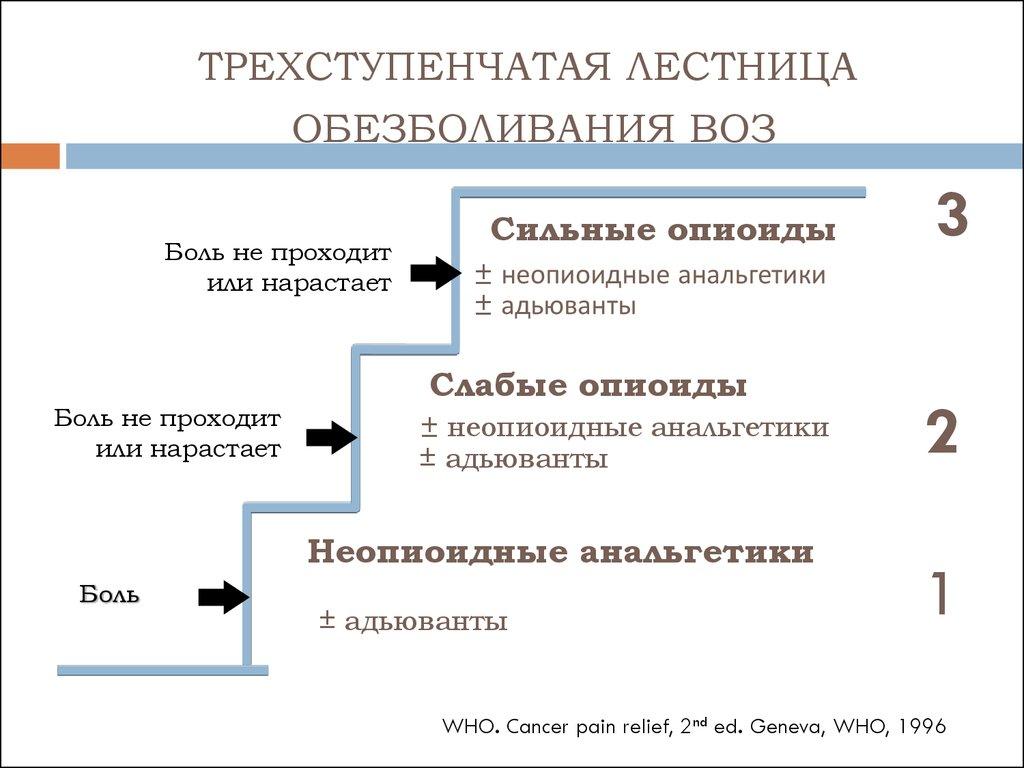
«Анальгетическая лестница ВОЗ»
1-я ступень НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
2-я ступень СЛАБЫЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
3-я ступень СИЛЬНОДЕЙСТВУЮЩИЙ ОПИАТ + НЕНАРКОТИЧЕСКИЙ АНАЛЬГЕТИК или НПВП (с возможным добавлением адъювантов)
В целом такая тактика лечения хронической боли позволяет достичь удовлетворительного обезболивания у 77-90% онкологических больных. В России зарегистрированы основные лекарственные препараты как из группы НПВП, так и из группы опиоидов для лечения хронической боли, рекомендуемые ВОЗ.
По мнению экспертов ВОЗ, для длительной терапии хронической боли анальгетики следует использовать в удобных для пациентов неинвазивных формах, предназначенных для введения: внутрь, трансбуккально, подъязычно, трансдермально, ректально.
Для длительной плановой терапии предпочтительны в лекарственные формы продленного действия (депо-формы).
К 1-й ступени «лестницы обезболивания» ВОЗ относят препараты из группы ненаркотических анальгетиков (парацетамол, метамизол) и препараты из группы НПВП (кеторолак, диклофенак, кетопрофен, лорноксикам, нимесулид, мелоксикам, целекоксиб).
Применение НПВП показано на всех этапах терапии боли у онкологических больных. У больных с опухолями и/или метастазами, поражающими мягкие ткани и кости, всегда развивается выраженное перифокальное воспаление. В начале 70-х годов ХХ века было установлено, что болеутоляющее, жаропонижающее и противовоспалительное действие НПВП обусловлено подавлением синтеза простагландинов. НПВП снижают продукцию простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ).

На сегодня выделяют три изоформы ЦОГ. Считают, что избирательное угнетение ЦОГ-2 приводит к подавлению воспаления и боли. В то же время сохранение активности ЦОГ-1 определяет репаративные процессы в желудке, кровоток в почках. Было отмечено, что парацетамол и метамизол слабо влияют на синтез простагландинов в периферических тканях, но подавляют продукцию простагландинов в ЦНС. В последние годы появились сведения о том, что в ЦНС имеется третий, отличный от первых двух тип ЦОГ, названный ЦОГ-3. Ингибирование ЦОГ-3 головного мозга сопровождается подавлением боли и снижением температуры тела при лихорадке.
Все НПВП могут вызывать осложнения со стороны желудочно-кишечного тракта (ЖКТ): диспепсию, язвы, кровотечения и перфорацию верхних и нижних отделов ЖКТ, железодефицитную анемию.
Все НПВП могут вызывать осложнения со стороны сердечно-сосудистой системы (ССС): дестабилизацию артериальной гипертензиии сердечной недостаточности, повышают риск «кардиоваскулярных катастроф» (инфаркт миокарда, ишемический инсульт) и летальности.
Все НПВП могут оказывать негативное влияние на функцию почек и печени (особенно при наличии заболеваний последних),а в ряде случаев вызывать серьезные нефро- и гепатотоксические реакции.
Препараты группы противопоказаны при эрозивно-язвенных поражениях желудочно-кишечного тракта (ЖКТ) в стадии обострения, состояниях гипокоагуляции (в том числе при гемофилии, геморрагическом диатезе, тромбоцитопении),при бронхиальной астме, тяжелой хронической сердечной недостаточности, гиповолемии, тяжелой почечной и печеночной недостаточности, состояниях, сопровождающихся гиперкалиемией, могут вызвать обострение и осложнения воспалительных заболеваний кишечника (ВЗК).
НПВП могут вызывать кожные реакции и бронхоспазм. Риск развития осложнений со стороны указанных органов и систем существенно отличается при использовании различных НПВП. Для предотвращения осложнений необходим учет факторов риска и выбор наиболее безопасного НПВП.
Для снижения риска развития НПВП гастропатии необходимо дополнительное назначение препаратов из группы ингибиторов протонной помпы и применение низких доз аспирина для снижения риска кардиоваскулярных осложнений. В настоящее время НПВП классифицируются по степени селективности ингибирующей активности в отношении разных изоформ ЦОГ.
В клинике «Медицина 24/7» работает круглосуточный хоспис для онкологических больных. Весь коллектив клиники работает на то, чтобы продлить жизнь человека и устранить болезненные симптомы. Наши врачи назначают и проводят паллиативное лечение для облегчения состояния пациента, а также подбирают наиболее подходящую схему обезболивания. Наши медсестры и санитарки готовы обеспечить достойный уход пациенту на терминальной стадии рака.
Литература:
- Исакова М.Е. Болевой синдром в онкологии. — М.: Практическая медицина, 2011. — 384 с.
- Каприн А.Д., Абузарова Г.Р., Хороненко В.Э. и др. Фармакотерапия хронического болевого синдрома у онкологических пациентов. Медицинская технология. — М.: МНИОИим. П.А. Герцена, 2015. — 48 с.
- Машфорт М.Л., Купер М.Г., Кохен М.Л. и др. Боль и аналгезия. Руководство для практикующих врачей / Перевод сангл. А.Н. Редькин; ред. рус. изд. Бунятян А.А., НасоновЕ.Л., Никода В.В. — М.: Литтерра, 2004. — 488 с.
- Новиков Г.А., Осипова Н.А. Лечение хронической боли онкологического генеза: учебное пособие. Москва. — 83 с.
- Новиков Г.А. Контроль симптомов в паллиативной медицине. — М.: ГЭОТАР-Медиа, 2013. — 248 с.
- Осипова Н.А., Абузарова Г.Р., Петрова В.В. Принципы клинического применения наркотических и ненаркотических аналгетических средств при острой и хронической боли. Методические указания. Практическое руководство для врачей. М., 2005. — 79 с.
- Штрибель Х.В. Терапия хронической боли. Практическое руководство / Пер. с нем.; ред. Осипова Н.А., ДаниловаА.Б., Осипова В.В. — М.: ГЭОТАР-Медиа, 2005. — 303 с.
- Ahmedzai S.H., Leppert W., Janecki M., Pakosz A., LomaxM., Duerr H., Hopp M.
- Long-term safety and efficacy of oxycodone/naloxoneprolonged-release tablets in patients with moderate-to-severechronic cancer pain. Support Care Cancer. 2015 Mar; 23 (3):823-30.
- Caraceni A., Hanks G., Kaasa S. et al. Use of opioid analgesicsin the treatment of cancer pain: evidence-basedrecommendations from the EAPC // Lancet Oncol. 2012 Feb;13 (2): e 58-68.
- Mystakidou K., Parpa E., Tsilika E. et al. Pain management ofcancer patients with transdermal fentanyl: a study of 1828 stepI, II, & III transfers. // J. Pain. 2004; 5: 119–13212. Skaer T.L. Transdermal opioids for cancer pain. // HealthQual. Life Outcomes. 2006 Mar 31; 4: 2413. World Health Organization. Cancer pain relief: with a guide toopioid availability. 2. Geneva: WHO; 1996.14. Zech D.F., Grond S., Lynch J., Hertel D., Lehmann K.A.Validation of World Health Organization guidelines forcancer pain relief: A 10-year prospective study. Pain. 1995;63: 65–76.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 1. 2018.
Источник
