Патология глаз при псевдоэксфолиативном синдроме тахчиди

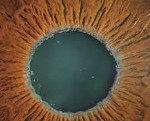
Псевдоэксфолиативный синдром – это увеопатия, характеризующаяся отложением амилоидоподобного вещества на структурах переднего сегмента глазного яблока. Клиническая картина представлена зрительной дисфункцией, появлением «помутнений» и «радужных кругов» перед глазами, затуманиванием зрения. Диагностика базируется на проведении ультразвуковой биомикроскопии, классической биомикроскопии с использованием щелевой лампы, скополаминовой пробы, УЗИ, визометрии, тонометрии, периметрии, гониоскопии. Консервативная терапия основывается на применении антиоксидантов, антигипоксантов, гипотензивных средств, витаминов группы В, А, Е.
Общие сведения
Псевдоэксфолиативный синдром впервые был описан финским ученым Дж. Линдбергом в 1917 году. Наблюдается взаимосвязь между развитием болезни и возрастом пациента. В 50-59 лет вероятность возникновения патологии составляет 1-2,5%, в 60-69 лет – 30%, после 70 лет – 42%. Согласно статистическим данным, заболевание диагностируется у 30% россиян старше 50 лет. Риск развития глаукомы у пациентов с псевдоэксфолиативным синдромом равен 64,6%. Патология чаще встречается среди представителей женского пола, однако тяжелее протекает у мужчин. Распространенность наиболее высока в серверных регионах.
Псевдоэксфолиативный синдром
Причины псевдоэксфолиативного синдрома
Этиология заболевания до конца не изучена. Продолжительное время ученые связывали развитие патологии с изменениями строения эпителия хрусталика, однако диагностика псевдоэксфолиативного синдрома после интракапсулярной экстракции катаракты позволила опровергнуть эту теорию. На сегодняшний день ведущая роль в развитии болезни отводится действию следующих факторов:
- Ультрафиолетовое излучение. Воздействие ультрафиолета индуцирует свободно-радикальное окисление и деструкцию клеточной мембраны. Это влечет за собой атрофию с типичными признаками эксфолиации.
- Травматическое повреждение. Травмы глазного яблока приводят к локальным изменениям, которые у генетически скомпрометированных лиц являются пусковым фактором пигментной дисперсии.
- Внутриорбитальные инфекции. Многие авторы полагают, что поражение глаз обусловлено повышенной проницаемостью гематоофтальмического барьера (ГОБ). Способностью проникать через ГОБ наделена токсоплазма, вирус опоясывающего герпеса и краснухи.
- Нарушения иммунного статуса. В пользу этой этиологической теории псевдоэксфолиативного синдрома свидетельствует обнаружение в слезной жидкости повышенной концентрации интерлейкинов 6, 10, иммуноглобулина класса А и лактоферрина.
- Генетическая предрасположенность. У некоторых пациентов можно установить нарушение экспрессии генов в ядре и митохондриях. Встречаемость ПЭС среди родственников гораздо выше, чем в популяции. Прослеживается аутосомно-доминантный тип наследования.
Ученые полагают, что развитию болезни способствует курение и аутоиммунные патологии. Удается проследить взаимосвязь между возникновением ПЭС и артериальной гипертензией, атеросклерозом, аневризмой аорты в анамнезе. Некоторые исследователи полагают, что данные изменения – это следствие системной васкулопатии, поэтому пациенты с ПЭС часто страдают кардиоваскулярными заболеваниями.
Патогенез
Ключевая роль в механизме развития заболевания отводится образованию и депонированию аномального экстрацеллюлярного микрофибриллярного белка на поверхности передней капсулы хрусталика и радужки, цилиарном теле, цинновых связках, по краю зрачкового отверстия. Реже визуализируются патологические отложения в области передней камеры. Установлено, что белок относится к амилоидоподобной субстанции, за его синтез отвечает пигментный эпителий и меланоциты радужки. Согласно современным представлениям, патогенез ПЭС связан с нарушением эпителио-мезенхимальных взаимоотношений в структурах глазного яблока. Проникновение белковых структур в толщу его оболочек ведет к их дистрофическому перерождению.
Псевдоэксфолиативный синдром принято рассматривать как системное нарушение метаболизма соединительной ткани. Подтверждением этой теории является обнаружение специфических отложений в паренхиматозных органах (печень, почки, сердце, головной мозг) и кожных покровах. Учеными было обнаружено 14 антигенов главного комплекса гистосовместимости (HLA) при наследуемой форме патологии. Прогрессирование заболевания ведет к атрофии пигментной каймы, что проявляется выраженной дисперсией пигмента. Пигментоциты удается обнаружить в УПК и на радужной оболочке. Из-за поражения дренажной сети нарушается отток водянистой влаги с последующим повышением внутриглазного давления.
Классификация
В офтальмологии различают генетически детерминированный и иммуноопосредованный вариант развития. Вне зависимости от патогенеза болезнь всегда возникает в преклонном возрасте. По выраженности дистрофических изменений выделяют следующие степени псевдоэксфолиативного синдрома:
- I – проявляется легкой атрофией радужки. Патологический процесс не распространяется за пределы корня оболочки. Кайма зрачка имеет неравномерную структуру. В области хрусталика определяется маловыраженное наслоение амилоида.
- II – атрофия стромы радужной оболочки умеренная. На поверхности радужки и в зоне УПК выявляются выраженные псевдоэксфолиативные и пигментные отложения.
- III – атрофические изменения резко выражены. Пигментная кайма имеет вид «целлофановой пленки», что обусловлено дисперсией пигмента. Поражение связочного аппарата вызывает подвывих, реже – вывих хрусталика.
Клиническая классификация базируется на результатах ультразвуковой биомикроскопии. Различают следующие стадии патологического процесса:
- I – признаки поражения соответствуют псевдоэксфолиативному синдрому. Удается визуализировать точечные включения в передних отделах глаз.
- II – к вышеописанным изменениям присоединяются начальные признаки повреждения цинновой связки в виде чередования зон истончения с утолщением. Длина волокон разная.
- III – аномальные включения становятся более плотными, провоцируют разрушение связочного аппарата.
- IV – включения объединяются в большие конгломераты, которые приводят к увеличению продольной оси глазного яблока за счет удлинения переднего сегмента.
Симптомы псевдоэксфолиативного синдрома
Для заболевания характерно длительное бессимптомное течение. Вначале поражается один глаз (зачастую левый). Вовлечение второго глазного яблока, как правило, наблюдается спустя 5-10 лет после развития первых симптомов. Жалобы обычно возникают уже после массивного отложения амилоида. Пациенты отмечают появление «помутнений» перед глазами. При взгляде на источник света появляются специфические «радужные круги». Снижение остроты зрения обусловлено поражением хрусталика, повышением ВГД и атрофией сфинктера радужки. Нарушается аккомодационная способность, в дальнейшем расстройства аккомодации сопровождаются затуманиванием зрения, нарушением рефракции. Болевой синдром появляется только при повреждении связочного аппарата.
Заболевание очень медленно прогрессирует. Пациенты часто игнорируют клинические проявления. Помимо жалоб со стороны глаз при отложении белка во внутренних органах возникают симптомы их поражения. При депонировании амилоида в печени отмечается чувство тяжести в правом подреберье, реже – желтушность кожных покровов. Боль в пояснице по типу почечной колики, нарушения мочеиспускания являются типичными признаками скопления белковых масс в паренхиме почек. При распространении патологического процесса в толщу миокарда наблюдается ощущение сдавливания за грудиной, покалывание в области сердца. Доказано, что ПЭС широко распространена среди больных сенильной деменцией, когнитивными расстройствами, хронической ишемией головного мозга, болезнью Альцгеймера.
Осложнения
Отложение белка в толще хрусталиковых масс провоцирует развитие вторичной катаракты ядерного типа, которая зачастую сопровождается слабостью связочного аппарата. Это приводит к тому, что более чем у половины больных катарактой возникает сублюксация, реже – люксация хрусталика. В большинстве случаев патология осложняется офтальмогипертензией. Поражение трабекулярной сети ведет к возникновению псевдоэксфолиативной открытоугольной глаукомы, а с прогрессированием заболевания – к глаукомной оптической нейропатии или слепоте. Поражение мейбомиевых желез становится причиной ксерофтальмии.
Диагностика
Постановка диагноза на доклинической стадии затруднена. Выявить первые признаки можно только при помощи ультразвуковой биомикроскопии. Специфические методы диагностики включают:
- Биомикроскопию глаза. Позволяет визуализировать скопления белого или сероватого оттенка, напоминающи е хлопья на поверхности оболочек переднего отдела органа зрения. Хаотичные скопления пигмента могут формировать веретено Крукенберга. Псевдоэксфолиации по структуре похожи на воспалительные преципитаты.
- Гониоскопию. В передней камере определяются множественные включения, которые на поздних стадиях формируют крупные конгломераты. При нарушении проницаемости гематоофтальмического барьера в водянистой влаге обнаруживается взвесь крови. Объем камеры не изменен.
- Бесконтактную тонометрию. Характерно повышение внутриглазного давления, которое при вторичной глаукоме тяжело поддается снижению медикаментозным путем. При поражении дренажной системы дополнительно проводится электронная тонография.
- УЗИ глаза. При использовании ультразвуковой диагностики можно обнаружить разрыв цинновой связки с возникновением сферофакии. Из-за массивных отложений белка нарушается соотношение размеров переднего и заднего сегментов. Методика также применяется с целью обследования заднего сегмента глаз при снижении прозрачности оптических сред.
- Ультразвуковую биомикроскопию. Дает возможность выявить мелкоточечные включения слабой акустической плотности на оболочках глаза, разницу длины и лизис отдельных волокон цинновой связки.
- Скопаламиновую пробу. При 1 степени при проведении пробы зрачковое отверстие расширяется до 5 мм, при 2 – до 3,5-4 мм. При 3 степени патологии реакция зрачка отсутствует.
- Визометрию. Зрительная дисфункция наблюдается при помутнении оптических сред или вторичной глаукоме. При тяжелом течении острота зрения снижается вплоть до светоощущения.
- Периметрию. Определяется концентрическое сужение поля зрения. В ряде случаев удается диагностировать выпадение отдельных участков из зрительных полей, скотомы.
Пациентам с данной патологией в анамнезе показана консультация невропатолога, ревматолога, кардиолога, гастроэнтеролога, отоларинголога. Необходимость проведения комплексного обследования вызвана системным поражением фиброзной ткани. Часто выявление первых симптомов поражения глаза позволяет диагностировать отложения амилоида в других паренхиматозных органах.
Лечение псевдоэксфолиативного синдрома
Этиотропная терапия псевдоэксфолиативного синдрома не разработана. Цель консервативного лечения – предупредить развитие тяжелых осложнений. На ранних стадиях показано применение:
- Антиоксидантов. Используются лекарственные средства, в состав которых входит супероксиддисмутаза. СОД относится к классу металлопротеидов. Антиоксиданты вызывают разрушение активных форм кислорода, которые оказывают повреждающее влияние на ткани глаза.
- Антигипоксантов. С целью улучшения метаболизма и стимуляции процесса тканевого дыхания применяется цитохром С. Инстилляции препарата способствуют ускорению эпителизации и репарации повреждений структур передних сегментов глаз.
- Гипотензивных средств. Показаны при повышении внутриглазного давления, признаках офтальмогипертензии и начальных стадиях развития псевдоэксфолиативной глаукомы.
- Витаминотерапии. Доказана эффективность применения метилэтилпиридинола (структурный аналог витамина В6), который обладает фибринолитическим и антиоксидантным действием. В окислительно-восстановительных процессах также участвует витамин А (ретинола ацетат) и Е (токоферола ацетат).
При длительном течении патологии целью лечения является устранение или снижение выраженности вторичных осложнений. Медикаментозная терапия псевдоэксфолиативной глаукомы зачастую не оказывает должного эффекта. Возникает необходимость в лазерном или хирургическом вмешательстве. Наиболее целесообразно проведение ранней лазерной трабекулопластики, однако спустя 3-4 года возникают рецидивы повышения ВГД. При выборе метода удаления сублюксированного хрусталика следует отдавать предпочтение факоэмульсификации. Методикой резерва остается экстракапсулярная экстракция.
Прогноз и профилактика
Исход заболевания зависит от степени тяжести, характера поражения структур переднего отдела глаз и типа осложнений. При своевременной диагностике и лечении осложнений прогноз в отношении зрительных функций благоприятный. Возникновение вторичной глаукомы ассоциировано с резистентностью к консервативной терапии и риском необратимой потери зрения. Специфическая профилактика не разработана. Даже при ранних симптомах псевдоэксфолиативного синдрома необходима постановка на диспансерный учет у офтальмолога из-за высокой вероятности развития глаукомы. Показан регулярный контроль внутриглазного давления. Больные должны проходить комплексное офтальмологическое обследование не реже, чем два раза в год.
Источник
Патогенез псевдоэксфолиативного синдрома (ПЭС) является многофакторным сложным процессом [5, 9]. Проведенные ранее исследования показали, что в его развитии определенную роль играют нейроциркуляторные нарушения в переднем отрезке глаза, запускаемые дисфункцией вегетативной нервной системы (ВНС) [7, 8]. В частности, было доказано, что у пациентов с ПЭС тонус парасимпатической нервной системы преобладает над тонусом симпатической. Одним из возможных вариантов объяснения этого является угнетение симпатического отдела ВНС. Общеизвестно, что существенным клиническим признаком ПЭС, помимо псевдоэксфолиативных отложений на различных внутриглазных структурах, является наличие ригидного зрачка, с трудом поддающегося действию мидриатиков, что может быть обусловлено угнетением передачи по симпатическим волокнам вследствие повреждения симпатических центров или нарушения проведения импульсов по ходу всех трех нейронов вследствие травмы, сдавления, воспаления.
Учитывая близость к позвоночному столбу симпатических нервных образований, ответственных за обеспечение мидриаза, можно предположить, что деформации позвоночника, различные структурные изменения межпозвоночных дисков, оказывая компрессию в проекции симпатических центров, могут вызвать нарушение проведения импульсов с угнетением функции мидриаза, а также развитие всего остального симптомокомплекса нейротрофических и гемомикроциркуляторных изменений, типичных для ПЭС.
Цель работы — на основании данных магнитно-резонансной томографии (МРТ) выявить возможные структурные изменения шейного отдела позвоночника дегенеративного характера у больных ПЭС, которые могли бы вызывать у них нарушения симпатической иннервации компрессионного происхождения.
Под нашим наблюдением находились 33 пациента с ПЭС в возрасте от 50 до 79 лет (средний возраст 64,2±7,2 года), из них 19 женщин и 14 мужчин. Офтальмологическое обследование было общепринятым. Особое внимание обращалось на биомикроскопические признаки ПЭС. Отмечались имеющиеся псевдоэксфолиации на зрачковой кайме, передней поверхности хрусталика, задней поверхности роговицы, в углу передней камеры, на цинновых связках. В последнем случае использовалась биомикроскопия с помощью линзы Гольдмана в состоянии медикаментозного мидриаза. Только полное отсутствие биомикроскопических признаков ПЭС позволяло нам считать глаз интактным, а процесс клинически односторонним. Косвенным подтверждением интактности глаза в плане ПЭС являлись нормальные или близкие к таковым значения времени зрачкового цикла (ВЗЦ) и давления в передних цилиарных артериях. Эти показатели определялись по описанным ранее методикам [6, 7]. Выполнялась фоторегистрация состояния переднего отдела глаза на фотощелевой лампе BP-900 фирмы «Haag-Streit».
Пациенты с ПЭС подразделялись следующим образом. Псевдоэксфолиативные отложения на интраокулярных структурах обоих глаз были выявлены у 12 пациентов, правостороннее поражение имелось у 11 человек, левостороннее — у 10. У 18 пациентов наряду с ПЭС установлено наличие помутнений хрусталика.
Контрольную группу составили 11 пациентов с начальной катарактой без признаков ПЭС. Возраст их колебался от 50 до 69 лет (средний возраст 57,9±7,2 года). Женщин было 6, мужчин — 5. Офтальмологическое обследование было таким же, как в основной группе.
Для установления уровня и характера поражения позвоночного столба и выявления возможного компрессионного воздействия на нервные образования (корешки и узлы), могущего вызывать нарушения симпатической иннервации, в процессе углубленного обследования всем лицам обеих групп была выполнена МРТ шейного отдела позвоночника на аппарате Magnetom Vision (производства фирмы «Siemens»). Показанием к назначению данного вида обследования явилось наличие клинической картины шейного остеохондроза, верифицированного неврологом.
Основные данные обследования наших пациентов, позволяющие представить взаимосвязи между наличием ПЭС, стороной его локализации и деформациями шейного отдела позвоночника, вызывающими компрессию нервных образований, ответственных за симпатическую иннервацию зрачка, представлены в табл. 1—3.


Все пациенты имели шейный остеохондроз, верифицированный данными МРТ. В качестве основного критерия, свидетельствующего о компрессионном воздействии на нервные структуры, расположенные паравертебрально, нами были выделены протрузии межпозвоночных дисков. Они подразделялись на право-, левосторонние, циркулярные, а также центральные (задние) с латерализацией вправо или влево либо без латерализации (медианные). При оценке выраженности протрузий учитывались их размеры и наличие сдавления ими корешков спинного мозга. При распространении протрузий за пределы задней продольной связки позвоночника они классифицировались как грыжи.
У всех 33 пациентов основной группы наблюдались изменения шейного отдела позвоночника в виде протрузий межпозвоночных дисков. Локализация протрузий определялась на уровне позвонков от CII—CIII до CVII—ThI. В 30 (90,9%) случаях имелись МР-признаки сдавления корешков спинного мозга на различных уровнях — от CII—CIV до CVII—ThI. Размеры протрузий варьировали от 3×3 до 10×3 мм. У двух пациентов протрузии на уровне CVI—CVII носили характер грыж, сдавливающих корешки спинного мозга.
У всех 11 пациентов контрольной группы также имелись протрузии на уровне позвонков от CII—CIII до CVI—CVII(табл. 4). Однако сдавление корешков спинного мозга наблюдалось только в двух случаях на уровне CV—CVI и CVI—CVII (18,2%). У одного пациента протрузия имела характер задней медианной грыжи без латерализации и признаков сдавления корешков.
Однако сдавление корешков спинного мозга наблюдалось только в двух случаях на уровне CV—CVI и CVI—CVII (18,2%). У одного пациента протрузия имела характер задней медианной грыжи без латерализации и признаков сдавления корешков.
Для пояснения патогенетического и клинического значения положения протрузий уместно привести некоторые сведения из анатомии симпатического отдела ВНС. Симпатическая иннервация зрачка представлена тремя нейронами [3]. Центральный нейрон начинается в заднем гипоталамусе и неперекрещенным спускается по стволу мозга до цилиоспинального центра Будге в латеральном промежуточном веществе спинного мозга между сегментами CVIII и ThII Преганглионарный нейрон идет от цилиоспинального центра до верхнего шейного симпатического узла. Верхний шейный симпатический ганглий находится на уровне второго и третьего шейных позвонков, вблизи их поперечных отростков. Этот ганглий образован слиянием ганглиев первых трех, а иногда и четырех шейных сегментов. Он отдает серые постганглионарные соединительные веточки нервным корешкам CIII и CIV. Постганглионарный нейрон в виде внутреннего симпатического нерва поднимается вдоль внутренней сонной артерии, в полости черепа проходя через каротидный канал и образуя внутреннее сонное сплетение, вплотную прилежащее к артерии на всем ее протяжении. В области пещеристой пазухи на нижнемедиальной поверхности сонной артерии из симпатических волокон образуется пещеристое сплетение, которое простирает ветви к ганглию тройничного нерва и его глазной ветви. Далее симпатические волокна идут в составе носоресничного нерва и достигают дилататора зрачка через длинные цилиарные нервы.
По нашим данным, в основной группе в 10 (30,3%) случаях значимые протрузии со сдавлением корешков спинного мозга располагались на уровне CIII—CIV, что соответствует положению верхнего шейного симпатического узла. Протрузии на уровне CVI—CVII встречались у 20 (60,6%) больных. Данный уровень поражения с учетом известного несоответствия длины спинного мозга и позвоночника соответствует проекции сегментов CVIII—ThII, т.е. положению цилиоспинального центра дилататора [10]. У 24 (72,7%) больных протрузии находились на уровне CV—CVI. Синотопически на уровне шестого шейного позвонка находится средний шейный симпатический ганглий, связанный со звездчатым ганглием. Значение уровня поражения CV—CVI можно предположить, учитывая сведения о том, что симпатические волокна, покидая спинной мозг и направляясь по шейному стволу к верхнему шейному ганглию, проходят, не давая синапсов, через нижний и средний шейные ганглии [3]. Следовательно, в среднем шейном ганглии имеется представительство пупилломоторных волокон.
Таким образом, самыми частыми из всех встречавшихся вариантов локализации по уровню были протрузии межпозвоночных дисков, приближенные к проекции цилоспинального центра дилататора (CV—CVI) или соответствующие данной проекции (CVI—CVII) (рис. 1). Рисунок 1. Частота встречаемости протрузий межпозвоночных дисков и сдавления корешков спинного мозга в зависимости от уровня локализации протрузии у пациентов с ПЭС. Реже встречались протрузии в проекции верхнего шейного симпатического узла на уровне CIII—CIV. В целом же протрузии на уровне цилиоспинального центра или в проекции верхнего шейного симпатического узла либо сочетание обоих вариантов были отмечены в 84,8% случаев. Аналогичные закономерности имелись и в контрольной группе, где, однако частота встречаемости протрузий, как уже отмечалось, была значительно меньше (рис. 2).
Рисунок 1. Частота встречаемости протрузий межпозвоночных дисков и сдавления корешков спинного мозга в зависимости от уровня локализации протрузии у пациентов с ПЭС. Реже встречались протрузии в проекции верхнего шейного симпатического узла на уровне CIII—CIV. В целом же протрузии на уровне цилиоспинального центра или в проекции верхнего шейного симпатического узла либо сочетание обоих вариантов были отмечены в 84,8% случаев. Аналогичные закономерности имелись и в контрольной группе, где, однако частота встречаемости протрузий, как уже отмечалось, была значительно меньше (рис. 2). Рисунок 2. Частота встречаемости протрузий межпозвоночных дисков и сдавления корешков спинного мозга в зависимости от уровня локализации протрузии у лиц контрольной группы.
Рисунок 2. Частота встречаемости протрузий межпозвоночных дисков и сдавления корешков спинного мозга в зависимости от уровня локализации протрузии у лиц контрольной группы.
Сочетание протрузий на уровне CIII—CIV и CVI—CVII отмечено у 2 (6,1%) пациентов, что соответствует поражению на уровне обоих крупных нервных образований: как цилиоспинального центра, так и верхнего шейного узла. Аналогичное поражение можно было предполагать у 1 (3,0%) пациента с сочетанием протрузий на уровне CIII—CIV и CVII—ThI. Сочетание протрузий на уровне CIII—CIV и CV—CVI встречалось у 3 (9,1%) больных. У 17 (51,5%) пациентов имелось сочетание протрузий на уровне CV—CVI и CVI—CVII.
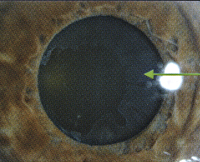
При сравнительном анализе изменений позвоночного столба и стороны поражения ПЭС (право- или левосторонний) была выявлена определенная тенденция, демонстрирующая преимущественную направленность латерализации протрузий межпозвоночных дисков, соответствующей стороне поражения ПЭС. Так, при правосторонней локализации псевдоэксфолиативных отложений правосторонние или центральные протрузии с латерализацией вправо встречались у 6 (54,5%) из 11 пациентов. При левостороннем поражении ПЭС левосторонние или центральные протрузии с латерализацией влево были отмечены у 6 (60%) из 10 пациентов. Пример такого сочетания представлен на рис. 3—5. Рисунок 3. Правый глаз больного В. без признаков ПЭС.
Рисунок 3. Правый глаз больного В. без признаков ПЭС. Рисунок 4. Левый глаз больного В. с выраженными псевдоэксфолиативными отложениями по зрачковому краю радужки.
Рисунок 4. Левый глаз больного В. с выраженными псевдоэксфолиативными отложениями по зрачковому краю радужки. Рисунок 5. МР-томограмма шейного отдела позвоночника больного В. Имеется задняя левосторонняя парамедианная протрузия межпозвоночного диска на уровне СV—СVI (стрелка), сдавливающая левый корешок спинного мозга.
Рисунок 5. МР-томограмма шейного отдела позвоночника больного В. Имеется задняя левосторонняя парамедианная протрузия межпозвоночного диска на уровне СV—СVI (стрелка), сдавливающая левый корешок спинного мозга.
При двустороннем поражении ПЭС было установлено наличие сочетанных протрузий в различных вариантах: имелись центральные задние без латерализации (66,7%) в сочетании с циркулярными (41,7%) и латерализованными (58,3%) видами. Интересен следующий факт, отмеченный в этой же группе: при большей выраженности ПЭС на правом или левом глазу определялась латерализация протрузии соответствующей направленности.
Отдельного упоминания заслуживают выявленные у пациентов с ПЭС на МР-томограммах признаки сдавления корешков спинного мозга. Они отмечались при всех локализациях протрузий, кроме CII—CIII(см. рис. 1).
В значительно меньшем числе случаев признаки сдавления имелись и у лиц контрольной группы (см. рис. 2). Несомненный интерес представляет выявленная у пациентов с ПЭС латерализация признаков сдавления корешков. В связи с тем, что сдавление отмечалось не только при латерализованных протрузиях, но и при циркулярных, а также центральных (задних) без латерализации, соответствие компрессии стороне поражения ПЭС встречалось значительно чаще, чем наличие латерализованных вариантов протрузий. Так, при правостороннем ПЭС сдавление корешков справа отмечалось у 10 (90,9%) из 11 больных, сочетаясь у 4 с левосторонним сдавлением (см. табл. 1). При левостороннем ПЭС сдавление левых корешков отмечалось у 9 (90%) из 10 больных. При этом сопутствующее сдавление правых корешков имелось у 6 пациентов (см. табл. 2). При двустороннем ПЭС у 11 (91,7%) из 12 пациентов было двустороннее сдавление корешков. Во всех трех группах имелось по одному случаю вообще без сдавления корешков (см. табл. 1—3).
Полученные результаты позволяют предположить, что именно компрессионные нарушения симпатических нервных образований на уровне шейного отдела позвоночника могут играть решающую роль в зрачковых нарушениях, описанных нами ранее у пациентов с ПЭС [7, 8]. Однако симпатическая иннервация обеспечивает не только дилатацию зрачка. Хорошо известна ее трофическая и регулирующая роль для структур глаза, в частности для сосудистой оболочки. Из одной ветви, отдаваемой пещеристым сплетением к цилиарному ганглию, происходят короткие ресничные нервы, которые снабжают кровеносные сосуды глазного яблока сосудосуживающими волокнами и контролируют работу меланоцитов увеального тракта [1—3]. Блокирующие влияния на данный путь симпатической передачи могут служить источником гемомикроциркуляторных и трофических нарушений в радужной оболочке, клетки пигментного эпителия которой, возможно, являются продуцентами псевдоэксфолиативного материала [4]. Таким образом, симптомокомплекс структурных нарушений в шейном отделе позвоночника может являться одним из звеньев патогенеза ПЭС.
1. У всех пациентов с ПЭС выявлены структурные деформации шейного отдела позвоночника с наличием протрузий межпозвоночных дисков, приводящих к сдавлению корешков спинного мозга в 90,9% случаев.
2. Уровень локализации протрузий межпозвоночных дисков у пациентов с ПЭС соответствует локализации важнейших симпатических нервных образований, принимающих участие в зрачковом рефлексе: цилиоспинальному центру Будге и верхнему шейному симпатическому узлу. Нарушение иннервации, вызванное компрессионным действием протрузий на симпатические центры, может ингибировать работу дилататора и способствовать тем самым нарушениям зрачкового цикла.
3. У пациентов с односторонним ПЭС при наличии латерализованных межпозвоночных протрузий направленность латерализации совпадала со стороной поражения ПЭС в 54,5—60% случаев.
4. Структурные изменения позвоночника при шейном остеохондрозе, приводящие к нейротрофическим и гемомикроциркуляторным нарушениям, могут иметь патогенетическое значение в развитии ПЭС.
Источник
