Патологоанатомическая картина при двс синдроме

Морфологические
изменения при ДВС-синдроме складываются
из целого комплекса признаков, тесно
переплетающихся с проявлениями основного
заболевания и обусловленными пусковыми
механизмами, длительностью процесса и
лечебными мероприятиями. Среди всех
морфологических признаков по степени
диагностической ценности выделяют
прямые и непрямые.
Наибольшую
значимость имеют прямые признаки –
фибриновые образования, имеющие
разнообразную структуру и являющиеся
объективным морфологическим свидетельством
активации свертывания крови:
– отдельные волокна
и пучки фибрина, а также игловидные
перекрещивающиеся волокна фибрина
(предтромбы), построенные из
нестабилизированного фибрина;
– выстилание слоем
фибрина стенок сосудов, возникающее
при повреждении последних преимущественно
в зонах десквамации эндотелия;
– микротромбы,
локализующиеся в основном в
микроциркуляторном русле и имеющие
разнообразный вид в зависимости от
механизмов развития ДВС-синдрома:
• фибриновые
микротромбы, построенные из
стабилизированного фибрина и образующиеся
при относительно медленном развитии
процесса;
• гиалиновые
микротромбы, возникающие при стремительном
развитии процесса и состоящие из
нестабилизированного фибрина и/или
гемолизированных эритроцитов;
• глобулярные
микротромбы, возникающие на почве
нарушений кровообращения с агрегацией
эритроцитов, последующим гемолизом и
отложением окутывающего «тени»
эритроцитов фибрина;
• тромбоцитарные,
лейкоцитарные, эритроцитарные
микротромбы, отражающие участие в
фибринобразовании тех или иных форменных
элементов крови, построены в основном
из нестабилизированного фибрина;
• смешанные
микротромбы из стабилизированного и
нестабилизированного фибрина.
Наряду с микротромбами
большое значение в развитии блокады
сосудистого русла отводится агрегации
форменных элементов крови (эритроцитов
и тромбоцитов) – постоянного морфологического
признака ДВС-синдрома.
Непрямые признаки
ДВС-синдрома представляют собой следствие
развития блокады сосудистого русла
агрегатами клеток крови, микротромбами
и гемодинамических расстройств – некрозы.
К непрямым признакам относят также
геморрагический синдром.
Морфологическая картина стадий двс-синдрома
Сравнение
клинико-лабораторных данных и
морфологических изменений позволило
определить морфогенетическую картину
развития ДВС-синдрома.
1-я и 2-я стадии
ДВС-синдрома характеризуются появлением
на фоне сосудистого поражения (набухание
и десквамация эндотелия, плазматическое
пропитывание, фибриноидное набухание
и фибриноидный некроз) следующей картины
изменений:
– агрегация
тромбоцитов и эритроцитов вплоть до
развития сладж-феномена (необратимая
агрегация эритроцитов);
– развитие
гемодинамических расстройств со спазмом
артериальных сосудов и шунтированием
кровотока;
– образование
отдельных нитей и тяжей фибрина,
предтромбов, единичных микротромбов.
3-я стадия ДВС-синдрома
также характеризуется преимущественно
микроциркуляторными расстройствами в
виде агрегации и сладжирования форменных
элементов крови с сепарацией плазмы
(расслоение крови) в вено-венулярном
отделе сосудистого русла, спазма
артериальных сосудов и шунтирования
кровотока. Выраженность фибринобразования
в этой стадии зависит от состояния
сосудистых стенок. Однако в любом случае
внутрисосудистые фибриновые структуры
немногочисленны, хотя и разнообразны
по составу – предтромбы; фибриновые,
глобулярные, гиалиновые, смешанные и
др.; микротромбы различного «возраста»;
выстилание фибрином сосудистых стенок,
что отражает многообразие механизмов
активации свертывания крови и
непрерывность, волнообразность процесса.
Кроме того, в 3-й
стадии появляются, иногда выступая на
первый план, признаки геморрагического
синдрома, чаще всего в виде мелкоочаговых
кровоизлияний в серозные оболочки,
слизистые, внутренние органы, реже – в
кожу.
На почве блокады
сосудистого русла агрегатами форменных
элементов крови, микротромбами и
гемодинамических расстройств в 3-й, а
затем в 4-й стадии ДВС-синдрома формируется
разнообразная органная патология, чаще
всего следующая:
– «шоковое легкое»:
альвеолярный отек с кровоизлияниями,
внутрисосудистая агрегация эритроцитов,
микротромбоз, образование гиалиновых
мембран;
– микротромбоз
капилляров клубочков с некротическим
нефрозом вплоть до образования
симметричных кортикальных некрозов
почек;
– кровоизлияния и
некроз коры надпочечников (синдром
Уотерхауза-Фридериксена);
– некроз аденогипофиза;
– дистрофические
изменения с рассеянными мелкоочаговыми
некрозами
и кровоизлияниями
головного мозга, миокарда, печени,
поджелудочной железы;
– кровоизлияния,
эрозии и язвы желудочно-кишечного
тракта.
Соседние файлы в предмете Патологическая анатомия
- #
- #
- #
Источник
Патологическая анатомия
Конспект лекций. Минск: Международный государственный экологический университет имени А. Д. Сахарова, 2009.
5.1. Общие нарушения кровообращения
5.1.7. Синдром диссеминированного внутрисосудистого свертывания (двс-синдром, тромбогеморрагический синдром, коагулопатия потребления)
Синдром диссеминированного внутрисосудистого
свертывания характеризуется распространенным образованием маленьких тромбов
(фибринных, эритроцитарных, гиалиновых) в микроциркуляторном русле всего
организма в сочетании с несвертываемостью крови, приводящей к множественным
массивным кровоизлияниям. Это — серьезное и часто фатальное осложнение
многочисленных болезней и требует ранней диагностики и лечения. В основе его
лежит дискоординация функций свертывающей и противосвертывающей систем крови,
ответственных за гемостаз.
Во многих случаях причина диссеминированного
внутрисосудистого свертывания крови неизвестна. Наиболее частые причины
ДВС-синдрома: обширное повреждение эндотелия, например, при грам-отрицательной
бактериемии (грам-негативный сепсис, эндотоксический шок) (таблица 1); прямое
повреждение эндотелиальных клеток при вирусных и риккетсиозных инфекционных
заболеваниях; иммунное повреждение эндотелия, например, при развитии
гиперчувствительности цитотоксического и иммунокомплексного (II и III) типов;
попадание в кровоток тромбопластических веществ, например, при эмболии
амниотической жидкостью, содержащей тромбопластин, который обладает
прокоагулянтной активностью, укусе змей (особенно гадюки Russell),
промиелоцитарной лейкемии (промиелоциты содержат тромбопластические вещества),
при шоке и при любом состоянии, связанном с обширными некрозами ткани.
Таблица 1
Заболевания, при которых
возможно развитие ДВС-синдрома
Инфекционные
заболевания
—Грам-негативная и грам-положительная бактериемия
—Менингококковый сепсис
—Диссеминированная грибковая инфекция
—Риккетсиозы
—Тяжелая виремия (например, геморрагическая
лихорадка)
—Малярия, вызванная Plasmodium falciparum
—Неонатальные или внутриматочные инфекции
Гинекологические
заболевания
—Эмболия околоплодными водами
—Внутриутробная гибель плода
—Отслойка плаценты
Болезни
печени
—Обширный некроз печени
—Цирроз печени
Злокачественные
опухоли
—Острая промиелоцитарная лейкемия
—Метастазирование рака, наиболее часто —
аденокарциномы
Другие
заболевания
—Васкулиты мелких сосудов
—Обширная травма
—Лихорадка
—Тепловой удар
—Хирургические вмешательства с искусственным
кровообращением
—Укусы змей
—Тяжелый шок
—Внутрисосудистый гемолиз
Многочисленные тромбы сосудов микроциркуляторного
русла при ДВС-синдроме приводят к нарушению перфузии тканей с накоплением в них
молочной кислоты и развитием их ишемии, а также к образованию микроинфарктов в
большом количестве органов. Тромбы особенно часто встречаются в микрососудах
легких, почек, печени, надпочечников, гипофиза, головного мозга,
желудочно-кишечного тракта, кожи и сочетаются с множественными геморрагиями,
дистрофией и некрозом органов и тканей (кортикальный некроз почек, некрозы и
кровоизлияния в легких, головном мозге и др.). Необходимо знать, что в ряде
случаев при аутопсии вследствие параллельного и преобладающего
действия фибринолитической системы микротромбы могут не обнаруживаться (так
называемый фибринолиз).
Следует указать, что диссеминированный тромбоз
приводит также к израсходованию факторов свертывания крови с развитием коагулопатии
потребления. При этом наблюдается тромбоцитопения, которая вместе с
истощением фибриногена и других факторов свертывания, ведет к развитию
патологической кровоточивости. Эта тенденция к кровоточивости усугубляется
чрезмерной активацией фибринолитической системы (активация фактора Хагемана
XII, который запускает внутренний путь свертывания крови и ведет к
преобразованию плазминогена в плазмин). Продукты распада фибрина, возникающие
при воздействии плазмина на фибрин, также имеют антикоагулянтные свойства, еще
более усиливая кровоточивость.
Значение — развивается
острая полиорганная недостаточность, которая служит причиной смерти больных.
Прогноз определяется
своевременностью диагностики и начала лечения, которое включает в себя введение
гепарина для ингибирования формирования тромбов и введение тромбоцитов и плазмы
для восстановления израсходованных факторов свертывания крови. Контроль уровней
продуктов распада фибрина, фибриногена и количества тромбоцитов используется
для постановки диагноза и контроля эффективности терапии.
Основное различие между ДВС-синдромом и локальным
тромбозом заключается в том, что при ДВС-синдроме одновременно генерализованно
активируются и система свертывания, и система фибринолиза, а при тромбозе эти
изменения наблюдаются только местно. В одних случаях при ДВС-синдроме
преобладает тромбоз, что ведет к ишемии тканей, в других — фибринолиз, что
ведет к появлению кровоизлияний.
Источник
Патологическая анатомия ДВС-синдрома
Морфологические изменения при ДВС-синдроме складываются из целого комплекса признаков, тесно переплетающихся с проявлениями основного заболевания и обусловленными пусковыми механизмами, длительностью процесса и лечебными мероприятиями. Среди всех морфологических признаков по степени диагностической ценности выделяют прямые и непрямые.
Наибольшую значимость имеют прямые признаки – фибриновые образования, имеющие разнообразную структуру и являющиеся объективным морфологическим свидетельством активации свертывания крови:
– отдельные волокна и пучки фибрина, а также игловидные перекрещивающиеся волокна фибрина (предтромбы), построенные из нестабилизированного фибрина;
– выстилание слоем фибрина стенок сосудов, возникающее при повреждении последних преимущественно в зонах десквамации эндотелия;
– микротромбы, локализующиеся в основном в микроциркуляторном русле и имеющие разнообразный вид в зависимости от механизмов развития ДВС-синдрома:
· фибриновые микротромбы, построенные из стабилизированного фибрина и образующиеся при относительно медленном развитии процесса;
· гиалиновые микротромбы, возникающие при стремительном развитии процесса и состоящие из нестабилизированного фибрина и/или гемолизированных эритроцитов;
· глобулярные микротромбы, возникающие на почве нарушений кровообращения с агрегацией эритроцитов, последующим гемолизом и отложением окутывающего «тени» эритроцитов фибрина;
· тромбоцитарные, лейкоцитарные, эритроцитарные микротромбы, отражающие участие в фибринобразовании тех или иных форменных элементов крови, построены в основном из нестабилизированного фибрина;
· смешанные микротромбы из стабилизированного и нестабилизированного фибрина.
Наряду с микротромбами большое значение в развитии блокады сосудистого русла отводится агрегации форменных элементов крови (эритроцитов и тромбоцитов) – постоянного морфологического признака ДВС-синдрома.
Непрямые признаки ДВС-синдрома представляют собой следствие развития блокады сосудистого русла агрегатами клеток крови, микротромбами и гемодинамических расстройств – некрозы. К непрямым признакам относят также геморрагический синдром.
Сравнение клинико-лабораторных данных и морфологических изменений позволило определить морфогенетическую картину развития ДВС-синдрома.
1-я и 2-я стадии ДВС-синдрома характеризуются появлением на фоне сосудистого поражения (набухание и десквамация эндотелия, плазматическое пропитывание, фибриноидное набухание и фибриноидный некроз) следующей картины изменений:
– агрегация тромбоцитов и эритроцитов вплоть до развития сладж-феномена (необратимая агрегация эритроцитов);
– развитие гемодинамических расстройств со спазмом артериальных сосудов и шунтированием кровотока;
– образование отдельных нитей и тяжей фибрина, предтромбов, единичных микротромбов.
3-я стадия ДВС-синдрома также характеризуется преимущественно микроциркуляторными расстройствами в виде агрегации и сладжирования форменных элементов крови с сепарацией плазмы (расслоение крови) в вено-венулярном отделе сосудистого русла, спазма артериальных сосудов и шунтирования кровотока. Выраженность фибринобразования в этой стадии зависит от состояния сосудистых стенок. Однако в любом случае внутрисосудистые фибриновые структуры немногочисленны, хотя и разнообразны по составу – предтромбы; фибриновые, глобулярные, гиалиновые, смешанные и др.; микротромбы различного «возраста»; выстилание фибрином сосудистых стенок, что отражает многообразие механизмов активации свертывания крови и непрерывность, волнообразность процесса.
Кроме того, в 3-й стадии появляются, иногда выступая на первый план, признаки геморрагического синдрома, чаще всего в виде мелкоочаговых кровоизлияний в серозные оболочки, слизистые, внутренние органы, реже – в кожу.
На почве блокады сосудистого русла агрегатами форменных элементов крови, микротромбами и гемодинамических расстройств в 3-й, а затем в 4-й стадии ДВС-синдрома формируется разнообразная органная патология, чаще всего следующая:
– «шоковое легкое»: альвеолярный отек с кровоизлияниями, внутрисосудистая агрегация эритроцитов, микротромбоз, образование гиалиновых мембран;
– микротромбоз капилляров клубочков с некротическим нефрозом вплоть до образования симметричных кортикальных некрозов почек;
– кровоизлияния и некроз коры надпочечников (синдром Уотерхауза-Фридериксена);
– некроз аденогипофиза;
– дистрофические изменения с рассеянными мелкоочаговыми некрозами и кровоизлияниями головного мозга, миокарда, печени, поджелудочной железы;
– кровоизлияния, эрозии и язвы желудочно-кишечного тракта.
Источник
Диссеминированное внутрисосудистое свертывание (ДВС) ㅡ клинико-патологический синдром, осложняющий течение различных заболеваний. ДВС характеризуется системной активацией патологических путей, приводящей к нарушению регуляции коагуляции; проявляется образованием фибриновых сгустков с последующей органной дисфункцией и сопутствующим потреблением тромбоцитов и факторов свертывания, клинически проявляющимся кровотечениями.
Смертность от ДВС за последние годы значительно снизилась. По данным министерства здравоохранения Японии, смертность от ДВС упала с 65 % в 1998 году до 46 % в 2010 и 2012 годах, такая же тенденция наблюдается и в США (с 76 до 51 % между 2006 и 2010 годами). Данное снижение смертности обусловлено более глубоким пониманием патогенеза заболевания, улучшением ранней диагностики и применением новых протоколов лечения ДВС.
Этиология
ДВС часто развивается на фоне сепсиса либо инфекции (30–51 %), травмы (черепно-мозговая травма, ожоги, жировая эмболия) или больших оперативных вмешательств (45 %). Другими причинами ДВС могут быть деструкция органов (тяжелый панкреатит), злокачественный процесс, тяжелые акушерские патологии (эмболия амниотической жидкостью, отслойка плаценты, тяжелая преэклампсия, послеродовое кровотечение), фульминантная печеночная недостаточность, цирроз печени, тяжелые токсические или иммунологические реакции (отравление ядами змей, переливание несовместимой крови, отторжение трансплантата), сосудистые заболевания (гемангиомы, аневризмы аорты, синдром Казабаха-Мерритта).
Патофизиология ДВС
К развитию ДВС приводит нарушение регуляции противосвертывающей и свертывающей систем крови. Формирование фибринового сгустка является продуктом целого каскада реакций, в которых задействованы как факторы свертывания, так и клеточные элементы. Выделяют внутренний и внешний пути активации коагуляции. Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь) (рис. 1).
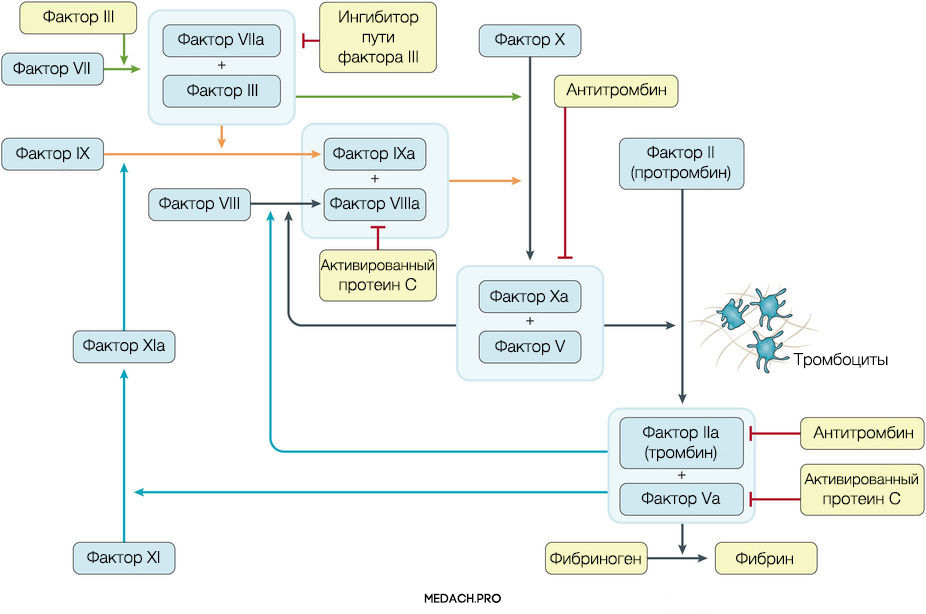
Рисунок 1 | Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь)
Тканевой фактор (ТФ) представляет собой мембрано-ассоциированный гликопротеин, находящийся в субэндотелиальном слое сосудов, в физиологических условиях не контактирующий с кровью. Выброс тканевого фактора могут спровоцировать различные процессы, такие как прямое повреждение сосудов, воспалительные и иммунологические реакции. При сепсисе ТФ непосредственно продуцируется моноцитами, а также выделяется в результате взаимодействия тромбоцитов со стенкой сосудов, что приводит к значительному усилению коагуляции. Выброс провоспалительных цитокинов и хемокинов провоцируется взаимодействием ТФ, тромбина и других факторов коагуляции с воспалительными клетками через специфические протеаза-активируемые рецепторы (PARs) 1–4 типа, а также дополнительно тромбином через Toll-like рецепторы 4 типа (TLR4). Развитие ДВС на фоне онкологических процессов имеет свои особенности, так как некоторые опухоли могут производить прокоагулянтные факторы (тканевой фактор и цистеиновая протеаза фактора X) (рис. 2).
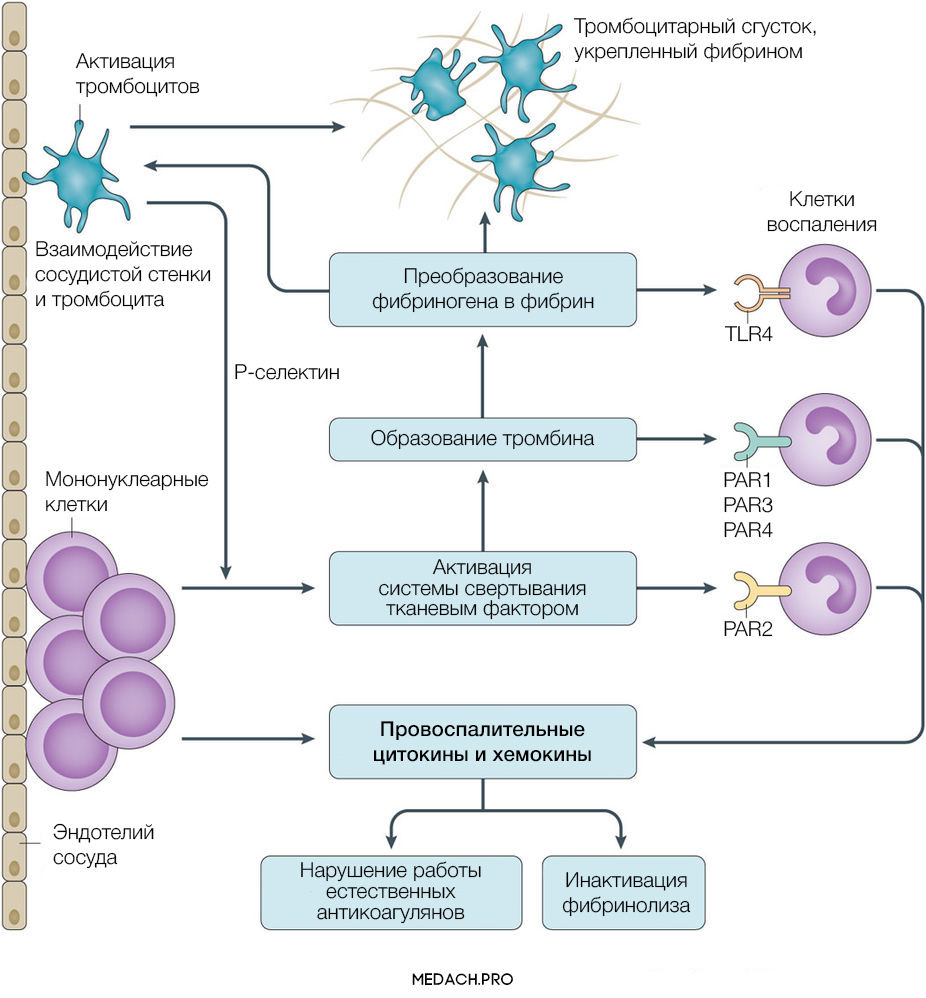
Рисунок 2 | Активация прокоагулянтных факторов в патогенезе ДВС-синдрома
Важное место в процессе свертывания занимает тромбин: он не только участвует в преобразовании фибриногена в фибрин, но также активирует другие факторы и ко-факторы свертывания (факторы VII, IX и XI). Тромбин инициирует скрепление частиц фибриногена в мономеры, а затем и в полимеры. Последующая стабилизация тромба происходит с помощью тромбин-активируемых факторов XIII (фактора XIIIа).
Реакции коагуляции контролируются противосвертывающей системой крови, включающей в себя: антитромбин (блокирует фактор Xa и тромбин), протеин С (протеолитически разрушает Va и VIIIa факторы), ингибитор пути тканевого фактора (ингибирует комплекс тканевой фактор-VIIa фактор).
При сепсис-индуцированном ДВС нарушаются все три компонента противосвертывающей системы. Во-первых, снижается уровень антитромбина в результате нарушения его синтеза в печени, увеличения его клиренса из-за образования протеаза-антитромбинового комплекса, экстраваскулярных потерь из-за повышения проницаемости клеточной стенки и разрушения эстеразой нейтрофилов. В дополнение к этому, в стенке сосудов нарушается синтез протеогликанов, способствующих связи антитромбина с гепарин-сульфатом. Во-вторых, при сепсисе снижается активность протеина С и его кофактора — протеина S, который обладает как антикоагулянтным, так и в некоторой степени противовоспалительным эффектами. В-третьих, нарушается работа системы ингибитора пути активации тканевого фактора (ИПТФ). В норме ИПТФ присутствует на поверхности эндотелия сосудов или циркулирует в крови в связанном с липопротеинами виде. Его роль в развитии ДВС пока плохо изучена.
Повреждение тромбоцитов играет центральную роль в нарушении коагуляции при ДВС. Тромбоциты могут активироваться как напрямую, через провоспалительные медиаторы (фактор активации тромбоцитов), так и опосредованно через тканевой фактор и тромбин. Впоследствии на мембране активированных тромбоцитов происходит фиксация фибрина. Тромбин стимулирует экспрессию на мембране тромбоцитов Т-селектина, который регулирует адгезию тромбоцитов к лейкоцитам и эндотелию сосудистой стенки, а также ускоряет секрецию ТФ мононуклеарами. В дополнение ко всему повреждение эндотелия и взаимодействие тромбоцит-сосудистая стенка вызывает выброс в кровь ультра-больших мономеров фактора фон Виллебранда (vWF). Фактор фон Виллебранда является важным медиатором адгезии тромбоцитов и коагуляции крови, его деградация осуществляется с помощью металлопротеиназы ADAMTS-13. Доказано, что недостаток металлопротеиназы и, вследствие этого, снижение деградации vWF способствует развитию ДВС-синдрома и более тяжелому его течению.
Фенотип ДВС синдрома
Повышенное образование тромбина при ДВС-синдроме приводит к манифестации различных фенотипов, которые не обязательно характеризуются повышенным тромбообразованием. Например, ранняя гиперфибринолитическая (геморрагическая) фаза, вызывающая всплеск продукции тромбина в ранней фазе тяжелой травмы. Через 24–48 часов она сменяется прокоагулянтной (тромботической) фазой, характерной чертой которой является гиперпродукция плазмин-ингибирующего комплекса, приводящая к супрессии активности протеина С. Фенотип ДВС частично зависит от этиологического фактора, но в большей степени обусловлен преобладающим нарушением в регуляции гемостаза организма [2, 3]. Часто наблюдается активация системы свертывания (повышение тромбин-антитромбинового комплекса), однако степень фибринолитической активности (ингибитора активатора плазминогена) варьирует в зависимости от причины (рис. 3).
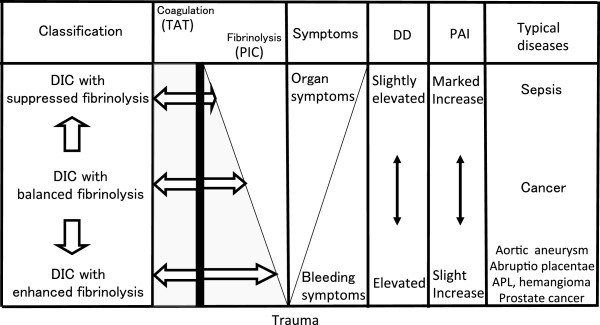
Рисунок 3 | Фенотипы ДВС-синдрома. TAT — комплекс тромбин-антитромбин; PIC — комплекс плазмин-альфа-2-антиплазмин; DD — Д-димер; PAI — ингибитор активатора плазминогена
В столбце «Symptoms» обозначен переход от кровотечений к органному поражению (развитие микро- и макротромбозов). На данном рисунке не обозначены продукты деградации фибрина (ПДФ), тем не менее при гиперфибринолитическом фенотипе ДВС имеется тенденция к преобладанию ПДФ над количеством Д-димеров. При терапии препаратами транс-ретиноевой кислоты при остром промиелоцитарном лейкозе ингибируется экспрессия опухолевыми клетками аннексина II, в результате чего меняется и фенотип ДВС (теряет характеристики гиперфибринолитического, приобретая характеристики прокоагулянтного фенотипа).
Диагностика
Критерии для выявления ДВС-синдрома по шкале ISTH (International Society of Thrombosis and Haemostasis Scoring System):

Рисунок 4 | ISTH (International Society of Thrombosis and Haemostasis Scoring System)
Критерии Japanese Association for Acute Medicine (JAAM):

Рисунок 5 | Japanese Association for Acute Medicine (JAAM)
Данные шкалы отличаются различной чувствительностью в отношении прогнозирования смертности: считается, что шкала JAAM имеет бо́льшую чувствительность к неявному ДВС-синдрому, в результате чего смертность при ДВС-синдроме, выявленном по данной шкале, почти в два раза ниже (около 22%).
Критерии ДВС Japanese Ministry of Health, Labor and Welfare (JMHLW):

Рисунок 6 | Japanese Ministry of Health, Labor and Welfare (JMHLW)
Данные критерии не адаптированы для пациентов с заболеваниями печени или нефротическим синдромом.
На основании представленных выше шкал выставляется диагноз ДВС. Наиболее подходящая шкала выбирается в зависимости от возможности проведения определенных лабораторных тестов и клинической ситуации. При возможности пациенту рекомендуется проводить контроль лабораторных показателей коагуляции каждые 8 часов.
Лечение
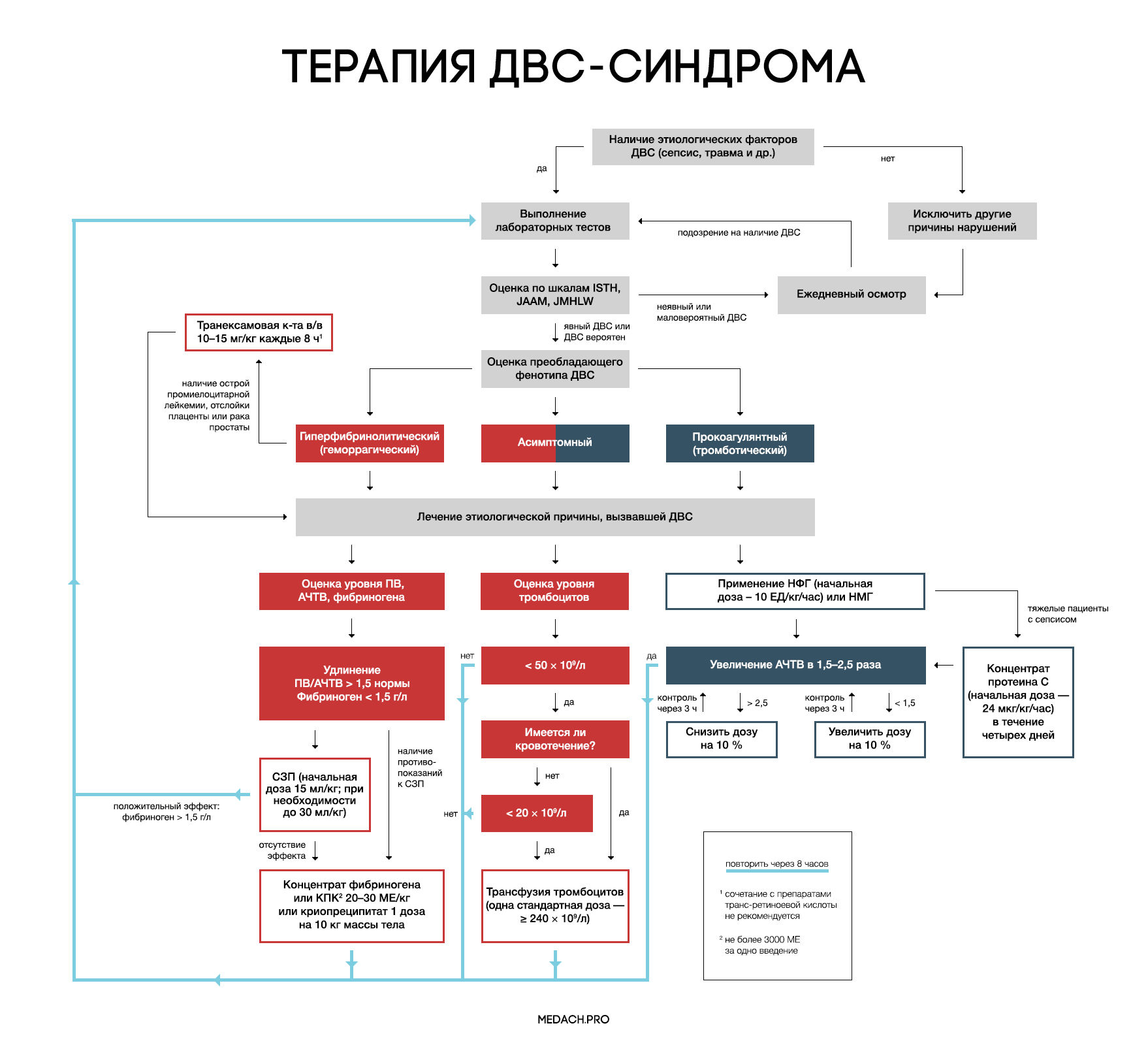
Рисунок 7 | Алгоритм тактики ведения пациентов с ДВС-синдромом (авторская работа Medach)
Терапия этиологического фактора
Главным в терапии ДВС-синдрома является лечение состояния, вызвавшего его развитие. Выделяют два варианта течения ДВС-синдрома:
— Контролируемый ДВС-синдром: характеризуется временным нарушением регуляции коагуляционных механизмов и быстрым восстановлением после ликвидации провоцирующего состояния (трансфузионная реакция, отслойка плаценты). В ряде случаев может разрешаться самостоятельно.
— Неконтролируемый ДВС-синдром (вызван сепсисом или травмой): в этом случае помимо ликвидации основной этиологической причины требуется незамедлительное начало терапии.
Важно отметить, что раннее начало применения препаратов, влияющих на систему свертывания крови (до развития ДВС-синдрома), может в значительной степени нарушить регуляцию гемостаза и, вследствие этого, ухудшить состояние пациента.
Заместительная терапия
Рекомендации по заместительной терапии ДВС сделаны на основании объединения данных гайдлайнов различных сообществ (British Committee for Standards in Haematology (BCSH), Japanese Society of Thrombosis and Hemostasis (JSTH), Italian Society for Thrombosis and Hemostasis (SISET)), занимающихся интенсивной терапией ДВС. При сочетании активного кровотечения или риска его развития и определенных уровней лабораторных показателей рекомендуется применение тромбоцитарной массы, свежезамороженной плазмы (СЗП), криопреципитата или концентрата фибриногена, концентрата протромбинового комплекса (КПК). Все нижеперечисленные рекомендации касаются категории пациентов с активным кровотечением.
Рекомендуется трансфузия тромбоцитов при наличии признаков активного кровотечениями и уровне тромбоцитов < 50 × 10^9 /л либо при отсутствии кровотечения, но наличии высокого риска его развития и уровне тромбоцитов < 20 × 10^9 /л. Трансфузия тромбоцитарной массы начинается с одной стандартной взрослой дозы (более 240 × 10^9/л). Переливание СЗП может применяться при удлинении ПВ/АЧТВ (больше 1,5 от нормы) или снижении уровня фибриногена менее 1,5 г/дл. Начальная доза СЗП составляет 15 мл/кг, при необходимости более жесткой коррекции уровня факторов свертывания допустимо использование дозы 30 мл/кг, однако следует помнить, что такие высокие дозы СЗП могут вызвать перегрузку объемом. КПК или концентрат фибриногена применяются при наличии подтвержденной тяжелой гипофибриногенемии (< 1,5 г/дл), несмотря на использование СЗП либо при наличии противопоказаний к ее применению. При применении 3 грамм концентрата фибриногена уровень фибриногена плазмы крови повышается примерно на 1 г/л. Такой же эффект достигается при переливании 4 единиц СЗП или 2 доз криопреципитата (10 донорских единиц). При планировании у пациентов инвазивных процедур необходимо контролировать уровень лабораторных показателей свертывания крови, и при необходимости превентивно провести трансфузию тромбоцитов или СЗП. Эффективность и безопасность применения рекомбинантного фактора VIIа у пациентов с ДВС требует дальнейшего исследования.
Антикоагулянтная терапия
Применение антикоагулянтов противопоказано при развитии ДВС-синдрома в результате травмы, или при травматическом шоке в сочетании с активным кровотечением. Для использования при ДВС-синдроме с преобладанием тромбозов рекомендуется нефракционированный гепарин (НФГ) или низкомолекулярные гепарины (НМГ). НФГ применяется в начальной дозе 10 ЕД/кг/час под контролем АЧТВ с поддержанием его увеличения в 1,5–2,5 раза от нормы. Необходимо помнить о профилактике тромбоэмболии НФГ или НМГ у тяжелых пациентов без признаков кровотечений. Уровень антитромбина III может частично использоваться для оценки дальнейшей эффективности применения гепарина, но зачастую имеются сложности (высокая стоимость, отсутствие реагентов) при измерении активности антитромбина III. На данный момент крупные исследования о применении НМГ у пациентов с ДВС-синдромом отсутствуют, и возможность профилактики НМГ строится на данных их использования у пациентов хирургического профиля.
Синтетические ингибиторы протеаз (габексата мезилат, нафамостата мезилат) разрешены к использованию в Японии, однако крупные РКИ, показывающие их эффективность при ДВС-синдроме, отсутствуют.
Концентраты антикоагулянтных факторов
Исследования в данном направлении ведутся на протяжении уже многих лет; так, с 1980 года проводятся испытания концентрата антитромбина, однако его эффективность при ДВС-синдроме до сих пор не доказана. На основании предположения, что при ДВС происходит угнетение выработки протеина С, зародилась идея применения активированного протеина С. После проведения больших исследований данный препарат показал эффективность в группах с тяжелой сопутствующей патологией (сепсис). Крупных исследований, сравнивающих эффективность рекомбинантного активированного человеческого протеина С и полученного из плазмы концентрата протеина С, не проводилось. Концентрат протеина С применяется в виде продолжительной инфузии со скоростью 24 мкг/кг/час в течении четырех дней. При необходимости проведения инвазивных процедур введение протеина С прерывается до их выполнения (период полувыведения около 20 минут), а затем возобновляется через несколько часов. При применении протеина С необходимо учитывать повышение рисков кровотечения (2–3,5 %) и внутричерепного кровоизлияния (0,1–0,3 %), а также то, что в исследованиях препарата не участвовали пациенты с тромбоцитопенией ( < 30 x 10^9/л). Для контроля терапии используется АЧТВ. Исследования по применению тифакогина (рекомбинантного ингибитора пути тканевого фактора) не увенчались успехом.
На данный момент имеется ряд исследований по безопасности и эффективности рекомбинантного растворимого человеческого тромбомодулина (rhTM), однако их результаты гетерогенны. Проведенный метаанализ данных исследований показал, что препараты rhTM оказывают положительный эффект на выживаемость в группе тяжелого сепсиса и пациентов с количеством баллов по шкале APACHE II более 24 или по шкале SOFA более 11. На данный момент исследования препаратов rhTM перешли в третью фазу.
Антифибринолитики
При ДВС-синдроме фибринолиз заблокирован повышением уровня ингибитора активатора плазминогена (PAI-1). Следовательно, при кровотечениях, вызванных ДВС-синдромом, применение антифибринолитиков не рекомендуется, за исключением случаев развития гиперфибринолитического фенотипа ДВС, возникшего на фоне острой промиелоцитарной лейкемии, отслойки плаценты или карциномы простаты.
Отличительными лабораторными особенностями гиперфибринолитического фенотипа является наличие повышенного уровня тромбин-антитромбинового комплекса (≥ 20 мкг/л) и плазмин-ингибирующего комплекса (≥ 10 мкг/л), а также снижение активности альфа-2-ингибитора плазмина более чем на 50 %.
При таком фенотипе показано использование транексамовой кислоты в дозе по 1 грамму (10–15 мг/кг) через каждые 8 часов. У пациентов с лейкемией часто проводится лечение препаратами транс-ретиноевой кислоты, но, по данным исследований, ее сочетание с транексамовой кислотой повышает риск развития тромбозов. Данную комбинацию необходимо применять в крайнем случае, при наличии признаков жизнеугрожающего кровотечения.
Источники
Levi M. et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation //British journal of haematology. – 2009. – Т. 145. – №. 1. – С. 24-33.
Gando S., Levi M., Toh C. H. Disseminated intravascular coagulation //Nature Reviews Disease Primers. – 2016. – Т. 2. – С. 16037.
Gando S., Wada H., Thachil J. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma‐shock (COT/ACOTS) //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 5. – С. 826-835.
ISTH, International Society on Thrombosis and Haemostasis. Adapted with permission from from Taylor Jr. FB, Toh CH, Hoots WK, et al. Towards Definition, Clinical and Laboratory Criteria, and a Scoring System for Disseminated Intravascular Coagulation. Thromb Haemost 2001; 86: 1327–30.
Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T, Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine Disseminated Intravascular
Coagulation (JAAM DIC) Study Group: A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 2006, 34: 625-631.
Kobayashi N. et al. Criteria for diagnosis of DIC based on the analysis of clinical and laboratory findings in 345 DIC patients collected by the Research Committee on DIC in Japan //Disseminated intravascular coagulation. – Karger Publishers, 1983. – Т. 49. – С. 265-275.
Wada H. et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines //Journal of thrombosis and haemostasis. – 2013. – Т. 11. – №. 4. – С. 761-767.
Afshari, A., Wetterslev, J., Brok, J. & Moller, A. M. Antithrombin III for critically ill patients. Cochrane Database Syst. Rev. 3, CD005370 (2008).
Abraham, E. et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290, 238–247 (2003).
Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models //Journal of intensive care. – 2014. – Т. 2. – №. 1. – С. 20.
Источник
