Подходы к лечению синдрома диабетической стопы

 Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Распространенность и экономические аспекты
В XXI в. сахарный диабет (СД) стал ведущим неинфекционным заболеванием. Каждые 10 с в мире становится на 2 больных СД больше – это 7 млн в год. По мнению экспертов Всемирной организации здравоохранения, СД занимает 1-е место среди заболеваний, приводящих к инвалидности, и 3-е – по смертности [1–4].
Согласно исследованиям Эндокринологического научного центра (ЭНЦ), в России распространенность СД достигает 10–12 млн человек (7–8% населения страны). Наиболее высокая распространенность СД среди взрослого населения крупных городов. При этом соотношение мужчин и женщин – 1:3. В половине случаев СД 2-го типа выявляется на 5–7-м году от начала заболевания, и у 20–30% выявляются специфические осложнения: катаракта, ретинопатия, нефропатия, нейропатия, синдром диабетической стопы (СДС), ишемическая болезнь сердца, артериальная гипертония и др. [5–8].
СДС приводит к гнойно-некротическим поражениям стоп с последующей потерей нижних конечностей – к самой высокой инвалидизации. Окончательные цифры распространенности СДС в настоящее время неизвестны. Тем не менее установлено, что у 15% больных СД развиваются патологические изменения в стопах или голеностопном суставе [9–13].
В последние годы широко обсуждаются не только клинические, но и экономические, социальные аспекты профилактики и лечения СДС, методы клинико-экономического анализа и, прежде всего, учет всех затрат, связанных с лечением СДС [1, 14].
На 18-м конгрессе Международной федерации диабета (МФД) были представлены, в частности, данные о распространенности язвенных дефектов при СДС в странах Балканского региона – 7,5%. Диагноз СД впервые ставится во время хирургического вмешательства у 15–19% больных, подвергающихся ампутации. Специалисты МФД считают, что вероятная частота ампутаций при СД составляет 5–24 на 100 000 населения в год, или 6–8 на 1000 больных в год, а в эпидемиологически неблагоприятных регионах достигает 24 на 1000 больных в год. В России, согласно данным государственного регистра, эти показатели колеблются от 0,76 до 18,2 и в среднем составляют 6,4 случая на 1000 больных [3, 4, 11, 15].
Расходы на лечение СДС в развитых странах составляют около 12–15% от всех затрат на лечение СД, в развивающихся странах они могут составлять до 40% от общего объема финансовых ресурсов, выделяемых на СД. Подсчитано, что на проведение одной ампутации в зарубежных странах тратится более 10 000 долл. Общие затраты на лечение СДС в среднем составляют 13 179 долл. и меняются в зависимости от степени тяжести по классификации Wagner в пределах от 1892 долл. при I степени до 27 721 долл. при IV–V степени тяжести. Лечение СДС на фоне хронической артериальной недостаточности нижних конечностей обходится в 4,5 раза дороже, чем при сохранном периферическом кровотоке. Ежегодная стоимость лечения язвенных поражений стоп при СДС в США составляет 5 млрд долл. прямых медицинских затрат и 400 млн долл. косвенных медицинских затрат. Кроме того, в США зафиксировали, что 77% людей старше 75 лет после ампутации не способны вернуться в собственный дом и им нужна дополнительная помощь и поддержка социальных групп [8, 16–18].
Анализ работы отделения диабетической стопы ЭНЦ показал, что при своевременно начатой адекватной терапии СДС понижается риск хирургических вмешательств и тяжелых осложнений: у 98% больных с нейропатической инфицированной формой СДС можно избежать хирургического вмешательства; у 60% с нейроишемической формой – проведения ампутаций на уровне голени и бедра; у 25% с критической ишемией – предотвратить высокие ампутации на уровне бедра; на 50% уменьшить частоту образования язв стоп в группе высокого риска [4, 5, 13].
Летальность среди больных СД, перенесших высокую ампутацию конечности по поводу гангрены, в течение последующих 5 лет достигает 68%, в ближайшие 3 нед. – 22%, в течение года – 11–41%, через 3 года – 20–50%, через 5 лет – от 39–68%. Частота ипсилатеральных ампутаций через год после первой ампутации – до 24%, через 2 года – 30%, через 5 лет – 49% и контралатеральных ампутаций через год после первой ампутации – до 12%, через 2 года – 23%, через 5 лет – 28-51%. Рецидивы язв на стопах через 1, 3, 5 лет составили 44, 61, 70% соответственно. Рецидивирующие деструктивные поражения ухудшают проблемы лечения, реабилитации, социальной помощи, увеличивая экономические затраты [19–23].
Если распространенность СД, а соответственно и СДС будет увеличиваться с той же скоростью, что и сейчас, то к 2025 г. экономический ущерб составит от 213 до 396 млрд долл. в год. 75% прироста заболевания придутся на развивающиеся страны. По данным немецких исследователей, общая стоимость лечения больных СД в Германии составляет приблизительно 5 млрд. евро, а средняя стоимость лечения 1 пациента – 5000 евро в год. Ежегодные общие затраты в России на лечение нейроишемической формы СДС составляют 56,2 млн долл., при этом затраты на ампутации достигают 14,4 млн долл. [2, 5, 17].
По оценке главного экономиста Morgan Stanley Эльги Бартш, сочетание двух факторов – СД и ожирения – снизит среднегодовые темпы роста валового внутреннего продукта (ВВП) в странах Организации экономического сотрудничества и развития (ОЭСР) в 2015–2035 гг. с 2,3 до 1,8%, в странах БРИКС (Бразилия, Россия, Индия, Китай, Южно-Африканская Республика) – с 4,5 до 4,2%. Согласно прогнозам ОЭСР, среднегодовые темпы роста ВВП России составят 2,8%. При сохранении нынешнего уровня потребления сахара гражданами страны этот показатель снизится до 2%. Согласно результатам исследования, проведенного фармацевтической компанией «Ново Нордиск», «Инвестиции в лечение сахарного диабета в России», ежегодные прямые затраты, связанные с СД в России, составляют 12,5 млрд долл. США. При этом 42% объема этих средств расходуется на лечение осложнений, которые выявляются у 40–50% людей в момент постановки диагноза. Соответственно диагностика заболевания на ранних стадиях позволит российскому обществу сэкономить более 1,5 млрд долл. США из средств, выделяемых на здравоохранение [13].
Принципы терапии
По мнению большинства авторов, в лечении пациентов с синдромом диабетической стопы должны участвовать квалифицированные эндокринолог, гнойный хирург, сосудистый хирург, ортопед, специально обученный средний медицинский персонал, а комплексное лечение должно включать общие и местные методы (рис. 1) [24–26].
Тактика комплексного лечения зависит от формы заболевания [14, 15, 18, 19, 21, 27]. Мы, как и ряд специалистов, выделяем следующие клинические формы СДС.
1. Нейропатическая форма:
– без остеоартропатии;
– с остеоартропатией – «сустав Шарко».
2. Нейроишемическая форма с учетом других характеристик.
К общим принципам терапии пациентов с СДС относятся коррекция факторов риска, компенсация углеводного обмена и поддержание целевых показателей углеводного обмена, компенсация сопутствующих заболеваний, системная антибактериальная, антитромботическая, вазопротекторная терапия в сочетании с адекватным обезболиванием.
К местным принципам лечения относятся: обеспечение полной разгрузки пораженной области с помощью разгрузочного полубашмака, индивидуальной разгрузочной повязки, костыля, сложной ортопедической обуви, кресла-каталки; контроль раневой инфекции, заключающийся в первичной обработке раны и местном лечении раны с правильным выбором повязки в зависимости от фазы течения раневого процесса; хирургическое лечение гнойно-некротического очага стопы с закрытием ран и/или формированием культи пораженной стопы при помощи реконструктивных и пластических операций; восстановление магистрального артериального кровотока в сосудах нижних конечностей.
Перспективным является применение L-лизина эсцината в комплексном лечении язвенных и гнойно-некротических поражений при СДС. Эффективность препарата объясняется его противоотечным действием, связанным со снижением проницаемости сосудистой стенки и улучшением венозного оттока. L-лизина эсцинат обладает стабилизирующим действием на мембраны клеток, снижает активность лизосомальных ферментов, принимающих непосредственное участие в воспалительном процессе. Кроме того, препарат блокирует эффекты фосфолипазы А2, которая является ключевым веществом в развитии воспалительной реакции, связанной с повреждением мембран клеток различными факторами при ишемии, инфекции и травме. Стабилизация фосфолипазы А2 способствует снижению активности простагландинов, что также приводит к уменьшению воспалительного ответа. Доказано также влияние L-лизина эсцината на такие медиаторы воспаления, как гистамин, серотонин, которые выделяются из тромбоцитов, тучных клеток и создают основу для классической воспалительной реакции. Комплексный эффект препарата L-лизина эсцината апробирован в нейрохирургической, неврологической, травматологической практике, ангиологии и флебологии [26–31].
Мы регулярно применяем L-лизина эсцинат по 10 мл в разведении на 50 мл физиологического (0,9%) раствора внутривенно капельно в течение 10 дней у пациентов с нейропатической формой СДС в послеоперационном периоде, с трофическими язвами на фоне нейропатических отеков и у больных с язвами на фоне венозной недостаточности (СЕАР 2-3). Отмечаем благоприятное течение послеоперационного периода, более раннее уменьшение отеков, снижение болевого синдрома, нейропатических болей, заживление язв. Рекомендуем применение L-лизина эсцината для лечения язвенных и гнойно-некротических поражений при СДС в амбулаторной и стационарной практике.
Заключение
СД является серьезным заболеванием, способным привести к тяжелым социально-экономическим и демографическим последствиям. Вопрос о влиянии СДС на качество жизни остается малоизученным. Неизвестны долговременные затраты, связанные с лечением рецидивов язв, проведением повторных ампутаций и увеличением расходов на социальное обслуживание. Кроме того, неучтенными остаются непрямые затраты вследствие утраты человеком из-за болезни профессиональных и социальных функций, что наносит обществу материальный и духовный ущерб.
Опыт других стран, например США, показал, что мультидисциплинарный подход, ранняя диагностика и обучение больных позволяют снизить количество язв стопы и ампутаций на 49–85% и существенно уменьшить расходы государства. Использование программ по профилактике осложнений и обучению больных СД приводит к уменьшению количества ампутаций почти в 2 раза, а экономический эффект от внедрения программ обучения составил 10 млн долл. [2, 5, 9, 11, 13, 21].
Учитывая вышеизложенное, 20 апреля 2015 г. в Кремле Президент РФ Владимир Путин подписал Закон о ратификации соглашения о сотрудничестве стран СНГ в борьбе с ростом заболеваемости сахарным диабетом [18], что в сочетании с грамотным ведением пациентов с СДС может улучшить прогноз как для этих пациентов, так и для больных СД в целом.
Источник
По прогнозам ВОЗ, общая численность больных сахарным диабетом, составлявшая в 1996 году 120 млн. человек, возрастет к 2025 году до 250 млн. из–за увеличения продолжительности жизни, малоподвижного образа жизни, изменения режима питания. У больных сахарным диабетом развиваются такие грозные осложнения, как патология сердца, почечная недостаточность, слепота, поражение стоп. Диабетическая стопа занимает лидирующие позиции в этом перечне.
Согласно определению ВОЗ синдром диабетической стопы (СДС) – это инфекция, язва и/или деструкция глубоких тканей, связанная с неврологическими нарушениями и снижением магистрального кровотока в артериях нижних конечностей различной степени тяжести.
Эпидемиология
СДС – это самое частое осложнение диабета. С ним связана примерно треть госпитализаций больных диабетом. Этот синдром, который в половине случаев заканчивается ампутацией одной или обеих нижних конечностей, возникает у 80% больных сахарным диабетом спустя 15–20 лет после начала болезни. Две трети больных умирают от гангрены нижних конечностей. В 40% наблюдений после первой ампутации на уровне бедра или голени больные теряют подвижность и могут передвигаться только в пределах квартиры. В 50–70% случаев развиваются гнойно–некротические осложнения на стопе оставшейся конечности, что может явиться показанием к ее ампутации. При этом развитие гангрены у больных с сахарным диабетом наблюдается в 40 раз чаще, чем в общей популяции. Приблизительно 40–60% всех нетравматических ампутаций нижних конечностей проводится больным диабетом; в 85% случаях ампутациям нижних конечностей предшествует язва стопы; причиной возникновения язв стоп у больных сахарным диабетом в 4 случаях из 5 является внешняя травма; среди больных диабетом распространенность язв составляет 4–10%. В развитых странах частота ампутаций, связанных с диабетом, составляет 6–8 случаев на 1000 больных диабетом; в 50–70% случаев причиной ампутации является гангрена, в 20–50% – инфекция; пребывание больных в стационаре с язвой стопы на 50% дольше, чем у больных с сахарным диабетом без язвы; для заживления язв на амбулаторном этапе требуется от 6 до 14 недель.
Патогенез
Патогенез определяется совокупностью ряда факторов. Первое – микроангиопатия. Под микроангиопатией подразумевается поражение только мелкой сосудистой сети. Основные изменения происходят в базальной мембране капилляров. Это характеризуется накоплением в ней PAS–положительных веществ, в том числе мукополисахаридов, гликопротеидов, липидов. При этом мембрана капилляров утолщается в 2–5, а иногда в 8–10 раз. Отмечается ее расщепление на слои, между которыми располагаются коллагеновые волокна. Указанные изменения мембраны и эндотелия капилляров приводят к нарушению селективной фильтрации биологических жидкостей и обменной диффузии, что препятствует удалению продуктов обмена, обеспечению тканей питательными веществами и кислородом. Гипоксия вызывает деструктивные изменения тканей вплоть до развития гангренозно–некротического процесса. Атеросклеротические поражения (макроангиопатия) у больных сахарным диабетом развиваются на 10 лет раньше и протекают более злокачественно. Особенностью атеросклероза у больных сахарным диабетом является относительно редкое поражение крупных сосудов, частое поражение артерий среднего и мелкого колибра и артериол. Атеросклеротические поражения встречаются в подколенной, большеберцовой области и в артериях стопы. Специфическим и наиболее частым проявлением диабетических ангиопатий является медиокальциноз. Его частота и интенсивность нарастают по направлению к дистальным артериям конечностей.
Полинейропатия возникает за счет нарушения метаболизма глюкозы в нервной ткани, гликолизирования мембран нервных клеток и повреждения vasa nervorum. Соматическая и автономная нейропатии могут рассматриваться, как самостоятельные факторы развития трофической язвы. Соматическая, длительно протекающая сенсомоторная нейропатия приводит к характерной деформации стопы, препятствующей нормальному ее положению при ходьбе и стоянии. Сенсорная диабетическая нейропатия проявляется снижением болевой, тактильной, температурной, вибрационной, проприоцептивной чувствительности. Стопа, лишенная механизмов защиты (отсутствие реакции на механическую, термическую, химическую травму), имеет высокий риск гнойно–некротических поражений.
Остеоартропатии. При сахарном диабете имеется выраженная кальциурия и потеря солей, которая может превышать их поступление. При рентгеновском исследовании определяются различные изменения в костно–суставном аппарате: на фоне резкой деформации стопы возможно увеличение объема мягких тканей. Выявляется остеопороз и остеосклероз. Отмечается остеолиз суставных поверхностей, деструкция и фрагментация отдельных участков кости, спонтанные патологические переломы. При деформации стопы значительно уменьшается ее площадь опоры, из–за чего наиболее выступающие участки стопы испытывают повышенное давление и являются источником образования язв.
Общий и местный иммунодефицит. Выраженный энергетический дефицит, наблюдаемый при сахарном диабете, снижает адаптационный потенциал организма и приводит к дисбалансу клеточного и гуморального иммунитета, а также к недостаточности факторов неспецифической защиты организма. Одним из основных дефектов иммунитета при сахарном диабете считается нарушение фагоцитарной функции полиморфно–ядерных лейкоцитов. В основе патологии лежит снижение способности нейтрофилов к фагоцитозу микроорганизмов, что приводит к неполному уничтожению антигена. Данные изменения приходят к норме в эксперименте при нормализации гликемии. Остается спорным вопрос о том, являются ли эти нарушения следствием метаболических изменений или результатом нарушенной микроциркулции.
До настоящего времени остается не вполне ясной роль лимфатической системы в пато– и саногенезе синдрома диабетической стопы. Имеются очень скудные, подчас противоречивые данные, преимущественно новосибирских ученых. По данным одних авторов имеется усиление лимфооттока от пораженной конечности, по данным других авторов, наоборот, имеет место блок или резкое снижение лимфотока в больной конечности. В институте клинической и экспериментальной лимфологии проводятся исследования, направленные на выяснение роли лимфатической системы в патогенезе синдрома диабетической стопы.
Клиника, диагностика
Исходя из преобладания нейропатии или ишемии, выделяют следующие клинические формы СДС:
- нейропатические
- ишемические
- нейроишемические.
Жалобы больных различны. На ранних этапах пациенты жалуются на утомляемость ног, зябкость, парестезии. Постоянство и выраженность этих жалоб зависят от стадии заболевания.
При длительном существовании диабета развивается деформация стопы с увеличением ее поперечного размера, поперечным и продольным плоскостопием, увеличением в объеме и деформацией голеностопного сустава. Развивается молоткообразная деформация пальцев, гипертрофия головок метатарзальных костей с образованием натоптышей (нейроостеоартропатия, стопа Шарко).
В связи с изменением температурной, тактиальной, проприоцептивной чувствительности часты микротравмы (обработка мозолей, инородные тела в обуви, тесная обувь, тепловые процедуры). Самопроизвольного заживления не происходит, развиваются флегмоны, трофические язвы, гангрены стоп. Распространены микотические повреждения стоп в результате атрофии и деформации ногтевой пластинки.
Признаком ишемической формы СДС является синдром перемежающейся хромоты. Если окклюзия компенсируется адекватным кровотоком, то симптомов в покое может не быть, но при нагрузке появляется перемежающаяся хромота.
При осмотре пациента с СДС следует обращать внимание на цвет конечностей, наличие отека, деформации стопы, наличие патологической подвижности в суставах, локализацию язвы, характер отделяемого, подрытость краев, состояние окружающей кожи (экзема, индурация, целлюлит).
Имеет диагностическую ценность определение тактильной, болевой, температурной, вибрационной чувствительности, сухожильных рефлексов. Специальные методы исследования направлены на выявление поражений артерий конечностей. Это рентгеноконтрастная артериография, допплеровское исследование кровотока артерий, компьютерная видеокапилляроскопия. Для оценки состояния раны необходимы цитологическое и бактериологическое исследования язв. Наряду с общепринятыми методами обследования больных мы применяем реолимфовазографию с оценкой скорости и объема оттекающей периферической лимфы и крови, тепловизионное исследование с помощью компьютерного тепловизора последнего поколения с определением зон термоасимметрии. Кроме того, используем метод импедансометрии с оценкой удельного сопротивления внеклеточного пространства.
Лечение
В клинике НИИКиЭЛ СО РАМН разработана программа комплексного обследования и лечения больных с синдромом диабетической стопы.
По нашему мнению, хирургическое лечение больных с диабетической стопой должно состоять из ряда этапов:
1. Общая лекарственная терапия.
2. Оздоровление кожи вокруг язвы и ликвидация перифокального воспаления.
3. Нормализация венозного и лимфатического оттока и ликвидация отека конечности.
4. Ликвидация гнойно–некротических процессов и воспалительных изменений в язве.
5. Подавление микрофлоры.
6. Активизация репаративной регенерации.
7. Общая и местная иммуномодуляция.
8. Хирургическое лечение (повторные некрэктомии, аутодермопластика язвенных дефектов, экономные ампутации).
Общая терапия включает применение спазмолитических средств, препаратов, улучшающих реологические свойства крови. Среди препаратов, улучшающих микроциркуляцию, необходимо отметить алпростадил. Кроме того, в программу лечения следует включать препараты липоевой кислоты и Мидокалм. Использование Мидокалма у больных с синдромом диабетической стопы обосновано ввиду следующих качеств препарата: препарат усиливает кровоснабжение ишемизированной области; улучшает кровоснабжение конечностей без изменения АД и коронарного кровотока; усиливает лимфообращение в конечности. В комплексную программу терапии больных с диабетической стопой мы включаем курс модифицированных плазмаферезов. Из физиотерапевтических процедур средством улучшения микроциркуляции является гипербарическая оксигенация, лазеротерапия.
Местная терапия язв предполагает тщательную санацию ран, оздоровление кожи вокруг раны, ежедневные перевязки. При этом мы считаем обязательным полный отказ от местного применения мазей у больных с диабетическими язвами.
Для борьбы с инфекцией (по показаниям) мы используем антибиотики с учетом чувствительности микрофлоры. При этом локальное применение антибиотиков мы считаем нецелесообразным, т.к. при местном применении антибиотики не уничтожают микрофлору, а лишь изменяют ее состав. Предпочтение отдаем внутриартериальному и лимфотропному применению антибиотиков. Мы не разделяем мнение, что облитерирующие заболевания сосудов нижних конечностей должны служить безусловным противопоказанием для лимфотропной терапии с введением препарата в межпальцевые промежутки. Мы считаем, что все осложнения (инфильтрация, отек, некроз в зоне введения препарата) вызваны несоблюдением техники лимфотропной инъекции. Из препаратов предпочтение отдаем аминогликозидам.
Для местного лечения мы применяем сорбционно–аппликационную терапию, разработанную в клинике НИИКиЭЛ. Мы используем сорбционные препараты, приготовленные на основе сорбента СУМС–1. На правах функционального синергиста СУМС–1 усиливает или восстанавливает утраченную дренажно–детоксикационную функцию лимфатического региона конечности. Кроме того, СУМС–1 адсорбирует на себя девитализированные ткани, фибрин, микробные тела, раневой экссудат. Так, в первую (гнойно–некротическую) фазу раневого процесса местно мы применяем сорбент СУМС–1 с адсорбированным на нем протеолитическим ферментом имозимазой в чередовании с СУМС–1 с адсорбированным на нем метронидазолом. Адсорбцией данных препаратов на сорбенте мы нивелируем отрицательные эффекты ферментной терапии и добиваемся пролонгированного протеолитического и антимикробного действия. По очищении раны мы применяем сорбент СУМС–1 с адсорбированным на нем раствором «Куриозина», представляющим собой ассоциат цинка и гиалуроновой кислоты.
Известно, что цинк присутствует в организме человека как компонент более чем 70 ферментов, участвующих в процессах заживления ран. По данным экспериментальных работ, при заживлении ран резко повышается потребность в цинке. Соответственно становится оправданным использование цинка при лечении трофических язв любой этиологии вообще и при синдроме диабетической стопы, в частности.
С другой стороны, известно, что гиалуроновая кислота является основным компонентом соединительной ткани, под ее влиянием усиливается миграция в рану фибробластов и пролиферация эпителиальных клеток. Мелкие молекулы гиалуроновой кислоты обладают действием, усиливающим ангиогенез, что ускоряет процессы заживления ран. Поэтому использование Куриозина в местной терапии трофических язв на фоне сахарного диабета не должно вызывать сомнений.
Адсорбцией же Куриозина на СУМС–1 мы добились усиления его действия и возможности применения не только в III, но и во II фазе течения раневого процесса.
Следующим компонентом комплексного лечения больных со стопой диабетика является применение разработанных в клинике института лимфомодулирующих блокад.
По данным реолимфовазографии больных с синдромом «стопа диабетика» характеризуют нарушения венозного и лимфатического оттока конечности, выражающиеся в снижении скорости и объема оттекающей лимфы и периферической венозной крови. С целью коррекции этих нарушений нами разработаны и внедрены лимфостимулирующие блокады. Используемая в клинике методика основана на воздействии лимфотропно вводимой лекарственной смеси на симпатическую иннервацию конечностей. Производится пролонгированная лимфостимулирующая блокада по разработанным в клинике авторским методикам. Воздействие лекарственной смеси заключается не только в пролонгированной симпатической блокаде, но и в стимуляции образования и оттока лимфы от корешков спинного мозга, уменьшении отека нервных стволов и сплетений, восстановлении метаболизма нервных структур. Кроме того, пролонгированные блокады обладают выраженным аналгезирующим эффектом. Используя пролонгированные блокады, у большинства больных удалось снять выраженный болевой синдром.
Собственные результаты
Всего в клинике пролечено 52 больных с синдромом «стопа диабетика». Среди них 36 женщин, 16 мужчин. Средний возраст больных – 58,5 лет (22–78 лет). У 68% были трофические язвы стопы и нижней трети голени, у 12% – гангрена стопы. Всем пациентам проводилась комплексная терапия, включая этапные некрэктомии, экономные ампутации конечностей. Всего выполнено 9% высоких ампутаций больным с гангреной стопы и голени. Экономные ампутации выполнены у 14,3%. Применяя разработанные методы лечения, нам удалось сократить смену фаз течения раневого процесса в среднем на 7–12 дней по сравнению в существующими методами лечения. Полного заживления язв удалось достичь в 58% случаях. У остальных больных с язвенными дефектами наблюдалось уменьшение язв, либо их очищение 42% (рис. 1–3).
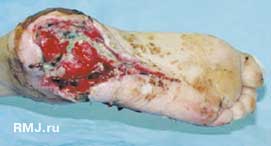
Рис. 1. Пациентка Т. 78 лет.
Трофическая язва, сформировавшаяся на фоне синдрома диабетической стопы
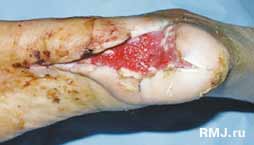
Рис. 2. Та же пациентка
на 12 сутки после начала лечения. Язва очистилась от некрозов и фибрина, заполнилась грануляционной тканью
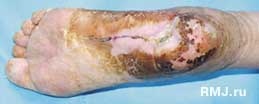
Рис. 3. Та же пациентка
на 27 сутки после начала лечения. Результат лечения
Нами проведено цитологическое исследование мазков–отпечатков ран больных с синдромом диабетической стопы. Мы использовали окраску по Май–Грюнвальду, увеличение х 960–1400. Получены следующие результаты. До лечения в мазках–отпечатках ран преобладали нейтрофилы с признаками дегенеративных изменений (87%), кроме того, в большом количестве присутствовали бактерии кокковой формы, фибрин и тканевой детрит. Через 5 суток после начала комплексной терапии микрофлора в мазках отсутствовала, число нейтрофилов с дегенеративными изменениями и количество фибрина и тканевого детрита резко уменьшалось (14%). Через 12 суток в мазках преобладали лимфоциты. На 18 сутки в цитограмме в большом количестве присутствовали эритроциты, моноциты и макрофаги. Таким образом, к 12 суткам цитограммы характеризовали собой воспалительно–регенераторный тип, а к 18 суткам – регенераторный тип (рис. 4–5).

Рис. 4. Пациентка К. 67 лет.
Преобладание в цитограмме мазков-отпечатков раны нейтрофилов с дегенеративными изменениями. Присутствуют бактерии кокковой флоры, фибрин, тканевой детрит. Окраска по Май-Грюнвальду. Ув. х 960
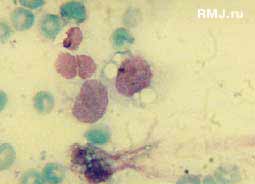
Рис. 5. Та же пациентка.
16 суток после начала лечения. Преобладание в мазке-отпечатке моноцитов, макрофагов. Окраска по Май-Грюнвальду. Ув. х 1400
Профилактика
Важная роль в профилактике синдрома диабетической стопы отводится самим больным с сахарным диабетом. Необходим постоянный контроль гликемии, т.к. компенсанция сахарного диабета – залог предотвращения поражения нижних конечностей. Важен тщательный уход за ногами, тщательный подбор обуви, профилактика травм, переохлаждений, перегрева. Ношение ортопедической обуви является залогом предотвращения натоптышей, омозолелостей, деформаций стопы.
Важная роль в профилактике синдрома диабетической стопы отводится самим больным с сахарным диабетом. Необходим постоянный контроль гликемии, т.к. компенсанция сахарного диабета – залог предотвращения поражения нижних конечностей. Важен тщательный уход за ногами, тщательный подбор обуви, профилактика травм, переохлаждений, перегрева. Ношение ортопедической обуви является залогом предотвращения натоптышей, омозолелостей, деформаций стопы.
Лечение больных с синдромом диабетической стопы – трудоемкая и дорогостоящая задача. Только совместными усилиями врачей различных специальностей и самих пациентов можно добиться положительных результатов. Разработанные в НИИКиЭЛ СО РАМН методы терапии являются патогенетически обоснованными и позволяют улучшить результаты лечения больных с синдромом диабетической стопы.
Литература:
1. Богданец Л.И., Кириенко А.И., Алексеева Е.А. Местное лечение венозных трофических язв // «Гедеон Рихтер в СНГ», 2000, N2.
2. Любарский М.С., Шумков О.А., Шевела А.И., и др. Лимфостимуляция в лечении синдрома «стопа диабетика». Москва. Сб. мат. Конгресса лимфологов России. 2000, С. 203.
3. Шумков О.А., Любарский М.С., Шевела А.И., и др. Аппликационно–лимфокорригирующая местная терапия гнойных ран на фоне сахарного диабета. Новосибирск. Мат. Международного симпозиума «Проблемы экспериментальной, клинической и профилактической лимфологии». 2000. С. 188–189.
4. Jeffrey Muha // Local wound care in diabetic foot // Postgraduate medicin, Jul 1999, Vol 106, N1.
5. John L. Culleton // Preventing diabetic foot complications // Postgraduate medicin, Jul 1999, Vol 106, N1.
Источник
