Причины болевого синдрома у новорожденных
Что мы знаем о боли у новорожденных?
И.А. Саввина1,2, А.А. Борисова3, В.Ю. Новиков1, В.И. Гурская1
1 ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России, Санкт-Петербург, РФ
2 ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава РФ, Санкт-Петербург, РФ
3 Schneider Children’s Medical Centre of Israel, Petah Tikva, Israel
Вернуться к списку публикаций…
Резюме
Безопасное и эффективное лечение боли у новорожденных требует наличия информативных и достоверных способов её оценки. Оценка болевого синдрома у новорожденного является первым этапом в выборе дальнейшей тактики обезболивания, коррекции проводимого лечения. Приведенные в статье шкалы оценки боли у новорожденных могут быть использованы в ежедневной практике врачей неонатологов, детских анестезиологов-реаниматологов.Стратегия профилактики и лечения болевого синдрома определяется четким представлением о причинах возникновения боли у новорожденного, составлением плана действий с применением нефармакологических и фармакологических методов купирования болевого синдрома.
Ключевые слова: боль, новорожденный, шкалы оценки боли, профилактика и методы лечения боли
Актуальность
Боль остается актуальной проблемой современной хирургии и отделений анестезиологии и реанимации. Безопасное и эффективное лечение боли у новорожденных требует, в первую очередь, наличия информативных и достоверных способов её оценки. Существуют две основные особенности оценки интенсивности боли и эффективности анальгезии в неонатологии:
– невозможность активного сотрудничества пациентов при выполнении исследований;
– отсутствие четкой границы, после которой физиологические и поведенческие реакции однозначно указывают на боль.
В то же время, именно у данной группы пациентов из-за незрелости развивающейся в постнатальном периоде нервной системы некупированная боль приводит к развитию неадекватных стресс-ответов с изменениями белкового метаболизма, ослаблением иммунного ответа и формированием патологических реакций на боль в отдаленном будущем.
Боль — неприятное сенсорно-эмоциональное переживание, связанное с истинным или потенциальным поврежением тканей.
Восходящие пути болевой чувствительности (спиноталамический путь) функционально активны с 20-й недели гестации. Таламические афференты начинают достигать соматосенсорной зоны в возрасте 20 недель и визуализируются с 20-22 недели гестации. Эти афференты являются достаточно зрелыми морфологически и образуют синапсы с подкорковыми нейронами примерно к 21-й неделе гестации. После 23-30-й недели внутриутробного развития начинается миелинизация нервных трактов, вовлеченных в ноцицепцию. Таламокортикальный путь полностью миелинезирован к 37-й неделе гестации, однако остальные пути миелинезируются позже. У новорожденных детей слабо выражена дифференцирующая способность коры головного мозга, что ограничивает возможности психоэмоционального выражения болевых ощущений и делает ответную реакцию на различные болевые воздействия чрезмерной и мало специфичной.
Причин возникновения боли у новорожденных детей может быть множество, и свидетельствовать они могут о различных заболеваниях: родовой травме, гнойно-воспалительных заболеваниях, врожденных пороках развития. Кроме того, появление боли может быть связано с медицинскими манипуляциями и оперативными вмешательствами.
Основные причины неадекватной анальгезии у новорожденных:
- убеждение некоторых врачей, что новорожденные дети не ощущают боль или менее чувствительны к ней;
- безграмотное убеждение некоторых врачей, что «хорошая седация лучше любой анальгезии»;
- отсутствие общепринятых, простых методов выявления и оценки болевого синдрома;
- редкое или в меньших дозах использование наркотических анальгетиков из-за опасения возникновения побочных эффектов, в частности угнетения дыхания;
- неиспользование ненаркотических анальгетиков в качестве доказанного эффективного метода обезболивания;
- невозможность или ограничение современных методов анальгезии из-за технической сложности, отсутствия навыков, опыта использования, в частности, регионарных методов обезболивания;
- отсутствие препаратов, разрешенных для использования в неонатальном периоде.
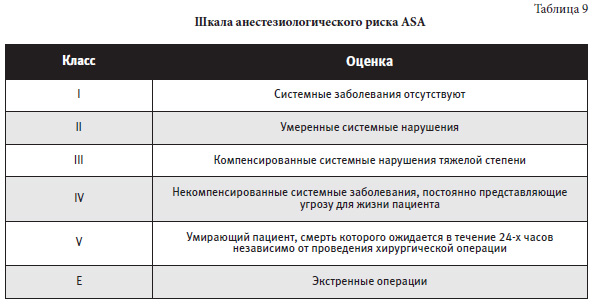
Физиологический ответ новорожденного на боль представлен в таблице 1.
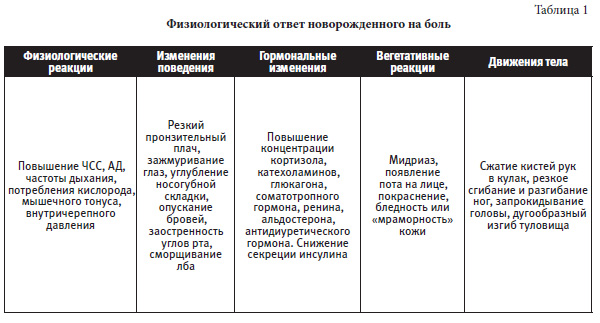
Оценка болевого синдрома у новорожденного является первым этапом в выборе дальнейшей тактики обезболивания, коррекции проводимого лечения. Для повседневной практики предложено несколько шкал оценки боли:
1. Шкала боли NFCS (Neonatal Facial Coding System) представлена в таблице 2.
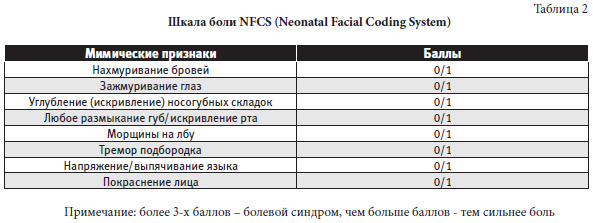
Примечание: более 3-х баллов – болевой синдром, чем больше баллов – тем сильнее боль Шкала оценки боли у новорожденных NIPS (Neonatal Infant Pain Scale) представлена в таблице 3.
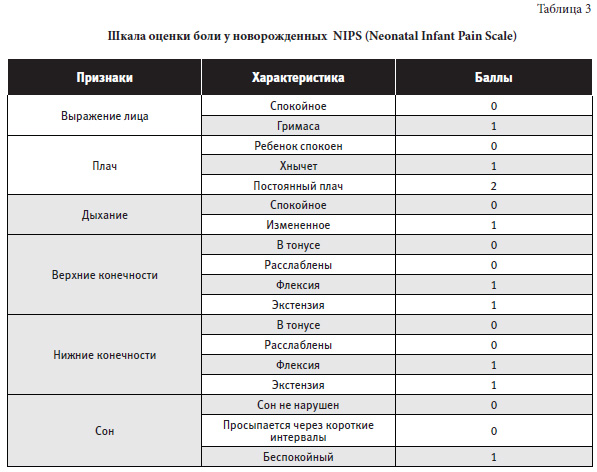
Примечание: баллы по 6 показателям суммируются; 0 – нет боли, 3-5 баллов – умеренно выраженная боль; >5 баллов – сильная боль. Низкий балл может наблюдаться у детей в тяжелом состоянии на фоне медикаментозной седации.
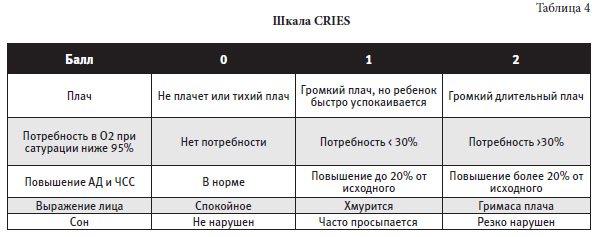
Шкала CRIES (Crying, Requires increased oxygen, Increased vital signs, Expression, Sleeplessness) (Krechel and Bildner, 1995) разработана для использования у новорожденных с 32 недель гестационного возраста до 6 месяцев. Каждый из пяти показателей этой шкалы оценивается от 0 до 2 баллов. Представлена в таблице 4.
Стратегия профилактики боли
- У новорожденного нужно предугадать боль. Это просто – что больно вам, то больно и для новорожденного малыша! Сложнее обезболить малыша при выраженных болевых ощущениях, чем предупредить их развитие.
- Ограничение количества пункций, уколов. За одну пункцию следует стремиться сделать забор большего количества анализов для микроаналитических методик.
- Ограничение использования центральных катетеров (катетер-линия, пупочные, венозный и артериальный катетеры).
- Отказ от инвазивного мониторинга и переход на транскутанный мониторинг, если позволяет состояние новорожденного.
- Необходимо снизить частоту осмотров подвздутого, увеличенного «хирургического» животика малыша. Хотя в ряде случаев это по-медицински может быть и оправдано, но для малыша крайне болезненно.
- Болезненные процедуры должен производить более подготовленный, опытный персонал.
- Бережное проведение перевязок и удаление пластыря.
- Обеспечение адекватной премедикации перед инвазивными процедурами.
- Применение соответственного атравматичного/малотравматичного оборудования и инвентаря (мелкие иглы).
Этапы обеспечения адекватного обезболивания
1. Определение цели применения обезболивающей терапии: выполнение рутинных ежедневных манипуляций, постановка венозных катетеров, проведение анестезиологического пособия, послеоперационное обезболивание.
2. Оценка выраженности болевого синдрома с применением специальных шкал.
3. Построение плана профилактики и лечения болевого синдрома: выбор препарата, выбор дозы, выбор тактики введения (болюсное, методом постоянной инфузии, регионарная, местная).
4. Оценка эффективности обезболивания и коррекция плана лечения боли при недостаточном обезболивании.
Для отделения анестезиологии и реанимации новорожденных (ОАиРН) можно адаптировать трехступенчатую «лестницу» обезболивания ВОЗ:
1-я ступень – слабая боль: нефармакологические методы и/или парацетамол в/в 2-я ступень – умеренно выраженная боль: парацетамол в/в + промедол/кетамин 3-я ступень – сильная боль – боль после «больших» оперативных вмешательств: парацетамол + сильные опиоидные анальгетики – фентанил, морфин болюсно или постоянным введением.
На каждой ступени необходимо рассмотреть возможность адъювантной терапии:
– седативная терапия;
– регионарные методы обезболивания.
Методы лечения болевого синдрома
1. Нефармакологические методы – соответствуют принципам программы NIDCAP (Neonatal Individualized Developmental Care and Assessment Program), разработанной в 1984 году в США доктором психологии Heidelise Als из Бостонской детской клиники и Гарвардской медицинской школы. Целью данной программы является грамотная организация ухода за новорожденными с учетом их анатомо-физиологических особенностей, а также моделирование условий, максимально приближенных к внутриутробным и исключающим стрессовые агрессивные воздействия. Схема включает в себя:
А) Создание комфортной среды:
– микроклимат, правильное положение тела;
– иммобилизация шейного отдела позвоночника при родовых травмах, конечностей при переломах;
– защита целостности кожных покровов;
– щадящая тактильная стимуляция, в том числе и бережное удаление пластыря;
– своевременный туалет и смена мокрых пеленок;
– деятельность медицинского персонала следует ориентировать «с доминантой на ребенка»;
– инвазивные процедуры должны осуществляться атравматичным (малотравматичным) оборудованием только подготовленным персоналом с увеличением периодов отдыха между болезненными манипуляциями – поддерживание у ребенка чувства его «безопасности», «нужности», «сопереживания» со стороны окружающих взрослых, бережное пеленание, нежное поглаживание, соска, ласковая речь, участие родителей в уходе (метод «кенгуру», «skin to skin»);
Б) Применение раствора сахарозы или глюкозы через соску. За 2 мин (интервал 2 мин от начала использования раствора per os до возникновения обезболивания совпадает со временем, необходимым для освобождения эндогенных опиоидов) перед болезненной процедурой детям назначают сахарозу (глюкозу) с концентрацией более 20% (оптимальная — 24%) в дозе 0,1–0,5 мл/кг, используя шприц, или обмакивая в раствор соску-пустышку;
2. Фармакологические методы коррекции болевого синдрома:
А) Местная анестезия – ЭМЛА-крем – его эффективность показана во время люмбальной пункции, пункции вен и артерий, обрезании крайней плоти и внутримышечных инъекций. При уколе пальца или пятки для забора крови аналгезия не подтверждена. Крем рекомендуется для применения у детей старше 34 недель гестации, однократно в течение суток. При превышении дозы или экспозиции возможно образование метгемоглобина, особенно у недоношенных детей до 26 недель гестации. Длительность аппликации должна быть 30 мин;
Б) Регионарные методы анальгезии – лекарственные средства селективного действия, целенаправленно обеспечивающие обратимое прерывание в первую очередь болевых импульсов в проводниках периферической нервной системы. В последнее время для купирования процедурной и послеоперационной боли у новорожденных возросло применение местных анестетиков по таким направлениям, как локальная инфильтрация, блокады нервных периферических стволов, спинальное введение. Регионарные методы следует рассматривать не как альтернативу общей анальгезии, а как ее возможный дополнительный компонент. Самым изученным и используемым методом у новорожденных является каудальная эпидуральная анальгезия. Эпидуральное пространство новорожденных заполнено рыхлой жировой тканью с низким содержанием фиброзных волокон, что позволяет проводить эпидуральный катетер на любой уровень вдоль позвоночного столба. В тоже время вены эпидурального пространства не имеют клапанной системы. Т.о., случайная инъекция анестетика, введение воздуха и т.д., приводит к развитию системной токсической реакции. Техника выполнения:
Выполнение катетеризации должно выполняться в условиях общей анестезии, чаще всего р-р кетамина 1-2 мг/кг. Крестцово – копчиковая мембрана пунктируется по средней линии максимально высоко на уровне рожек крестцовой кости. Известны 2 способа:
1. Кожу пунктируют под углом 90 градусов, с дальнейшим поворотом иглы на 30-40 градусов в краниальном направлении при прохождении hiatus sacralis при достижении эпидурального каудального пространства;
2. «Техника без поворота иглы» – пункция крестцово-копчиковой связки под углом 60 градусов;
Расчет дозы анестетика по схемам Armitadge – 0,5—1—1,25 мл/кг в зависимости от необходимого уровня блока. Для продленной инфузии используется раствор бипивакаина 0,0625% в дозе 0,1-0,2 мл/кг/ час. Добавление наркотического анальгетика – промедол 0,1 мг/кг, морфин 0,03 мг/кг обеспечивают анальгезию до 14 часов.
В) Ненаркотические анальгетики – самым изученным и безопасным у новорожденных является парацетамол 1% – анальгетик 1-й ступени ВОЗ. Является обезболивающим и жаропонижающим средством.
Блокирует синтез простагландинов ( ПГ) в ЦНС. Нарушает проведение болевых импульсов в афферентных путях, уменьшает пирогенное действие ПГ на центр терморегуляции в гипоталамусе, усиливает теплоотдачу. Доза: 10-15 мг/кг в/в каждые 6-8 часов.
Г) Опиоидные анальгетики – являются препаратами первой линии для лечения острой и сильной боли. Ключевым принципом для их безопасного и эффективного использования является титрование дозы.
Морфин гидрохлорид 1% – однократная доза: – 0.05-0.2 мг/кг в/в в течение 5 мин. Повторять дозу можно каждые 4-6 часов. Продленная инфузия: доза насыщения — 100-150 мкг/кг в течение первого часа.
Поддерживающая доза — 10-20 мкг/кг в течение часа. Относится к списку off-label препаратов, при назначении необходим протокол.
Фентанил 0,005% – однократная доза 1-4 мкг/кг медленно в/в. Повторять можно каждые 2-4 часа.
Продленная инфузия: доза 1-5 мкг/кг. Постоянная концентрация достигается очень быстро. При проведении анестезиологического пособия доза препарата 5-50 мкг/кг, каждые 15-25 минут.
Тримеперидин гидрохлорид 2% (Промедол) – однократная доза 0,05 – 0,3 мг/кг, для обезболивания повторное введение промедола рекомендуется использовать через 4-6 часов. В качестве компонента общей анестезии вводят внутривенно 0,5-2,0 мг/кг/час. Суммарная доза во время операции не должна превышать 2 мг/кг/час. Для постоянной внутривенной инфузии промедол вводят 10-50 мкг/кг/час (0,01-0,05 мг/кг/час).
Д) Антагонист NMDA – рецепторов – кетамин 5% – препарат выбора для проведения малых оперативных вмешательств, не требующих выключение самостоятельного дыхания; для проведения манипуляций в ОАиРН (постановки центральных венозных катетеров, люмбальная пункция, обеспечение общей анестезии при постановке эпидуральных катетеров и т.п.). NMDA рецепторная активация – важный компонент центральной сенсибилизации, в отличие от взрослого населения, у новорожденных эти рецепторы присутствуют во всем сером веществе дорсального рога спинного мозга в более высокой концентрации и с генерализованным распространением реакции. Дозировка: однократная доза 1-2 мг/кг в/в; в/м 3-5 мг/ кг. Продленная инфузия – 0,5 – 1,8 мг/кг/час (8-30 мкг/кг/мин).
Адьювантная терапия:
1. Бензодиазепины – диазепам 0,3-0,5 мг каждые 8 часов (относится к списку off-label препаратов, при назначении необходим протокол). Мидазолам – 0,05-0,15 мг/кг каждые 2-4 часа, продленная инфузия – 10-60 мкг/кг/час;
2. Барбитураты – тиопентал натрия 2-6 мг, продленная инфузия 1-4 мг/кг/час;
3. Пропофол – 2,5-3,0 мг/кг, продленная инфузия – 9-14 мг/кг/час;
4. Натрия оксибутират – 100 – 150 мг болюсное введение, продленная инфузия 25 – 50 мг/час;
5. Миорелаксанты: панкуроний 0,04 -0,15 мг/кг; пипекуроний бромид (ардуан) – 0,05-0,1 мг/кг.
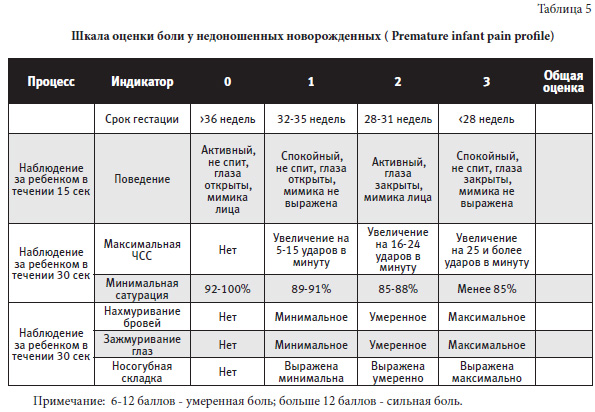
Шкала оценки боли у недоношенных новорожденных (Premature infant pain profile), предложенная в 1996 г. авторами Stevens B., Johnston C., Petryshen P.,Taddio A., отображена в таблице 5.
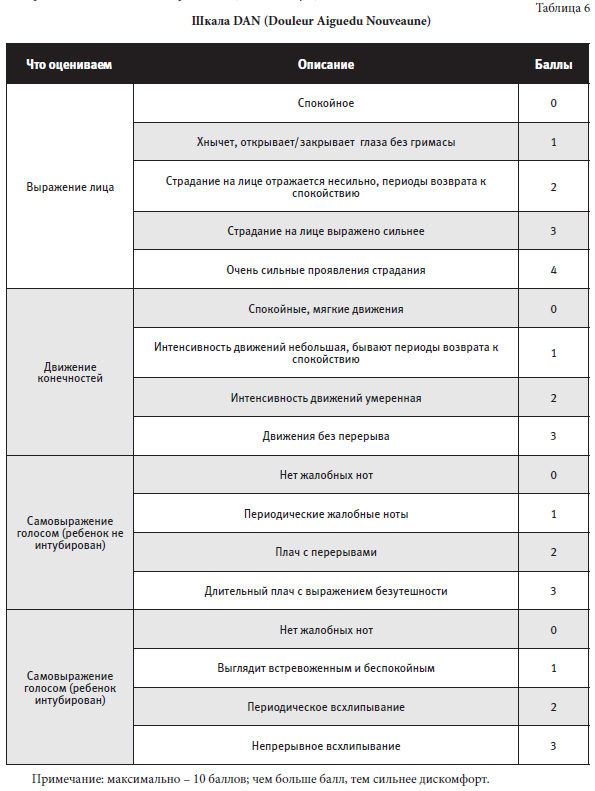
Шкала DAN (Douleur Aiguedu Nouveaune) используется для оценки острой и хронической боли у новорожденных по внешним признакам ( см. таблицу 6).
Для оценки боли у новорожденных, которые находятся на искусственной вентиляции легких (ИВЛ), используют шкалу COMFORT ( таблица 7).
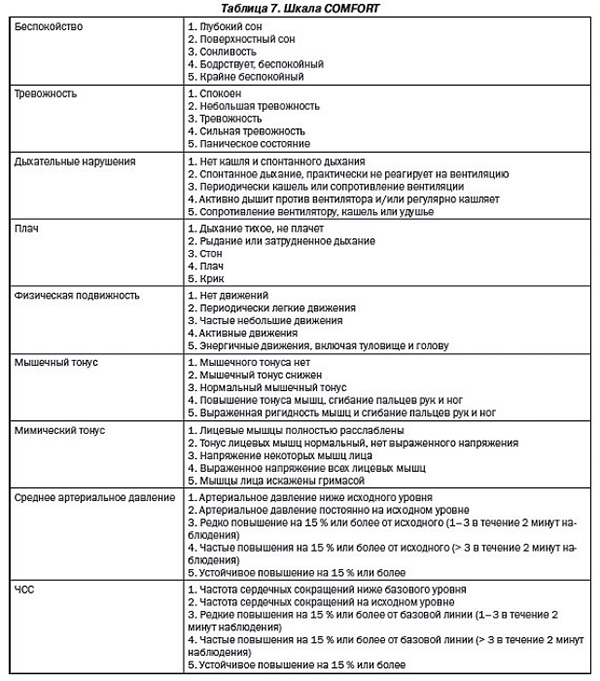
Примечание: каждый показатель оценивается по шкале от 1 до 5. Значения от 17 до 26 свидетельствуют об адекватной седации и обезболивании.
Ниже перечислены болезненные диагностические манипуляции и лечебные процедуры, проводимые у новорожденных в ОаиРН.
Диагностические манипуляции :
– пункция артерии;
– бронхоскопия;
– эндоскопия;
– пункция пятки;
– люмбальная пункция;
– осмотр глаз (ретинопатия и др.) ;
– пункция мочевого пузыря;
– пункция вены.
Tерапевтические процедуры:
– катетеризация мочевого пузыря;
– введение и удаление центральных катетеров;
– введение и удаление дренажа в полость плевры;
– физиотерапия грудной клетки;
– перевязка;
– введение желудочного зонда;
– внутримышечные инъекции;
– лазерная терапия для лечения ретинопатии;
– катетеризация периферических вен;
– мeханическая вентиляция;
– дренажные положения;
– удаление лейкопластыря;
– удаление швов;
– интубация/экстубация трахеи;
– пункция желудочков мозга.
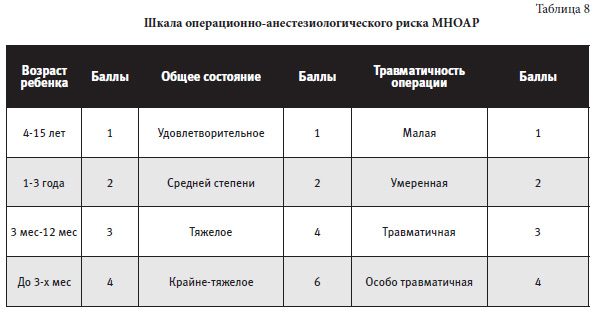
Оценка риска:
I ст (незначительная) – 3 балла II ст (умеренная) – 4-5 баллов III ст (средняя) – 6-7 баллов IV ст (значительная) – 8-10 баллов V ст (чрезвычайная) – <10 баллов

Литература
- Современные возможности лечения острой послеоперационной боли у пациентов детского возраста / Кондратьев А.Н., Саввина И.А., Хачатрян В.А., Лебедева А.О. // Нейрохирургия и неврология детского возраста. – 2007. – № 3. – С. 30-36.
- Лебедева А.О. Упреждающая антиноцицептивная терапия в детской анестезиологии // Актуальные вопросы клинической и экспериментальной медицины. Сборник тезисов к научно-практической конференции молодых ученых. – Спб., 2009. – С. 212-214.
- Pain in neonates and infants / Edited by K.J.S. Anand, B.J. Stevens, P.J. McGrath // Third edition, Elsevier, 2007. – 329 P.
- Julia Harris, Anne-Sylvie Ramelet, Monique van Dijk, et al. Clinical recommendations for pain, sedation, withdrawal and delirium assessment in critically ill infants and children: an ESPNIC position statement for healthcare professionals. Guidelines.// Intensive Care Med. – 2016. – №42. – P. 972-986.
Тольяттинский медицинский консилиум. №3-4 2017
Источник
… боль – одно из первых ощущений всякого приходящего в этот мир.
ВВЕДЕНИЕ. За время пребывания в родильном доме, а тем более в стационаре, доношенные и особенно недоношенные новорожденные переносят большое количество манипуляций и процедур, большинство из которых достаточно болезненны. Однако долгое время, вплоть до середины 1970-х годов, существовало твердое убеждение, что новорожденные не способны воспринимать физическую боль вследствие незрелости периферических болевых рецепторов ЦНС и неполной миелинизации проводящих волокон. Вследствие этого лечение боли у новорожденных до начала 80-х годов редко проводилось адекватно, поскольку предполагалось, что они из-за незрелой нервной системы практически не чувствуют боли. Только в течение последних двух десятилетий удалось получить подтверждение того, что новорожденные чувствуют боль. Появились возможности оценить реакцию мозга младенца на болевой раздражитель. Британские медики фиксировали мозговую деятельность недоношенного ребенка в момент забора у него крови из пятки и после этой процедуры. Специальным образом обработанные снимки показали характерное изменение кровоснабжения коры в этот момент. А это означало одно: болевой сигнал до мозга доходит даже у родившихся раньше срока новорожденных.
В настоящее время полагают, что боль, перенесенная в период новорожденности, нарушает развитие системы ноцицепции (болевой системы) и приводит к необратимым функциональным и структурным изменениям в ЦНС, тем самым изменяя «программу» ответа на боль в будущем. Все это имеет поздние поведенческие и психологические последствия.
Возросший интерес к проблеме боли у детей в последние годы объясняется выявленными тяжелыми последствиями неконтролируемой боли, перенесенной в период новорожденности. Стали известны такие последствия тяжелой неконтролируемой боли, как риск развития внутрижелудочковых кровоизлияний, сепсиса, перивентрикулярной лейкомаляции, ишемии головного мозга. Адекватная аналгезия и профилактика боли при манипуляциях и процедурах способны уменьшить дискомфорт ребенка, минимизировать гормональные и метаболические изменения в ответ на стресс, улучшить переносимость врачебных манипуляций и процедур по уходу. Врачи стали ставить вопросы о необходимости облегчения ненужных страданий младенцев при использовании медицинских вмешательств.
ПРИЧИНЫ БОЛИ У НОВОРОЖДЕННЫХ. Боли новорожденных могут быть обусловлены различными причинами. Условно их можно разделить на 2 группы причин:
| I группа причин | II группа причин |
| различные заболевания новорожденных, обусловленные интранатальными и постнатальными причинами | медицинские вмешательства |
| – агрессивная акушерская тактика в родах (механическое выдавливание плода, акушерские щипцы, вакуум-экстракция, стимулированные роды, грубое извлечение при кесаревом сечении и пр.); – родовые травмы ЦНС, шейного отдела позвоночника, переломы костей, гематомы и др. родовые травмы; – внутричерепные кровоизлияния, окклюзионная гидроцефалия; – врожденные пороки развития (гастрошизис, вентральные и спинно-мозговые грыжи); – гнойно-воспалительные заболевания новорожденных – омфалит, менингит и менинго- энцефалит, остеомиелит, некротический энтероколит, перитонит. | – реанимационные пособия (интубация, искусственная вентиляция легких, катетеризация сосудов и пр.); – хирургические операции и вмешательства; – болезненные процедуры (частые осмотры медперсонала, инъекции, пункции и катетеризация сосудов, дренирование плевральной полости, перикарда и суставной сумки, интубация и отсасывание содержимого трахеи, забор крови из пальца, пятки и вены, смена пластыря, повязок). |
БОЛЕВЫЕ РЕАКЦИИ НОВОРОЖДЕННЫХ. К особенностям болевой реакции у новорожденных относят гипералгезию – генерализованный характер ответа на болевое раздражение, который максимально выражен у недоношенных детей. То есть особенность новорожденных в том, что боль вызывает реакцию всего организма. А это более вредно, чем реакция локальная. Болевые реакции новорожденных делят на поведенческие, физиологические, нейроэндокринные и обменные:
| поведенческие болевые реакции | физиологические болевые реакции | нейроэндокринные и обменные болевые реакции |
| – отсутствие коммуникабельности, контакта с осматривающим – безразличие и/или вздрагивания, тремор конечностей и подбородка при дотрагивании; – отказ от еды, срыгивания, рвота; – вскрикивания, стоны, более или менее продолжительный неэмоциональный, раздраженный, монотонный крик, болезненный крик; – болезненный плач (важно различать характер плача – эмоциональность, громкость, тональность, продолжительность, периодичность); – болевые гримасы (сморщенный лоб, нахмуренные брови, дрожь подбородка, полузакрытые глаза, углубление носогубного треугольника); – гипертонус конечностей и сжатые в кулаки руки, спонтанный рефлекс Моро, описто- и гипотонус конечностей и вялость; – отсутствие спонтанной двигательной активности или локальное обездвиживание (например конечности при переломах или остеомиелите); – вышеупомянутые голосовые и мимические реакции при пассивных движениях (например, при взятии на руки ребенка с травмой шейного отдела позвоночника или при пассивных движениях поврежденной конечности). | – изменения частоты и механики дыхания (обычно тахикардия и тахипноэ, но возможны и приступы апноэ); – изменения частоты и ритма сердечных сокращений; – изменения повышения артериального давления; – снижение PO2 и повышение PCO2 в крови; – снижение сатурации крови и тканей; – неустойчивая температура тела, быстрая охлаждаемость; – напряжение большого родничка; – метеоризм; – потливость ладоней; – бледность или пятнистость кожи; – расширение зрачков. | – увеличение синтеза и высвобождения катехоламинов, эндорфинов, глюкокортикоидов, глюкагона, кортизола (изменение уровня кортизола в плазме, моче и слюне) и снижение секреции инсулина и тиреоидного гормона; – увеличение рениновой активности плазмы; – гипергликемия; – метаболический ацидоз за счет увеличения уровней лактата, пирувата, кетоновых тел; – катаболическая направленность обмена, отрицательный азотистый обмен и отсутствие прибавок массы тела. |
ЛЕЧЕНИЕ БОЛИ У НОВОРОЖДЕННЫХ. Прежде чем переходить к лечению боли у новорожденных необходимо заметить, что эффективность лечения болевого синдрома зависит в первую очередь от оценки выраженности боли. Задачи обезболивания у новорожденных и детей состоят в эффективном снижении боли и страданий, качестве выполненной процедуры или операции, скорейшем выздоровлении и отсутствии или минимизации осложнений. Большое значение в болевых ощущениях новорожденного имеют окружающая среда, наличие рядом родителей (особенно мамы), отношение врачей и среднего медицинского персонала. В отсутствие родителей даже новорожденный ребенок может демонстрировать признаки боли в тех случаях, когда физиологические показатели свидетельствуют о его комфорте. В конечном итоге цель обезболивания минимизировать боль (продолжительность, интенсивность и тяжесть побочных явлений), помочь ребенку справиться с болевыми ощущениями и воспрепятствовать накоплению «болевого опыта». Существуют нефармакологические (для предотвращения легкой или средне-тяжелой боли) и медикаментозные методы лечения боли у новорожденных ( читать).
Источник
