Роль гормонов надпочечников в развитии общего адаптационного синдрома
В 1936 г. Г. Селье установил, что при действии самых различных патогенных и чрезмерных по силе и длительности раздражителей в организме возникают определенные неспецифические изменения, названные им общим адаптационным синдромом. Это состояние может развиваться, когда организм попадает в неадекватные условия существования: многочисленные травмы, чрезмерная мышечная нагрузка, охлаждение, отравления, инфекции, сильное эмоциональное возбуждение. Обшим для всех этих воздействий является ответная реакция организма, выражающаяся в гипертрофии коры надпочечника, уменьшении тимуса, селезенки и лимфатических узлов. На фоне этих изменений развиваются дегенеративные процессы в печени, отечность, снижается тонус мышц и температура тела, появляются кровоизлияния и язвы желудочно-кишечного тракта. Факторы, вызывающие эту неспецифическую реакцию, принято называть стрессорами, поскольку общий адаптационный синдром возникает при таком состоянии организма, которое Г. Селье назвал состоянием «напряжения» (stress).
В ходе адаптации организма к неблагоприятным условиям происходит мобилизация механизмов, снижающих патологическое воздействие. Если предотвратить развитие адаптационных реакций, существенно понижается сопротивляемость организма и может наступить смерть. В развитии общего адаптационного синдрома выделяют три стадии.
Первая стадия — «реакция тревоги», характеризуется усиленной секрецией адренокортикотропного гормона, который, в свою очередь, стимулирует секрецию глюкокортикоидов и выделение их в кровоток. В крови уменьшается число нейтрофилов, понижается уровень глюкозы, повышается проницаемость стенок кровеносных сосудов, появляются точечные кровоизлияния.
Вторая стад и я — «стадия резистентности». При продолжающемся воздействии повреждающего фактора происходит гиперплазия коры надпочечников, наряду с усиленным синтезом глюкокортикоидов в надпочечнике накапливаются холестерин и аскорбиновая кислота. Процессы обмена веществ приходят в норму, выравниваются сдвиги метаболизма, обнаруживаемые в начале неблагоприятного воздействия. Наряду с этим уменьшаются тимус и лимфатические узлы.
Третья стадия — «стадия истощения», наступает, если напряжение слишком велико или неадекватно длительно и организм не может к нему приспособиться. Кора надпочечника, несмотря на гиперплазию, не способна вырабатывать нужное количество гормонов; клетки содержат мало липоидных гранул и аскорбиновой кислоты. В крови нарастает количество эозинофилов и лимфоцитов, отмечается гипертрофия лимфатических узлов. В условиях нарушения адаптации и истощении защитных механизмов наступает смерть как следствие нарушения резистентности организма и развития инфекционных процессов.
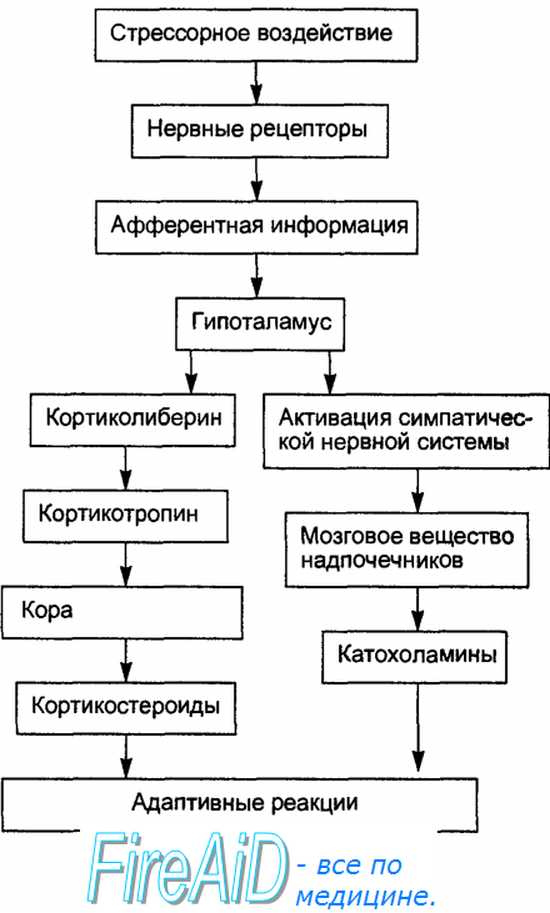
Вполне очевидно, что в развитии общего адаптационного синдрома главную роль играют гипофиз и кора надпочечников. Гипофиз секретирует АКТГ, стимулирующий синтез и выделение глюкокортикоидов, представляющих собой, по мнению Г. Селье, адаптационные гормоны. Адаптационные гормоны (кортикостерон, гидрокортизон), обладая противоспалительным действием, подавляют реакции соединительной ткани на патогенный раздражитель, усиливая катаболические процессы в организме. Их природными антагонистами являются соматотропный гормон и минералкортикоиды коры надпочечника (альдостерон, дезоксикортикостерон), стимулирующие анаболические процессы и усиливающие воспалительную реакцию. Следует учитывать, что «стрессоры» прежде всего действуют на рецепторы и состояние «напряжения» развивается рефлекторно с непосредственным участием ЦНС: кора больших полушарий и подкорковые образования воздействуют на гипоталамические структуры, ответственные за выделение кортиколиберина.
Усиленная продукция кортиколиберина, АКТГ и глюкокортикоидов — три необходимые составные части формирования общего адаптационного синдрома. В этой связи весьма интересной для понимания проблемы адаптации является индивидуальная чувствительность организма к стрессорным воздействиям. При различном исходном уровне возбудимости животные различных типов нервной деятельности неадекватно реагируют на однозначные по величине факторы среды. В этой связи промышленное животноводство, неизбежно сталкивающееся со стрессорны- ми воздействиями, требует соответствующей селекционной работы, направленной на отбор «стрессоустойчивых» животных, у которых неблагоприятные факторы среды меньше влияют на уровень продуктивности и состояние их здоровья.
Источник
Оглавление темы “Гормоны почек. Гормоны сердца. Гормоны сосудов. Гормоны при стрессе. Выделение гормонов при повреждении тканей.”: Стресс. Гормоны при стрессе. Общий адаптационный синдром. Гормональное обеспечение общего адаптационного синдрома, или стресса.Примером неспецифического участия эндокринной системы в приспособительных реакциях организма являются изменения ее деятельности при стрессе. Состояние стресса возникает как следствие действия на организм любых сильных, в том числе экстремальных и повреждающих, раздражителей. При действии на организм экстремальных факторов неспецифические реакции стресса прежде всего направлены на стимуляцию энергетического обеспечения приспособительных процессов. Ведущую роль в этих неспецифических реакциях играют катехоламины и глюкокортикоиды, в значительных количествах мобилизуемые в кровь (рис. 6.30). Активируя катабо-лические процессы, эти гормоны ведут к гипергликемии — одной из начальных реакций субстратного энергообеспечения. Как следствие гипергликемии на некоторое время повышается в крови уровень инсулина. Метаболические перестройки при таком гипергормональном профиле связаны, прежде всего, с активацией в печени фосфорилазы и гликогенолизом, а поступающая в кровь глюкоза под влиянием инсулина интенсивно утилизируется тканями, прежде всего скелетными мышцами, что увеличивает их работоспособность и повышает теплообразование в организме. Жиромобили-зующий эффект глюкокор-тикоидов и катехоламинов способствует повышению в крови второго важнейшего энергетического субстрата — свободных жирных кислот. Однако подобный «форсированный» режим функционирования эндокринной системы из-за ограниченности функциональных резервов не может длиться долго, вскоре содержание инсулина в крови уменьшается, что носит название «функциональный транзиторный диабет». Это необходимое условие для усиления жиромобилизующего эффекта глюкокортикоидов и активации глюконеогенеза. Важнейшим источником глюкозы как энергетического материала в этот период становится глюко-неогенез, но на образование глюкозы расходуется дефицитный пластический материал — аминокислоты. Необходимым условием длительно повышенного энергоснабжения является переключение энергетического обмена с углеводного типа на липидный, тем более что углеводные резервы в виде гликогена достаточно быстро оказываются практически исчерпанными. Постепенно снижается продукция глюкокортикоидов, устанавливается новое гормональное соотношение: нерезко повышенный уровень глюкокортикоидов при более значительном снижении уровня инсулина. Этот новый уровень функционирования эндокринной системы способствует восстановлению равновесия между катаболическими и анаболическими процессами, расходы белка на энергетические нужды снижаются. Жиромобилизующий эффект гормональной перестройки и образование транспортной формы эндогенного жира — липопротеинов очень низкой плотности — приводят к тому, что растет использование клетками липидов как источников энергии. Жирные кислоты интенсивно окисляются в скелетных мышцах, миокарде и печени. Образующиеся при этом кетоновые тела усиленно окисляются в мышечной ткани, почках, а также сердце и мозге. Особенно резко ограничивается потребление углеводов мышечной и жировой тканью, что экономит глюкозу для углеводзависимых тканей — головного мозга, кроветворной ткани и эритроцитов, в некоторой степени — миокарда. Таким образом, происходящие при стрессе гормональные и метаболические перестройки обеспечивают длительное неспецифическое повышение энергообеспечения приспособительных процессов.
Стресс как неспецифическая реакция приспособления и компенсации нарушенных функций может при резкой выраженности сопровождаться и активацией гипоталамо-гипофизарно-тиреоидной системы, приводя к росту в крови уровня тиреоидных гормонов. Физиологический стресс, например эмоциональное напряжение, напротив, характеризуется снижением гормональной активности щитовидной железы. Гиперфункция щитовидной железы в ответ на повреждение тканей является неспецифической реакцией компенсации, поскольку тиреоидные гормоны, благодаря стимуляции синтеза белков, способствуют клеточным регенеративным процессам и репарации поврежденных структур. Активация гипоталамо-гипофизарно-тиреоидной системы может носить и черты специфической компенсации, например в условиях холодового стресса, как компенсация термического угнетения метаболизма. Стресс при экстремальных состояниях сопровождается активацией и других гормональных систем — гипоталамо-гипофизарно-андрогенной и гипоталамо-нейрогипофизарной. Повышение активности системы гонадолиберины—гонадотропины—андрогены (одним из проявлений является повышение либидо) и избыточно секретируемые при этом андрогены за счет анаболического эффекта способствуют репаратив-ным процессам. При хирургическом и эмоциональном стрессе повышается секреция вазопрессина. Компенсаторное значение активации секреции вазопрессина заключается в облегчении консолидации процессов памяти, формирования аналгезии, потенцировании эффектов кортиколиберина на секрецию кор-тикотропина, восстановлении нарушенной при кровопотере гемодинамики. Избыточная секреция вазопрессина при травмах является примером опережающей перестройки эндокринных механизмов компенсации, реализующей избыточный гормональный сигнал для предотвращения возможности потери организмом воды при кровотечении. Реакция гипоталамо-нейрогипофизарной системы может быть и специфической компенсацией возникших в организме нарушений водно-солевого и осмотического гомеостазиса (осмотический стресс). – Также рекомендуем “Выделение гормонов при повреждении тканей. Регенерация. Репарации. Гормональная регуляция местных компенсаторных реакций.” |
Источник
Адреналин повышает систолическое артериальное давление и минутный объем сердца, увеличивает частоту сердечных сокращений, расширяет коронарные сосуды.
Норадреналин снижает частоту сердечных сокращений и минутный объем сердца.
В1 0. Поджелудочная железа, ее эндокринная система.
Поджелудочная железа — вторая после печени по величине железа пищеварительной системы. Длина ее у взрослого человека 14–22 см (чаще всего составляет 16–17 см), ширина 3–9 см (в области головки), толщина 2–3 см. Масса органа около 70–90 г.
Поджелу́дочная железа́ человека — орган пищеварительной системы; крупная железа, обладающая внешнесекреторной и внутреннесекреторной функциями. Внешнесекреторная функция органа реализуется выделением панкреатического сока, содержащего пищеварительные ферменты. Производя гормоны, поджелудочная железа принимает важное участие в регуляции углеводного, жирового и белкового обмена.
Этот орган (поджелу́дочная железа́) расположен под желудком. У поджелудочной железы есть эндокринная функция, но она также является экзокринной железой (железой внешней секреции, с выводным протоком). Как эндокринная железа она производит инсулин и глюкагон – два гормона, которые контролируют количество сахара в крови. Эти гормоны производятся участками железы, называемым островками Лангерганса. Поджелудочная железа также выделяет пищеварительные соки в двенадцатиперстную кишку (тонкую кишку). Эти соки, которые смешиваются с желчью, являются смесью ферментов, которые переваривают пищу.
Островки Лангерганса. В них находятся клетки двух типов. Каждый тип производит один из гормонов поджелудочной железы, инсулин (понижает уровень сахара в крови) или глюкагон (повышает уровень сахара в крови). Повреждение этих клеток может привести к диабету. глюкагон, а инсулин понижает уровень сахара в крови.
Пищеварительный орган. Поджелудочная железа – это тонкий орган, расположенный внутри петли двенадцатиперстной кишки. Пищеварительные соки содержат соли, которые нейтрализуют желудочные кислоты.
Микроскопический срез. Островки Лангерганса – это участки секреторных клеток в поджелудочной железе. Эти островки окружены клетками, которые выделяют пищеварительные соки. Внутри островков находятся В-клетки, производящие инсулин. Глюкагон производится А-клетками. Пищеварительные соки проходят в центральный проток, соединяющий железу с двенадцатиперстной кишкой. А гормоны «собираются» капиллярами, проходящими в этих островках.
В11. Мужские половые железы, их внутрисекреторная функция.
Мужские и женские половые железы выполняют генеративную функцию и являются эндокринными.
Половые железы (семенники у мужчин, яичники у женщин) относятся к железам со смешанной функцией, внутрисекреторная функция проявляется в образовании и секреции половых гормонов, которые непосредственно поступают в кровь.
Семенники закладываются в ранних этапах развития мальчика еще в организме матери. Основными функциями семенников плода являются:
— выработка фактора, направляющего формирование структур половых органов по мужскому типу:
— секреция гормона тестостерона, под влиянием которого происходит развитие половых органов, а также настройка гипоталамуса на «мужской» тип селекции гонадолиберина.
Структурной и функциональной единицей мужской половой железы являются извитые семенные канальцы. (строение семенника: сперматазойды, просвет извитого семенного канальца, клетки Сертоли, клетки Лейдига). Общая их длина около 250 м. Стенка канальца выстлана клетками Сертоли. Между ними, а также к ближе к просвету канальца расположены клетки , из которых формируются зрелые сперматазойды. В клетках Сертоли образуется белок, необходимый для концентрирования и транспорта половых гормонов
Мужские половые гормоны – андрогены образуются в интерстициальных клетках семенников. Различают два вида андрогенов – тестостерон и андростерон.
Андрогены стимулируют рост и развитие полового аппарата, мужских половых признаков и появление половых рефлексов.
Они контролируют процесс созревания сперматозоидов, способствуют сохранению их двигательной активности, проявлению полового инстинкта и половых поведенческих реакций, увеличивают образование белка, особенно в мышцах, уменьшают содержание жира в организме. При недостаточном количестве андрогена в организме нарушаются процессы торможения в коре больших полушарий.
Половые железы являются парными органами. В мужском организме они представлены семенниками, или яичниками. Половые железы относятся к железам со смеженной функцией. За счет внешнесекреторной функции этих желез образуются половые клетки. Внутрисекреторная функция заключается в выработке половых гормонов.
Источник
Надпочечники представляют парные эндокринные железы, расположенные поверх каждой почки. Железы имеют треугольную и полулунную формы. Каждый надпочечник состоит из двух слоев: коркового и мозгового. В корковом слое синтезируются гормоны кортизол, альдостерон и небольшое количество эстрогенов и тестостерона. В мозговом слое образуются катехоламины, норадреналин и адреналин.
Кортизол выполняет множество важных функций. Гормон определяет, как быстро организм превращает жиры, белки и углеводы в энергию. Кортизол участвует в регуляции кровяного давление, сердечно-сосудистой функции, отвечает за иммунные реакции и реакции воспаления. Наиболее значимая функция гормона — это адаптация организма к стрессовым воздействиям и ситуациям.
Функция надпочечников в значительной степени контролируется специальными областями мозга — гипоталамусом и гипофизом. Ось гипоталамус-гипофиз-надпочечники формирует реакцию на стресс.
Стресс и надпочечники
При столкновении с угрозой, в коре головного мозга появляется сигнал тревоги, который поступает в гипоталамус. Гипоталамус синтезирует гормон, воздействующий на гипофиз. Итогом реакций является стимуляция надпочечников и выброс ими в кровь кортизола и адреналина.
Адреналин увеличивает частоту сердечных сокращений, повышает кровяное давление и увеличивает расход энергии. Кортизол, основной гормон стресса, увеличивает уровень сахара в крови, улучшает использование мозгом глюкозы и повышает доступность веществ, которые восстанавливают ткани.
Кортизол ограничивает функции, которые были вредными в антистрессовых реакциях. Он определяет иммунный ответ, угнетает деятельность пищеварительной и репродуктивной системы, замедляет процессы роста. Сложная система реагирования тесно взаимодействует с отделами мозга, которые контролируют настроение, мотивацию и страх.
Система стресс-реакции организма способна к самоограничению. Как только воспринимаемая угроза проходит, уровни гормонов возвращаются к прежним значениям. По мере снижения уровня адреналина и кортизола, частота сердечных сокращений и артериального давления достигают исходных значений, остальные системы возобновляют свою деятельность.
Когда стрессовый фактор присутствует постоянно, организм оказывается в условиях постоянного напряжения. Система антистрессового реагирования остается во включенном состоянии долгое время.
Что такое усталость надпочечников?
При длительно существующем стрессовом факторе, надпочечники истощаются и происходит их дезадаптация. В медицине это состояние называется «синдром стресса надпочечников» или «синдром усталости надпочечников». Наблюдается снижение выработки кортизола, его количества становится недостаточным для поддержания нормального здоровья.
Симптомы усталости надпочечников включают:
- аутоиммунные состояния;
- хроническую усталость (всегда чувство усталости);
- выпадение волос;
- гормональный дисбаланс;
- резистентность к инсулину;
- головокружение;
- снижение сексуального влечения/либидо;
- нестабильное настроение;
- депрессия;
- проблемы с кожей;
- нарушения сна;
- увеличение веса;
- тяга к сладкому и соленому.
Все, что вызывает сильное и продолжительное напряжение, ведет к дезадаптации надпочечников.
Такими факторами являются:
- напряженная жизненная ситуация (смерть близкого человека, развод, переезд);
- хронические болезни;
- хронический стресс (финансовый стресс, вредные условия труда, плохие семейные отношения, злоупотребление алкоголем);
- нездоровая диета и отсутствие физических упражнений;
- плохой сон и т. д.
Диагностика состояния
Врач на основании тщательно собранного анамнеза, жалоб, назначает исследование уровня кортизола. Анализ можно выполнить по крови и по слюне.
Источник
