Синдром апера видно на узи
Синдром Апера у плода. Диагностика и прогноз при синдроме Апера
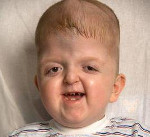
Синдром Апера (Apert), или акроцефалосиндактилия, является редко встречающейся аномалией, которая характеризуется мальформациями черепа, лица и конечностей и в 50% случаев сопровождается умственной отсталостью различной степени тяжести. Впервые этот синдром был описан Уитоном (Wheaton) в 1894 году и обобщен Апером (Apert) в 1906 году, который представил 9 клинических наблюдений этой патологии.
По некоторым данным частота встречаемости синдрома Апера (Apert) составляет от 0,0625 до 0,1 на 10 000 родов. Вследствие высокого уровня неонатальной смертности ожидаемая распостраненность в общей популяции приблизительно оценивается на уровне от 5 х 106 до 1 х 105 на 10 000 новорожденных. Соотношение по половому признаку составляет 1:1.
Синдром Апера (Apert) представляет собой аутосомное нарушение с доминантным типом наследования. Большинство случаев возникает спорадически и обусловлено появлением новых мутаций. Описана связь возникновения патологии с увеличением возраста родителей.
При развитии заболевания вследствие новой мутации риск рецидива маловероятен. Если один из родителей является носителем заболевания, риск рецидива составляет 50%.
Наиболее типичными признаками синдрома Апера (Apert) являются краниосиностоз (с вовлечением коронарного шва при данном заболевании), двухсторонняя симметричная синдактилия конечностей (варежкообразные кисти и стопы) и гипоплазия срединных отделов лица. Дополнительные признаки, появляющиеся с переменной частотой, могут быть представлены:
• скелетными аномалиями, такими как уменьшенная по высоте и широкая голова; высокий «башенный» мозговой череп (акроцефалия); выступающий лоб; гипертелоризм и проптоз глазных яблок; глубокая переносица с носом, напоминающим клюв попугая; гипоплазия верхней челюсти; прогнатия;
• пороками сердца, такими как стеноз ствола легочной артерии, «верхом сидящая» аорта и дефекты межжелудочковых перегородок;
• аномалиями центральной нервной системы, такими как гидроцефалия, мальформации мозолистого тела и лимбических структур, аномалии извилин, гипоплазия белого вещества и гетеротопия серого вещества.
Также в антенатальном периоде может выявляться многоводие (вызванное уменьшением заглатывания плодом амниотической жидкости) и постнатально -умственная отсталость, появление и степени тяжести которой предположительно коррелируют со степенью поражения центральной нервной системы.
Имеются сообщения о пренатальной диагностике с помощью ультразвукового исследования и фетоскопии во всех триместрах беременности. Эхографическим маркером данной патологии в первом триместре также может быть увеличение толщины воротникового пространства.
Наиболее распространенными мутациями, которые вызывают синдром Апера (Apert), являются замены нуклеотидов серина на триптофан S252W и пролина на аргинин P253R, происходящие в гене рецептора 2 фактора роста фибробласта (FGFR2). При подозрении на синдром Апера (Apert) рекомендуется проведение молекулярно-генетических исследований у плода (путем биопсии ворсин хориона или амниоцентеза), а также обследование родителей, особенно в тех семьях, где заболевание регистрируется впервые.
Недавно выполненное исследование выявило, что при мутации P253R отмечаются меньшая выраженность черепно-лицевых аномалий и более значимымые деформации конечностей. Кроме того, с помощью генетических методов была выявлена связь между нарушением экспрессии генов рецепторов фактора роста кератиноцитов (KGFR) и возникновением деформаций конечностей при синдроме Апера (Apert).
В дифференциальный диагноз могут быть включены генетические синдромы, характеризующиеся наличием краниосиностоза, такие как синдромы Крузона (Crouzon), Пфайффера (Pfeiffer), Карпентера (Carpenter) и Сэтре-Чотцена (Saethre-Chotzen). В настоящее время для исключения этих аномалий могут использоваться молекулярно-генетические методы исследования.
До наступления периода жизнеспособности плода может быть предложено прерывание беременности. В более поздние сроки гестации стандартная акушерская такика не изменяется. Рекомендуется родоразрешение в специализированных перинатальных медицинских центрах.

Синдром Апера I
– Также рекомендуем “Синдром Арнольда-Киари. Множественный врожденный артрогрипоз плода”
Оглавление темы “Врожденные пороки развития плода”:
1. Особенности диагностики фетальных синдромов. Ахондрогенез и его частота
2. Генетические нарушения при ахондрогенезе. Ахондроплазии у плода
3. Дифференциальный диагноз ахондроплазии у плода. Синдром акрофациального дизостоза – синдром Нагера
4. Акромезомелическая дисплазия. Синдром Эйкарди
5. Врожденный СПИД. Фетальная ВИЧ-инфекция
6. Синдром амниотических перетяжек. Диагностика и прогноз при синдроме амниотических перетяжек
7. Синдром Апера у плода. Диагностика и прогноз при синдроме Апера
8. Синдром Арнольда-Киари. Множественный врожденный артрогрипоз плода
9. Асфиксическая дисплазия грудной клетки. Синдром асплении и полисплении
10. Синдром Беквита-Видемана. Диагностика и прогноз синдрома Беквита-Видемана
Источник

Синдром Апера – генетическое заболевание, характеризующееся нарушениями процессов окостенения черепа и связанными с этим вторичными расстройствами, а также многочисленными пороками развития скелета и конечностей. Симптомами этого состояния являются карликовый рост, башенная форма черепа, расширенная переносица, незаращение твердого нёба, синдактилии на руках и ногах. Диагностика синдрома Апера производится по характерной клинической картине патологии, на основании рентгенологических данных и молекулярно-генетических исследований. Специфического лечения заболевания не существует, применяют поддерживающую терапию, проводят хирургические вмешательства паллиативного характера.
Общие сведения
Синдром Апера (акроцефалосиндактилия 1 типа) – генетическая патология, обусловленная нарушением образования некоторых видов соединительной ткани, главным образом костной. Впервые данное состояние было описано в 1906 году французским педиатром Э. Апером, дальнейшие исследования подтвердили генетическую природу этого заболевания. Этиология и молекулярно-генетические механизмы развития синдрома Апера были определены значительно позднее – лишь в 1995 году. Данная патология может наследоваться по аутосомно-доминантному механизму, однако в подавляющем большинстве случаев ее причиной являются спонтанные мутации в половых клетках родителей (так называемые герминативные мутации).
Синдром Апера с одинаковой частотой поражает как мальчиков, так и девочек, его встречаемость составляет в среднем 1 случай на 160 000-200 000 новорожденных. Врачи-генетики в настоящее время относят синдром Апера к особой группе наследственных заболеваний – акроцефалосиндактилиям, характеризующиеся одновременным поражением костей черепа и конечностей. Особенностью этой патологии является важность ее как ранней диагностики, поскольку паллиативные мероприятия в раннем возрасте могут в значительной степени влиять на дальнейшее интеллектуальное развитие больного.
Синдром Апера
Причины синдрома Апера
Синдром Апера, согласно последним научным данным, обусловлен мутациями гена FGFR2, расположенного на 10 хромосоме. Он кодирует белок-рецептор фактора роста фибробластов-2, который оказывает значительное влияние на развитие клеток соединительных тканей, в том числе и костной. Значительный размер (20 экзонов) и специфическое расположение гена делают его уязвимым к различного рода повреждениям, которые затем фенотипически проявляются наследственными заболеваниями. Помимо синдрома Апера дефекты гена FGFR2 приводят к развитию таких патологий, как синдром Бира-Стивенсона, синдром Пфайффера, синдром Сетре-Чотзена, краниофациально-скелетно-дерматологическая дисплазия и ряду других. Поэтому исследования данного гена довольно распространены в современной генетике.
Как показали исследования 1995-2000 годов, наиболее часто (в 96% случаев) к развитию синдрома Апера приводят мутации в области 7 экзона гена FGFR2. При этом на долю мутации S252W приходится порядка 74-76% от всех случаев заболевания, а примерно 21-23% вызываются дефектом P253R. Таким образом, причиной подавляющего большинства случаев синдрома Апера являются всего лишь два типа мутации, что упрощает молекулярно-генетическую диагностику этого состояния. Так как эти дефекты относятся к миссенс-мутациям, полученный в результате трансляции такого гена рецептор к фактору роста фибробластов имеет нарушенную структуру и неспособен выполнять свои функции. Это приводит к нарушению процессов окостенения черепа, в частности – к преждевременному зарастанию швов и остановке нормального роста черепной коробки. Дефект рецепторов при синдроме Апера также становится причиной пороков развития иных структур, где участвуют фибробласты (стенки сосудов крупного калибра, сердце, кости лицевого черепа, трахея). Наследуется это состояние по аутосомно-доминантному механизму, но чаще всего имеют место спонтанные мутации.
Кроме того, при синдроме Апера возникает аномальная экспрессия гена KGFR, тоже расположенного на 10 хромосоме. Он кодирует последовательность белка, являющегося рецептором к фактору роста кератоцитов. Никаких мутаций или других нарушений в структуре KGFR при синдроме Апера выявлено не было, лишь его чрезмерная активность, приводящая к увеличению количества кодируемых им рецепторов. Возможно, это явление объясняется сложными взаимоотношениями генов или же рецептор к фактору роста фибробластов 2 обладает супрессирующим действием на ген KGFR. Результатом аномальной экспрессии этого гена становятся фенотипические нарушения формирования конечностей – различные формы синдактилии, всегда встречающиеся при синдроме Апера, иногда полидактилия.
Симптомы синдрома Апера
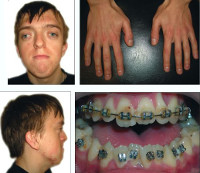
Некоторые проявления синдрома Апера заметны с самого рождения – например, синдактилия, которая может быть полной или в виде перепонок. Как правило, срастаются 2, 3 и 4 пальцы на кистях, иногда аналогичный порок возникает и на пальцах ног. Среди неонатологов симптом иногда носит название «среднего пальца» – в тяжелых случаях эти три пальца прочно срастаются между собой и имеют один общий ноготь. Другим постоянным симптомом синдрома Апера, обнаруживающимся сразу после рождения или в первые месяцы жизни, является раннее развитие синостоза костей черепа. Чаще всего происходит срастание венечного или стреловидного шва, что по мере роста головного мозга приводит к деформации черепа по типу «башенной». Из-за черепного синостоза у больных синдромом Апера наблюдается хроническое повышение внутричерепного давления, становящееся причиной задержки умственного развития, головных болей, тошноты и рвоты.
Помимо деформации черепа о наличии синдрома Апера свидетельствует характерный внешний вид больных. У них обычно обнаруживается плоский или выпуклый лоб, гипертелоризм и экзофтальм, может развиваться косоглазие. Деформации затрагивают и кости лицевого черепа – переносица расширена, челюсти нередко недоразвиты, наблюдается нарушение прикуса. Из других симптомов синдрома Апера иногда регистрируются нарушения дыхания (из-за недоразвития верхней челюсти, сужения хоан или трахеи), незаращение твердого нёба, врожденные пороки сердца, аномалии развития позвонков, почек, прямой кишки.
У взрослых лиц, страдающих синдромом Апера, может возникать атрофия зрительных нервов вплоть до полной слепоты. Интеллектуальное развитие больных часто отстает от возрастной нормы, однако достоверно неизвестно, обусловлено это генетическими нарушениями или вторичными факторами (хронической внутричерепной гипертензией). Практически всегда при синдроме Апера наблюдается карликовый рост. При соответствующем паллиативном лечении и уходе больные могут доживать до преклонного возраста, но риск внезапной смерти из-за поражений дыхательной, нервной и сердечно-сосудистой систем у них намного выше, чем в популяции.
Диагностика синдрома Апера
Диагностика синдрома Апера производится на основании осмотра и изучения настоящего статуса пациента, рентгенологических исследований, молекулярно-генетических анализов. При осмотре у больного выявляется синдактилия (у лиц старшего возраста могут обнаруживаться следы ее хирургической коррекции), деформация черепа – башенный череп или брахикефалия, характерный внешний вид лица. С возрастом у больных синдромом Апера могут нарастать признаки нарушения дыхания, при ЭхоКГ нередко определяются пороки сердца и сосудов – стеноз легочного ствола или аорты, дефекты межжелудочковой перегородки. Иногда на этом фоне выявляются признаки сердечной недостаточности. Также возможно наличие иных пороков развития – аномалий позвонков, глухоты, слепоты (из-за катаракты, пигментного ретинита, атрофии зрительных нервов), патологий почек и поджелудочной железы. Из-за столь широкого спектра возможных нарушений больные синдромом Апера нуждаются в тщательном и всестороннем медицинском обследовании.
Рентгенологическими методиками уже у маленьких детей можно обнаружить синостоз костей черепа в области венечного или стреловидного шва. В дальнейшем при помощи рентгенографии можно определить характерную для синдрома Апера деформацию черепной коробки, пороки развития костей лицевого черепа, аномалии позвонков и другие нарушения. Наиболее достоверным диагностическим методом при этом состоянии является молекулярно-генетический анализ. Как правило, для выявления синдрома Апера производят секвенирование 7 экзона гена FGFR2, иногда используют менее затратные техники, ориентированные только на поиск наиболее распространенных мутаций (S252W и P253R), приводящих к этому заболеванию. Подобные методики более дешевые и быстрые в выполнении, обладают точностью на уровне 95%, возможно их использование в качестве пренатальной диагностики этого состояния. Подобный анализ особенно актуален, если посредством профилактических УЗИ у плода выявляются нарушения, предположительно связанные с синдромом Апера – пороки развития черепа, сердца, верхних или нижних конечностей.
Лечение синдрома Апера
Специфического лечения синдрома Апера на сегодняшний день не существует, однако паллиативные и симптоматические мероприятия могут значительно облегчить состояние больного и улучшить качество его жизни. Особенно важно как можно раньше диагностировать это заболевание по той причине, что своевременная хирургическая коррекция черепного синостоза позволит избежать значительного роста внутричерепного давления. По многочисленным данным, после таких операций, произведенных в раннем детстве, признаки умственной неполноценности у больных синдромом Апера были выражены значительно слабее, иногда сохранялся нормальный интеллект. Поэтому борьба с внутричерепной гипертензией играет центральную роль в паллиативном лечении этого состояния. Если же у пациентов имеется умственная отсталость, то ее выраженность снижается путем психокоррекционной работы.
Другой часто выполняемой паллиативной хирургической операцией при синдроме Апера является вмешательство для разделения сросшихся пальцев на руках и ногах. Это относительно несложная процедура при перепончатом типе сращения, однако при более тяжелых формах порока операция значительно усложняется. При синдроме Апера также может потребоваться помощь хирургов в случае пороков сердца, сужения хоан или трахеи, нарушения формирования прямой кишки и других проявлений этого генетического заболевания. Больные нуждаются в регулярных медицинских обследованиях у специалистов различного профиля.
Прогноз и профилактика синдрома Апера
Прогноз синдрома Апера неопределенный по причине очень широкого спектра проявлений и значительного диапазона их выраженности. На прогноз также оказывают влияние такие факторы, как своевременность диагностики заболевания, объем паллиативного и симптоматического лечения. При относительно легких случаях синдрома Апера или правильной терапии этого состояния больные могут доживать до преклонного возраста. При этом возможно снижение интеллекта и появляющиеся с возрастом нарушения все новых органов и систем, что негативно сказывается на качестве жизни пациентов. В тяжелых случаях наблюдается летальный исход в раннем детстве из-за врожденных пороков сердца или полиорганной недостаточности.
Профилактика синдрома Апера возможна только в качестве пренатальной диагностики, которая может производиться как ультразвуковыми методиками, так и путем молекулярно-генетического анализа. Обычно проявления патологии сначала обнаруживаются на профилактических УЗИ, а затем диагноз подтверждается врачом-генетиком. Если данное состояние удается выявить на ранних сроках беременности, то ставится вопрос о ее прерывании.
Источник
Наиболее часто встречающиеся осложнения беременности — патологии развития плода. Отклонения происходят как в результате воздействия внешних факторов (курение, токсическое отравление, приём медикаментов), так и по независящим от человека генетическим причинам.
СТОИМОСТЬ СКРИНИНГА ПАТОЛОГИЙ ПЛОДА В НАШЕЙ КЛИНИКЕ В САНКТ-ПЕТЕРБУРГЕ
| Цена УЗИ плода 1 скрининг + диск | 2000 руб. |
| Пренатальный скрининг трисомий I триместр | 1245 руб. |
| Пренатальный скрининг трисомий II триместр | 1600 руб. |
Звоните бесплатно: 8-800-707-1560 *Клиника имеет лицензию на оказание этих услуг | |
Врождённые патологии плода — трисомии
 Такие патологии встречаются часто, но большинство эмбрионов с хромосомными аномалиями гибнут внутриутробно в результате спонтанных выкидышей. Трисомии имеют генетическую природу и возникают в момент зачатия.
Такие патологии встречаются часто, но большинство эмбрионов с хромосомными аномалиями гибнут внутриутробно в результате спонтанных выкидышей. Трисомии имеют генетическую природу и возникают в момент зачатия.
Чтобы предупредить рождение малышей с тяжелыми патологиями, семейным парам, планирующим рождение ребёнка, рекомендуют пройти кариотипирование — изучение хромосомных наборов, позволяющее определить генетическую совместимость и возможность иметь здоровое потомство.
Кариотипирование имеет 99% достоверность, благодаря которой можно заранее узнать, имеют ли супруги предрасположенность к хромосомным мутациям.
На ранних сроках без специальных анализов обнаружить трисомию невозможно. С этой целью проводится перинатальный скрининг — серия анализов, определяющих врождённые аномалии плода. Первый скрининг проводится на сроке 11-13 недель и включает ультразвуковую диагностику и анализы крови на гормоны.
Скрининг проводится добровольно. Но процедуру настоятельно рекомендуется пройти женщинам из группы риска, которые:
- забеременели в возрасте старше 35 лет;
- имели замершие беременности;
- подвергались ионизированному или радиационному облучению;
- работают на предприятиях химической промышленности;
- имеют вредные привычки (курение, употребление алкоголя и наркотиков);
- неблагоприятная экологическая обстановка;
- возраст отца ребенка старше 50 лет.
УЗИ определяет:
- положение эмбриона в матке (исключение внематочной беременности);
- количество плодов (одноплодная или многоплодная беременность);
- форма конечностей, черепа, строение лица;
- сердцебиение;
- устанавливается копчико-теменной размер (высота плода от копчика до темечка);
- нормальное или патологическое строение головного мозга;
- толщина воротникового пространства:
- размер носовой кости:
- зрелость и функциональность плаценты.
Параметры, указывающие на патологии плода
На скрининговом УЗИ гинеколог осматривает воротниковую зону плода и шею.
При хромосомных аномалиях жидкость скапливается в воротниковой зоне плода. По этой же причине увеличивается количество складок на шее. В норме толщина воротниковой зоны не должна превышать 2,7 мм на сроке 13 недель.
Если толщина превышает норму, женщине дополнительно назначают УЗИ для исследования носовой кости у плода. При хромосомных нарушениях кость значительно короче нормы. Однако и этот параметр на 100% подтверждением наличия синдрома у плода не является.
Обычно первый замер делается на сроке 11 недель. Если была выявлена гипоплазия (укорочение) или аплазия (неразвитость) носовой кости, второй замер проводится на сроке 13 недель. Длина носовой косточки на сроке 12 недель составляет в норме 2-4,2 мм, в 20 недель — 5,7-8,3 мм.
Копчико-теменной размер также имеет большое значение при диагностике хромосомных нарушений. Этот параметр устанавливается на сроке 6-14 недель. Позже формируется плацента, и показатели будут несколько искаженными.
Точность замеров зависит во многом от квалификации специалиста ультразвуковой диагностики. Замер делается строго по сагиттальной линии от копчика до темечка при отсутствии двигательной активности плода. На 9-й неделе КТР составляет 23 мм, на 12-й — 52 мм. Если показатель немного не соответствует норме, в этом нет ничего страшного. Превышение показателей свидетельствует о слишком интенсивном росте плода, а нехватка — о возможной хромосомной патологии.
Ультразвуковая диагностика при перинатальном скрининге не является 100% подтверждением аномалий развития у плода. Она лишь выявляет возможные симптомы отклонений. Если они замечены, женщину отправляют на второй этап скрининга — биохимическое исследование крови на определение биохимических маркеров бета-ХГЧ и плазменного белка РАРР-А.
Анализ проводится на сроке до 14 недель, потому что позже показатели не будут отличаться от обычных. Нормой является показатель РАРР-А на 8-й неделе 0,17-1, 54 мЕд/мл, на 12-й неделе — 0,79-4,76, а на 14-й неделе не превышает 8,54 мЕд/мл и не опускается ниже 1,47.
Если показатели занижены, это свидетельствует о болезни Эдвардса, синдромах Дауна или Корнелии де Ланге. Сывороточный белок повышается при большом весе плода, предлежании плаценты и многоплодной беременности.
Скрининг позволяет выявить возможные патологии развития плода. Если они будут подтверждены несколькими видами диагностики, женщине будет предложено прервать беременность.
Синдром Патау
Проявляется в дополнительной 13-й хромосоме. Рождённый малыш имеет множество внешних и внутренних патологий, он имеет небольшую продолжительность жизни.
Если существует высокий риск рождения малыша с синдромом Патау, у беременной берут материал для проведения анализа с использованием флуоресцентной полимеразной цепной реакции (взятие ворсинок хориона, амниотической жидкости, пункция кровеносных сосудов пуповины).
Если по каким-то причинам 1-й скрининг проведен не был, с помощью ультразвуковой диагностики можно определить синдром Патау на более поздних сроках. Но в этом случае, при решении сделать аборт, придется прибегать к хирургической методике.
Он проявляется следующим образом:
- многоводие на 3-м триместре;
- асимметрия полушарий мозга;
- маленькие размеры головы по сравнению с телом;
- лишние пальцы на руках и ногах;
- толщина воротниковой зоны больше нормы;
- учащённое сердцебиение;
- пороки развития внутренних органов.
В большинстве случаев женщины идут на аборт, потому что при синдроме Патау малыш рождается глубоким инвалидом, не способным к социальной адаптации и нормальной жизни. 95% детей умирает до года.
Синдром Дауна
Существует много хромосомных патологий, но именно синдром Дауна является самым часто встречающимся и узнаваемым. Патология заключается в лишней хромосоме в 21 паре. С помощью УЗИ синдром Дауна можно визуализировать на 11-13-й неделе беременности. К характерным признакам заболевания относятся:
- короткие трубчатые кости рук и ног;
- аплазия (отсутствие) носовой кости;
- утолщение воротниковой зоны более 3 мм, наличие шейных складок из-за скопления амниотической жидкости;
- гипоплазия (недоразвитость) мозжечка;
- уменьшение лобно-таламического расстояния;
- увеличение угла между подвздошными костями;
- нарушение венозного кровотока;
- увеличенный мочевой пузырь;
- тахикардия;
- кишечная непроходимость;
- увеличенное расстояние между глазами;
- отставание копчико-теменного размера на 10%.
Ультразвуковой скрининг точен на 91%. Но бывают и исключения, поэтому гинекологи с выводами не спешат, не проведя дополнительную диагностику.
Даже если на УЗИ у плода не была выявлена носовая кость, в 2% случаев малыш рождается совершенно здоровым. 5% малышей с нарушением венозного кровотока не имеют синдрома Дауна.
Обследование делается на сроке не позднее 13 недель. Окончательный диагноз ставится только в совокупности генетической и ультразвуковой диагностики.
Синдром Эдвардса
Это трисомия, при которой в 18-й паре появляется лишняя хромосома. По распространённости занимает 2-е место после синдрома Дауна. Встречается у девочек в 3 раза чаще, чем у мальчиков.
С помощью УЗИ патология выявляется на сроке не раньше чем в 12 недель. Врач на экране аппарата УЗИ видит следующие нарушения развития плода, характерные для синдрома Эдвардса:
- заячья губа или волчья пасть;
- микроцефалия (слишком маленький мозг);
- низкие показатели КТР;
- снижение сердечных сокращений;
- грыжа брюшной полости;
- аплазия носовой кости;
- отсутствие одной артерии в пуповине;
- выпячивание подвздошной кишки;
- отсутствие заднего прохода или пищевода;
- недоразвитость мозжечка;
- гипоплазия мозолистого тела;
- искривление позвоночника;
- аномальная форма почек;
- удвоенный мочеточник;
- сглаживание или отсутствие мозговых извилин.
60% малышей с синдромом Эдвардса умирает до 1 года. Редко дети с такой патологией доживают до 10 лет. Помимо умственной отсталости, у малышей наблюдаются несовместимые с жизнью пороки развития внутренних органов, требующие хирургического вмешательства и длительного восстановления.
В большинстве случаев при комплексном подтверждении синдрома Эдвардса беременная решается на аборт.
Синдром Шерешевского-Тёрнера
Встречается в основном у плодов женского пола. Заключается в отсутствии или дефекте 45-й или 46-й Х-хромосомы. В 99% случаев генетическая аномалия заканчивается выкидышем на стадии вынашивания.
В 80% хромосомная патология передаётся от отца. Больше всего при данном генетическом заболевании страдает детородная система девочки. Также весьма выраженными бывают аномалии развития тела.
Основные показатели синдрома Шерешевского-Тёрнера на УЗИ — размеры копчико-теменной зоны и толщина воротникового пространства. Плод при данной патологии имеет гораздо меньшие размеры, чем положено по сроку беременности. При рождении такой малыш в среднем имеет рост около 40 см при весе 2000-2500 граммов.
Вторая характерная черта — увеличение толщины воротниковой зоны. На затылке за ушными раковинами у плода образуются кожные складки, которые при рождении трансформируются в кожную перепонку, натянутую между головой и плечами.
На ранних сроках с помощью УЗИ можно увидеть укорочение пястных и плюсневых костей, отсутствие или недоразвитость пальцевых фаланг, деформация запястных суставов. Межпозвоночные диски сплющены, имеются искривления позвоночника.
На более поздних сроках у плода наблюдаются сердечно-сосудистые патологии — сегментарное сужение просвета аорты, незаращивание межжелудочковой перегородки, незаращение соустья между лёгочной артерией и аортой.
При синдроме Шерешевского-Тернера страдает половая система. У плода наблюдается аплазия яичников, аномалия наружных половых органов. соски широко расставлены, грудная клетка имеет бочкообразную форму.
Дети с синдромом Шерешевского-Тёрнера лучше приспособлены к жизни, чем малыши со схожими хромосомными отклонениями. Они вырастают до взрослого возраста, имея рост до 150 см. Иногда умственное и психическое развитие не нарушено, но ребёнок с таким заболеванием имеет много проблем со здоровьем, в подростковом возрасте ему требуется гормональная терапия и различные эстетические операции.
Полисомия по Х или Y-хромосоме
Полисомия по Х-хромосоме заключается в том, что вместо пары Х-хромосом имеется третья лишняя Х-хромосома. На УЗИ увидеть признаки патологии невозможно, потому что внешние проявления заметны только после рождения малыша. Единственное, что должно насторожить — это увеличение толщины воротниковой зоны, однако точную картину покажет только генетическое изучение хориона и анализ амниотической жидкости.
Полисомия по Y-хромосоме заключается в лишней Y-хромосоме, поэтому патология встречается в основном у мальчиков. Единственный признак патологии, видимый на УЗИ, —утолщение воротниковой зоны.
Дети с полисомией в целом имеют шансы реализоваться в жизни.
- Девочки с трисомией по Х-хромосоме не имеют ярко выраженных расстройств. У них имеются нарушения речи, очень высокий рост, узлы на пальцах. Однако в будущем у них есть вероятность родить здоровое потомство.
- С мальчиками ситуация обстоит хуже: у них часто выявляется имбецильность (средняя степень умственной отсталости), агрессивное и антисоциальное поведение, шизофрения.
Трисомия по Y-хромосоме выражается в особенном строении тела (широкий таз, узкие плечи, жир на животе). У мальчиков тяжёлая нижняя челюсть, маленький покатый лоб.
При тяжёлой форме патологии заметны дебильность (глубокое нарушение умственной деятельности), агрессивное поведение. При постоянной работе с дефектологами и педагогами увеличиваются шансы адаптации ребёнка в обществе.
Синдром Лангера-Гидеона
Заключается в нарушении 8-й хромосомы. Патология приводит к глубокой инвалидности.
На УЗИ можно увидеть челюстно-лицевые аномалии: малыш рождается с длинным широким носом, у него недоразвита нижняя челюсть. На хрящах наблюдаются наросты, из-за этого конечности развиваются неравномерно, позвоночник искривлён, пальцы рук укороченные и искривлённые.
Дети с синдромом Лангера-Гидеона не разговаривают, у них наблюдается умственная и психическая отсталость.
Синдром Апера
Это редкая мутация в гене FGFR2 10-й хромосомы, заключающаяся в нарушении образования костной и соединительной ткани.
На УЗИ заметны следующие признаки синдрома Апера:
- многоводие у беременной;
- увеличение толщины воротникового пространства;
- деформация черепной коробки;
- аномалия позвонков;
- сердечная недостаточность;
- большое расстояние между глазами;
- сращивание нескольких пальцев.
У новорождённого лицо плоское и немного вогнутое. кости лица деформированы, глаза выпуклые и расположены асимметрично. Лоб очень большой, и не соответствует пропорциям лица.
Сердечно-сосудистая патология не позволяет ребёнку вести полноценный образ жизни.
Синдром Беквита-Видеманна
Болезнь вызвана мутацией гена в 11-й хромосоме. При заболевании психика и умственное развития не страдают, однако ребёнок имеет множество физических недугов.
На УЗИ патология выражается в первую очередь в увеличении массы плода, вес которого значительно превышает среднестатистические показатели. При этом плод имеет непропорционально длинные конечности.
На более поздних сроках отмечается увеличение селезёнки, печени, почек и поджелудочной железы. У малышей с синдромом Беквита-Видеманна увеличен язык, из-за этого на УЗИ можно разглядеть деформацию костей челюсти. При данной патологии аномально развиваются почки, в них имеются кальциевые отложения.
Малыши с этим заболеваниям редко доживают до 10-летнего возраста, потому что имеют склонность к онкологическим опухолям, от которых и умирают.
Синдром Уильямса
Мутация встречается в 7-й хромосоме. Для патологии характерна гиперкальциемия — повышение уровня сахара в крови. Плод имеет маленький вес, не соответствующий срокам.
На ранних сроках заметить патологию сложно, но затем на УЗИ видны диспропорции скелета, связанные с недостаточным образованием эластина. Также у малыша просматривается деформация лица: выпуклый лоб, короткий нос, низко посаженные глаза. Дети с синдромом Уильямса имеют «лицо Эльфа», им сложно разжевывать пищу, тяжело двигаться из-за деформации суставов.
Малыши гиперчувствительны к звукам, имеют ярко выраженные музыкальные способности, обожают петь и слушать музыку. При этом им сложно осваивать точные дисциплины, они подвержены тревожным расстройствам, у них вырабатывается мало мелатонина, такие дети мало спят.
Приобретённые патологии плода
Приобретенные патологии возникают под воздействием негативных факторов (радиация, токсическое отравление) и образа жизни матери (алкоголизм, курение, наркомания).
Врождённые пороки органов и костей
Редко у плода развивается один такой порок, обычно это комплекс патологий, затрагивающих несколько жизненно важных органов.
Врождённые пороки имеют следующие разновидности:
- аплазия — полное отсутствие органа с сохранением сосудистой ножки;
- агенезия — полное отсутствие органа без сохранения сосудистой ножки;
- гипоплазия — недоразвитость органа;
- дистопия — расположение органа в неположенном месте.
Ультразвуковая диагностика врождённых пороков проводится трижды:
- 1-я диагностика — 10-13 недель;
- 2-я диагностика — 19-20 недель;
- 3-я диагностика — 31-32 недели.
Исследование позволяет выявить большинство патологий:
- отсутствие или деформацию органа;
- анэнцефалию (отсутствие головного мозга);
- атрезию (отсутствие) конечностей;
- аномалия скелета лица (заячья губа, волчья пасть);
- незаращение спинномозгового канала;
- пороки сердца;
- гидроцефалия (скопление жидкости в головном мозге).
Гипертензионно-гидроцефальный синдром
Это патология, при которой спинномозговая жидкость скапливается под мозговыми оболочками. Осложнение выявляется на УЗИ на поздних этапах беременности.
Характеризуется большим объёмом головы плода, диспропорцией между мозговыми долями, выпиранием родничка. Чем раньше выявлена патология, тем больше шансов на благоприятный исход.
Гидроцефалия
Это скопление спинномозговой жидкости в желудочках головного мозга, в результате чего они увеличиваются в размерах, и возрастает внутричерепное давление.
Гидроцефалию выявляют на 2 семестре беременности. Главным показателем является увеличение высоты тела желудочка головного мозга выше нормы (свыше
