Синдром беквита видемана где сдать

Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Беквит-Видемана синдром (BWS) врожденное заболевание, которое характеризуется чрезмерно быстрым ростом в младшем возрасте, ассиметрией развития тела, повышенным риском развития рака и некоторых врожденных дефектов, нарушением поведения ребенка. Впервые описано как семейная форма омфалоцеле с макроглоссией в 1964 году, немецким доктором Ханс-Рудольф Видеманом. В 1969 году, Дж. Брюс Беквит из Университета Лома Линда, штат Калифорния, описал подобные симптомы у нескольких пациентов. Первоначально, профессор Видеман ввел термин синдром EMG, чтобы описать сочетание врожденной пупочной грыжии, макроглоссии и гигантизма. Со временем, эта патология была переименована в синдром Беквит-Видемана (BWS).
[1], [2], [3], [4]
Код по МКБ-10
Q87.3 Синдромы врожденных аномалий, проявляющиеся избыточным ростом [гигантизмом] на ранних этапах развития
Эпидемиология
Синдром Беквита-Видеманна встречается с частотой 1 на 13 700 новорождённых.
[5], [6], [7], [8]
Причины синдрома Беквита-Видеманна
Синдром Беквита-Видеманна со сложным типом наследования, локус заболевания расположен на коротком плече хромосомы 11 (CDKN1C, H19, IGF2, и KCNQ1OT1 гены). Аномальное метилирование нарушает регуляцию этих генов, что приводит к чрезмерно быстрому росту и другим характерным особенностей синдрома Беквит-Видемана.
Около 1% всех людей с данным синдромом имеют хромосомные аномалии, такие как перегруппировки (транслокации), ненормальное копирование (дублирование), или утраты (удаления) генетического материала из хромосомы 11.
Возможна молекулярно-генетическая верификация изменений этого локуса.
[9], [10], [11], [12], [13]
Симптомы синдрома Беквита-Видеманна
Заболевание характеризуется преждевременным быстрым ростом ребенка в раннем возрасте. После 8 лет рост замедляется. У некоторых детей с синдромом Беквит-Видемана отдельные части тела с одной стороны могут вырасти до аномально больших размеров (так называемая гемигиперплазия), что приводит к асимметричности внешнего вида.
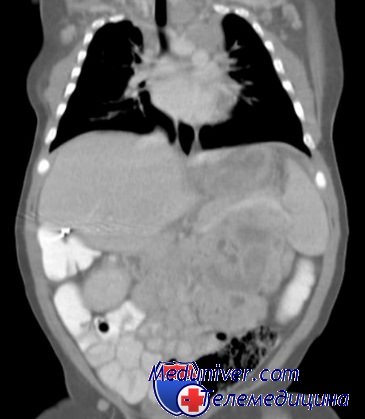
Некоторые младенцы с синдромом Беквит-Видемана имеют аномально большой язык (макроглоссия), что иногда затрудняет дыхание и глотание, аномально большие органы брюшной полости (спланхномегалия), кожные складки или ямки возле ушей, гипогликемию и аномалии почек.
Дети имеют повышенный риск развития нескольких типов раковых опухолей, в частности, рака почки, опухоли Вильмса и гепатобластомы.
[14], [15], [16]
Осложнения и последствия
Возможные осложнения у больных с синдромом Беквита-Видеманна:
- вероятность неонатальной гипогликемии (60%) с развитием судорог, обусловленных транзиторным гиперинсулинизмом;
- высокая частота (10-40%) эмбриональных опухолей, особенно при нефромегалии или соматической асимметрии тела, требует наблюдения и проведения ультразвукового исследования почек 3 раза в год до 3-летнего возраста и в последующем 2 раза в год до 14-летнего возраста (своевременная диагностика опухоли Вильмса).
[17], [18], [19], [20], [21]
Диагностика синдрома Беквита-Видеманна
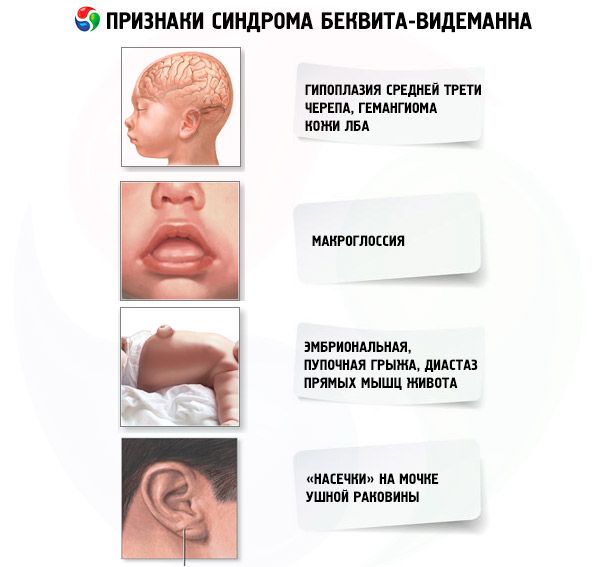
Диагноз синдром Беквита-Видеманна необходимо рассматривать у детей с аномалиями передней стенки живота (эмбриональной или пупочной грыжей, расхождением прямых мышц), макроглоссией, неонатальной гипогликемией и опухолями (нейробластомой, опухолью Вильмса, карциномой печени).
Диагностические критерии:
- Большая масса тела при рождении или постнатальное опережение физического развития.
- Дефекты закрытия передней стенки живота (эмбриональная, пупочная грыжа, диастаз прямых мышц живота).
- Висцеромегалия (нефромегалия, гепатомегалия, спленомегалия).
- Макроглоссия.
- Необычное лицо (гипоплазия средней трети, гемангиома кожи лба, «насечки» на мочке ушной раковины).
[22], [23], [24], [25], [26]
Какие анализы необходимы?
Лечение синдрома Беквита-Видеманна
Дефекты брюшной стенки устраняются с помощью хирургического лечения.
Гипогликемия у новорожденных с BWS должна лечиться в соответствии со стандартными протоколами терапии неонатальной гипогликемии.
Макроглоссия с возрастом часто становится менее заметной и не требует какого-либо лечения. В тяжелых случаях, макроглоссия устраняется с помощью операции. Некоторые хирурги рекомендуют выполнять оперативное вмешательство между 3 и 6 месяцами.
Гемигипертрофия в тяжелых случаях корректируется ортопедическими методами.
[27]
Прогноз
Синдром Беквита-Видеманна имеет разный прогноз для жизни. Он определяется своевременной диагностикой гипогликемии (профилактика умственной отсталости) и ранней диагностикой эмбриональных опухолей.
Продолжительность жизни, как правило, не отличается от здоровых людей.
Источник
Синдром Беквитта-Видемана: причины, диагностика, лечениеЭтиология и встречаемость синдрома Беквитта-Видемана. Синдром Беквитта-Видемана (MIM №130650) — панэтнический синдром, обычно спорадический, но иногда может наследоваться как аутосомно-доминантный. Синдром Беквитта-Видемана встречается приблизительно у одного из 13 700 живорожденных. Синдром Беквитта-Видемана вызван нарушением баланса экспрессии импринтированных генов в регионе р15 хромосомы 11. Эти гены включают транскрибируемые, но не транслируемые KCNQOT1 и Н19, и кодирующие белки гены CDKN1C и IGF2. В норме эти гены импринтированы и экспрессируются только из отцовского (IGF2 и KCNQOT1) или только материнского аллеля (HI9 и CDKN1C). IGF2 кодирует инсулиноподобный фактор роста, стимулирующий рост; CDKN1C кодирует супрессор клеточного цикла, ограничивающий деление и рост клеток. Транскрипция РНК Н19 и KCNQOT1 подавляет экспрессию материнской копии IGF2 и отцовской копии CDKN1С соответственно. Несбалансированная экспрессия импринтированных генов в 11р15 может происходить по множеству механизмов. Мутации в материнском аллеле CDKN1C обнаруживают в 5-10% спорадических случаев и в 40% семей с аутосомно-доминантным синдромом Беквитта-Видемана. Большинство пациентов с синдром Беквитта-Видемана, тем не менее, имеют снижение экспрессии материнского аллеля гена CDKN1С вследствие аномального импринтинга, а не мутации. У 10-20% индивидуумов с синдромом Беквитта-Видемана снижение экспрессии материнской копии CDKN1C и повышение экспрессии IGF2 вызвано отцовской изодисомией 11р15. Поскольку соматическая рекомбинация, ведущая к сегментной однородительской дисомии, происходит после зачатия, больные с сегментной однородительской дисомией — мозаики, и для выявления изодисомии может потребоваться исследование других тканей, кроме крови. Еще 1-2% больных с синдром Беквитта-Видемана имеют цитогенетически обнаруживаемую хромосомную аномалию, например, материнскую транслокацию, инверсию хромосомы 11 или дупликацию отцовской хромосомы 11р15. Таким образом, чтобы исключить структурную аномалию 11р15 при проведении генетического консультирования, необходимо кариотипирование родителей. При синдроме Беквитта-Видемана также обнаружены редкие микроделеции в гене KCNQOT1 или Н19, нарушающие импринтинг. У остальных пациентов аномалии в импринтинге и экспрессии генов остаются невыясненными.
Патогенез синдрома Беквитта-ВидеманаВ ходе гаметогенеза и в раннем зародышевом развитии у мужчин и женщин устанавливаются различные типы метилирования ДНК в генах KCNQOT1 и Н19. Аномальный импринтинг при синдроме Беквитта-Видемана легче всего обнаружить при анализе метилирования ДНК в специфических участках CpG в генах KCNQOT1 и Н19. У 60% лиц с синдромом Беквитта-Видемана обнаруживают гипометилирование материнского аллеля KCNQOT1. У других 2-7% больных гиперметилирование материнского гена Н19 снижает его экспрессию, что приводит к избыточной экспрессии IGF2. Несоответствующая экспрессия обоих родительских аллелей IGF2 может объяснить избыточный рост, наблюдаемый при синдроме Беквитта-Видемана. Аналогично снижение экспрессии материнской копии CDKN1С удаляет ограничение роста плода. Фенотип и развитие синдрома Беквитта-ВидеманаСиндром Беквитта-Видемана связан с пренатальным и постнатальным избыточным ростом. До 50% больных рождаются недоношенными и превышают массу тела, соответствующую гестационному сроку при рождении. Плацента также увеличена, а беременность часто осложняется многоводием. Кроме этого, у новорожденных с синдром Беквитта-Видемана часто бывают такие осложнения, как омфалоцеле, макроглоссия, неонатальная гипогликемия и кардиомиопатия, приводящие к 20% смертности. Неонатальная гипогликемия обычно мягкая и непостоянная, но есть сообщения о некоторых случаях более серьезной гипогликемии. Пороки развития почек и повышение кальция в моче с развитием нефрокальциноза и мочевых камней отмечают почти у половины больных. Гиперплазия различных сегментов тела или отдельных органов может выявляться уже при рождении и становится более или менее заметной со временем. Развитие больных обычно нормальное, если у них нет несбалансированной хромосомной аномалии. Дети с синдромом Беквитта-Видемана имеют повышенный риск развития эмбриональных опухолей, особенно опухоли Вильмса и гепатобластомы. Общий риск новообразований у детей с синдромом Беквитта-Видемана приблизительно 7,5%; риск значительно снижается после достижения детьми 8 лет. Особенности фенотипических проявлений синдрома Беквитта-Видемана: Лечение синдрома Беквитта-ВидеманаОказание помощи детям с синдромом Беквитта-Видемана включает лечение имеющихся симптомов, например коррекцию омфалоцеле и гипогликемии. Макроглоссия может потребовать специальных методов вскармливания или занятий с логопедом. При крупных дефектах брюшной стенки, асимметрии длины ног и при пороках развития почек может оказаться необходимым хирургическое вмешательство. Если имеется гиперкальциурия, может быть назначена терапия, направленная на уменьшение выделения кальция. Важно периодическое обследование на эмбриональные опухоли, поскольку они отличаются быстрым ростом и злокачественностью. Текущие рекомендации для исключения опухолей — УЗИ брюшной полости каждые 3 мес в течение первых 8 лет жизни и измерение сывороточного АФП каждые 6 нед в течение первых нескольких лет жизни.
Риск повторения – наследования синдрома Беквитта-ВидеманаРиск повторения для сибсов и потомства детей с синдромом Беквитта-Видемана существенно изменяется в зависимости от молекулярной основы заболевания. См. таблицу риска повторения для различных молекулярных изменений. Повышение риска синдрома Беквитта-Видемана при применении вспомогательных репродуктивных технологийВспомогательные репродуктивные технологии, например ЭКО и ИКСИ, становятся обычной процедурой, составляющей теперь во многих странах до 1-2% всех рождений. Ретроспективные исследования показали, что при беременностях, закончившихся новорожденными с синдромом Беквитта-Видемана, ЭКО использовалось в 10-20 раз чаще по сравнению с контролем. Риск синдрома Беквитта-Видемана после ЭКО оценивают как 1 на 4000, что в 9 раз выше, чем в общей популяции. Причина повышенной встречаемости дефектов импринтинга после ЭКО неизвестна. Встречаемость синдрома Прадера-Вилли, дефекта отцовского импринтинга, после ЭКО не повышена, а частота синдрома Ангельмана, дефекта материнского импринтинга, после ЭКО повышается, что позволяет предположить специфические отношения между ЭКО и материнским импринтингом. Поскольку отцовский импринтинг происходит задолго до ЭКО, а материнский происходит значительно ближе ко времени оплодотворения, роль ЭКО, как предрасполагающего к дефектам импринтинга фактора, требует серьезного анализа. Пример синдрома Беквитта-Видемана. А.Б., 27-летняя беременная, обратилась в пренатальный диагностический центр для проведения ультрасонографии 2-го уровня и генетического консультирования после планового УЗИ, обнаружившего крупный для данного гестационного возраста мужской плод с возможным омфалоцеле. Беременность, первая у каждого из родителей, наступила самопроизвольно, без вспомогательных репродуктивных технологий. После обследования ультрасонографией 2-го уровня семье выдано заключение, что плод имеет множество аномалий, наиболее соответствующих диагнозу синдрома Беквитта-Видемана, хотя не исключены и другие врожденные дефекты. Семейная пара решила не подвергаться процедуре амниоцентеза. Младенец родился кесаревым сечением в 37 нед с массой тела при рождении 9 фунтов и 2 унции (4 кг 140 г) и заметно увеличенной плацентой. Отмечены омфалоцеле, макроглоссия и вертикальные складки на мочках ушей. Консультант-генетик поставил клинический диагноз синдрома Беквитта-Видемана. После развития гипогликемии ребенок переведен в палату интенсивного наблюдения и в течение 1 нед получал внутривенные вливания глюкозы; гипогликемия разрешилась спонтанно. Результаты оценки сердечно-сосудистой деятельности нормальные, омфалоцеле откорректировано хирургическим путем без осложнений. Исследование метилирования гена KCNQOT1 подтвердило дефект импринтинга в 11р15, соответствующий диагнозу синдрома Беквитта-Видемана. Для исключения опухоли Вильмса рекомендовано каждые 3 мес УЗИ органов брюшной полости до достижения 8 лет и определение сывороточного АФП каждые 6 нед, как скрининговое обследование на гепатобластому, в течение первых 3 лет жизни. При последующих визитах, с учетом отрицательного семейного анамнеза и нормальных кариотипов родителей, дефект импринтинга в этой семье был расценен как спорадический случай синдрома Беквитта-Видемана с низким риском повторения. – Также рекомендуем “Наследственный рак молочной железы и яичников: причины, диагностика, лечение” Оглавление темы “Наследственные болезни”:
|
Источник
Русский Медицинский Сервер / Лечение в Италии / Центр лечения редких заболеваний в Милане / Синдром Беквита-Видемана – лечение в Италии
Одна из редких генетических аномалий, вероятность которой при проведении интрацитоплазматической инъекции сперматозоидов (ИКСИ) несколько повышена против средних эпидемиологических значений, связана с превышением норм роста плода при беременности и с несогласованным развитием различных отделов организма. Это так называемый синдром Беквита – Видеманна (Beckwith-Wiedemann-Syndrom), или синдром «гигантизма с пуповинной грыжей». В некоторых странах употребляется также название синдром EMG (Exomphalos-Makroglossie-Gigantismus).
Типичный признак данного расстройства: увеличенные размер и вес плода, а также новорожденного. Причем рост организма нередко носит асимметричный характер. Это не просто отклонения в линейных размерах тела по разным осям, но и непропорционально большой размер некоторых внутренних органов: печени, селезенки, почек, даже языка.
- Еще один типичный признак: порок развития мышц передней брюшной стенки, в результате чего часть кишечника, печень, иногда и другие органы располагаются вне брюшной полости. Они «выпадают» в грыжевой мешок.
- Характерна также почечная недостаточность, проявляющаяся в форме гидронефроза (застой жидкости в почечных лоханках). В почках могут присутствовать кисты.
- Сразу после родов может проявиться тяжелая гипогликемия (недостаток глюкозы в крови).

При большом росте младенца обращают на себя внимание маленький череп (микроцефалия), выступающие глазные яблоки, недоразвитие лицевых мускулов.
Нередко симптоматика дополняется наличием эмбриональных опухолей (гепатобластома, нейробластома и т.п.)
Синдром Беквита – Видеманна хорошо диагностируется еще на этапе внутриутробного развития (УЗИ при беременности). Основные расстройства, обусловленные им, лечатся. Дефект передней брюшной стенки подлежит хирургической коррекции, позиция внутренних органов также корректируется во время операции.
Название «EMG-синдром» происходит из трех наиболее манифестных его признаков – экзомфалос (E), макроглоссия (M) и гигантизм (G). Среди свойственных синдрому признаков основными являются макроглоссия, пуповинная грыжа и другие пупочные аномалии, а также гипогликемия.
Макроглоссия выявляется в любом возрасте ребенка, часто отмечается с рождения. Язык может не помещаться во рту, за счет чего рот ребенка открыт, а лицо напоминает таковое у больного с гипотиреозом. Увеличенный язык затрудняет сосание и даже дыхание новорожденного, у более старших детей отмечают дизартрические расстройства.
Гипогликемия у новорожденного манифестирует уже на первые-третьи сутки. Развивающиеся за счет этого коматозные состояния могут повлечь за собой смерть ребенка на первом году жизни или тяжелое органическое поражение мозга, сопровождающееся умственной отсталостью. Развитие гипогликемических состояний связано с гиперплазией островковых клеток поджелудочной железы, приводящей к гиперинсулинемии. С начинающейся еще внутриутробно гиперпродукцией инсулина, обладающего анаболическим действием, связывают как макроглоссию, макросомию, висцеромегалию, так и предрасположенность к развитию опухолей паренхиматозных органов. Явления гипергликемии самопроизвольно убывают в течение первых месяцев жизни больного.
Склонность к увеличению массы тела отмечается уже при рождении, она обычно превышает 4000 г, а длина – 52 см. Внутриутробная висцеромегалия, по-видимому, является причиной образования различных грыж, в том числе характерного для синдрома омфалоцеле (пуповинной грыжи). Пуповинная грыжа диагностируется у новорожденного и может быть различной по величине, иногда достигая размеров детской головки.
Макросомия с увеличением мышечной ткани и подкожного жирового слоя отмечается с рождения или развивается постнатально. Постнатальный гигантизм относится к менее постоянным признакам, иногда проявляется увеличением одной половины тела.
Грудные младенцы и дети до восьми лет с синдромом Беквита – Видеманна должны регулярно обследоваться на предмет состояния почек, надпочечников, печени и всей брюшной полости. В рамках таких обследований проводятся УЗИ и магнитно-резонансная томография нижнего брюшного отдела.
Дополнительные меры контроля: анализы крови и мочи. После исполнения восьми лет следует по-прежнему регулярно сдавать кровь и мочу на анализ.
Типичным признаком является наличие вертикальных бороздок на мочках ушных раковин, кроме этого, встречаются округлые вдавления на задней поверхности завитка. Часто имеют место гемигипертрофия и пигментные невусы. Отмечаются висцеромегалия (гепатомегалия, нефромегалия, панкреатомегалия, реже — кардиомегалия), а также гиперплазия матки, мочевого пузыря, клитора, тимуса.
Микроскопически выявляют гиперплазию клеток островков Лангерганса в поджелудочной железе, нефрогенную бластому в почках, наличие резко увеличенных клеток и ядер в надпочечниках. Встречаются двурогая матка, крипторхизм, диафрагмальная грыжа, неправильное деление легких на доли, дефект межжелудочковой перегородки, добавочная селезенка, незаконченный поворот кишечника. Костный возраст опережает паспортный, отмечается расширение метафизов длинных трубчатых костей с кольцевым сужением диафизов.
В ряде случаев наблюдается иммуно-дефицитное состояние. В 5% случаев имеется склонность к развитию злокачественных опухолей (опухоль Вильмса, рак надпочечников). Выявляются полицитемия, гипогликемия, являющаяся очень характерным симптомом (особенно в период новорожденности), гиперлипидемия, гиперхолестеринемия, гипокальциемия. Умеренная умственная отсталость обычно связана с гипогликемией. Однако в большинстве случаев психическое развитие соответствует возрасту. Популяционная частота неизвестна.
Уровень неонатальной смертности составляет примерно 21% и в основном обусловлен застойной сердечной недостаточностью. Для выживших прогноз в целом бывает благоприятным и зависит от тяжести сочетанных аномалий и наличия отдаленных осложнений. До наступления периода жизнеспособности плода может быть предложено прерывание беременности.
В более поздние сроки проводится эхографическая оценка развития плода в динамике. В случаях подозрения на макросомию может быть предложено кесарево сечение из-за риска развития дискоординации родовой деятельности. Целесообразно родоразрешение в специализированных пренатальных медицинских центрах для проведения раннего хирургического лечения дефектов передней брюшной стенки и коррекции гипогликемии. Рекомендуется эхографическое обследование ребенка каждые три месяца в течение первых 6 лет жизни для выявления опухолей органов брюшной полости.
! Несмотря на то, что многие из описанных в данном разделе болезней считаются неизлечимыми, в Центре лечения редких заболеваний в Милане постоянно ведется поиск новых методов. Благодаря генной терапии удалось добиться выдающихся результатов и полностью излечить некоторые редкие синдромы.
Обратитесь к консультанту на сайте или оставьте заявку – так вы можете узнать, какие методы предлагают итальянские врачи. Возможно, данное заболевание уже научились лечить в Милане.
+7 (925) 50 254 50 –
срочное лечение в Италии
ЗАПРОС в КЛИНИКУ
Источник