Синдром дауна и тетрада фалло
Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
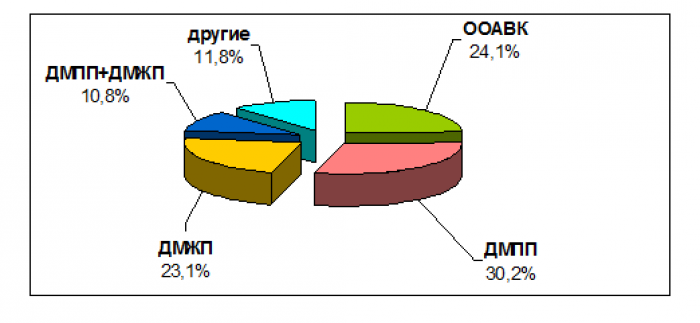
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник
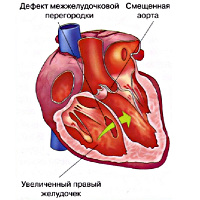
Тетрада Фалло – сочетанная врожденная аномалия сердца, характеризующаяся стенозом выводного тракта правого желудочка, дефектом межжелудочковой перегородки, декстропозицией аорты и гипертрофией миокарда правого желудочка. Клинически тетрада Фалло проявляется ранним цианозом, задержкой развития, одышкой и одышечно-цианотическими приступами, головокружением и обмороками. Инструментальная диагностика тетрады Фалло включает проведение ФКГ, электрокардиографии, УЗИ сердца, рентгенографии грудной клетки, катетеризации полостей сердца, вентрикулографии. Оперативное лечение тетрады Фалло может быть паллиативным (наложение межсистемных анастомозов) и радикальным (полная хирургическая коррекция порока).
Общие сведения
Тетрада Фалло – сложный врожденный порок сердца «синего» типа, морфологическую основу которого составляют четыре признака: обструкция выходного отдела правого желудочка, обширный ДМЖП, гипертрофия правого желудочка и смещение аорты. В кардиологии тетрада Фалло встречается в 7-10 % случаев среди всех врожденных пороков сердца и составляет половину всех пороков цианотического типа. Подробная анатомическая характеристика порока, как самостоятельной нозологической формы, впервые была дана французским врачом-патологоанатомом Е.L.A. Fallot в 1888 г., по имени которого впоследствии он и был назван.
По структуре дефекта к тетраде Фалло наиболее близки триада Фалло (стеноз отверстия легочной артерии, дефект межпредсердной перегородки и гипертрофия правого желудочка) и пентада Фалло (тетрада Фалло и ДМПП). Тетрада Фалло может сочетаться с другими аномалиями сердца и сосудов: праворасположенной дугой аорты, аномалиями венечных артерий, стенозом ветвей легочной артерии, открытым артериальным протоком, полной формой открытого атриовентрикулярного канала, добавочной левосторонней верхней полой веной, частичным аномальным дренажом легочных вен.
Тетрада Фалло
Причины тетрады Фалло
Тетрада Фалло формируется вследствие нарушения процесса кардиогенеза на 2–8 нед. эмбрионального развития. К развитию порока могут приводить перенесенные беременной на ранних сроках гестации инфекционные заболевания (корь, скарлатина, краснуха); прием лекарственных средств (снотворных, седативных, гормональных и др.), наркотиков или алкоголя; воздействие вредных производственных факторов. В формировании ВПС прослеживается влияние наследственности.
Тетрада Фалло нередко встречается у детей с синдромом Корнелии де Ланге (амстердамской карликовостью), включающим олигофрению и множественные аномалии развития («лицо клоуна», атрезию хоан, деформацию ушных раковин, готическое небо, косоглазие, миопию, астигматизм, атрофию зрительных нервов, гипертрихоз, деформацию грудины и позвоночника, синдактилию стоп, уменьшение количества пальцев, пороки развития внутренних органов и т. д.).
Пусковым механизмом тетрады Фалло служит неправильная ротация (против часовой стрелки) артериального конуса, вследствие чего происходит смещение клапана аорты правее относительного легочного. При этом аорта располагается над межжелудочковой перегородкой («аорта-всадник»). Неправильное положение аорты обусловливает смещение легочного ствола, который несколько удлиняется и сужается. Ротация артериального конуса препятствует соединению его собственной перегородки с межжелудочковой перегородкой, что обусловливает образование ДМЖП и последующее расширение правого желудочка.
Классификация тетрады Фалло
С учетом характера обструкции выводного тракта правого желудочка анатомические варианты тетрады Фалло представлены четырьмя типами: эмбриологическим, гипертрофическим, тубулярным и многокомпонентным.
I тип тетрады Фалло – эмбриологический. Обструкция обусловлена смещением конусной перегородки кпереди и влево или (и) ее низким расположением. Зона максимального стеноза соответствует уровню разграничительного мышечного кольца. Фиброзное кольцо легочного клапана практически не изменено или умеренно гипоплазировано.
II тип тетрады Фалло – гипертрофический. В основе обструкции лежит смещение конусной перегородки кпереди и влево или (и) ее низкое расположение, а также выраженные гипертрофические изменения ее проксимального сегмента. Зона максимального стеноза соответствует уровню отверстия выходного отдела правого желудочка и разграничительного мышечного кольца.
III тип тетрады Фалло – тубулярный. Обструкция вызвана неравномерным разделением общего артериального ствола, в результате чего легочный конус оказывается резко гипоплазированным, суженным и укороченным. При данном типе тетрады Фалло может иметь место гипоплазия фиброзного кольца или клапанный стеноз легочного ствола.
IV тип тетрады Фалло – многокомпонентный. Причина обструкции – значительное удлинение конусной перегородки или высокое отхождение перегородочно-краевой трабекулы модераторного тяжа.
В связи с особенностями гемодинамики различают три клинико-анатомических формы тетрады Фалло: 1) с атрезией устья легочной артерии; 2) цианотичная форма со стенозом устья различной степени; 3) ацианотичная форма.
Особенности гемодинамики при тетраде Фалло
Степень гемодинамических нарушений при тетраде Фалло определяется выраженностью обструкции выводного отдела правого желудочка и наличием дефекта в межжелудочковой перегородке.
Наличие значительного стеноза легочной артерии и септального дефекта больших размеров обусловливает преимущественное поступление крови из обоих желудочков в аорту и меньшее – в легочную артерию, что сопровождается артериальной гипоксемией. Ввиду большого дефекта перегородки давление в обоих желудочках становится равным. При крайней форме тетрады Фалло, связанной с атрезией устья легочной артерии, в малый круг кровообращения кровь попадает из аорты через открытый артериальный проток или через коллатерали.
При умеренной обструкции общее периферическое сопротивление выше, чем сопротивление стенозированного выводного тракта, поэтому развивается лево-правый сброс крови, приводящий к развитию ацианотичной (бледной) формы тетрады Фалло. Однако по мере прогрессирования стеноза возникает сначала перекрестный, а в дальнейшем – веноартериальный (право-левый) сброс крови, что означает трансформацию порока из «белой» формы в «синюю».
Симптомы тетрады Фалло
В зависимости от времени появления цианоза выделяют пять клинических форм и соответственно столько же периодов манифестации тетрады Фалло: раннюю цианотичную форму (появление цианоза с первых месяцев или первого года жизни), классическую (появление цианоза на втором-третьем году жизни), тяжелую (протекает с одышечно-цианотическими приступами), позднюю цианотичную (появление цианоза к 6–10 годам) и ацианотичную (бледную) форму.
При тяжелой форме тетрады Фалло цианоз губ и кожных покровов появляется с 3-4 месяцев и становится стабильно выраженным к 1 году. Синюшность усиливается при кормлении, плаче, натуживании, эмоциональном напряжении, физической нагрузке. Любая физическая активность (ходьба, бег, подвижная игра) сопровождается нарастанием одышки, появлением слабости, развитием тахикардии, головокружением. Характерное положение пациентов с тетрадой Фалло после нагрузки – сидя на корточках.
Крайне тяжелым проявлением клинической картины тетрады Фалло служат одышечно-цианотические приступы, которые обычно появляются в возрасте 2-5 лет. Приступ развивается внезапно, сопровождается беспокойством ребенка, усилением цианоза и одышки, тахикардией, слабостью, потерей сознания. Возможно развитие апноэ, гипоксической комы, судорог с последующими явлениями гемипареза. Одышечно-цианотические приступы развиваются вследствие резкого спазма инфундибулярного отдела правого желудочка, что приводит к поступлению всего объема венозной крови через дефект в межжелудочковой перегородке в аорту и усилению гипоксии ЦНС.
Дети с терадой Фалло могут отставать в физическом (гипотрофия II-III ст.) и моторном развитии; они часто болеют повторными ОРВИ, хроническим тонзиллитом, гайморитом, рецидивирующими пневмониями. У взрослых пациентов с тетрадой Фалло возможно присоединение туберкулеза легких.
Диагностика тетрады Фалло
При объективном обследовании пациентов с тетрадой Фалло обращает внимание бледность или синюшность кожных покровов, утолщение пальцевых фаланг («барабанные палочки» и «часовые стекла), вынужденная поза, адинамия; реже – деформация грудной клетки (сердечный горб). Перкуторно обнаруживается незначительное расширение границ сердца в обе стороны. Типичными аускультативными признаками тетрады Фалло служат грубый систолический шум во II-III межреберье слева от грудины, ослабление II тона над легочной артерией и др. Полная аускультативная картина порока фиксируется с помощью фонокардиографии.
Рентгенография органов грудной клетки выявляет умеренную кардиомегалию, типичную форму сердца в виде башмачка, обеднение легочного рисунка. ЭКГ-картина характеризуется значительным отклонением ЭОС вправо, гипертрофическими изменениями миокарда правого желудочка, неполной блокадой правой ножки пучка Гиса.
С помощью УЗИ сердца непосредственно определяются все анатомические компоненты тетрады Фалло: степень легочного стеноза, величина смещения аорты, размер ДМЖП и выраженность гипертрофии правого желудочка.
Зондирование полостей сердца позволяет выявить высокое давление в правом желудочке, снижение насыщения артериальной крови кислородом, прохождение катетера из правого желудочка в аорту. При проведении аортографии и легочной артериографии обнаруживается наличие коллатерального кровотока, ОАП, патологии легочной артерии. При необходимости выполняется левая вентрикулография, селективная коронарография, МСКТ и МРТ сердца.
Дифференциальный диагноз тетрады Фалло проводится с транспозицией магистральных сосудов, двойным отхождением аорты и легочной артерии от правого желудочка, одножелудочковым сердцем, двухкамерным сердцем.
Лечение тетрады Фалло
Все пациенты с тетрадой Фалло подлежат хирургическому лечению. Медикаментозная терапия показана при развитии одышечно-цианотических приступов: ингаляции увлажненного кислорода, внутривенное введение реополиглюкина, натрия гидрокарбоната, глюкозы, эуфиллина. В случае неэффективности лекарственной терапии необходимо незамедлительное наложение аортолегочного анастомоза.
Способ оперативной коррекции тетрады Фалло зависит от тяжести течения порока, его анатомо-гемодинамического варианта, возраста пациента. Новорожденным и детям раннего возраста с тяжелой формой тетрады Фалло на первом этапе требуется проведение паллиативных операций, которые позволили бы снизить степень риска осложнений при последующей радикальной коррекции порока.
К паллиативным (шунтирующим) типам операций при тетраде Фалло относятся: наложение подключично-легочного анастомоза Блелока-Тауссиг, внутриперикардиальное анастомозирование восходящей аорты и правой легочной артерии, наложение центрального аорто-легочного анастомоза с помощью синтетического или биологического протеза, наложение анастомоза между нисходящей аортой и левой легочной артерией и др. Для уменьшения гипоксемии применяются операции открытой инфундибулопластики и баллонной вальвулопластики.
Радикальная коррекция тетрады Фалло предусматривает проведение пластики ДМЖП и устранения обструкции выходного отдела правого желудочка. Обычно она проводится в возрасте от полугода до 3-х лет. Специфическими осложнениями операций, выполняемых при тетраде Фалло, могут являться тромбоз анастомоза, острая сердечная недостаточность, легочная гипертензия, аневризма правого желудочка, АВ–блокада, аритмии, инфекционный эндокардит.
Прогноз тетрады Фалло
Естественное течение порока в значительной мере зависит от степени легочного стеноза. Четверть детей с тяжелой формой тетрады Фалло погибает в первый год жизни, из них половина – в период новорожденности. Без операции средняя продолжительность жизни – 12 лет, менее 5% больных доживают до 40-летия. Причиной гибели больных с тетрадой Фалло чаще всего становится тромбоз сосудов головного мозга (ишемический инсульт) или абсцесс мозга.
Отдаленные результаты радикальной коррекции тетрады Фалло хорошие: пациенты трудоспособны и социально активны, удовлетворительно переносят физические нагрузки. Однако чем в более позднем возрасте выполнена радикальная операция, тем хуже ее отдаленные результаты. Все пациенты с тетрадой Фалло нуждаются в наблюдении кардиолога и кардиохирурга, антибиотикопрофилактике эндокардита перед проведением стоматологических или хирургических процедур, потенциально опасных в отношении развития бактериемии.
Источник
