Синдром гийена барре формулировка диагноза
(информация для пациентов)
 Что такое “Синдром Гийена-Барре” (СГБ)?
Что такое “Синдром Гийена-Барре” (СГБ)?
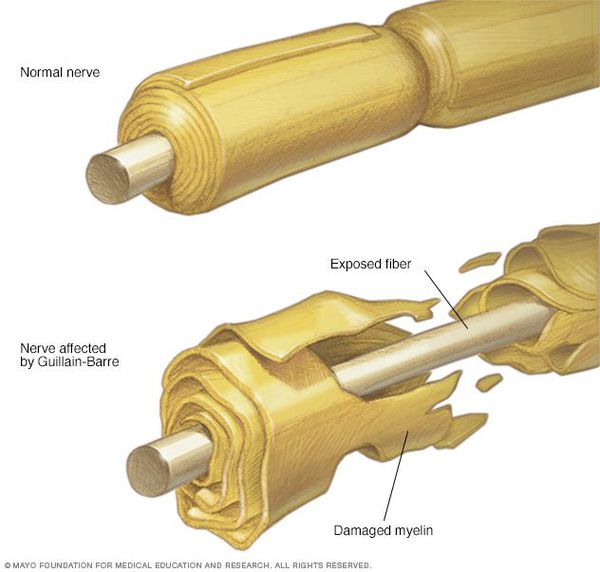
Синдром Гийена-Барре объединяет группу острых дизиммунных нейропатий, гетерогенных (разных) по патофизиологическим механизмам развития и клиническо-нейрофизиологической картине.
Форм данного заболевания очень много, но наиболее часто диагностируемыми в практике являются:
- острая воспалительная демиелинизирующая полинейропатия (80% от всех случаев)
- острая моторная аксональная нейропатия (10–15%)
- острая моторно-сенсорная аксональная нейропатия (5-10%)
Эти формы объединяет клиническая картина – развитие острого вялого тетрапареза, когда быстро (в течение менее 4 недель) развивается слабость мышц конечностей и туловища.
Другие формы СГБ (синдром Миллера Фишера, острая пандизавтономия, фаринго-цервико-брахиальная форма, лицевая диплегия и др.) встречаются крайне редко (<1%).
Как часто встречается данное заболевание?
Синдром Гийена-Барре (СГБ) в настоящее время является самой частой причиной острых периферических параличей во многих странах мира, в том числе и в России. Эта нозология входит в число первых семи приоритетных научно-исследовательских направлений в мировой неврологии и включена в европейский перечень орфанных болезней. Заболеваемость составляет 1-2 случая на 100 000 населения в год. Это означает, что в городе Москве заболевает примерно до 200 человек в год.
Какой механизм развития данного заболевания?
В настоящее время практически полностью раскрыт патогенетический механизм развития СГБ. Многочисленные исследования продемонстрировали, что СГБ является дизиммунной полинейропатией, которая может быть спровоцирована различными инфекционными агентами (бактериями, вирусами), а также вакцинацией, оперативными вмешательствами, травмами, стрессом, физической нагрузкой, переохлаждением и т.д.
В большинстве случаев, за 1–3 недели до развития СГБ, отмечаются признаки того или иного инфекционного заболевания: ОРВИ, грипп, гайморит, бронхит, корь, паротит, краснуха, гастроэнтерит и другие. Основными инфекционными триггерами считаются Campylobacter jejuni, цитомегаловирус, Mycoplasma pneumoniae, вирусы Epstein-Barr, ECHO, Коксаки, гриппа А, В и герпеса. Многочисленные серологические, иммунологические, морфологические, микробиологические и другие исследования к настоящему временя позволили достоверно установить, что развитие СГБ после инфицирования C. jejuni происходит по механизму “молекулярной мимикрии”, обусловленной схожестью антигенов структурных компонентов периферических нервов человека с антигенами данного возбудителя. Однако СГБ может развиваться и на фоне полного здоровья.
Последнее время активно проводятся исследования по установлению генетической предрасположенности к СГБ, а также выявлению иммуногенетических факторов, повышающих вероятность развития данного заболевания у каждого конкретного человека.
 Что беспокоит пациентов при данном заболевании?
Что беспокоит пациентов при данном заболевании?
- симметричная слабость мышц, которая нарастает с ног и распространяется выше и выше, вовлекая мышцы туловища, рук, шеи и иногда лица
- нарушение походки вплоть до невозможности самостоятельно ходить
- симметричное онемение и покалывание в руках и ногах (“как будто перчатки и носки надели”)
- болевой синдром в спине, в руках и ногах
- у каждого четвертого пациента развивается слабость дыхательных мышц, нарушение глотания и речи – это “опасные” симптомы, при появлении которых требуется перевод в реанимационное отделение
Как развивается синдром Гийена-Барре (СГБ)?
СГБ – это острая полинейропатия, симптомы которой прогрессируют быстро, в пределах 1 месяца (в среднем за 2 недели). СГБ в большинстве случаев развивается “по восходящему типу”: сначала захватывая стопы (слабость и онемение), а затем симптомы распространяются выше – на бедра, тазовый пояс, туловище (мышц спины и брюшного пресса), кисти, плечевой пояс. В тяжелых случаях вовлекаются мышцы лица и глотки.
Не характерны для СГБ симптомы поражения центральной нервной системы и нарушение функции тазовых органов.
СГБ опасно развитием жизнеугрожающих нарушений – слабости дыхательных и бульбарных мышц (нарушение глотания и речи). Предсказать их развитие невозможно.
!!!При подозрении на синдром Гийена-Барре необходима срочная госпитализация!!!
Всегда ли синдром Гийена-Барре протекает тяжело?
СГБ протекает с разной степенью тяжести. Встречаются легкие и среднетяжелые формы, когда пациент сохраняет способность ходить. Это характерно для большинства пациентов. Тяжелые и крайне тяжелые формы заболевания, при которых пациент обездвижен и нуждается в искусственной вентиляции легких из-за слабости дыхательной мускулатуры, отмечаются у каждого четвертого пациента.
На основании чего устанавливается диагноз “Синдром Гийена-Барре”?
Пациент с подозрением на СГБ должен быть госпитализирован в стационар, где проводится его обследование и уточнение диагноза. Обследование на амбулаторном этапе недопустимо.
Для подтверждения диагноза СГБ необходимы:
- анализ истории развития заболевания
- оценка неврологического статуса
- электронейромиография (ЭНМГ)
- общий анализ ликвора
Для исключения иных причин острого вялого тетрапареза назначаются следующие лабораторные и инструментальные обследования:
- общий клинический и развернутый биохимический анализы крови;
- RW, анти-ВИЧ, НВsAg и анти-HCV;
- общий анализ мочи;
- электролиты крови (Na+,K+);
- КФК общий
- магнитно-резонансная томография (МРТ) – по необходимости
Проведение ЭНМГ-исследования необходимо во всех случаях при подозрении на СГБ, поскольку данный метод позволяет не только подтвердить поражение периферических нервов, но и уточнить характер их повреждения, следовательно определить форму заболевания. Исследование пациентов в ранние сроки заболевания (когда симптоматика только нарастает и очень важно быстро поставить диагноз) имеет особенности, поэтому должно быть проведено хорошо подготовленным и опытным специалистом на миорафе высокого класса. Методологические ошибки и недостаточный объем данного исследования часто приводят к ошибочным диагнозам. Поэтому мы рекомендуем проведение ЭНМГ в нашем центре.
Какое лечение СГБ разработано на данный момент?
При СГБ важно вовремя (в первые 2 недели от появления признаков болезни) и в полном объеме провести патогенетическую терапию:
- высокообъемный программный плазмаферез (ПФ) или
- высокодозную внутривенную иммунотерапию препаратами иммуноглобулина человеческого класса G (ВВИГ).
Патогенетическая терапия используются, прежде всего, с целью прерывания “аутоиммунной агрессии”, развивающейся при СГБ. При этом предполагается достичь торможения дальнейшего развития заболевания, снизить длительность периода нарастания симптоматики, ускорить начало периода восстановления и добиться максимально полного выздоровления.
Глюкокортикостероиды при СГБ неэффективны и ухудшают прогноз!
К неспецифическим методам лечения относят симптоматическую терапию и реабилитацию. При этом восстановительное лечение является ключевым как в остром, так и в отдаленном периодах. Прием нейрометаболических, ноотропных препаратов, витаминов группы В при СГБ не рекомендован ни в остром периоде, ни в восстановительном, в связи с отсутствием доказательной базы.
Какой прогноз у пациентов с диагнозом синдром Гийена-Барре?
Прогноз восстановления при СГБ благоприятный – в подавляющем большинстве случаев пациенты полностью выздоравливают. Неблагоприятное течение и неполное восстановление ассоциированы с возрастом старше 60 лет, предшествующей диареей, необходимостью в ИВЛ, развитием грубого тетрапареза в течение 7 дней от начала болезни, неэффективностью патогенетической терапии.
При правильной терапевтической тактике, средней степени тяжести заболевания ходьба с опорой становится возможной у 90% больных уже к концу 1-3 месяцев от начала заболевания. Иная ситуация наблюдается после тяжелых форм СГБ: ходьба с опорой становится возможной у большинства больных только к полугоду от начала заболевания; а процесс восстановления затягивается на годы.
ФГБНУ НЦН уже многие годы занимается диагностикой и лечением пациентов с синдромом Гийена-Барре. Коллективом ФГБНУ НЦН во главе с член-корреспондентом РАН Супоневой Н.А. подготовлены клинические рекомендации по ведению данной категории пациентов (в настоящий момент проходят утверждение).
В ФГБНУ НЦН возможно поэтапное лечение пациентов с синдромом Гийена-Барре:
- от отделения реанимации, где в полном объеме опытными специалистами проводится необходимая патогенетическая терапия (высокообъемный плазмаферез или введение иммуноглобулина при наличии у пациента препарата), тщательный уход, контроль и поддержка жизненоважных функций (в том числе ИВЛ)
- до отделения реабилитации, где накоплен большой опыт по поэтапному восстановлению пациентов с СГБ.
Сотрудники центра заболеваний периферической нервной системы консультируют пациентов амбулаторно в рамках ОМС и на коммерческой основе.
ЗАПИСЬ НА ПРИЕМ И ЭНМГ/иЭМГ ПО МНОГОКАНАЛЬНОМУ ТЕЛЕФОНУ
+7 (495) 374-77-76
+7 (985) 931-60-24
Будьте здоровы!!!
Источник
Синдром Гийена – Барре – это острая, обычно быстро прогрессирующая воспалительная полинейропатия, характеризующаяся мышечной слабостью и умеренным выпадением дистальной чувствительности и самоограничивающимся течением. Заболевание имеет аутоиммунную природу. Диагноз ставится на основе клинических данных. Лечение включает в себя плазмаферез, внутривенные иммуноглобулины, искусственную вентиляцию легких при тяжелом течении.
Синдром Гийена – Барре – это наиболее распространенная из приобретенных воспалительных нейропатий. Существует несколько разновидностей. При некоторых вариантах преобладает демиелинизация; при других вариантах поражается аксон.
Хотя причина не до конца понятна, заболевание расценивают как аутоиммунное.
Примерно у двух третей пациентов синдром Гийена-Барре возникает через 5 дней – 3 недели после банального инфекционного заболевания, операции или вакцинации. Инфекция – триггерный фактор у более 50% пациентов; наиболее частые патогены включают:
Кишечные вирусы
Вирусы герпеса (включая цитомегаловирус и вирус Эпштейна-Барр)
Группа случаев последовала вслед за осуществлением программы вакцинации против свиного гриппа в 1976 году, но позже выяснилось, что эта связь была ложной из-за предвзятости.
Побочные эффекты ингибиторов контрольных точек иммунного ответа включают синдром, который напоминает синдром Гийена-Барре.
Клинические проявления
У большинства пациентов доминирует вялый парез, причем проксимальные мышцы поражаются в большей степени и нарушения чувствительности выражены меньше. Обычно практически симметричная мышечная слабость с парестезиями начинается распространяться с ног и затем поражает руки, но в некоторых случаях парез начинается с мышц рук или головы. В 90% случаев слабость обычно достигает максимума на 3-4 неделе заболевания. Выпадают глубокие сухожильные рефлексы. Функция сфинктеров обычно не нарушается. Слабость остается неизменной в течение различного периода времени, как правило, в течение нескольких недель, а затем разрешается.
При тяжелом течении более чем в половине случаев страдают лицевые и орофарингеальные мышцы. Может развиваться дегидратация и недостаточность питания. В 5–10% случаев в связи с параличом дыхательных мышц требуется интубация трахеи и проведение ИВЛ.
У некоторых пациентов (возможно, при вариантной форме) развивается выраженная, угрожающая жизни вегетативная дисфункция с колебаниями артериального давления, нарушением секреции антидиуретического гормона, аритмиями, закупоркой желудочно-кишечного тракта, задержкой мочи и нарушением реакции зрачков на свет.
При нетипичном варианте (синдроме Фишера или синдроме Миллера-Фишера) могут развиваться офтальмоплегия, атаксия и арефлексия.
Клиническая оценка
Нейрофизиологическое исследование
Исследование спинномозговой жидкости (СМЖ)
Диагноз синдром Гийена-Барре ставится, прежде всего, на основании клинической картины.
Аналогичная острая слабость может возникать при миастении, ботулизме, полиомиелите (в основном за пределами США), клещевом параличе, инфицировании вирусом Западного Нила и метаболических невропатиях, но эти нарушения обычно можно различить по следующим критериям:
Миастения является интермиттирующей и усугубляется при физической нагрузке.
При ботулизме в половине случаев наблюдаются фиксированные расширенные зрачки и выраженный парез черепных нервов без нарушения чувствительности.
Полиомиелит обычно возникает во время эпидемий.
Инфекция, вызванная вирусом Западного Нила, сопровождается головной болью, лихорадкой и асимметричным вялым параличом, но без нарушений чувствительности.
Метаболические нейропатии развиваются на фоне хронических метаболических нарушений.
Необходимы проведение анализов на наличие инфекционных заболеваний и оценка иммунного статуса, включая тесты на гепатит и ВИЧ, и электрофорез белков сыворотки.
При подозрении на синдром Гийена – Барре показана госпитализация для выполнения нейрофизиологического исследования (анализ скорости распространения возбуждения по нерву и электронейромиография), проведения анализа ликвора и наблюдения с определением форсированной жизненной емкости легких каждые 6–8 часов. При нейрофизиологическом исследовании 2/3 случаев выявляется замедление скорости распространения возбуждения и признаки сегментарной демиелинизации, однако отсутствие патологических изменений не позволяет исключить диагноз и не должно становиться причиной откладывания лечения.
При анализе ликвора может выявляться белково-клеточная диссоциация (повышение уровня белка и нормальное количество лейкоцитов), но ее может не быть в течение 1-й недели заболевания, а в 10% случаев она вообще отсутствует.
В отдельных случаях, компрессия шейного отдела спинного мозга могут имитировать синдром Гийена-Барре, особенно когда присутствует сопутствующая полинейропатия (вызывая или способствуя пониженной рефлекторности) и бульбарное поражение отчетливо не выражено; в таких случаях выполняют МРТ-исследование.
Синдром Гийена – Барре фатальный в < 2%. В большинстве случаев через несколько месяцев наступает улучшение, но примерно у 30% взрослых и у еще большей доли детей резидуальная слабость сохраняется примерно в течение 3 лет. Остаточные дефекты могут потребовать профессиональной переподготовки, ортопедической коррекции или операции.
Интенсивная поддерживающая терапия
Внутривенный иммуноглобулин (ВВИГ) или плазмаферез
Синдром Гийена – Барре – это неотложное состояние, требующее постоянного мониторинга и поддержания жизненно важных функций, обычно в палате интенсивной терапии и реанимации. Необходимо часто измерять форсированную жизненную емкость легких, чтобы при необходимости начать респираторную поддержку. При снижении форсированной жизненной емкости до уровня < 15 мл/кг показана интубация трахеи. Неспособность приподнять голову от подушки – еще один тревожный симптом, часто развивающийся одновременно с появлением пареза диафрагмы.
При невозможности приема жидкости через рот следует проводить инфузионную терапию с поддержанием диуреза на уровне не менее 1,0–1,5 л/день. В условиях постельного режима конечности следует оберегать от травм и сдавливания.
Тепло облегчает боль, что может использоваться при назначении ранней физиотерапии. Следует избегать иммобилизации, чреватой развитием анкилозов и контрактур. Как можно раньше следует обеспечивать пассивные движения в суставах в полном объеме, а после уменьшения остроты симптомов начинают активные упражнения. Низкомолекулярный гепарин (НМГ) помогает предотвратить тромбоз глубоких вен у пациентов, прикованных к постели. В нескольких рандомизированных исследованиях и мета-анализах сообщалось, что НМГ более эффективны, чем нефракционированный гепарин в низких дозах (обычно назначается в дозе 5000 единиц 2 раза в день), при этом риск кровотечения при их применении одинаковый.
При раннем назначении ВВИГ (IVIG) 2 г/кг в течение 1-2 дней или, более медленно, 400 мг/кг внутривенно 1 раз в день в течение 5 дней подряд является терапией выбора; оно имеет некоторые преимущества в период до 1 месяца от начала заболевания.
Плазмаферез помогает при проведении на ранних стадиях заболевания; он применяется также при неэффективности IVIG (внутривенного иммуного глобулина). Плазмаферез относительно безопасен; он позволяет укоротить длительность заболевания и пребывания в стационаре и снижает риск смерти и частоту развития стойкого паралича. Плазмаферез удаляет введенные ранее внутривенные иммуноглобулины, нивелируя их эффект, поэтому его не следует проводить во время или вскоре после завершения лечения иммуноглобулинами, рекомендуется соблюдать интервал как минимум 2–3 сут. Рекомендовано подождать, по крайней мере, 2-3 дня после отмены IVIG.
Кортикостероиды не улучшают течение заболевания и могут ухудшить его исход.
Синдром Гийена – Барре обычно начинается как восходящий, относительно симметричный вялый парез.
В первую очередь необходимо провести дифференциальный диагноз с другими заболеваниями, которые сопровождаются сходными симптомами (например, с миастенией, ботулизмом, клещевым параличом, инфекцией, вызванной вирусом Западного Нила, метаболическими нейропатиями, полиомиелитом), основываясь на данных анамнеза и результатах обследования.
Несмотря на то что диагноз устанавливается на основании клинических данных, необходимо провести нейрофизиологическое исследование и анализ ликвора.
Около 70% пациентов полностью выздоравливают, но в некоторых случаях (от 2 до 5%) развивается хроническая воспалительная демиелинизирующая полинейропатия.
Важнейшим фактором восстановления является интенсивная поддерживающая терапия.
Лечение следует начинать с ВВИГ, при их неэффективности проводят плазмаферез.
Источник
Дата публикации 26 февраля 2018Обновлено 23 июля 2019
Определение болезни. Причины заболевания
Синдром Гийена-Барре (ГБС) — острое аутоиммунное заболевание периферической нервной системы, характеризующееся мышечной слабостью. Это расстройство охватывает группу острых нарушений периферической нервной системы. Каждый вариант характеризуется особенностями патофизиологии и клинического распределения слабости в конечностях и черепных нервах.
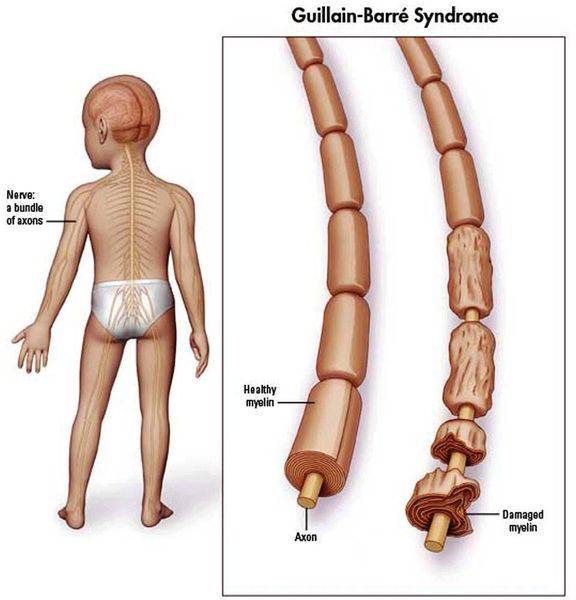
У 70% пациентов с ГБС наблюдалось предшествующее инфекционное заболевание перед появлением неврологических симптомов.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы синдрома Гийена — Барре
Симптомы ОРВИ или расстройства желудочно-кишечного тракта отмечаются у 2/3 пациентов. Первыми симптомами ГБС являются парестезии пальцев конечностей, за которыми следует прогрессирующая слабость мышц нижних конечностей и нарушения походки. Болезнь прогрессирует в течение нескольких часов или дней, возникает слабость верхних конечностей и развиваются паралич черепных нервов. Параличи обычно симметричны и носят, конечно, периферический характер. У половины пациентов боль может быть первоначальной жалобой, что затрудняет диагноз. Атаксия и боль чаще встречаются у детей, чем у взрослых. Задержка мочи наблюдается у 10%-15% больных. Поражение вегетативных нервов проявляются головокружениями, гипертонией, чрезмерным потоотделением и тахикардией.
При объективном обследовании выявляется восходящая мышечная слабость, а также арефлексия. Сухожильные рефлексы нижних конечностей отсутствуют, но рефлексы верхней конечности могут вызываться. Мышечная слабость может задействовать и респираторные мышцы. Поражение черепных нервов отмечается в 35-50%, вегетативная нестабильность в 26%-50%, атаксия — в 23%, дизестезия — в 20% случаев.[1]
Наиболее распространенными признаками вегетативной дисфункции являются синусовая тахикардия или брадикардия и артериальная гипертония. У пациентов с тяжелой вегетативной дисфункцией наблюдаются изменения периферического вазомоторного тонуса с гипотензией и лабильностью артериального давления.
Нечастые варианты клинического течения болезни включают лихорадку в начале неврологических симптомов, тяжелую сенсорную недостаточность с болью (миалгии и артралгии, менингизм, корешковая боль), дисфункции сфинктеров.
Возможность ГБС должна рассматриваться у любого пациента с быстрым развитием острой нервно-мышечной слабости. На ранней стадии ГБС следует отличать от других заболеваний с прогрессирующей симметричной мышечной слабостью, включая поперечный миелит и миелопатию, острую токсическую или дифтеритическую полиневропатию, порфирию, миастению и нарушения электролитного обмена (например, гипокалиемия).
Патогенез синдрома Гийена — Барре
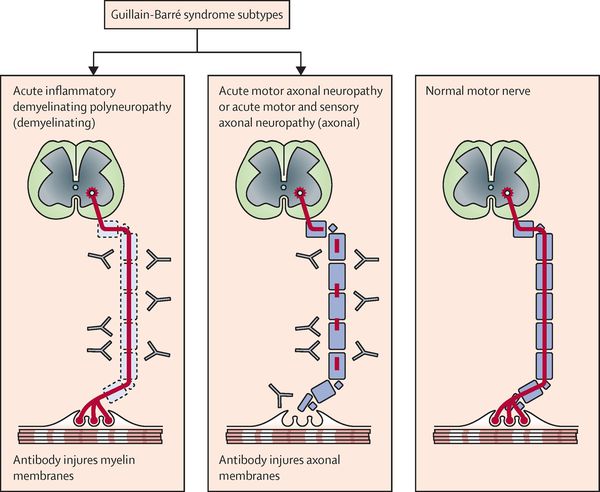
Нейрофизиологические процессы, лежащие в основе ГБС, подразделяются на несколько подтипов. Наиболее распространенные подтипы включают:
- острую воспалительную демиелинизирующую полирадикулопатию;
- острую двигательную аксональную невропатию;
- острую моторную и сенсорную аксональную нейропатию;
- синдром Миллера-Фишера, как вариант ГБС, характеризуется триадой признаков: офтальмоплегия, атаксия и арефлексия.
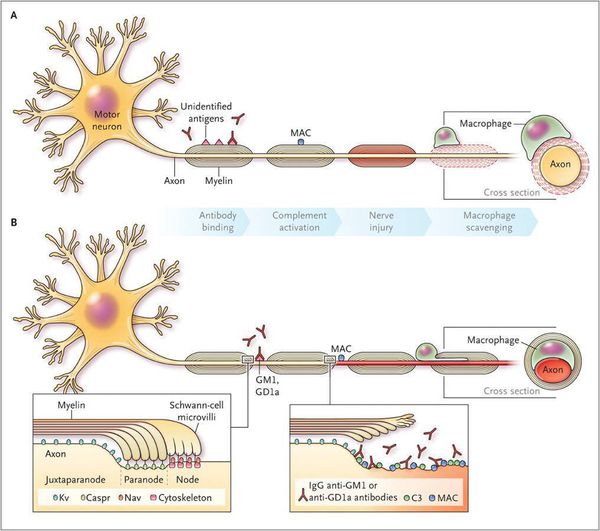
Считается, что ГБС развивается вследствие выработки антител против белка инфекционного агента, которые перекрестно реагируют с ганглиозидами нервных волокон человека. Аутоантитела связываются с миелиновыми антигенами и активируют комплемент, с формированием мембранно-атакующего комплекса на внешней поверхности клеток Шванна. Повреждение оболочек нервных стволов приводит к нарушениям проводимости и мышечной слабости (на поздней стадии может происходить и аксональная дегенерация). Демиелинизирующее поражение наблюдается по всей длине периферического нерва, включая нервные корешки.
Поражаются все типы нервов, в том числе вегетативные, моторные и сенсорные волокна. Вовлечение двигательных нервов происходит значительно чаще, чем сенсорных.

Осложнения синдрома Гийена — Барре
Пациенты с ГБС подвержены риску опасных для жизни респираторных осложнений и вегетативных нарушений.
Показания для перевода в отделение интенсивной терапии включают:
- быстрое прогрессирование моторной слабости с поражением респираторных мышц;
- вентиляционную дыхательную недостаточность;
- пневмонию;
- бульбарные расстройства;
- тяжелую вегетативную недостаточность.
Осложнения проводимого лечения, требующие интенсивной терапии, включают перегрузку жидкостью, анафилаксию на введение внутривенного иммуноглобулина или гемодинамические нарушения при проведении плазмафереза.
У 15%-25% детей с ГБС развивается декомпенсированная дыхательная недостаточность, которая требует механической вентиляции легких.[2] Респираторные нарушения чаще встречается у детей с быстрым прогрессированием заболевания, слабостью верхних конечностей, вегетативной дисфункцией и поражениями черепных нервов. Интубация трахеи может потребоваться у больных для защиты дыхательных путей, проведения механической вентиляции легких. При ГБС быстрое прогрессирование, двусторонний паралич лицевого нерва и вегетативная дисфункция предопределяют повышенную вероятность интубации. Необходимо планирование ранней интубации для минимизации риска осложнений и необходимости проведения экстренной интубации.
Вегетативная дисфункция повышает риск эндотрахеальной интубации. С другой стороны, дисавтономия может увеличить риск гемодинамических реакций на препараты, используемые для индукции анестезии во время интубации.
Признаки, указывающие на необходимость механической вентиляции легких:[4]
- вентиляционная дыхательная недостаточность;
- увеличение потребности в кислороде для поддержания SpO2 выше 92%;
- признаки альвеолярной гиповентиляции (PCO2 выше 50 мм. рт. ст.);
- быстрое снижение жизненной емкости на 50% по сравнению с исходным уровнем;
- невозможность кашля
Вегетативная дисфункция является основным фактором смертности при ГБС. Фатальный сердечно-сосудистый коллапс из-за вегетативной дисфункции наблюдается у 2%-10% тяжелобольных пациентов.[3] Мониторинг частоты сердечных сокращений, артериального давления и электрокардиограммы следует продолжать до тех пор, пока пациенты нуждаются в респираторной поддержке. Чрескожная кардиостимуляция может потребоваться при выраженной брадикардии. Гипотония корректируется восполнением объема циркулирующей крови (ОЦК), и, если пациент невосприимчив к восполнению ОЦК, применяются α-агонисты, такие как норадреналин, мезатон, адреналин.
При нестабильной гемодинамике непрерывная регистрация артериального и центрального венозного давления должна проводиться для контроля объема инфузионной терапии.
Артериальная гипертензия может возникать, но это осложнение не требует специального лечения, если оно не осложняется отеком легких, энцефалопатией или субарахноидальным кровоизлиянием.
Диагностика синдрома Гийена — Барре
Инструментальная диагностика
Люмбальная пункция
При люмбальной пункции результаты СМЖ обычно показывают повышенный уровень белка (> 45 мг/дл), без плеоцитоза (<10 клеток/мм3) (белково-клеточная диссоциация). Иногда уровень белка может оставаться нормальным, при умеренном повышении количества клеток (10-50 клеток/мм3). Цитоз выше, чем 50 клеток/мм3, свидетельствует против диагноза ГБС. В ряде случаев могут быть необходимы повторные люмбальные пункции для уточнения диагноза.
Нейрофункциональная диагностика
ЭНМГ (Электронейромиография) — единственный инструментальный метод диагностики, позволяющий подтвердить диагноз ГБС и уточнить характер патологических изменений (демиелинизирующий или аксональный) и их распространенность.[3]
Игольчатая электромиография характеризуется наличием признаков текущего денервационно-реиннервационного процесса при полинейропатии. Исследуют дистальные мышцы верхних и нижних конечностей (например, переднюю большеберцовую мышцу, общий разгибатель пальцев), а при необходимости и проксимальные мышцы (например, четырёхглавую мышцу бедра).
ЭНМГ-исследование у больных с ГБС зависит от клинических проявлений:
- при дистальных парезах исследуются длинные нервы на руках и ногах: не менее четырех двигательных и четырех чувствительных (двигательные и чувствительные порции срединного и локтевого нервов; малоберцовый, большеберцовый, поверхностный малоберцовый и икроножный нервы с одной стороны).
Оценка основных ЭНМГ- параметров:
- моторные ответы (дистальная латентность, амплитуда, форма и длительность), наличие блоков проведения и дисперсии ответов; анализируется скорость распространения возбуждения по моторным волокнам на дистальных и проксимальных участках.
- сенсорные ответы: амплитуда и скорость проведения возбуждения по сенсорным волокнам в дистальных отделах.
- поздних ЭНМГ-феноменов (F-волн): анализируются латентность, форма и амплитуда ответов, величина хронодисперсии, процент выпадений.
- при проксимальных парезах обязательным является исследование двух коротких нервов (подмышечного, мышечно-кожного, бедренного и др.) с оценкой параметров моторного ответа (латентности, амплитуды, формы).
Первые признаки денервационного процесса появляются через две-три недели после начала заболевания, признаки реиннервационного процесса — через месяц.
Лечение синдрома Гийена — Барре
Общее поддерживающее лечение и уход
Пациенты, требующие интенсивной терапии, требуют тщательного общего ухода. Запор наблюдается более чем в 50% случаев пациентов с ГБС в результате динамической непроходимости кишечника.
При боли применяют парацетамол. Катадолон и трамадол применяют при выраженном болевом синдроме. При нейропатической боли эффективны карбамазепин и габапентин.
В лечении ГБС предпринимаются различные виды иммуномодулирующей терапии.[1][2]
Внутривенный иммуноглобулин назначают в виде ежедневной инфузии (в дозе 0,4 гр/кг/день) в течение 5 дней в первые 2 недели болезни. Второй курс иммуноглобулина может потребоваться 5%-10% пациентов, при отрицательной динамике после первоначального улучшения. Механизм действия внутривенного иммуноглобулина, вероятно, многофакторный и, как полагают, включает модуляцию активации комплемента, нейтрализацию идиотипических антител, подавление воспалительных медиаторов (цитокины, хемокины).
Побочные эффекты иммуноглобулина включают головную боль, миалгию и артралгию, гриппоподобные симптомы, лихорадку. У пациентов с дефицитом IgA может развиться анафилаксия после первого курса внутривенного иммуноглобулина.
Плазмаферез способствует удалению антител, вовлеченных в патогенез ГБС. В течение каждого сеанса 40-50 мл/кг плазмы заменяют смесью 0,9% раствора хлорида натрия и альбумина. Проведение плазмафереза приводит к сокращению времени выздоровления и снижению потребности в искусственной вентиляции. Эти преимущества очевидны, если плазмаферез проводится в течение первых двух недель после начала болезни. Осложнения, связанные с плазмаферезом, включают гематому в области венопункции, пневмоторакс после катетеризации подключичной вены и сепсис. Плазмаферез противопоказан пациентам с тяжелой гемодинамической нестабильностью, кровотечением и сепсисом.
Комбинация плазмафереза и иммуноглобулина не показала клинических преимуществ.
Кортикостероиды не должны использоваться при лечении ГБС, т. к. не ускоряют выздоровление, не уменьшают вероятность ИВЛ и не влияют на долгосрочный результат.[2]
Прогноз. Профилактика
ГБС остается серьезным заболеванием, несмотря на улучшение результатов лечения. По сравнению со взрослыми, у детей чаще отмечается более благоприятное течение заболевания, с полным, а не частичным выздоровлением. Причинами неблагоприятного исхода при ГБС являются дыхательная недостаточность, осложнения искусственной вентиляции легких (пневмония, сепсис, острый респираторный дистресс-синдром и тромбоэмболические осложнения), остановка сердца, вторичная по отношению к дисавтономии.
Восстановление обычно начинается через две-четыре недели после прекращения прогрессирования симптомов. Среднее время от начала заболевания до полного выздоровления составляет 60 дней. Данные относительно долгосрочного исхода ГБС ограничены. 75% – 80% пациентов полностью выздоравливают. Около 20% пациентов не могут ходить через полгода.
Младшая возрастная группа (менее 9 лет), быстрое прогрессирование и максимальная мышечная слабость, потребность в искусственной вентиляции легких являются важными предикторами длительного двигательного дефицита.[4]
Источник
