Синдром холестаза у новорожденных клинические рекомендации

Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Холестаз – это нарушение выведения билирубина, что приводит к повышению уровня прямого билирубина и желтухе. Известно много причин холестаза, которые выявляют при лабораторном исследовании, сканировании печени и желчевыводящих путей и иногда биопсии печени и операции. Лечение холестаза зависит от причины.
[1], [2], [3], [4], [5], [6], [7]
Причины холестаза новорожденного
Холестаз может возникнуть в результате внепеченочных или внутрипеченочных нарушений или при их сочетании. Наиболее частой внепеченочной причиной является атрезия желчевыводящих путей. Известно большое число внутрипеченочных нарушений, которые объединены собирательным термином «синдром неонатального гепатита».
Атрезия желчевыводящих путей – это обструкция желчных ходов в связи с прогрессирующим склерозом внепеченочных желчных протоков. В большинстве случаев атрезия желчевыводящих путей развивается через несколько недель после рождения, вероятно, после воспалительного процесса и Рубцовых изменений внепеченочных (и иногда внутрипеченочных) желчных протоков. Это состояние редко встречается у недоношенных новорожденных или у детей непосредственно после рождения. Причина воспалительного ответа неизвестна, однако считают, что имеют место инфекционные причины.
Синдром неонатального гепатита (гигантоклеточный гепатит) – это воспалительный процесс в печени новорожденного. Известно большое количество метаболических, инфекционных и генетических причин; в некоторых случаях заболевание носит идиопатический характер. Метаболические заболевания включают дефицит альфа1антитрипсина, муковисцидоз, гемохроматоз новорожденных, дефекты дыхательной цепи и окисления жирных кислот. Инфекционные причины включают врожденный сифилис, вирусы ECHO, некоторые герпесвирусы (вирус простого герпеса, цитомегаловирус); вирусы гепатита реже являются причиной. Также известны менее распространенные генетические дефекты, такие как синдром Алладжиля и прогрессирующий семейный внутрипеченочный холестаз.
[8], [9], [10], [11], [12]
Патофизиология холестаза новорожденного
При холестазе первичной причиной является недостаточная экскреция билирубина, что приводит к повышению конъюгированного билирубина в крови и уменьшению желчных кислот в ЖКТ. В результате низкого содержания желчных кислот в ЖКТ развивается синдром мальабсорбции жиров и жирорастворимых витаминов (A, D, Е, К), который приводит к гиповитаминозу, недостаточному питанию, задержке роста.
Симптомы холестаза новорожденного
Симптомы холестаза обнаруживают в течение первых двух недель жизни. У детей отмечается желтуха и часто темная моча (конъюгированный билирубин), ахоличный стул, гепатомегалия. Если холестаз продолжается, развивается постоянный зуд, а также симптомы дефицита жирорастворимых витаминов; кривая роста может снижаться. Если причинное заболевание приводит к развитию фиброза и цирроза печени, может развиться портальная гипертензия с последующим асцитом и желудучно-кишечным кровотечением из варикозно расширенных вен пищевода.
Диагностика холестаза новорожденного
Любой ребенок с желтухой после двух недель жизни должен быть обследован для выявления холестаза с измерением общего и прямого билирубина, печеночных ферментов и других функциональных печеночных тестов, включая уровень альбумина, РТ и РТТ. Холестаз выявляют по повышению общего и прямого билирубина; когда диагноз холестаза подтверждается, необходимы дальнейшие исследования для определения его причины. Это обследование включает тесты для выявления инфекционных агентов (например, токсоплазмоз, краснуха, цитомегаловирус, герпесвирус, ИМС, вирусы гепатитов В и С) и метаболических нарушений, включая исследование мочи на органические кислоты, сыворотки крови на аминокислоты, альфа1 антитрипсин, потовые пробы для диагностики муковисцидоза, мочи для определения восстанавливающих веществ, тесты на галактоземию. Также следует провести сканирование печени; выведение контраста в кишечник исключает атрезию желчевыводящих путей, однако недостаточная экскреция может наблюдаться как при атрезии желчевыводящих путей, так и при тяжелом гепатите новорожденных. УЗИ органов брюшной полости может помочь в оценке размеров печени и визуализации желчного пузыря и общего желчного протока, однако эти данные неспецифичны.
Если диагноз не был поставлен, обычно относительно рано проводят биопсию печени. Для пациентов с атрезией желчевыводящих путей типично увеличение портальных триад, пролиферация желчных протоков, усиление фиброза. Гепатит новорожденного характеризуется нарушением строения долек с многоядерными гигантскими клетками. Иногда диагноз остается неясным, и тогда требуется хирургическое вмешательство с проведением оперативной холангиографии.
[13], [14], [15], [16], [17], [18]
Лечение холестаза новорожденного
Начальное лечение холестаза новорожденного консервативное и состоит из обеспечения адекватного питания с введением витаминов A, D, Е, К. У детей на искусственном вскармливании следует использовать смеси с высоким содержанием среднецепочечных триглицеридов, так как они лучше всасываются в условиях недостатка желчных кислот. Требуется введение достаточного количества калорий; детям может требоваться более 130 ккал/(кг х сут). У детей, у которых сохраняется небольшое количество выделяемой желчи, назначение урсодезоксихолевой кислоты в дозе 10-15 мг/ кг один или два раза в день может уменьшить зуд.
Специального лечения гепатита новорожденных нет. Детям с предполагаемой атрезией желчевыводящих путей требуется хирургическое обследование с интраоперационной холангиографией. Если диагноз подтверждается, проводится портоэнтеростомия по Касаи. В идеале это следует сделать в течение первых двух недель жизни. После этого срока прогноз значительно ухудшается. После операции у многих пациентов отмечаются серьезные хронические проблемы, включающие персистирующий холестаз, рецидивирующий восходящий холангит, задержку прибавки веса. Даже при оптимальном лечении у многих детей развивается цирроз и требуется пересадка печени.
Какой прогноз имеет холестаз новорожденного?
Атрезия желчевыводящих путей прогрессирует и при отсутствии лечения приводит к печеночной недостаточности, циррозу с портальной гипертензией в течение нескольких месяцев и смерти ребенка до года. Холестаз новорожденного, связанный с синдромом неонатального гепатита (особенно идиопатический), обычно медленно разрешается, однако может произойти повреждение ткани печени и привести к смерти.
Источник
Введение
Внутрипеченочный холестаз беременных (ВХБ) (син.: холестатический гепатоз) — это обратимая форма холестаза, характерная для беременности и проявляющаяся интенсивным кожным зудом, повышением уровня желчных кислот в сыворотке крови и/или ферментов печени, со спонтанным разрешением в послеродовом периоде (как правило, в течение 2–6 нед.) при отсутствии альтернативных причин. ВХБ осложняет течение 0,7% всех беременностей в мультиэтнической популяции [1]. Патогенез ВХБ связан с генетическими, гормональными факторами, а также воздействием окружающей среды. Например, у женщин Индо-Азиатского и Пакистано-Азиатского регионов ВХБ осложняет течение 1,2–1,5% беременностей, в Чили — 2,4%, в Скандинавских странах — 2,8%, а наибольшая частота ВХБ в мире наблюдается у беременных араукано-
индейской народности. В странах Европы распространенность ВХБ составляет менее 1% [2].
Факторами риска развития ВХБ являются наследственность, хронические заболевания печени, в т. ч. гепатит С и желчнокаменная болезнь, прием медикаментов, многоплодная беременность, индуцированная беременность (экстракорпоральное оплодотворение) [3]. Наиболее значимыми факторами риска являются наследственная предрасположенность и ВХБ в анамнезе. В таких случаях частота развития ВХБ в последующие беременности составляет 45–90% [2].
Диагностика ВХБ
Диагностика ВХБосновывается на анализе клинической картины, лабораторных и инструментальных исследованиях [4]. Критериями диагноза являются наличие кожного зуда (который не может быть объяснен другими причинами) и повышение уровня ферментов печени и желчных кислот в сыворотке крови. При ВХБ зуд возникает у 23% беременных, как правило, после 24 нед. и нередко в течение длительного времени остается единственным симптомом. Типичная локализация зуда — ладони, стопы, живот, где, как правило, выявляются расчесы. Интенсивность зуда возрастает в ночное время, поскольку процесс желчеобразования непрерывен, и в ночной период суток практически весь пул желчных кислот (около 4 г) остается в желчном пузыре. Это снижает качество жизни беременных. Зуд может появиться за несколько дней до изменений биохимических маркеров функции печени [5]. В 10% случаев наблюдается легкая желтуха за счет конъюгированного билирубина. Крайне редкими симптомами холестаза являются светлый стул (стеаторея) и темная моча. Однако ВХБ не является доминирующей причиной желтухи и зуда, и с целью исключения других причин необходимо проведение дополнительных исследований [4].
Ранними лабораторными (биохимическими) маркерами и основанием для постановки диагноза при бессимптомном течении ВХБ является повышение концентрации в сыворотке крови желчных кислот и/или ферментов печени, а в дальнейшем конъюгированного билирубина. У большинства беременных отмечается увеличение 1–2 ферментов печени [5]. Уровень желчных кислот является самым чувствительным маркером ВХБ и может повышаться до изменения других печеночных проб. Во время беременности уровень желчных кислот в сыворотке крови остается в пределах нормы для небеременных, но может несколько повышаться в III триместре за счет изменения метаболизма желчных кислот в результате высоких уровней циркулирующих эстрогенов и прогестерона и свидетельствовать о риске развития холестаза при нормальной беременности. Изолированное повышение сывороточного уровня желчных кислот и билирубина встречается редко, однако нормальные концентрации не исключают диагноз ВХБ. Оценка концентрации желчных кислот и ферментов печени должна проводиться с учетом референсных значений для беременных строго натощак, т. к. уровень желчных кислот в плазме крови значительно увеличивается после приема пищи. Верхняя граница физиологических значений печеночных проб у беременных на 20% ниже, чем у небеременных. Нормальными показателями биохимических параметров следует считать концентрацию желчных кислот <14 мкмоль/л, концентрацию аланинаминотрансферазы (АЛТ) <32 МЕ/л [4, 5].
Дифференциальный диагноз ВХБ
Дифференциальный диагноз ВХБ необходимо проводить с кожными болезнями, в т. ч. экземой, атопическим дерматитом, пиодермией, фолликулитом и др.; осложнениями беременности: преэклампсией, HELLP-синдромом [Н (hemolysis) — внутрисосудистый гемолиз, EL (elevated liver enzimes) — повышение печеночных ферментов, LP (low platelet count) — снижение уровня тромбоцитов], острой жировой дистрофией печени; желчнокаменной болезнью; гепатитами А, В, С; инфекционным мононуклеозом (вирус Эпштейна — Барр) и цитомегаловирусной инфекцией; первичным билиарным циррозом (антимитохондриальные антитела, антитела к гладкомышечным волокнам) (табл. 1) [6].

Отдельного рассмотрения заслуживают случаи лекарственного холестаза, встречающиеся с частотой от 1 случая на 10 000 до 1 случая на 100 000 пациентов, принимающих лекарства в терапевтических дозах (рис. 1) [5, 6].

Лекарственные поражения печени (ЛПП) могут быть обусловлены ингибированием экспрессии и/или функции гепатобилиарных транспортеров, приводящим к нарушению секреции желчи на гепатоцеллюлярном уровне, либо индукцией воспаления по типу идиосинкразии или гиперчувствительности на холангиоцеллюлярном уровне. Индивидуальная чувствительность к развитию холестаза под действием различных лекарственных препаратов может быть обусловлена генетически детерминированной экспрессией гепатобилиарных транспортеров и энзимов, участвующих в реакциях биотрансформации. ЛПП принято подразделять в зависимости от уровня повышения основных печеночных проб на гепатоцеллюлярные, холестатические и смешанные. Если уровень АЛТ повышен более чем в 5 раз от верхней границы нормы и индекс R (отношение АЛТ к щелочной фосфатазе (ЩФ)) ≥5, то следует предполагать гепатоцеллюлярное поражение печени. Повышение уровня ЩФ более чем в 2 раза и индекс R≤2 свидетельствуют о холестатическом поражении печени. Доля холестатических поражений печени среди всех лекарственных гепатопатий составляет около 30%. Как правило, холестатические ЛПП протекают легче, чем гепатоцеллюлярные, но разрешаются значительно медленнее. При смешанном ЛПП отмечается одновременное повышение уровней АЛТ и ЩФ более чем в 2 раза от верхней границы нормы, а индекса R — от 2 до 5 [6].
При диагностированном ЛПП рекомендуется прекращение приема препарата и тщательное наблюдение за клинической симптоматикой и биохимическими показателями (III/С2). Применение урсодезоксихолевой кислоты (УДХК) и кортикостероидов при ЛПП часто бывает эффективно, однако доказательная база в виде контролируемых исследований отсутствует (III/С2) [6].
Мониторинг холестаза беременных
При постановке диагноза ВХБ мониторирование концентрации печеночных ферментов и/или желчных кислот должно проводиться не реже 1 р./нед. до родоразрешения. В случаях персистирующего зуда и нормальных биохимических показателей необходимо проведение повторного анализа печеночных ферментов и желчных кислот не реже 1 р./нед. до появления патологических результатов или прекращения зуда [5]. Возвращение концентрации печеночных ферментов к нормальным значениям, вероятно, свидетельствует о неправильном диагнозе ВХБ.
Клиническое значение и перинатальные риски при беременности, осложненной ВХБ
Развитие ВХБ связано с потенциальным риском преждевременных родов (4–12%), в первую очередь ятрогенных (7–25%), увеличением частоты кесарева сечения
(с 10 до 36%), пассажа мекония (при доношенной беременности до 25–44,3% в сравнении с 7,6–12% в популяции, при недоношенной — до 18 при 3% соответственно) и послеродовых кровотечений (с 2 до 22%) [7, 8]. Риск перинатальных осложнений, в т. ч. преждевременных родов, мекониального пассажа и асфиксии плода, значительно повышается при раннем начале зуда (до 34 нед. беременности) и концентрации желчных кислот >40 мкмоль/л [9]. Так, частота мекониального пассажа возрастает линейно на 19,7% при увеличении концентрации желчных кислот на каждые 10 мкмоль/л и при концентрации желчных кислот >40 мкмоль/л составляет 10–44%. Риск мертворождения при развитии ВХБ составляет 0–11‰, при этом более 70% случаев наблюдаются до 37 нед. беременности [7–10]. Достоверные биохимические критерии и специфические методы антенатального мониторинга плода, прогнозирующие мертворождение, отсутствуют. Гибель плода при ВХБ, как правило, внезапная и не имеет связи с критериями плацентарной недостаточности, в т. ч. с задержкой роста плода, маловодием и патологическими параметрами допплерометрии.
Мониторинг состояния плода включает субъективную оценку шевеления плода, данные ультразвуковой эхографии, кардиотокографии (КТГ), амниоскопии (с 36–37 нед. при установленном диагнозе ВХБ). Прогностическая ценность ультразвуковой эхографии и КТГ в отношении оценки состояния плода и перинатального исхода при холестазе слабая [11].
Родоразрешение при ВХБ
При ВХБ показана дородовая госпитализация в 36 нед. с целью решения вопроса о времени и методе родоразрешения, в т. ч. об индукции родов. Доказательных данных о необходимости досрочного родоразрешения при ВХБ нет, однако существует практика индукции родов при тяжелых формах холестаза с выраженной гиперферментемией и концентрацией желчных кислот >40 мкмоль/л [5, 7]. При обсуждении вопроса о родоразрешении необходимо предупредить о невозможности точного прогнозирования перинатальных осложнений при ВХБ и целесообразности досрочного родоразрешения с целью снижения риска мертворождения. Также необходимо предупредить о риске проведения интенсивной терапии новорожденным. Так, частота госпитализации в отделение реанимации и интенсивной терапии новорожденных при досрочной индукции родов в 37 нед. составляет 7–11%, в 38 нед.— 6% и в 39 нед.— 1,5%. Решение о родоразрешении должно основываться не только на лабораторных результатах, но и на других факторах риска, т. к. сильной корреляции уровня печеночных ферментов и исхода для плода не выявлено. Принятие окончательного решения о времени и методе родоразрешения возможно только после полного информирования беременной о рисках для плода при индукции родов и возможном ухудшении состояния плода при пролонгировании беременности [5].
Лечение
При развитии зуда или повышении уровня печеночных ферментов необходимо по возможности прервать медикаментозную терапию. В первую очередь исключаются медикаменты, часто вызывающие холестаз, в т. ч. эритромицин, амоксициллин + клавулановая кислота.
Местное лечение. Водорастворимые кремы и гели с ментолом временно уменьшают интенсивность зуда и безопасны при беременности. Однако доказательная база, подтверждающая их эффективность, отсутствует. Возможен кратковременный эффект.
Системная терапия
Урсодезоксихолевая кислота (УДХК) уменьшает интенсивность зуда и нормализует функцию печени. УДХК замещает в желчи более гидрофобные эндогенные желчные кислоты и снижает их повреждающий эффект на мембраны гепатоцитов. УДХК обладает плейотропными свойствами, цитопротективным, антиоксидантным и антифибротическим эффектами, снижает восприимчивость гепатоцитов к воспалительным агентам и нормализует спектр липидов. Комбинация УДХК и витамина E имеет цитопротективный и метаболический эффекты, способствует снижению скорости апоптоза, активности сывороточных трансаминаз, восстанавливает циркулирующий уровень адипонектина [12]. При холестерин-ассоциированной патологии билиарного тракта, в т. ч. билиарном сладже, холецистолитиазе и холестерозе желчного пузыря, заместительная урсотерапия значительно снижает уровень холестерина и приводит к устранению билиарного сладжа. Для лечения клинически манифестных холестатических заболеваний печени у беременных УДХК применяется во II и III триместрах (I/В1). При ВХБ прием УДХК уменьшает выраженность зуда и концентрацию печеночных ферментов (I/В1) [6, 13, 14]. Однако достоверное снижение перинатальной смертности при применении УДХК отсутствует [15]. Рекомендуемая доза составляет 10 мг на 1 кг массы тела в сутки. Начальная доза может составлять 1 г/сут (по 250 мг 4 раза) и быть увеличена до 1,5 г/сут. Принимать препарат целесообразно с приемом пищи или сразу после еды. Побочных эффектов применения УДХК у матерей и новорожденных не зафиксировано [16].
Антигистаминные препараты — блокаторы гистаминовых Н1-рецепторов — могут иметь положительный седативный эффект при приеме на ночь, но не оказывают существенного влияния на интенсивность зуда [16].
Адеметионин образуется из метионина в процессе АТФ-зависимой реакции, катализируемой метионин-аденозилтрансферазой, и участвует в биохимических реакциях
трансметилирования, транссульфатирования, трансаминирования и декарбоксилирования. Реакции метилирования необходимы для синтеза эндогенного фосфатидилхолина в гепатоцитах. В реакциях транссульфатирования адеметионин является предшественником цистеина, таурина, глутатиона. Адеметионин снижает токсичность желчных кислот в гепатоците, осуществляя их конъюгирование и сульфатирование. Конъюгация с таурином повышает растворимость желчных кислот и выведение их из гепатоцита. Процесс сульфатирования желчных кислот способствует их элиминации почками, облегчает прохождение через мембрану гепатоцита и выведение с желчью. Сульфатированные желчные кислоты защищают мембраны клеток печени от токсического действия несульфатированных желчных кислот, в высоких концентрациях присутствующих в гепатоцитах при внутрипеченочном холестазе. В реакциях трансметилирования (85% которых протекает в печени) адеметионин является донором метильной группы для синтеза фосфолипидов клеточных мембран, нейротрансмиттеров, нуклеиновых кислот и белков. При ВХБ адеметионин снижает выраженность кожного зуда и концентрацию ферментов печени. Оказывает холеретическое и гепатопротективное действие, сохраняющееся до 3 мес. после прекращения лечения. Рекомендованная доза и режим введения адеметионина составляет 400–800 мг/сут (1–2 флакона) внутривенно в течение 2 нед. Поддерживающая пероральная терапия — 800–1600 мг/сут в течение 2–4 нед. [5, 16]. Препарат противопоказан в I и II триместрах беременности.
Глюкокортикоиды не являются препаратами терапии холестаза первой линии. Рандомизированные доказательные исследования эффективности препаратов отсутствуют. В некоторых исследованиях рекомендована схема применения дексаметазона по 10 мг перорально в течение 7 дней с перерывом в 3 дня [5, 16]. Использование преднизолона безопасно во II и III триместрах беременности и при лактации, однако при применении в I триместре увеличивается риск развития расщелины твердого неба у детей [6].
Витамин К. ВХБ возникает в результате сниженной абсорбции пищевого жира вследствие недостаточной секреции желчных кислот в ЖКТ и снижения формирования мицелия. Увеличенная экскреция жира при ВХБ может быть субклинической (но с повышенным содержанием жира в кале) или клинической (стеаторея), что влияет на абсорбцию витамина К, который необходим для синтеза факторов II, VII, IX, X. У женщин с жировой мальабсорбцией, в первую очередь при обструкции желчевыводящих путей и заболеваниях печени, может наблюдаться дефицит витамина К. Водорастворимый витамин К (менадиона натрия бисульфит) может применяться при ВХБ и при увеличении протромбинового времени в дозе 5–10 мг/сут с 34 нед. беременности до родоразрешения с целью снижения риска послеродовых кровотечений более чем в 3 раза (III/С2), при этом необходимо соотнести пользу для матери и риск для плода [5, 6]. В случаях холестаза, стеатореи или доказанного низкого уровня жирорастворимых витаминов рекомендуется комплексное применение витаминов А, Е и К (III/С2) [6].
Ведение в послеродовом периоде
Снижение гиперферментемии после родов подтверждает диагноз ВХБ. Родильницам с ВХБ необходимо проведение биохимического анализа крови в течение 7–10 дней после родов с целью подтверждения диагноза, а с целью оценки динамики снижения концентрации печеночных ферментов и/или желчных кислот — через 6 и 8 нед. после родов [5, 16]. Если после родов симптоматика не купируется (или прогрессирует), необходимо провести дифференциальную диагностику с другими хроническими заболеваниями печени, в т. ч. с первичным билиарным циррозом, первичным склерозирующим холангитом, хроническим гепатитом С, при которых кожный зуд может появиться на последних неделях беременности.
Родильницам с ВХБ целесообразно избегать эстрогенсодержащие методы контрацепции, которые провоцируют появление зуда у 10% женщин.
Заключение
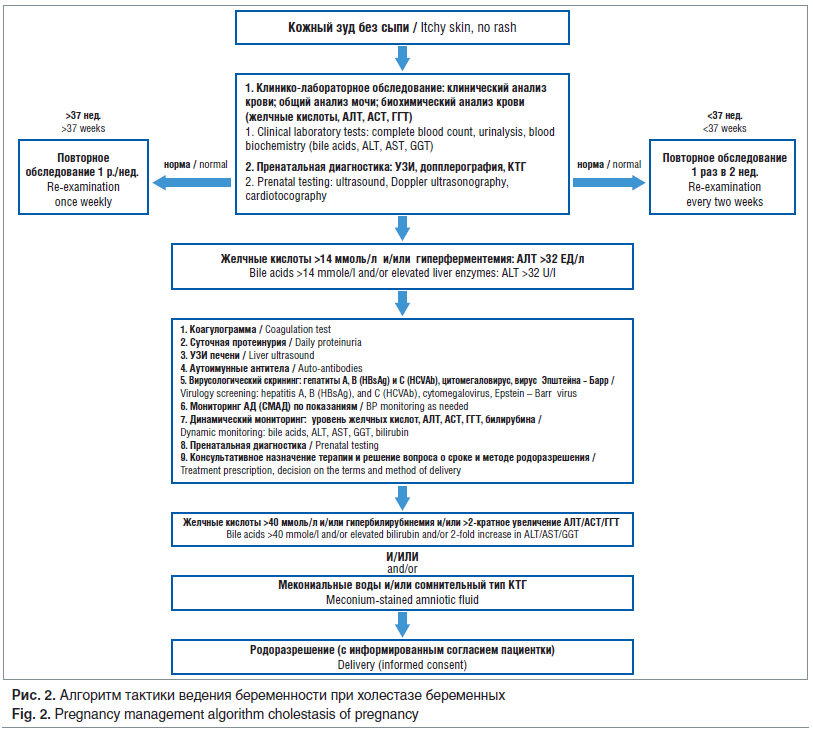
Ввиду прогрессивного увеличения возраста беременных и сопутствующей экстрагенитальной патологии вопросы своевременной диагностики нарушений функции печени и желчевыводящих путей и рациональной акушерской тактики являются актуальными и требуют дифференцированного подхода. Некоторые осложнения беременности, в т. ч. преэклампсия, HELLP-синдром, нередко имеют неспецифические симптомы печеночной дисфункции. Таким образом, знание алгоритмов дифференциальной диагностики и акушерской тактики позволяет достоверно уменьшить риски материнской и перинатальной заболеваемости и смертности (рис. 2).
Сведения об авторах:
1Козлов Павел Васильевич — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета, врач высшей категории, ORCID iD 0000-0002-9916-6128;
2Самсонова Инна Владимировна — к.м.н., заместитель главного врача по медицинской части, врач высшей категории, ORCID iD 0000-0002-1228-1765.
1ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
2ГБУЗ «ГКБ № 52 ДЗМ». 123182, Россия, г. Москва, ул. Пехотная, д. 3.
Контактная информация: Козлов Павел Васильевич, e-mail:
drkpv@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 21.08.2019.
About the authors:
1Pavel V. Kozlov — MD, PhD, professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-9916-6128;
2Inna V. Samsonova — MD, PhD, Deputy Head Doctor for Medical Work, ORCID iD 0000-0002-1228-1765.
1Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117437, Russian Federa-
tion.
2City Clinical Hospital No. 52. 3, Pekhotnaya str., Moscow, 123182, Russian Federation.
Contact information: Pavel V. Kozlov, e-mail: drkpv@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 21.08.2019.
Источник
