Синдром избыточной массы тела патогенез

Над статьей доктора
Белодедова А. С.
работали
литературный редактор
Елена Бережная,
научный редактор
Сергей Федосов
Дата публикации 24 ноября 2017Обновлено 29 октября 2020
Определение болезни. Причины заболевания
Ожирение — хроническое заболевание, которое характеризуется патологическим увеличением массы тела за счет жировой ткани.
Согласно данным ВОЗ, в 2009 г. в мире около 2,1 миллиарда человек имели избыточную массу тела или ожирение, при этом в России среди людей с таким диагнозом 51,7% женщин и 46,5% мужчин. К 2016 году это показатель вырос и уже составляет 57% (а это более 82 млн человек!).
По данным 2017 г., у каждого второго взрослого и каждого шестого ребенка есть избыточный вес или ожирение. По уровню ожирения лидируют США — 38,2% населения имеют этот диагноз; ниже всех этот показатель в Японии — 3,7 %. Согласно проведенному исследованию, женщины с более низким уровнем образования в 2-3 раза чаще страдают ожирением по сравнению с более образованными представительницами слабого пола.[1]
По этиологии различают:
- первичное (алиментарно-конституциональное) ожирение, и вторичное (симптоматическое). Первичное составляет 90-95% случаев, является следствием образа жизни — снижение физической активности, потребление жирной высококалорийной пищи, продуктов с высоким содержанием сахара и рафинированных углеводов.
- Причиной вторичного ожирения может стать эндокринная патология (снижение функции щитовидной железы, гипогонадизм, синдром «пустого» турецкого седла, опухоли гипофиза, синдром Кушинга и др.), генетические дефекты структур регуляции жирового обмена, психические заболевания. В патогенезе вторичного ожирения образ жизни также играет существенную роль.[2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы ожирения
Основная жалоба пациентов – на лишний вес.
Среди других жалоб:[3]
- одышка при физической нагрузке;
- повышение артериального давления;
- сухость во рту;
- нарушение менструального цикла у женщин;
- громкий храп во сне;
- повышенная дневная сонливость;
- боли в суставах;
- снижение потенции у мужчин и др.
Патогенез ожирения
- Наследственные факторы (25-70%);
- Избыточное употребление жирной и высококалорийной пищи, сахара, рафинированных углеводов, алкоголя, преимущественно в вечернее время;
- Нарушение пищевого поведения, которое определяется семейными и национальными стереотипами питания. Психическая активность и пищевые привычки тесно взаимосвязаны, поэтому существует предположение, что одной из причин ожирения является нарушение обмена серотонина и рецепции эндорфинов. Таким образом, пища (особенно углеводистая) — это своего рода «допинг», поэтому можно провести параллель между ожирением (по типу психологической зависимости) и наркоманией или алкоголизмом. Воспринимая прием пищи как средство успокоения в стрессовых ситуациях, многие люди демонстрируют гиперфагическую реакцию на стресс.
- Низкая физическая активность. В результате сидячего образа жизни, отсутствия регулярных физических нагрузок (особенно аэробных — ходьба пешком в умеренном темпе 30–40 минут 3–4 раза в неделю, бег, езда на велосипеде, плаванье и т. п.) у организма снижаются энергозатраты, и в сочетании с высококалорийной диетой всё это способствует набору лишнего веса;
- Инсулинорезистенность играет важнейшую роль в развитии ожирения и метаболического синдрома, являясь причиной ожирения и сахарного диабета 2 типа. Инсулин — гормон, который обеспечивает нормальное протекание метаболизма и поддержку энергетического баланса за счет ингибирования образования глюкозы печенью и усиления поглощения ее мышечной и жировой тканью.
Классификация и стадии развития ожирения
Сегодня используется принятая ВОЗ классификация, которая рассчитывается согласно Индексу Массы Тела (ИМТ) (вес в кг/рост м2). Согласно этой классификации, нормальной массе тела соответствует ИМТ 18,5–24,9; избыточной — ИМТ 25–29,9; ожирению 1 степени соответствует ИМТ 30-34,9; ожирению 2 степени соответствует ИМТ 35-39,9; ожирение 3 степени (морбидное) – при ИМТ выше 40 .

Однако у этой классификации есть существенный недостаток — высокий % жира в организме бывает даже при нормальной массе тела («ожирение при нормальной массе тела»), и наоборот — спортсмен с хорошо развитой мышечной массой может иметь ИМТ, соответствующий 1 степени ожирения, хотя само собой, никакого ожирения у него нет. Поэтому для определения % жира в организме, а также воды и мышечной массы сегодня в медицине широко применяется метод биоимпедансного анализа состава тела. В норме нормальный процент жировой массы у мужчин — 10–20%, у женщин — 18–28%.[5]
Различают 2 основных типа жироотложения — андроидное (по типу «яблока», как правило, наблюдается у мужчин — отложение жира преимущественно в области верхней части живота) и гиноидное (по типу «груши», наблюдается у женщин — отложение жира в области бедер и нижней части живота). Отложение жира по типу «яблока» менее благоприятно, так как при этом типе ожирения чаще наблюдается висцеральное ожирение (жировые отложения вокруг внутренних органов), что способствует повышению риска возникновения сопутствующих заболеваний. Признаком висцерального ожирения считается объем талии больше 80 см у женщин и более 94 см у мужчин. Также соотношение объема талии к объему бедер в норме должно быть не более 1,0 у мужчин и 0,85 у женщин.
С недавних пор используется термин «саркопеническое ожирение» — его сопровождает потеря мышечной массы и мышечной силы; зачастую его можно встретить у людей пожилого возраста. Потеря мышечной массы в сочетании с ожирением чревата развитием сахарного диабета 2 типа, сердечно-сосудистых заболеваний, снижением качества жизни пациента и инвалидизацией.[6]
Осложнения ожирения
Ожирение является одним из существенных факторов, которые способствуют развитию метаболического синдрома. Его признаки:
- висцеральное ожирение;
- нарушения углеводного и липидного обмена;
- артериальная гипертензия.
Метаболический синдром часто сопровождается:
- сердечно-сосудистыми заболеваниями;
- сахарным диабетом;
- неалкогольной жировой болезнью печени (НАЖБП);
- желчнокаменной болезнью;
- синдромом поликистозных яичников;
- синдромом обструктивного апноэ сна;
- заболеваниями суставов (остеоартроз, подагра);
- повышением риска развития онкологических заболеваний (например, исследования выявили связь метаболического синдрома и инсулинорезистентности с раком предстательной железы).[7][8]
Неалкогольная Жировая Болезнь Печени (НЖБП) — одно из наиболее распространенных заболеваний печени, тесно ассоциированное с инсулинорезистентностью и метаболическим синдромом.[9] Именно у лиц с метаболическим синдромом отмечается максимальный риск развития НЖБП. По данным различных исследований, частота НЖБП у больных сахарным диабетом 2 типа и ожирением составляет от 70 до 100%. Инсулинорезистентность приводит к тому, что в печени накапливаются триглицериды и формируется жировой гепатоз, который (при отсутствии лечения) постепенно прогрессирует в фиброз, а затем и в цирроз печени.[10] На стадии стеатоза заболевание протекает бессимптомно, на стадии стеатогепатита наблюдается повышение печеночных ферментов. Стеатоз и фиброз являются обратимыми стадиями заболевания печени, поэтому крайне важно выявлять заболевание на ранней стадии, с целью предотвращения развития необратимого состояния — цирроза печени.
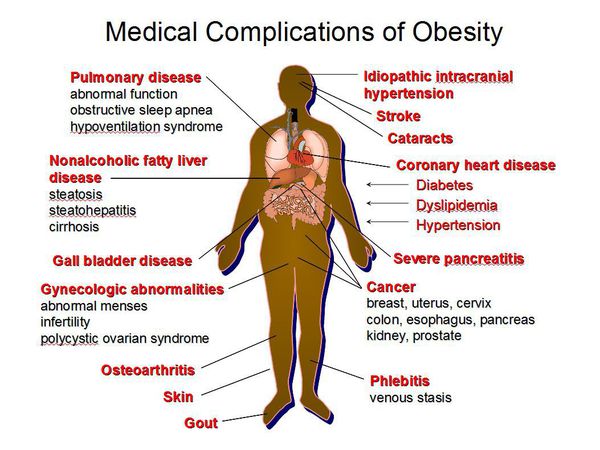
У пациентов с ожирением нередко наблюдается синдром обструктивного апноэ сна (СОАС) — заболевание, при котором происходит частичное или полное спадение дыхательных путей во сне. Характеризуется громким храпом во сне, эпизодами остановки дыхания во сне, выраженной дневной сонливостью. Данное состояние нарушает процесс сна, приводит к появлению усталости, выраженной дневной сонливости, проблемам с памятью, снижению работоспособности (засыпание на рабочем месте), повышает риск сердечно-сосудистых осложнений, а также ввиду низкого насыщения крови кислородом замедляет обмен веществ и мешает снизить вес пациенту с ожирением. Скрининговый метод диагностики СОАС — ночная пульсоксиметрия (неинвазивный метод измерения % насыщения крови кислородом). При наличии значительного снижения сатурации крови кислородом по данным пульсоксиметрии показано проведение полисомнографии.[11] С помощью этого метода осуществляется непрерывная регистрация различных физиологических сигналов тела человека: электрическая активность мозга, деятельность сердца, характер дыхания (наличие или отсутствие эпизодов остановки дыхания), степень насыщения крови кислородом.
Диагностика ожирения
Диагностика ожирения основывается на подсчете ИМТ для определения степени выраженности ожирения. Кроме того, рекомендуется проводить биоимпедансный анализ состава тела, чтобы исключить ожирение при нормальной массе тела и саркопеническое ожирение. Далее нужно исключить вторичные формы ожирения и выявить ассоциированные с ожирением заболевания (синдром обструктивного апноэ сна, сахарный диабет, неалкогольная жировая болезнь печени и др.).
Комплексное обследование при ожирении должно включать:
- антропометрию;
- исследование состава тела;
- измерение артериального давления;
- ЭКГ;
- УЗИ органов брюшной полости;
- исследование крови на глюкозу, липидный спектр (холестерин, ЛПВП, ЛПНП, триглицериды), печеночные показатели (АЛТ, АСТ, билирубин, ЩФ);
- исследование мочевой кислоты;
- проведение глюкозотолерантного теста;
- скрининг на СОАС (ночная пульсоксиметрия).
По показаниям, направление к смежным специалистам — эндокринологу, кардиологу, сомнологу, гастроэнтерологу, гинекологу (при наличии нарушений менструального цикла). При наличии симптомов нарушения пищевого поведения целесообразно направить пациента к психологу, психотерапевту.
Лечение ожирения
Лечение должно быть направлено в основном на коррекцию питания (диета с физиологической квотой белка, с повышенным содержанием пищевых волокон, исключением легкоусваиваемых углеводов, ограничением общих углеводов, животного жира; обогащение рациона омега-3 жирными кислотами), повышение физической активности (преимущественно за счет аэробных физических нагрузок), а также лечение сопутствующих ожирению заболеваний (нормализация артериального давления, уровня глюкозы и холестерина крови, уровня печеночных трансаминаз), предупреждение развития сердечно-сосудистых осложнений, сахарного диабета 2 типа и его осложнений, цирроза печени на фоне НЖБП. Если имеются нарушения пищевого поведения, для эффективного снижения веса важно ведение пациента совместно с психологом/психотерапевтом. И только если консервативное лечение ожирения оказалось неэффективным, а также при тяжелой степени ожирения пациенту показана бариатрическая хирургия.
Виды операций при ожирении:
- эндоскопическая установка внутрижелудочных баллонов;
- шунтирующие операции на тонкой кишке;
- операции, связанные с уменьшением объема желудочного резервуара;
- комбинированные вмешательства (желудочное, билиопанкреатическое шунтирование).
Прогноз. Профилактика
Профилактика направлена на нормализацию образа жизни: регулярная физическая активность, ограничение в рационе продуктов, богатых насыщенными жирами и рафинированными углеводами (кондитерские и колбасные изделия, лапша быстрого приготовления, дешевые полуфабрикаты и пр.), употребление достаточного количества овощей и фруктов (не менее 400 г. в день), включение в рацион зерновых продуктов (круп, хлеба грубого помола, макарон из твердых сортов пшеницы), употребление в пищу достаточного количества белка (за счет нежирных сортов мяса и птицы, рыбы, морепродуктов, яиц, творога, молочных продуктов), соблюдение режима труда и отдыха.
Источник
По современным представлениям одним из основных патогенетических механизмов, приводящих к развитию заболевания, является энергетический дисбаланс, заключающийся в несоответствии между количеством калорий, поступающих с пищей, и энергетическими затратами организма. Наиболее часто это происходит вследствие нарушения питания: избыточного поступления энергии с пищей по сравнению с энерготратами, качественных отклонений в соотношении пищевых веществ от принятых норм рационального питания (чрезмерного потребления жирной пищи) или нарушения режима питания – перемещения основной доли суточной калорийности пищи на вечерние часы. Жировая ткань является основным депо энергетических запасов. Избыток энергии, поступающий с пищей в виде триглицеридов, откладывается в жировых клетках – адипоцитах, вызывая увеличение их размеров и нарастание массы тела.
Не только избыточное или неправильное питание может приводить к развитию ожирения, нередко слишком большая масса тела – следствие нарушений расхода энергии в организме, обусловленных различными ферментативными, метаболическими дефектами, нарушениями окислительных процессов, состояния симпатической иннервации. Так, к примеру, у здоровых лиц с нормальной массой тела при избыточном питании развивается адаптивное увеличение скорости метаболизма, в частности отмечается значительное возрастание основного обмена, являющееся, по-видимому, своеобразным буфером, поддерживающим энергетический баланс и способствующим сохранению стабильности массы тела при изменении количества потребляемой пищи. У больных с прогрессирующим ожирением подобной адаптации не происходит.
Изучение пищевого поведения экспериментальных животных также показало, что перекармливание не всегда ведет к развитию ожирения, а у животных с генетически детерминированным ожирением нарастание массы тела не является лишь результатом гиперфагии и переедания. Особенности адренергической иннервации адипоцитов, в частности состояния бета3- и альфа-адренергических рецепторов клеточных мембран, могут оказывать влияние на скорость липолиза и липогенеза и в конечном итоге в некоторой степени определять количество депонированных триглицеридов в адипоците. Несомненно значение активности липопротеиновой липазы адипоцитов в механизмах развития ожирения.
Коричневая жировая ткань, получившая свое название из-за бурой окраски, обусловленной высоким содержанием цитохрома и других окислительных пигментов в адипоцитах, богато снабженных митохондриями, согласно главным образом экспериментальным исследованиям, может иметь значение в патогенезе как генетического, так и алиментарного ожирения. Она является одним из основных мест адаптивного и индуцированного диетой термогенеза. У новорожденных коричневая жировая ткань играет важную роль в поддержании температуры тела и адекватной реакции на холод. По мнению N. V. Rothwell и соавт., при избыточном питании коричневая жировая ткань гипертрофируется, превращая избыток энергии, поступающей с пищей, в тепло и тем самым препятствуя отложению ее в жировых депо.
Как свидетельствуют наблюдения многих авторов, у тучных лиц имеется нарушение специфического динамического действия пищи, вероятно, вызванное снижением процессов термогенеза в коричневой жировой ткани. Малая физическая активность или отсутствие адекватной физической нагрузки, создавая в организме избыток энергии, также способствуют увеличению массы тела. Несомненна роль наследственно-конституциональной предрасположенности: статистические данные свидетельствуют о том, что ожирение у детей худых родителей развивается примерно в 14 % случаев по сравнению с 80 %, когда оба родителя имеют избыточную массу тела. Причем ожирение возникает не обязательно с детства, вероятность его развития сохраняется на протяжении всей жизни.
Для возникновения ожирения установлено значение возрастных, половых, профессиональных факторов, некоторых физиологических состояний организма – беременности, лактации, климакса. Ожирение чаще развивается после 40 лет, преимущественно у женщин.
Согласно современным представлениям, при всех формах ожирения имеются нарушения центральных механизмов регуляции, изменяющие поведенческие реакции, особенно пищевое поведение, и обусловливающие нейрогормональные сдвиги в организме. В гипоталамусе, главным образом в области паравентрикулярных ядер и латеральной перифорникальной, происходит интеграция множества импульсов, поступающих из коры головного мозга, подкорковых образований, по симпатической и парасимпатической нервной системе, гормональных и метаболических. Нарушение любого звена этого регуляторного механизма может привести к изменениям потребления пищи, отложения и мобилизации жира и в конечном итоге к развитию ожирения.
Важное значение в формировании пищевого поведения имеют пептиды желудочно-кишечного тракта (холецистокинин, субстанция Р, опиоиды, соматостатин, глюкагон), являющиеся периферическими медиаторами насыщения, а также нейропептиды и моноамины центральной нервной системы. Последние влияют на количество потребляемой пищи, продолжительность еды, определяют пищевые наклонности. Одни (опиоидные пептиды, нейропептид Y, рилизинг-фактор гормона роста, норадреналин, у-аминомасляная кислота и т. д.) увеличивают, другие (холецистокинин, кортикотропин-рилизинг фактор, допамин, серотонин) снижают потребление пищи. Однако конечный результат их воздействия на пищевое поведение зависит от их концентрации, взаимодействия и взаимовлияния в определенных участках центральной нервной системы.
Важной составляющей механизмов патогенеза ожирения и его осложнений является сама жировая ткань. Как показано в последние годы, она обладает эндо-, ауто- и паракринной функциями. Вещества, выделяемые жировой тканью (лептин, фактор некроза опухолей А, ангиотензиноген, ингибитор активатора плазминогена 1 и др.) обладают разнообразным биологическим действием и могут влиять на активность метаболических процессов в тканях и различных системах организма либо непосредственно, либо опосредованно через нейроэндокринную систему, взаимодействуя с гормонами гипофиза, катехоламинами, инсулином. Особое значение в регуляции пищевого поведения, энерготрат организма и регуляции нейроэндокринной системы играет адипостатический гормон лептин – продукт овгена. Предполагается, что основное действие лептина направлено на сохранение жировых запасов. Ожирение характеризуется гиперлептинемиеи, являющейся, как предполагают, следствием резистентности к его действию.
Большую роль в развитии ожирения и его осложнений играет эндокринная система.
Поджелудочная железа. Одним из ведущих звеньев патогенеза ожирения и его осложнений является изменение секреции инсулина. Характерна гиперинсулинемия, сочетающаяся с нормальным или превышающим норму уровнем глюкозы в крови. Уже при ожирении I степени проведение глюкозо-толерантного теста выявляет гиперреакцию инсулина на введение глюкозы. С нарастанием степени ожирения его базальный уровень у большинства больных становится высоким и при ожирении III-IV степени может значительно превышать таковой у здоровых, а введение глюкозы или других инсулинотропных стимуляторов (аргинина, лейцина) способствует выявлению неадекватной реакции бета-клеток поджелудочной железы, выражающейся как в чрезмерном повышении, так и в снижении по сравнению с нормой секреции инсулина в ответ на стимуляцию. У больных с длительно существующим массивным ожирением увеличивается частота развития сахарного диабета. Одновременно с высоким содержанием инсулина в крови показатели гликемии не только не снижены, а нормальны или зачастую повышены, что позволяет предположить снижение эффективности действия эндогенного инсулина.
Непосредственные причины, приводящие к увеличению секреции инсулина и резистентности к его действию у больных с избыточной массой тела, к настоящему времени недостаточно выяснены. В генезе гиперинсулинемии при ожирении имеют значение инсулинорезистентность, нарушения гипоталамической регуляции, реализуемые через симпатическую и парасимпатическую нервную систему, опиоидные пептиды, желудочно-кишечные гормоны, в частности желудочный тормозящий полипептид, особенности питания.
В основе инсулинорезистентности лежит снижение чувствительности к инсулину на всех изучаемых метаболических путях, начиная со связывания его рецепторами. Предполагают, что при ожирении уменьшается число рецепторов к инсулину на поверхности эффекторных клеток, приводящее к снижению связывания и тем самым уменьшению специфического эффекта этого гормона.
Пострецепторный дефект действия инсулина, по мнению ряда авторов, развивается при длительном существовании ожирения. Инсулинорезистентность способствует развитию компенсаторной гиперинсулинемии, приводящей к дальнейшему снижению чувствительности периферических тканей к действию инсулина.
Глюкагон существенного значения в патогенезе вышеуказанных отклонений не имеет. Согласно данным литературы, секреция его не нарушена у больных с ожирением различной степени и длительности.
Соматотропная функция гипофиза при ожирении играет большую роль. Ее нарушение, несомненно, имеет значение в патогенезе возникновения, развития и поддержания избыточной массы тела. Показано, что при ожирении I-II степени базальная секреция соматотропина не изменена, реакция на инсулиновую гипогликемию снижена. С увеличением массы тела наблюдается снижение базальной секреции и отсутствие повышения уровня соматотропина ночью, реакция на введение L-дофа и рилизинг-фактор гормона роста значительно ниже нормы. Предполагается участие повышенной секреции соматостатина и нарушений допаминергической регуляции в генезе выявляемых нарушений образования соматотропина.
Гипоталамо-гипофизарно-половая система. Известно, что при ожирении нарушения менструальной и детородной функции у женщин и половой – у мужчин весьма часты.
В их основе лежат как изменения центральных регулирующих механизмов, так и изменения метаболизма половых стероидов на периферии, в частности в жировой ткани. Ожирение влияет как на сроки появления menarche, так и на дальнейшее становление менструальной функции. Для его появления и нормальной циклической деятельности яичников немаловажное значение имеет масса жировой ткани в организме. Согласно гипотезе Frisch-Rovelle, menarche наступает тогда, когда масса тела достигает так называемой критической массы, которая составляет 48 кг (жировая ткань – 22 %). Так как полные девочки растут быстрее и «критическую» массу набирают в более раннем периоде, менструации у них начинаются значительно раньше, хотя часто долго не устанавливаются и в дальнейшем нередко носят нерегулярный характер. Ожирение, возможно, обусловливает большую частоту бесплодия, вероятность развития поликистозных яичников и более раннее наступление менопаузы. Результаты изучения секреции гонадотропных гормонов в течение цикла у женщин с ожирением не выявляют каких-либо особенностей. Имеются сообщения о некотором снижении секреции ФСГ в фолликулиновую фазу цикла и низком предовуляторном подъеме ЛГ. Базальная секреция пролактина при ожирении не отличается от таковой у здоровых женщин, однако у большинства больных реакция пролактина на различные фармакологические стимулы (инсулиновую гипогликемию, тиролиберин, блокатор допаминовых рецепторов – сульпирид) снижена. Обнаружены выраженные индивидуальные различия на реакций гонадотропинов на стимуляцию люлиберином. Выявляемые нарушения свидетельствуют о дисфункции гипоталамо-гипофизарной системы при данной патологии. Большое значение в развитии половых расстройств при ожирении имеет периферический метаболизм эстрогенов и андрогенов и их связывание с белками плазмы. В жировой ткани, вероятно, в ее стромальных элементах происходит ускорение ароматизации андрогенов, в частности тестостерона и андростендион в эстрадиол и эстрон, соответственно приводящее к гиперэстрогении, способствующей возникновению маточных кровотечений. У некоторых больных может наблюдаться гиперандрогения, обусловленная как нарушениями стероидогенеза в яичниках, так и увеличением продукции андрогенов надпочечниками. Однако если увеличение продукции последних компенсируется ускорением скорости их метаболизма, то симптомы гиперандрогении у женщин могут отсутствовать. Отмечается изменение коэффициента андрогены/эстрогены в сторону его уменьшения. Имеются указания на взаимосвязь между характером распределения жира и данным показателем. Предполагается существование регионарной чувствительности адипоцитов к стероидам, преобладание андрогенов сочетается с увеличением адипоцитов преимущественно в верхней половине туловища. У части женщин с ожирением наблюдается неадекватная продукция прогестерона в лютеиновую фазу цикла, что может являться причиной снижения их фертильности. Кроме того, возможно развитие синдрома поликистозных яичников (вторичный склерокистоз яичников) с клиническими признаками гиперандрогении. Большую роль в развитии этих нарушений играют гипоталамо-гипофизарная дисфункция и нарушение периферического метаболизма половых стероидов в стромальных клетках жировой ткани.
У мужчин с избыточной массой тела выявляется низкий уровень тестостерона в плазме при отсутствии клинических признаков гипоандрогении, видимо, вследствие увеличения свободной фракции гормона. Усилено периферическое превращение тестостерона в эстрадиол и андростендиона в эстрон, нередко способствующее развитию гинекомастии. В некоторых случаях наблюдается снижение секреции лютропина и соответственно тестостерона с умеренно выраженными клиническими симптомами гипогонадотропного гипогонадизма как следствие торможения механизма обратной связи секреции гонадотропинов повышенным уровнем эстрогенов.
Гипоталамо-гипофизарно-надпочечниковая система. У больных с ожирением III-IV степени нередко выявляются нарушения суточного ритма секреции кортикотропина и кортизола. При этом, как правило, в утренние часы – нормальные уровни АКТГ и кортизола в плазме, в вечерние – низкие или превышающие норму. Реакция кортикотропина и кортизола на инсулиновую гипогликемию может быть нормальной, повышенной или сниженной. Для больных с ожирением, возникшим в детском возрасте, характерно нарушение механизмов обратной связи, выявляемое при изучении чувствительности гипоталамо-гипофизарной системы к дексаметазону, введенному в различное время суток (утром и ночью). У большого числа больных (особенно с ожирением III-IV степени) увеличена скорость продукции кортизола, ускорен его метаболизм, повышена экскреция 17-оксикортикостероидов с мочой. Уровень же кортизола в плазме остается в норме, так как повышение скорости метаболического клиренса кортизола приводит к уменьшению его содержания в плазме и через механизм обратной связи стимулирует секрецию АКТГ. В свою очередь повышение скорости секреции АКТГ ведет к увеличению продукции кортизола, и таким образом его уровень в плазме поддерживается в нормальных пределах. Повышение секреции кортикотропина обусловливает также ускорение продукции андрогенов надпочечниками.
Изучение метаболизма кортизола в опытах in vitro в жировой ткани показало, что ткань способна окислять кортизол в кортизон. В связи с тем что последний в меньшей степени подавляет секрецию кортикотропина, это также может стимулировать секрецию кортизола.
Гипоталамо-гипофизарно-тиреоидная система. Изучению функционального состояния щитовидной железы посвящены исследования многих авторов в связи с тем, что тиреоидные гормоны имеют большое значение в регуляции жирового обмена и в связи с дискутируемым до сих пор вопросом о возможности применения тиреоидных гормонов с лечебной целью при ожирении. Показано, что в начальных стадиях заболевания секреция тиреотропина, базальная и стимулированная тиреолиберином, остается в пределах нормы. И лишь при ожирении III-IV степени у ряда больных отмечается снижение реакции тиреотропина на тиреолиберин. В некоторых случаях падает и базальный уровень тиреотропного гормона в плазме.
Как правило, у большинства больных с избыточной массой тела не наблюдается изменений в содержании общих и свободных фракций тиреоидных гормонов. Характер питания в значительной мере определяет содержание тироксина (Т4) и трийодтиронина (Т3) в плазме и их соотношения. Общий калораж пищи, а также соотношение углеводов, белков и жиров являются важными параметрами, определяющими уровни Т4, Т3 и RT3 в крови. Обнаруживаемые изменения содержания тиреоидных гормонов в крови в зависимости от количества принимаемой пищи (особенно углеводов), по-видимому, являются компенсаторными и направлены на поддержание стабильности массы тела. К примеру, переедание приводит к ускорению периферического превращения Т4 в Т3, повышению Т3 в крови, а при голодании отмечается снижение уровня Т3 и увеличение Т4 в крови.
Некоторые авторы отмечают изменение чувствительности периферических тканей (наличие резистентности) к тиреоидным гормонам вследствие уменьшения рецепторных мест. Сообщается также о нарушении в некоторых случаях связывания Т4 тироксинсвязывающим глобулином, усилении распада Т4, приводящих к снижению содержания тироксина и соответственно трийодтиронина в тканях, развитию относительной тиреоидной недостаточности и появлению клинических признаков гипотиреоза у таких больных.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]
Источник
