Синдром лея подострая некротизирующая энцефалопатия
Каждая клетка организма человека, за малым исключением, содержит сотни митохондрий – вероятных древних прокариотических симбионтов, сохранивших собственный автономный генетический аппарат – митохондриальную ДНК (мтДНК). Одной из жизненно важных функций митохондрий является процесс производства внутриклеточной энергии – окислительное фосфорилирование – реализуемый на ферментных комплексах дыхательной цепи органелл, которые осуществляют транспорт электронов от NАDН и других субстратов к убихинону, сопряженный с экспортом протонов из матрикса в межмембранное пространство органелл.
Реверсивный поток электронов и протонов создает электрохимический градиент на внутренней митохондриальной мембране, необходимый для инициации синтеза АТФ. Незначительная, однако, едва ли не самая важная в функциональном отношении часть субъединиц дыхательных ферментов транслируется на генах мтДНК. Мутации мтДНК могут приводить к функциональному дефекту активности дыхательной цепи и служить причиной развития тяжелых неврологических нарушений неонатального и раннего детского возраста, часто манифестирующих синдромом энцефалопатии Ли.
Болезнь Ли (D. Leigh, современный английский невролог) – редкое прогрессирующее заболевание центральной нервной системы, проявляющееся в раннем детском возрасте и характеризующееся симптомами поражения серого вещества головного и спинного мозга.
В основе болезни лежит генетически детерминированное нарушение обмена тиамина, наследуемое чаще по аутосомно-рецессивному типу. Вследствие нарушения превращения тиаминпирофосфата в тиаминтрифосфат снижается содержание тиамина во многих отделах центральной нервной системы – в стволе мозга, базальных ганглиях, мозжечке, спинном мозге. В печени определяется дефицит пируваткарбоксилазы, что приводит к накоплению пирувата и лактата и нарушениям в цикле трикарбоновых кислот.
Морфологические изменения в нервной системе характеризуются поражением серого вещества ствола мозга, базальных ганглиев, четверохолмия, таламуса, мозжечка, спинного мозга. Патология нейронов варьирует от острого клеточного отека до полного хроматолиза. Выраженная пролиферация астроцитов, микроглии, эндотелия сосудов обнаруживается не только в сером, но и в белом веществе.
Возраст начала заболевания варьирует от 1 недели до 2 лет. К типичным начальным проявлениям относятся задержка темпа психомоторного развития, дыхательные нарушения по типу диспноэ, тахипноэ, апноэ, дыхания Чейна – Стокса. Дети становятся вялыми, сонливыми, снижается мышечный тонус, расстраивается координация движений, появляется тремор конечностей, усиливающийся при возбуждении и целенаправленных движениях. По мере течения заболевания гипотония мышц может сменяться их спастичностью, утрачиваются двигательные навыки, появляются миоклонические подергивания мышц. Сухожильные рефлексы снижены или повышены. Характерны различные зрительные и глазодвигательные расстройства: нарушение цветовосприятия, снижение зрения, вплоть до слепоты, атрофия зрительного нерва, нистагм, офтальмоплегия, дискоординированные движения глазных яблок, косоглазие, нарушение реакции зрачков на свет, миоз, мидриаз. Могут наблюдаться судороги, глухота, парезы конечностей вследствие поражения периферических нервов. Наряду с этим отмечаются расстройства функции печени, сопровождающиеся снижением аппетита, рвотой, потерей массы тела. У некоторых больных развивается кардиомиопатия.
Примерно у 30% больных в цереброспинальной жидкости обнаруживают увеличение содержания белка и невысокий плеоцитоз лимфоцитарного характера. На ЭКГ выявляют преобладание неспецифической медленноволновой активности. Прогноз неблагоприятный. Продолжительность болезни до 2 лет. Лечение не разработано.
Диагноз в амбулаторных условиях затруднен. Предположительный диагноз ставят на основании прогрессирующего нарастания неврологических расстройств, указывающих на избирательное поражение серого вещества головного и спинного мозга и наличия повторных случаев заболевания в семье. Дифференциальный диагноз проводят с амавротической идиотией, лейкодистрофиями, миоклонус-эпилепсией, энцефаломиелитом инфекционно-аллергического генеза. Исключительная зависимость органов и тканей от системы синтеза АТФ частично объясняет полиморфизм клинических проявлений, характерный для митохондриальных заболеваний, особенно у детей.
Обилие клинических синдромов наряду с ограниченностью использования генетического скрининга представляет основную причину затруднений диагностики этих состояний в клинике. Кроме того, значительная часть случаев может быть представлена редкими и новыми генетическими дефектами сомнительной значимости, что еще больше ограничивает возможности молекулярно-генетической верификации клинического диагноза митохондриопатий.
Клиническое наблюдение синдрома Ли
В данной статье приведено клиническое наблюдение случая летального синдрома Ли, манифестировавшего задержкой темпа физического и психомоторного развития, нарастанием мозжечковой недостаточности, наружной офтальмоплегии в результате симметричного поражения ствола головного мозга, вызванного мутацией в гене SURF1. Относительная редкость митохондриопатий в клинической практике и малая известность этой нозологической группы в целом, а также типичная клиническая манифестация синдрома в представленном наблюдении представляют интерес для широкого круга невропатологов, педиатров и медицинских генетиков.
Больная Е. 2006 года рождения, от 3-й беременности, протекавшей на фоне ОРВИ в 11-12 недель беременности, хронической ФПН в 36 недель, herpes labialis в последнем триместре беременности. Роды 2-е срочные, без особенностей, оценка по Апгар 8/9 баллов. Маловесная к сроку гестации, вес при рождении 2750 г. Выписана из роддома на 7-е сутки. Голову удерживает с 3-х месяцев, сидит с 8-ми месяцев, не ходит.
До болезни охотно ползала, стояла, переступала у опоры. В физическом развитии стала отставать с 6 месяцев, в двигательном – с 1 года. На первом году жизни обследовалась в гастроэнтерологическом отделении, выставлен д-з: «Целиакия. Гипостатура». Осмотрена генетиком в медикогенетическом центре – генетической патологии на момент осмотра не выявлено. В возрасте 1 года обследована на гормональный статус, выявлено повышение уровня кортизола в 1,5 раза. Старший сибс пробанда (брат), от первого брака матери, здоров и его психофизическое развитие соответствует возрасту. Родители ребенка здоровы. Двоюродный дядя отца болел рассеянным склерозом (заболел в 27 лет, умер через 5 лет от начала заболевания).
Манифестация настоящего заболевания была в возрасте 1,5 лет, в период реконвалесценции после ОРВИ, возникли жалобы на отсутствие опоры на правую ножку, шаткость в положении сидя и стоя, нарушение координации в руках. Вышеизложенные жалобы появились через 2 недели после перенесенной ОРВИ, с тенденцией к нарастанию в течение последующей недели, по поводу чего ребенок поступил в стационар.
Состояние при поступлении средней степени тяжести. В сознании, контакту доступна, сопротивляется осмотру. Обращенную речь понимает, выполняет простые инструкции. Сидит самостоятельно неуверенно, не ходит. В вертикальном положении тела, при поддержке, отсутствует опора на правую ножку. Со стороны ЧН: выявляется крупноразмашистый горизонтальный и вертикальный нистагм с ротаторным компонентом, усиливающийся в крайних отведениях глазных яблок; легкое ограничение подвижности глазных яблок кнаружи, 2-сторонний экзофтальм.
Мышечный тонус диффузно снижен. Глубокие рефлексы оживлены, без убедительной разницы. Вызываются патологические рефлексы – Якобсона-Ласка и Бабинского справа. В позе Ромберга не стоит. Предметы берет неуверенно. Интенционный тремор в руках и ногах. Менингеальные симптомы отрицательные. В анализе ликвора: цитоз 6/3, белок 0,55 г/л. В протеинограмме – гипогаммаглобулинемия (7,31 при N-13-22). В общем анализе крови – анемия легкой степени тяжести (Hb – 112 г/л).
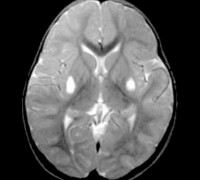
На МРТ головного мозга было выявлено воспалительное поражение с локализацией в области таламуса, базальных ганглиях, в стволе головного мозга с 2-х сторон, где выявлены очаги повышенного сигнала в режиме Т2 и сниженного в режиме Т1 с достаточно четкими неровными контурами вытянутой формы. МРТ головного мозга через 2 недели без существенной динамики.
На основании полученных данных выставлен клинический диагноз: «Вирусный энцефалит неуточненной этиологии. Минимальная церебральная дисфункция с атонически-астатическим синдромом, задержкой моторного развития. Гипостатура. Демиелинизирующее заболевание головного мозга?»
На фоне проведенного лечения – антибактериальная терапия (цефтриаксон), противогрибковые препараты (дифлюкан, флуконазол), противовирусные (зовиракс), гормрны (дексаметазон), нейротропные препараты (пирацетам, нейромидин), метаболическая терапия (вит С, Е, тиамин, L-карнитин), диуретики (фуросемид), кардио — А Б В.
В стволе головного мозга, распространяясь от продолговатого (А) до среднего мозга (Б), в области подкорковых ядер (В), симметрично с двух сторон визуализируются участки повышенного сигнала в режиме Т2, сниженного в режиме Т1 с достаточно четкими неровными контурами, вытянутой формы. Отдельные очаги имеют повышенный сигнал в режиме DW. Структура мозжечка обычная. Субарахноидальное пространство и боковые желудочки не расширены метаболические препараты (милдронат), сосудистые препараты (актовегин, эмоксипин), иммуномодулирующие средства (гамма ВВ), муколитики (амброксол, флуимуцил), ферменты (креон), эубиотики (бифиформ, линекс) отмечена положительная динамика: девочка стала эмоционально активнее, увереннее сидеть, ползать, стоять у опоры, переступать, менее выражены нистагм и атаксия в положении стоя (при поддержке).
Учитывая наличие у ребенка дизрафического статуса, гипертрихоза, гипостатуры, задержки физического и моторного развития, отягощенной наследственности по рассеянному склерозу, постепенно нарастающей неврологической симптоматики и картины МРТ головного мозга, направлена на консультацию в медико-генетический центр, с целью исключения дебюта наследственного демиелинизирующего заболевания головного мозга, где был заподозрен синдром Корнелии де Ланге. Далее, с целью уточнения диагноза, в медико-генетическом научном центре, в лаборатории наследственных болезней обмена веществ проведена ДНК-диагностика, выявившая частые мутации в гене SURF1, на основании чего выставлен заключительный диагноз: Подострая некротизирующая энцефаломиопатия (синдром Ли) – наследственная митохондриальная патология.
Спустя 3 месяца больная поступила повторно в клинику в связи с ухудшением в неврологическом статусе – начала утрачивать приобретенные ранее навыки, и в соматическом – снижение массы тела, слабость, субфебрилитет. Состояние при поступлении средней степени тяжести. На фоне сохраненного сознания и эмоциональной вялости, отмечались выраженная статическая и динамическая атаксия, мышечная диффузная гипотония, глазодвигательные нарушения. Рентгенологически выявлена острая двусторонняя очаговая пневмония. Выписана из неврологического отделения через месяц без существенной положительной динамики в неврологическом статусе, под динамическое наблюдение участкового педиатра и невропатолога.
Следующая госпитализация ребенка через 4,5 месяца в реанимационное отделение с жалобами на одышку, приступы задержки дыхания, тремор, цианоз носогубного треугольника, отказ от еды, регресс приобретенных ранее навыков, повышение температуры. При поступлении отмечается отрицательная динамика в неврологическом статусе: регресс психических функций, не сидит, не стоит, голову не удерживает, спонтанный крупноразмашистый нистагм, наружная офтальмоплегия, выраженная мышечная гипотония, атаксия, тремор в конечностях, дыхательные нарушения по типу диспноэ. Рентгенологически выявлена картина острой двухсторонней очаговой пневмонии.
За время пребывания в отделении реанимации проведено следующее лечение: антибактериальная терапия (цефтриаксон), нейротропные препараты (пирацетам, нейромидин), метаболическая терапия (вит Е, тиамин, L-карнитин), диуретики (фуросемид), кардиометаболические препараты (милдронат), сосудистые препараты (актовегин), муколитики (амброксол), ферменты (креон), эубиотики (линекс). Девочка получала также питание по 300 мл искусственной питательной смеси 4 раза в сутки через зонд.
Через 6 дней после поступления, несмотря на проводимое лечение, зарегистрирована смерть больной вследствие рекуррентной легочной инфекции и остановки дыхания. Патологоанатомический диагноз: Болезнь Ли, множественные симметричные глиальные рубцы, множественные мелкие кисты с зернистыми шарами, отек и участки колликвационного некроза, дистрофия глиальных клеток и множественные клетки-тени головного мозга.
Рассматривая приведенное наблюдение, можно отметить, что у пациентки с синдромом Ли была описана патогномоничная МРТ картина симметричности поражения ствола мозга с нарушением витальных функций, манифестацией заболевания после года, очаговой неврологической симптоматикой, задержкой темпов психофизического развития, при скудности спектра метаболических нарушений. Эти проявления послужили основанием заподозрить наследственное демиелинизирующее заболевание головного мозга и направить на проведение молекулярно-генетического скрининга, в результате чего были обнаружены частые мутаций в гене SURF1, характерные для наследственной митохондриальной патологи, на основании чего выставлен прижизненный диагноз: «Подострая некротизирующая энцефаломиелопатия (синдром Ли)».
Можно отметить нетипичный острый характер клинической манифестации заболевания в период реконвалесценции после ОРВИ, что определило трудности в диагностике заболевания, а также маскирование симптоматики эпизодами респираторных инфекций. С учетом наличия у больной очаговой прогрессирующей симптоматики, имевшей место нестойкой ремиссии с уменьшением выраженности неврологической симптоматики после назначения метаболической терапии, нельзя было исключить энцефалит. Однако исследования крови и ликвора не выявили признаков воспалительной реакции.
В практическом плане важным представляется также прогредиентный характер течения заболевания с рекуррентными эпизодами легочной инфекции и резким ухудшением состояния на их фоне. Не исключено, что неоднократно рецидивирующая инфекция являлась следствием нарушения иммунного статуса, что характерно для демиелинизирующих заболеваний.
Для митохондриопатий, вызванных мутациями мтДНК, характерен полиморфизм клинических проявлений. Однако во многих случаях удается проследить взаимосвязь специфического комплекса симптомов с характером специфического генетического дефекта. Все это предполагает специфичность экспрессии тех или иных мутаций в патогенезе митохондриопатий, объясняя прогностическую ценность и важность генетической диагностики.
Источник
Синдром Ли – генетически гетерогенное наследственное заболевание, характеризующееся разнообразными нарушениями метаболизма и формирования компонентов центральной нервной системы. Симптомы этой патологии, как правило, проявляются еще в раннем детстве, к ним относят мышечную гипотонию, проблемы со вскармливанием и задержку психомоторного развития. При дальнейшем прогрессировании заболевания возникают эпилептические припадки, гиперкинезы, дыхательные расстройства. Диагностика синдрома Ли осуществляется на основании данных настоящего статуса больного, магнитно-резонансной томографии, молекулярно-генетических анализов. Специфического лечения данной патологии не существует, симптоматическая терапия лишь незначительно замедляет прогрессирование заболевания.
Общие сведения
Синдром Ли (подострая некротизирующая энцефаломиелопатия) – наследственное нейродегенеративное заболевание центральной нервной системы, которое характеризуется ранним началом и неуклонным прогрессированием неврологических нарушений. Впервые данное состояние было описано в 1951 году английским психиатром Денисом Ли, который определил его как наследственный вариант энцефаломиелопатии. Дальнейшие исследования показали, что синдром Ли является крайне гетерогенным состоянием с точки зрения этиологии – его причиной становятся дефекты множества генов, расположенных на аутосомах, Х-хромосоме и митохондриальной ДНК. По этой причине механизм наследования заболевания может быть (в зависимости от характера мутации) аутосомно-рецессивным, сцепленным с полом или митохондриальным. Из-за разнообразия генетических дефектов, являющихся причиной синдрома Ли, различается и половое распределение этого состояния, однако, по мнению многих врачей-генетиков, в целом можно считать, что оно в равной степени поражает как мальчиков, так и девочек. Встречаемость составляет ориентировочно 1 случай на 34-36 тысяч новорожденных.

Синдром Ли
Причины и классификация синдрома Ли
Причинами развития синдрома Ли могут выступать мутации широкого спектра генов, расположенных на разных хромосомах. Однако патогенез этого состояния примерно сходен у различных форм патологии и чаще всего связан с нарушением процессов клеточного дыхания и функционирования дыхательной цепи митохондрий. В отношении некоторых форм синдрома Ли также замечено нарушение функционирования пируватдегидрогеназного комплекса. Нарушение структуры белков дыхательной цепи митохондрий приводит к недостаточному синтезу АТФ, являющемуся основным источником энергии во всех клетках организма. Нейроны и клетки нейроглии особенно чувствительны к недостатку энергии, что становится причиной развития разнообразных нарушений еще с детского возраста. Классификация всех генетических дефектов при синдроме Ли основана на том, какой компонент дыхательной цепи (представляющей собой белковый комплекс) митохондрий нарушен в результате мутации.
- Синдром Ли, обусловленный поражением комплекса 1 (НАДН-KoQ-редуктаза). Этот вариант может наследоваться как аутосомно-рецессивно, так и митохондриально. Наиболее распространенные варианты заболевания этого типа обусловлены мутациями ядерных генов NDUFA10 (расположен на 19-й хромосоме), NDUFS4 и DUFAF2 (5-я хромосома), NDUFS3 (11-я хромосома). Кроме того, к развитию синдрома Ли в результате поражения митохондриального комплекса 1 способны приводить дефекты митохондриальной ДНК – генов MTND1, MTND2 и MTND3. Результатом этого является нарушение начального этапа переноса электронов и водорода в дыхательной цепи, что снижает синтез АТФ.
- Синдром Ли, вызванный дефектами белков, входящих в митохондриальный комплекс 2 (сукцинат-KoQ-редуктаза). Заболевание этого типа наследуется только аутосомно-рецессивно, достоверно удалось установить взаимосвязь между синдромом Ли и мутациями гена SDHA, локализованного на 5-й хромосоме. Данный ген кодирует субъединицу А сукцинатдегидрогеназного комплекса, при генетических нарушениях такого типа активность фермента снижается, что и ведет к развитию заболевания.
- Синдром Ли, возникающий в результате нарушения структуры белков митохондриального комплекса 3 (KoQН2-цитохром с-редуктаза). К этой разновидности относят наиболее распространенный вариант заболевания, вызванный мутацией гена BCS1L, расположенного на 2-й хромосоме. Развитие синдрома Ли обусловлено пониженной экспрессией фермента убихинон-с-редуктазы, входящего в состав митохондриального комплекса 3. Его выделение регулируется специфическим белком, который кодируется геном BCS1L – в результате мутации полученный дефектный протеин не способен полноценно выполнять свои функции. Для этого варианта синдрома Ли характерно аутосомно-рецессивное наследование.
- Синдром Ли, обусловленный повреждением митохондриального комплекса 4 (цитохром с-оксидаза). Может быть вызван как мутациями ядерных генов (COX10, SCO1), в основном расположенных на 17-й хромосоме, так и повреждением митохондриальной ДНК – это удалось выяснить по характеру наследования некоторых форм, однако ключевые гены пока не определены.
- Синдром Ли, вызванный нарушением структуры митохондриального комплекса 5 (АТФ-синтаза). К этому варианту относят сравнительно редкие мутации гена ATPAF2, локализованного на 17-й хромосоме. В результате мутации нарушается работа АТФ-синтазы, образование АТФ окислительным путем резко снижается.
В качестве отдельного варианта синдрома Ли часто указывают форму заболевания, обусловленную мутациями гена PDHA1, который расположен на Х-хромосоме. В результате наследование данного типа патологии является сцепленным с полом – болеют почти исключительно мальчики, тогда как женщины выступают носительницами патологических генов. Митохондриальный тип наследования синдрома Ли также имеет множество особенностей. Передача патологических генов происходит от матери к потомству и продолжается только по женской линии. Поскольку каждая митохондрия имеет собственную молекулу ДНК, в клетке одновременно присутствуют как «здоровые», так и «больные» органеллы, а при делении клеток (в том числе и при мейозе в процессе образования яйцеклеток) распределение больных генов оказывается неодинаковым. Женщины с относительно небольшим процентом «больных» митохондрий в клетках могут быть фенотипически здоровыми, но передавать их своему потомству. Невозможно точно предсказать, какое количество патологических митохондрий получит ребенок таких носителей, поэтому вероятность развития синдрома Ли у детей этих женщин неопределенная.
Симптомы
Проявления синдрома Ли обычно возникают на протяжении первого года жизни ребенка, иногда они могут регистрироваться в возрасте 2-5 лет, в редких случаях развитие заболевания начинается в подростковый период. Обычно первым проявлением патологии становится сонливость или, наоборот, повышенная возбудимость ребенка, у грудных детей наблюдается нарушение питания, недобор массы тела. В дальнейшем синдром Ли приводит к задержке психофизического развития, а у детей старшего возраста – к постепенной утрате уже обретенных навыков. Среди других неврологических симптомов заболевания наиболее часто отмечаются парезы, тремор конечностей, нарушение координации движения, поражение периферических нервов, снижение сухожильных рефлексов. В дальнейшем могут регистрироваться клонические судороги и эпилептические припадки.
Из-за недостатка энергии, обусловленного синдромом Ли, страдает не только нервная система, но и другие органы с высоким потреблением АТФ. В большинстве случаев у больных детей отмечается мышечная гипотония и слабость. Затрагивает заболевание и печень – орган с очень высоким потреблением энергии. У пациентов с синдромом Ли нередко выявляется увеличение печени, желтуха, иногда гепатолиенальный синдром. По мере прогрессирования патологии возникают нарушения дыхания – оно становится затрудненным, иногда приобретает характер дыхания Чейна-Стокса. У ряда больных со временем развивается миокардиодистрофия.
Синдром Ли имеет прогрессирующие течение. На терминальных этапах наблюдается поражение органов зрения, которое проявляется нистагмом, нарушением цветовосприятия, косоглазием. В конечном итоге может возникнуть атрофия зрительного нерва и полная слепота. Мышечная гипотония и гипорефлексия сменяются спастическим напряжением мышц и повышением сухожильных рефлексов. Через 2-7 лет после появления первых симптомов синдрома Ли происходит резкое падение массы тела, вышеперечисленные проявления резко усиливаются, наступает летальный исход по причине дыхательной или сердечно-сосудистой недостаточности.
Диагностика и лечение синдрома Ли
Для определения наличия синдрома Ли применяют магнитно-резонансную томографию головного мозга, электронейромиографию, изучение наследственного анамнеза, молекулярно-генетические анализы. При осмотре выявляют характерные неврологические симптомы, тремор конечностей, отставание в психофизическом развитии, у младенцев – недобор массы тела. На магнитно-резонансной томографии мозга обнаруживают симметричные изменения в области продолговатого мозга, таламуса и моста, иногда аналогичные изменения могут регистрироваться и в спинном мозге. Наилучшие результаты диагностики синдрома Ли при помощи МРТ получаются при использовании T2W и FLAIR режимов.
В тех случаях, когда имеются признаки поражения периферических нервов и мышц, для диагностики синдрома Ли выполняют электронейромиографию. При этом заболевании главным и наиболее частым результатом ЭНМР становится замедление скорости прохождения нервного импульса, которое свидетельствует о демиелинизации нервов. Изучение наследственного анамнеза информативно в случае аутосомно-рецессивных форм заболевания, при мутации генов митохондриальной ДНК четко определить семейный характер патологии затруднительно. Молекулярно-генетическая диагностика массово используется только в отношении некоторых форм синдрома Ли (обусловленных мутациями генов BCS1L, SURF1 и некоторых других).
Специфического лечения данной патологии не существует, применяется симптоматическая терапия: противосудорожные и ноотропные средства, препараты для улучшения мозгового кровообращения. Важную роль в лечении синдрома Ли играет назначение витаминов, служащих кофакторами ферментов дыхательной цепи митохондрий – В1, В6, Q10. Их регулярный прием позволяет несколько замедлить прогрессирование заболевания и уменьшить выраженность симптомов. Однако, несмотря на все предпринятые терапевтические меры, 80% больных умирает через 2-7 лет после регистрации первых проявлений патологии.
Прогноз и профилактика
Прогноз синдрома Ли крайне неблагоприятный, так как большинство больных умирает через несколько лет после возникновения заболевания. Симптоматическое лечение может несколько замедлить прогрессирование патологии и ослабить выраженность проявлений, однако полноценного улучшения оно не обеспечивает. В большинстве случаев еще за год-два до летального исхода наступает полная инвалидизация больного, обусловленная неврологическими, дыхательными и метаболическими нарушениями. Причиной смерти при синдроме Ли чаще всего становится сердечно-сосудистая или дыхательная недостаточность. Профилактика этого заболевания осуществляется в рамках медико-генетического консультирования родителей перед зачатием ребенка.
Источник
