Синдром множественных врожденных пороков развития

О множественных врожденных пороках развития (МВПР) говорят тогда, когда отмечается нарушение структуры и функционирования минимум двух органов или систем. Обычно такие изменения сильно отражаются на жизнедеятельности, нередко становятся причиной внутриутробной гибели плода или неонатальной смерти. Некоторые множественные врожденные пороки развития (МВПР) не сокращают продолжительность жизни, но снижают ее качество, требуют постоянного контроля со стороны специалистов или определенных условий содержания.
Причины множественных врожденных пороков развития
Все этиологические факторы МВПР можно разделить на две группы:
- эндогенные — включают в себя генные, геномные и хромосомные мутации, заболевания эндокринной системы, метаболические нарушения, возраст родителей;
- экзогенные — физические (травмы), химические (лекарственные препараты, промышленная и бытовая химия) и биологические (вирусы, бактерии) агенты.
Эти причины приводят к хромосомным, генным и геномным нарушениям, влияют на процессы клеточного и тканевого развития. Большое число множественных врожденных пороков (МВПР) отличаются типом наследования, патогенезом, клиническими проявлениями, прогнозом для пациента.
Примеры множественных врожденных пороков развития (МВПР)
- Синдром Дауна. Развивается в результате трисомии по 21-й хромосоме. Пациенты имеют характерные черты лица, страдают задержкой умственного и речевого развития, у них нередко выявляется мышечная гипотония, катаракта, пороки сердца. Средняя продолжительность жизни составляет около 50 лет.
- Синдром Эдвардса. Данная разновидность множественных врожденных пороков развития (МВПР) обусловлена трисомией по 18-й хромосоме. У пациентов выявляется нарушение строения черепа, отсутствие или сужение слухового прохода, широкая грудная клетка, пороки сердечно-сосудистой системы, гипоплазия мозжечка, слабый тонус мускулатуры, судороги, тяжелая умственная отсталость. Характеризуется высокой летальностью.
- Синдром Марфана. Возникает при мутации в гене, который кодирует образование фибриллина. Данное соединение входит в состав практически всех эластичных волокон, поэтому у пациентов отмечается патология опорно-двигательного аппарата, органов зрения, сосудов. При регулярном и правильном лечении продолжительность жизни не снижается.
Другие виды множественных врожденных пороков развития (МВПР) оказывают существенное влияние на жизнедеятельность человека. При этом лечение возможно только симптоматическое, так как изменить дефекты в генах или хромосомах невозможно.
Методы диагностики
Диагностика множественных врожденных пороков развития (МВПР) может осуществляться дородовыми и послеродовыми способами. В первом случае проводятся скрининговые исследования, которые включают в себя УЗИ плода и анализ крови на специфические белки. Такое сочетание позволяет выявить большое количество множественных врожденных пороков развития (МВПР). Врач также может назначать дополнительные методы диагностики: биопсию ворсин хориона и амниоцентез. В этом случае получают не кровь матери, а материал плода, который затем отправляют на генетическое исследование.
Послеродовые методики также подразумевают генетические тесты, которые позволяют выявлять мутации в генах или определять кариотип. Пройти такое исследование можно в медико-генетическом центре «Геномед».
Нажимая на кнопку получить консультацию, Вы соглашаетесь на обработку персональных данных
Источник
Полувековой практикой клинической генетики и цитогенетики доказано, что для большинства хромосомных болезней, обусловленных численными или структурными аномалиями хромосом, характерны множественные врожденные пороки развития (МВПР). Если среди всех врожденных пороков на долю хромосомного дисбаланса приходится около 6 % [534], то среди МВПР удельный вес хромосомных болезней может достигать 51 % [181]. Именно поэтому цитогенетические исследования являются ведущими при выяснении причин МВПР.
Между тем МВПР могут быть следствием не только хромосомных, но и генных мутаций, а также результатом воздействия различных тератогенов, либо сочетанным эффектом этих факторов. Общепринятой классификации нехромосомных синдромов МВПР не существует, и при их описании используются различные подходы. Отечественные синдромологи выделяют несколько групп нехромосомных МВПР [28, 97].
- Моногенные синдромы — многочисленная группа (40 % от всех нехромосомных синдромов), представленная как доминантными, так и аутосомно-рецессивными формами, в том числе Х-сцепленными.
- Синдромы с неуточненным типом наследования, к которым могут относиться и мультифакториальные болезни с полигенным наследственным компонентом.
- Синдромы, вызванные действием внешних факторов. Так, около 5 % МВПР обусловлено внутриутробными инфекциями и заболеваниями матери [534].
- Неклассифицированные комплексы МВПР (сочетание пороков, не выделенных в синдромы), которые представляют отдельную группу нехромосомных синдромов.
Если при хромосомных синдромах для диагностики достаточно анализа кариотипа, то цитогенетические исследования при других формах МВПР лишь отвергают хромосомную природу данного комплекса пороков развития, но не позволяют точно установить диагноз. Что касается диагностики нехромосомных синдромов, то за последние десятилетия на биологических моделях лабораторных животных достигнут значительный прогресс в понимании структуры и функций генов, ответственных за изолированные пороки у человека [894]. Определенные надежды вселяют успехи в изучении на экспериментальных объектах семейств генов SOX, HOX, PAX, которые принимают участие в регуляции раннего эмбрионального развития у млекопитающих (см. главу 11).
Как известно, большинство врожденных пороков развития, в том числе и МВПР, являются следствием новых мутаций. Так, с мутациями de novo связано более 90 % случаев хромосомных синдромов и свыше 80 % синдромов с аутосомно-доминантным типом наследования [31]. При этом фенотипическая гетерогенность характерна для всех МВПР, независимо от их этиологической причины.
Следует иметь в виду, что в клинической генетике врачам приходится иметь дело с уже сформировавшимися пороками и синдромами, то есть с конечными фенотипическими эффектами геномных, хромосомных и генных мутаций. Естественно ожидать, что более полная информация о контроле процессов онтогенеза может быть получена при исследовании особенностей фенотипического проявления мутаций на более ранних стадиях развития человека, то есть еще до рождения.
Цитогенетические исследования в эмбриогенезе представляют большой интерес еще и потому, что многие хромосомные нарушения у человека, летальные на ранних стадиях, уже не встречаются в более поздние сроки и у новорожденных (см. главу 5). Предполагалось, что сравнительные цитогенетические и патоморфологические исследования позволят выяснить роль хромосомного дисбаланса не только в эмбриональной гибели, но и в формировании врожденных пороков развития, как совместимых, так и несовместимых с жизнью.
70-е годы ХХ века были ознаменованы крупномасштабными исследованиями спонтанных абортусов человека. Патоморфологическому описанию были подвергнуты тысячи эмбрионов и зародышевых оболочек, у которых были выявлены практически все типы геномных мутаций и многие структурные хромосомные аберрации. Так, было показано, что хромосомный дисбаланс приводит к различным по характеру и выраженности патологическим изменениям — бласто-, эмбрио- и фетопатиям, которые проявляются на клеточном, тканевом и органи- зменном уровнях [77, 91, 93]. Эти исследования сыграли важную роль в понимании специфичности и неспецифичности пороков развития, в формировании представлений о клеточном синдроме как патоморфологической основе хромосомных болезней [46, 47, 93, 96].
Вместе с тем, уже первые исследования спонтанных абортов обнаружили безусловную ограниченность такого подхода, связанную с особенностями исследуемого материала. Главная трудность заключалась в дифференциации первичных нарушений морфогенеза от вторичных, посмертных изменений. Между тем такая дифференциация имеет принципиальное значение при определении стадии, на которой прекратилось развитие, и тех изменений, которые привели к этой остановке [47]. Аутолиз тканей абортусов создает также определенные трудности при культивировании клеток, полученных из абортивного материала [93]. Успешное кариотипирование обычными методами возможно только у 46 % спонтанных абортусов. Установить кариотип у остальных можно только на интерфазных клетках с использованием молекулярно-цитогенетических методов анализа [100]. Естественно, что по своей точности «интерфазная» цитогенетика значительно уступает стандартному метафазному анализу.
Реальные возможности прижизненного изучения эмбрионов человека с хромосомными аберрациями появились только с разработкой методов исследования плода с помощью ультразвукового сканирования в сочетании с их кариотипированием на образцах материала, полученных на разных стадиях внутриутробного развития.
За последнее десятилетие ультразвуковые исследования стали неотъемлемой частью обследования плода. Ультразвуковая диагностика применяется как в качестве рутинного клинического метода определения сроков беременности и жизнеспособности плода, так и для выявления различных аномалий развития. Следует отметить, что изначально УЗИ с целью выявления пороков развития у плода применяли, главным образом, во II триместре беременности [879].
В настоящее время разрешающая способность ультразвуковых приборов и большой опыт многих тысяч УЗ-исследований позволяет подробно анализировать фенотипические особенности плода и в I триместре беременности [152, 178].
Такие исследования очень быстро привели к формированию представлений об ультразвуковых маркерах хромосомных болезней (sonogram indicators). Термин УЗ-маркеры используется для обозначения отклонений биометрических параметров и анатомических структур, позволяющих предполагать наличие хромосомной болезни у плода [749]. Изначально к таким ультразвуковым маркерам (УЗМ) относили синдром ВЗРП, некоторые аномалии скелета и лицевого черепа. По мере накопления знаний и совершенствования техники число УЗМ, рекомендуемых для скрининговых УЗИ, постоянно пополняется. При этом прогностическая значимость для диагностики хромосомной патологии у плода каждого из УЗМ различна и зависит от срока беременности. Однако, если спектр выявляемых аномалий во втором триместре достаточно велик, то основными УЗМ хромосомных болезней у плода с 10-й по 14-ю недели беременности являются толщина воротникового пространства (ТВП) и состояние оссификации носовых костей, толщина и число сосудов пуповины, размеры нижней челюсти. Увеличение ТВП является ультразвуковым маркером не только хромосомных болезней, но и таких достаточно частых аномалий как пороки сердца и магистральных сосудов, лимфатической и мочевыделительной систем и некоторых других [133, 152].
Дальнейшее совершенствование УЗ-техники (цветное сканирование, допплерометрия, трехмерное изображение и пр.) значительно увеличивает возможности детального прижизненного анализа анатомии плода практически на любой стадии развития и даже позволяет получить ценную информацию о состоянии и функциях некоторых органов и систем плода в развитии. Не случайно на сегодняшний день именно ультразвуковое исследование является наиболее эффективным методом изучения фенотипа плода в норме и при патологии.
Вполне закономерна, хотя реально весьма уязвима, наметившаяся в последние годы тенденция постановки диагноза конкретного наследственного синдрома исключительно по результатам УЗИ [40, 152, 178]. Действительно, некоторые пороки развития органов и систем и/или транзиторные состояния, не соответствующие сроку развития, чаще встречаются у плодов с определенными хромосомными болезнями. Однако строгой специфичности УЗМ по отношению к хромосомной патологии у плода вообще и, тем более, патогномоничных для определенных хромосомных синдромов не выявлено. Синдромологический подход в УЗ-диагностике, равно как и в клинической генетике и патологической анатомии, позволяет зарегистрировать аномалию развития, в первую очередь — изолированные и множественные пороки, и с той или иной вероятностью заподозрить наличие хромосомной патологии. Очевидно, что постановка диагноза хромосомной патологии у плода реально возможна только путем его кариотипирования. Кроме того, следует учитывать, что у многих плодов с хромосомным дисбалансом пороки развития отсутствуют, а фенотипические признаки столь невыразительны, что вполне могут оказаться не зарегистрированными в качестве УЗМ. Наконец, разграничение эхографических признаков на ВПР и УЗМ хромосомных болезней, учитывая транзиторный характер не только многих УЗМ, но и некоторых пороков развития, коррекция которых осуществляется за счет компенсаторных механизмов в процессе дальнейшего внутриутробного развития, также неубедительно. На наш взгляд, термин УЗМ хромосомных болезней может быть использован применительно к любым отклонениям в развитии, в том числе и порокам, независимо от степени их тяжести. Исключениями из этого правила являются лишь некоторые, в основном, изолированные пороки развития (например, анэнцефалия или дефекты заращения нервной трубки), при которых хромосомные нарушения у плода являются случайными находками. Это утверждение отнюдь не противоречит факту существования пороков развития, включая МВПР, хромосомной и генной этиологии. Анализ мутаций в генах-регуляторах эмбрионального развития, роль которых в возникновении ВПР доказана на модельных объектах, обсуждается в качестве перспективного направления профилактики врожденной и наследственной патологии (см. главы 9 и 11). Следовательно, кариотипирование является способом дифференциальной диагностики хромосомных и нехромосомных ВПР.
Таким образом, существующие представления об аномалиях эмбрионального развития плодов с хромосомным дисбалансом основаны на информации, полученной преимущественно при изучении спонтанных абортусов или новорожденных с МВПР Инвазивные методы позволяют провести пренатальное кариотипирование практически на любом сроке беременности (см. главу 9). При помощи УЗ-сканирования, ставшего неотъемлемой частью комплексных исследований состояния плода человека в рамках пренатальной диагностики, могут быть получены сведения об анатомических и функциональных особенностях развивающегося плода. Прижизненные особенности развития, дополненные патоморфологическими исследованиями абортного материала, который не подвергся аутолизу, помогают воссоздать картину фенотипического проявления хромосомного дисбаланса на разных сроках развития. Между тем, данные УЗ- и патоморфологического исследований, как правило, разрозненны, нередко противоречивы. Учитывая эти обстоятельства, очевидно, что полная информация может быть получена при тесном союзе специалистов по клинической генетике, ультразвуковой диагностике, патологической анатомии и физиологии. Возможно, такой альянс окажется продуктивным для решения целого ряда актуальных задач генетики развития. Так, до сих пор дискуссионным остается патогенез многих ВПР, не изучена динамика их формирования. Неясными остаются генез сочетанных пороков при возникновении достаточно устойчивых комплексов МВПР, их роль в реализации хромосомных эмбриолета- лей, в том числе крайне низкой жизнеспособности плодов с полным или мозаичным вариантом синдрома Шерешевского-Тернера и т. д.
Следует отметить, что такой комплексный анализ, включающий прижизненное фенотипирование плодов с хромосомными аномалиями, позволяет получить новую информацию, важную как для фундаментальной науки, так и для практической медицины. С одной стороны, выяснение взаимосвязи между дисбалансом отдельных хромосом или их сегментов и отклонениями в развитии плода способствует пониманию роли структурных и регуляторных генов в процессах раннего онтогенеза человека. С другой — выявление пороков или УЗМ у плода после кариотипирования позволяет оценить информативность изолированных и сочетанных УЗМ в качестве маркеров хромосомной патологии, что способствует повышению эффективности пренатальной диагностики.
Рассмотрение принципов патоморфологического анализа с целью точной диагностики ВПР выходит за рамки настоящей главы. Мы не касаемся также возможностей и эффективности ультразвуковой диагностики, подробно рассмотренных в специальной литературе [40, 133,152, 153, 178]. Отметим, однако, что не только срок беременности и уровень УЗ-обследования, но и квалификация врача УЗД существенно влияют на частоту и характер выявленных фенотипических признаков (маркеров), а знание эмбриологии человека и основ медицинской генетики — на своевременность и эффективность инвазивной пренатальной диагностики хромосомных болезней, более детально рассмотренной в главе 9.
Источник
Отделение интенсивной терапии новорожденных является местом, где часто приходится быстро принимать решение. Лечение многих расстройств одинаково и не зависит от причин, их вызвавших. Однако при лечении новорожденных с множественными врожденными пороками развития (синдромы МПР) неонатологу приходится сталкиваться со сложными клиническими вопросами, требующими глубоких знаний и достаточного опыта в диагностике заболеваний. При неправильной диагностике синдрома МПР потенциально эффективные методы лечения могут не использоваться и, напротив, могут применяться методы терапии относительно неэффективные. Более того, может быть дана неправильная оценка в отношении прогноза и риска рецидива.
Лишь несколько синдромов МПР угрожают жизни ребенка в неонатальном периоде. Однако важно отметить, что среди причин смерти в этот критический период жизни пороки развития занимают второе место после недоношенности.
I. Клиническая картина. Ниже перечислены симптомы и признаки, которые должны заставить врача заподозрить криптогенные аномалии и расстройства. Совершенно очевидно, что при наличии явных пороков развития синдром МПР будет немедленно распознан, вслед за чем последуют диагностические мероприятия. Однако, если внешние проявления заболевания выражены минимально или неспецифичны и уже начаты традиционные методы интенсивной терапии новорожденного, порок развития может остаться нераспознанным. Каждый из перечисленных ниже признаков наиболее характерен для новорожденных с синдромами MПР.
II. Общий диагностический подход. Общий подход к диагностике пороков развития у новорожденных не отличается от такового у детей старшего возраста, за исключением необходимости учитывать влияние родов и избыточное развитие жировой клетчатки у младенцев. Поскольку многие из этих новорожденных интубированы и на глазах у них защитная повязка, очень трудно заметить изменения лица. Необходимо рано и точно описать внешность ребенка, сделать фотоснимки. Если новорожденный находится в критическом состоянии, объективные диагностические тесты (генетические исследования, ультразвуковое исследование почек и сердца) приобретают особую значимость в выборе тактики лечения. В основе диагностики синдромов МПР у новорожденного лежит знание синдромов, наиболее часто встречающихся в неонатальном периоде плюс документирование их внешних проявлений и выполнение необходимых диагностических тестов, таких как хромосомный анализ. Такой подход необходим, так как большой процент детей с синдромами МПР умирают в неонатальном периоде, часто раньше, чем поставлен диагноз, а родители в таких случаях обычно отказываются разрешить вскрытие. Проблемы диагностики возникают также в связи с тем, что немедленно предпринимаются усилия по проведению интенсивной терапии. Тем не менее установление диагноза позволяет лечить ребенка более эффективно и целенаправленно. Если у вас есть возможность пригласить на консультацию генетика-клинициста или специалиста по врожденным аномалиям развития, попросите их осмотреть ребенка как можно раньше после рождения. Если такой возможности нет, помощь может оказать консультация по телефону с экспертом в этой области из специализированного медицинского центра.
III. Хромосомные синдромы. Хромосомные синдромы встречаются намного чаще других синдромов МПР, диагностируемых в неонатальном периоде.
A. Трисомия 21 (синдром Дауна)
1. Частота. Трисомия 21 — наиболее частый синдром МПР, встречающийся приблизительно у 1 ребенка из 600, родившихся живыми. Только 80% случаев точно диагностируются в отделениях для новорожденных. Это означает, что частота диагностических ошибок при этой наиболее распространенной причине МПР и задержки умственного развития составляет 20%. Причина диагностических ошибок, очевидно, заключается в том, что многие признаки трисомии 21 могут встречаться как изолированные симптомы и в остальном здоровых новорожденных.
2. Физикальные данные. Определяются эпикант, гипертелоризм, врожденная катаракта, пятна Брашфилда, единственная поперечная борозда на ладонях и монголоидный разрез глаз. И хотя любой из этих признаков может встречаться у здоровых новорожденных, их комбинация формирует легко узнаваемую картину, позволяющую рано поставить диагноз.
3. К сопутствующим аномалиям относятся врожденные пороки сердца, атрезия двенадцатиперстной кишки, пищевода, ануса. Перечисленные пороки развития могут быть причиной неотложных состояний у новорожденных с синдромом Дауна.
4. Мышечный гипотонус может приводить к расстройствам дыхания, глотания и аспирации.
Б. Трисомия 18 (синдром Эдвардса)
1. Частота. Приблизительно 1 : 5000 живорожденных.
2. Заболеваемость. Обусловливает высокую летальность в первые 3 мес жизни.
3. Физикальные данные. Проявляется микрогнатией, добавочными пальцами, высоким сводом стоп, врожденным пороком сердца (обычно ДМЖП или ОАП), помутнением роговицы, птозом и генерализованным мышечным гипертонусом.
B. Трисомия 13 (синдром Патау)
1. Частота. Приблизительно 1 : 7000 живорожденных.
2. Заболеваемость. Обусловливает высокую летальность в первые 3 мес жизни.
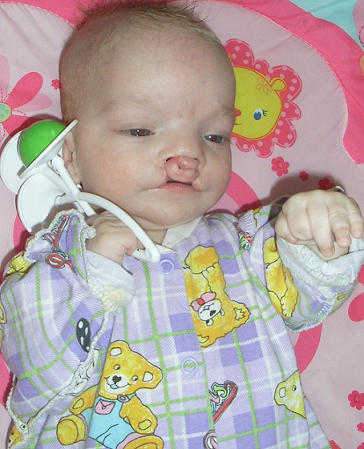
3. Физикальные данные. Проявляется расщеплением губы или неба, полидактилией, микрофтальмией и врожденным пороком сердца (обычно ДМЖП или ОАП).
Г. Синдром 45,X (Тернера)
1. Частота. Приблизительно 1 : 10 000 живорожденных девочек.
2. Заболеваемость. Синдром 45,X обычно совместим с жизнью, если ребенок рождается доношенным.
3. Физикальные данные. Шейная «перегородка», отеки на стопах и на затылке — отличительные признаки этого синдрома.
IV. Нехромосомные синдромы
А. Синдром Поттера (следствие олигогидрамниона)
1. Частота. Это второй по частоте синдром МПР (1:3000 живорожденных). Большинство случаев являются несиндромными и в 2—7% имеется риск рецидива в зависимости от специфики дефекта мочевыводящего тракта. В отдельных случаях синдром сочетается с триадой отвислого живота, когда на ранних сроках гестации произошла гидронефротическая трансформация почек с последующей декомпрессией живота, образованием на нем складок, формированием последствий олигогидрамниона (гипоплазия легких и синдром Поттера). Приблизительно 5% случаев являются составной частью синдрома МПР с первичными дефектами, не затрагивающими мочеполовую систему.
2. Заболеваемость. Почти все новорожденные с синдромом Поттера умирают.
3. Патофизиология. Агенезия почек ведет к снижению продукции амниотической жидкости (олигогидрамнион). Уменьшение количества околоплодных вод рассматривают как причину сопутствующей гипоплазии легких.
4. Клинические проявления
а. Анамнез. Необходимо выяснить у акушеров, было ли маловодие у беременной. У новорожденного, как правило, отмечается анурия.
б. Осмотр плаценты. В плаценте можно обнаружить желтоватые бляшки («амниотические узелки»).
в. Физикальные данные. Респираторный дистресс неясной этиологии и не поддающийся лечению, часто сочетающийся с пневмотораксом, деформированные стопы, легко переразгибающиеся в суставах пальцы, бедные хрящом большие уши, дополнительная складка в нижней части внутреннего угла глаза и клювовидный нос — классические проявления синдрома, связанного с выраженным и длительным маловодием.
5. Диагноз обычно подтверждается при обнаружении порока развития мочевыводящих путей при ультразвуковом исследовании почек и на аутопсии. Рекомендуется выполнять генетические исследования для исключения хромосомной этнологии заболевания. Риск рецидива зависит от специфического синдромного диагноза. В любом случае во время последующих беременностей должны регулярно производиться ультразвуковые исследования до тех пор, пока риск рецидива будет полностью исключен.
Б. Синдром амниотических перетяжек
1. Частота. Приблизительно 1 : 4000 живорожденных. В связи с тем что у некоторых новорожденных поражены многие участки тела и в 90% случаев перетяжки рассасываются перед родами, синдром часто просматривается или устанавливается неправильный диагноз.
2. Патофизиология. Этиология синдрома неизвестна. Большое значение в его формировании придают раннему разрыву амниотических оболочек и запутыванию в них различных частей тела. Возникающие в результате этого биомеханические силы могут приводить к деформации конечностей, пальцев и лицевого скелета. Могут также возникать препятствия к обратному поступлению в тело эмбриона висцеры (которая на ранних этапах эмбриогенеза в норме расположена вне его), приводя к развитию омфалоцеле и других пороков.
3. Физикальные данные
а. Конечности. «Ампутированные» (отсутствующие) конечности и пальцы, контрактуры, дистальные отеки.
б. Лицевой скелет. Расщелины губ и неба, энцефалоцеле.
в. Внутренние органы. Омфалоцеле, гастрошизис, эктопия пуповины.
4. Осмотр плаценты. Осмотр плаценты всегда важен, но в этих случаях он особенно необходим. Плодный пузырь часто маленький, отсутствует или скручен в тяжи. He все амниотические перетяжки вызывают патологические изменения у плода. В последние годы во время рутинного ультразвукового исследования беременных обнаружены амниотические перетяжки, не касавшиеся плода. При дальнейшем наблюдении обнаружено, что во всех этих случаях родились здоровые дети.
В. Артрогрипоз (множественные контрактуры суставов)
1. Частота. Приблизительно 1 : 3000 живорожденных.
2. Патофизиология. У 90% детей с артрогрипозом в основе заболевания лежат неврологические расстройства (поражение головного или спинного мозга). Многие синдромы, связанные с отсутствием двигательной активности (акинезией) плода, могут также характеризоваться артрогрипозом, так как нормальное развитие суставов плода зависит от его адекватной двигательной активности.
3. Клинические проявления. У новорожденного сочетанное поражение — сгибательные и разгибательные контрактуры суставов с их дислокацией. Дети с артрогрипозом центрального происхождения относятся к группе риска развития дыхательных расстройств и аспирации,
4. Лечение. Рано начатое лечение и реабилитация дают значительное улучшение состояния ребенка.
Г. Синдром Робена
1. Частота. Приблизительно 1 : 8000 живорожденных.
2. Патофизиология. В основе заболевания лежит тяжелая гипоплазия нижней челюсти, которая в этих случаях не способна поддерживать язык. Сопутствующий глоссоптоз приводит к тяжелой обструкции верхних дыхательных путей и формированию на ранних сроках внутриутробного развития расщелины неба.
3. Клинические проявления. У новорожденного определяются короткая челюсть, или запавший подбородок вследствие расщелины неба. Может отмечаться респираторный дистресс вследствие обструкции верхних дыхательных путей.
4. Дифференциальный диагноз. При многих синдромах (например, Стиклера, Кайтела—Манцке) имеются такие же изменения лицевого скелета, как и при синдроме Робена. При наличии первичных дефектов (пороков), не связанных с изменениями лицевого скелета, следует думать о синдроме МПР, отличном от синдрома Робена. Некоторые синдромы (например, синдром Стиклера) могут проявляться в младенческом возрасте только аномалиями лицевого скелета. Для исключения синдрома Робена и подтверждения синдрома Стиклера необходимы исследования, направленные на выявление миопии и уплощения скуловой кости.
5. Лечение. Введение воздуховода, интубация, трахеостомия и фиксация швами кончика языка к нижней десне являются эффективными временными мерами при глоссоптозе. Кормления через рот могут быть причиной дыхательных расстройств вследствие переполнения pta молоком, в связи с чем может потребоваться кормление через зонд или наложение гастростомы. Большинство случаев синдрома Робена не являются наследственными, и риск рецидива минимален.
V. Различные синдромы
A. Синдром VATER
1. Частота. Приблизительно 1:5000 живорожденных,
2. Клинические проявления. Основными признаками синдрома являются аномалии позвонков, атрезия ануса, трахеопищеводный свищ, атрезия пищевода и дефекты лучевой кости. Буква «V» в слове «VATER» может также отражать пороки сердца, а буква «R» — пороки почек, так как оба этих органа обычно поражаются при названном синдроме. Наличие дополнительных признаков, за исключением атрезии тонкой кишки, исключает диагноз синдрома «VATER». Эта неслучайная комбинация пороков, как правило, не имеет наследственного характера и требует исключения других аналогичных заболеваний, в том числе хромосомных синдромов.
Б. Синдром CHARGE
1. Частота. Встречаясь не столь часто, как синдром «VATER», является неотложным состоянием, так как у половины больных имеет место атрезия хоан.
2. Клинические проявления
а. Атрезия хоан. У новорожденного может быть выражен респираторный дистресс неясной этиологий.
б. Сопутствующие аномалии. У больных с синдромом «CHARGE» встречаются также пороки сердца, маленькие уши, колобомы сетчатки, микропенис. Реже отмечаются односторонний паралич лицевого нерва и нарушения глотания, которые, так же как и атрезия хоан, угрожают жизни больного. Постнатальная задержка роста и психомоторного развития завершает перечень главных признаков этого «неслучайного» и «негенетического» синдрома.
3. Диагноз. Каждому ребенку с дыхательными расстройствами неясной этиологии необходимо ввести через носовые ходы назогастральный зонд, особенно если у него выявлены множественные пороки развития. Перед тем как выставить диагноз синдрома CHARGE, необходимо исключить похожие заболевания и хромосомные синдромы.
B. Летальная карликовость с короткими конечностями и короткими ребрами
1. Частота. Приблизительно 1 : 5000 живорожденных.
2. Патофизиология. Три наиболее часто встречающихся при летальной карликовости признака — ахондрогенезия, танатофорная дисплазия и несовершенный остеогенез, тип II. Однако по меньшей мере еще 7 нарушений могут служить причиной смерти новорожденных. Все они генетические по происхождению.
3. Клинические проявления. Клиническая диагностика названных состояний у новорожденных затруднена. Обнаружение диспропорций физического развития у новорожденного с дыхательными расстройствами должно немедленно заставить предположить возможность наличия у него летальной карликовости. Из-за избыточного развития подкожного жирового слоя у новорожденных размеры грудной клетки бывает трудно оценить.
4. Диагноз. Если на рентгенограммах грудной клетки и живота обнаружены патологические изменения метафиза и эпифиза длинных трубчатых костей в сочетании с маленькими размерами грудной клетки, следует предположить наличие у ребенка летальной карликовости. При этом необходимо установить точный диагноз для определения прогноза и риска повторных случаев заболевания. Во всех случаях обязательным является рентгенологическое исследование всего скелета.
Г. Синдром Ди Джорджа
1. Клинические проявления
а. Физикальные данные включают пороки сердца, маленькие, неправильной формы уши, умеренно выраженные, неспецйфические изменения лица.
б. Лабораторные данные. Обычно отмечается гипокальциемия вследствие отсутствия или гипоплазии паращитовидных желез. Гипокальциемия часто обнаруживается раньше других признаков и указывает на необходимость немедленного целенаправленного исследования сердца и лицевого скелета.
2. Сопутствующие аномалии. Полная или частичная аплазия тимуса является скрытым признаком синдрома Ди Джорджа, который необходимо искать, так как он может быть самым грозным из всех имеющихся.
Д. Синдром Бекуита
1. Клинические проявления
а. Физикальные данные. Типичны макроглоссия и омфалоцеле, но у 20% больных имеется только один из этих признаков или нет ни того, ни другого.
б. Лабораторные данные. Независимо от наличия внешних признаков синдрома часто имеет место рефрактерная гипогликемия, которая должна вызвать подозрение на возможность синдрома Бекуита.
2. Лечение. Ранняя диагностика в постнатальном периоде и своевременное начало интенсивной терапии, направленной на ликвидацию гипогликемии, могут предотвратить задержку умственного развития.
VI. Тератогенные аномалии развития
A. Алкогольный синдром плода можно подозревать только на основе своеобразного фенотипа или рождения ребенка, маленького к гестационному возрасту. Он может также проявляться микроцефалией, микрофтальмией, уплощением максиллярной области. Для исключения тератогенного происхождения названных аномалий развития необходимо тщательное изучение анамнеза с целью выяснения фактов приема матерью наркотических средств.
Б. Гидантоинный синдром плода характеризуется типичным лицом (широкая, низкая переносица, гипepтелоризм, эпикант, птоз, оттопыренные, неправильной формы уши). У новорожденных с этим синдромом отмечается также высокая частота аплазии или гипоплазии ногтей пятых пальцев на кистях и стопах.
B. Новорожденные от матерей с сахарным диабетом
1. Частота. Риск врожденных пороков развития у таких детей в 2 раза выше, чем у потомства от матерей без диабета. У матерей с сахарным диабетом рождение детей с пороками развития наблюдается с частотой 1 : 2000 последовательных родов.
2. Клинические проявления. Хорошо известными аномалиями являются агенезий крестца, гипоплазия бедренной кости, врожденные пороки сердца и расщелина неба. К другим аномалиям относятся дефекты лучевой кости, гипоплазия ушных раковин, расщелина губы, микрофтальмия, голопрозэнцефалия, микроцефалия, анэнцефалия, спинномозговая грыжа, порок развития позвонков с гипоплазией одной из половин, пороки развития мочевыводящих путей, полидактилия с увеличением количества больших пальцев на стопах. У некоторых новорожденных от матерей с сахарным диабетом может быть много пороков развития, которые не связывают с диабетом у матери.
Источник
