Синдром plummer vinson что это такое

Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Синдром Пламмера – Винсона характеризуется атрофией слизистой оболочки полости рта, глотки и пищевода и проявляется множеством системных признаков: расстройство глотания, дисфагия, чувство жжения в языке, функциональный спазм пищевода и кардии, поверхностный глоссит, атрофия слизистой оболочки полости рта, глотки, пищевода и желудка, трещины углов рта, дистрофия ногтей, себорейный дерматит лица, блефарит, конъюнктивит, кератит с васкуляризацией роговицы, нарушение сумеречного зрения, хронический гастрит, порфинурия.
[1], [2], [3], [4]
Код по МКБ-10
D50.1 Сидеропеническая дисфагия
Причины синдрома Пламмера – Винсона
Причина заболевания неизвестна. Патогенез связывают с недостаточностью катализаторов, участвующих в обмене железа, которая приводит к дефициту в организме рибофлавина и железа.
[5], [6], [7], [8], [9], [10], [11], [12]
Диагностика синдрома Пламмера – Винсона
Диагноз устанавливают на основании перечисленных выше признаков. При рентгенографии выявляется феномен «пищеводных мембран», заключающийся в своеобразном изображении на передней стенке пищевода напротив перстневидного хряща. При эзофагоскопии в указанной области выявляется гиперкератоз слизистой оболочки в виде ороговевших пластинок.
Характерны изменения крови: гипохромная анемия, пойкило-, анизо-, микро- и планоцитоз, редко гиперхромная анемия, пониженное содержание железа в сыворотке крови, ахлоргидрия. Наблюдается почти исключительно у женщин.
[13], [14], [15], [16]
Лечение синдрома Пламмера – Винсона
Лечение синдрома Пламмера – Винсона на начальных стадиях заболевания может привести к временному улучшению общего состояния и длительным ремиссиям. При выраженных клинических формах излечение от синдрома Пламмера – Винсона практически исключено. Лечение заключается в назначении рибофлавина, лактофлавина, витамина В6, железосодержащих препаратов и средств, замещающих и нормализующих секреторную функцию желудка. Диета должна быть богата белками и витамином В6 (молоко и кисломолочные продукты, печень, яйца, мясо, пивные дрожжи, фрукты, овощи, ржаной хлеб).
Синдром Пламмера – Винсона имеет сомнительный прогноз.
Источник
Синдром Пламмера-Винсона – это системное заболевание. Его основные проявления – снижение гемоглобина, связанное с недостатком железа, атрофия слизистой органов пищеварения и нарушение глотания. Кроме этого, у больных наблюдаются отклонения и со стороны других органов и систем. Пациенты жалуются на плохое состояние ногтей и кожи, воспаление языка, нарушение зрения. Это сложная патология, плохо поддающаяся терапии. Болезнь встречается преимущественно у женщин в возрасте от 20 до 50 лет.
Этиология
Медицинские исследования не установили точной причины синдрома Пламмера-Винсона. Предполагается, что эта патология возникает из-за недостаточности ферментов, участвующих в метаболизме железа. В результате образуется дефицит витамина В2 и В9 (рибофлавина и фолиевой кислоты). А также организму начинает не хватать железа. Недостаток этого элемента приводит к анемии, слабости мышц, участвующих в акте глотания, патологическим изменениям эпителия пищевода и желудка.
Другими причинами развития заболевания может быть неправильное питание, при котором в рационе содержится недостаточно продуктов с железом, а также генетическая предрасположенность.

Некоторые ученые-медики считают, что эта патология связана с аутоиммунными нарушениями. Нередко синдром Пламмера-Винсона встречается у больных ревматоидным артритом, тиреоидитом и непереносимостью белка глютена.
Симптомы
В начале заболевания пациенты жалуются на слабость, повышенную утомляемость, усталость. У них наблюдается учащенное сердцебиение. Это первые признаки железодефицитной анемии. Далее начинаются системные изменения во многих органах, что выражается в следующих симптомах:
- Человеку становится трудно проглатывать пищу, при этом возникают боли в пищеводе. Сначала больной не может употреблять только грубую еду. Но затем затруднения возникают даже при глотании мягких продуктов и жидкостей.
- Из-за атрофии слизистой возникает поражение верхней части пищевода. Затем развивается гастрит и энтерит.
- Ногти истончаются и приобретают вогнутую форму.
- Кожа лица становится сальной, воспаленной и покрытой угрями.
- В уголках рта можно заметить воспаленные трещины.
- Губы воспаляются, краснеют и шелушатся.
- Дефицит железа приводит к изменению цвета белков глаза. Склеры приобретают синеватый или голубоватый оттенок. Больной начинает хуже видеть при плохом освещении или в темное время суток. Могут возникать заболевания глаз: кератит, конъюнктивит, блефарит.
- Моча приобретает красноватый цвет.
- Характерны изменения обоняния и вкуса. У больного появляется пристрастие к неприятным запахам и острой, соленой или кислой еде.
- Язык становится красным, воспаленным. Его поверхность сглаживается и выглядит лакированной. Такой признак можно встретить у 10% больных синдромом Пламмера-Винсона. Фото языка пациента можно увидеть ниже.
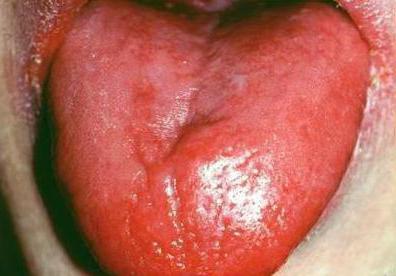
При обнаружении таких симптомов необходимо немедленно обращаться к врачу. Терапией этой патологии занимаются врачи-гематологи и гастроэнтерологи. Заболевание опасно осложнениями. Атрофические изменения слизистой желудка и пищевода нередко приводят к образованию злокачественных опухолей на этих органах.
По МКБ-10 синдром Пламмера-Винсона обозначается под кодом D50.1, как один из видов железодефицитной анемии. Другое название этого заболевания – сидеропеническая дисфагия.

Диагностика
Предварительный диагноз можно поставить на основании жалоб пациента и характерных изменений кожи, ногтей, языка. Это позволяет врачу заподозрить у больного железодефицитную анемию. Для уточнения характера патологии необходимо исследовать картину крови и состояние пищевода.
Назначается подробный гематологический анализ. У пациентов с синдромом Пламмера-Винсона выявляется сниженный гемоглобин, изменение правильной формы и размера эритроцитов, уплощение кровяных клеток. Кроме этого, следует сдать анализ на содержание ферритина. У больных этот показатель обычно резко снижен.
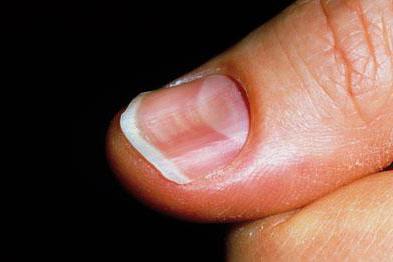
Важную роль в диагностике синдрома Пламмера-Винсона играет обследование состояния пищевода. Необходимо сделать рентгенографию этого органа, а также эзофагоскопию. У пациентов наблюдается утолщение и ороговение эпителия пищевода. На рентгеновских снимках можно заметить картину в виде “паутины” в верхней части органа.
Лечение
Пациентам с синдромом Пламмера-Винсона назначают препараты железа, лекарства, содержащие рибофлавин, фолиевую кислоту, лактофлавин и пиридоксин. Больным необходимо принимать медикаменты, улучшающие секрецию желудка и переваривание пищи. Рекомендуется диета с высоким содержанием белков и витамина В6. Пациентам полезно включать в рацион молочные продукты, печень, мясо, яйца, овощи.

Прогноз
На ранних стадиях синдрома Пламмера-Винсона своевременное лечение и соблюдение диеты поможет добиться длительной ремиссии и улучшения самочувствия. Однако при выраженных симптомах прогноз заболевания неблагоприятный. В запущенных случаях излечить эту патологию практически невозможно.
Пациенты, страдающие этим синдромом, должны периодически проходить тщательное гастроэнтерологическое и онкологическое обследование, так как атрофические изменения пищевода считаются предраковым состоянием.
Профилактика
Специфическая профилактика синдрома Пламмера-Винсона в настоящее время не разработана, так как точные причины патологии не установлены. Однако можно снизить вероятность развития этого заболевания. Необходимо включать в рацион продукты, богатые железом и витаминами группы В, вести активный образ жизни с разумными физическими нагрузками и систематически контролировать уровень гемоглобина. Всё это поможет минимизировать риск возникновения железодефицитной анемии.
Источник
Синдром Пламмера-Винсона (сПВ) определяется классической триадой симптомов – дисфагией, железодефицитной анемией и стриктурой пищевода. Несмотря на редкость cПВ, своевременность диагностики крайне важна: известно, что заболевание сопряжено с высоким риском развития плоскоклеточного рака шейного отдела пищевода.
В литературе можно встретить несколько названий этого синдрома [9, 24]. Наиболее распространенным является название, принятое в честь физиологов Генри Стенли Пламмера (Henry Stanley Plummer, 1874-1936 гг.) и Портера Пейзли Винсона (Porter Paisley Vinson, 1890-1959 гг.), которые работали в клинике Мейо. В 1912 г. Г.С. Пламмер сообщил о нескольких пациентах с хронической железодефицитной анемией, дисфагией, спазмом верхних отделов пищевода без органического стеноза, который истолковали, как неврологический спазм [26]. В 1919 г. П.П. Винсон описал собственное наблюдение сужения пищевода и связал эту находку с ранним сообщением Пламмера [32]. Несколько лет спустя он опубликовал описание серии больных с дисфагией, которые были успешно излечены бужированием. Большинство больных составляли женщины [33].
Другое название этого патологического состояния – синдром Паттерсона-Браун-Келли, принятое в честь британских ларингологов Дональда Росса Паттерсона (Donald Ross Paterson, 1863-1939 гг.) и Адама Браун-Келли (Adam Brown-Kelly, 1865-1941 гг.), которые в 1919 г. независимо друг от друга описали характерные клинические признаки этого синдрома [13, 25]. Несмотря на то что Д.Р. Паттерсон дал наиболее полное определение выявленного синдрома, он не упоминал анемию.
Точных данных о распространенности и частоте сПВ до настоящего времени нет. В первой половине XX века считали, что сПВ обычно характерен для людей белой расы из северных стран, при этом чаще болеют женщины среднего возраста [34]. Сегодня пациентов с подобным заболеванием можно встретить крайне редко. Например, из 1000 наблюдений, в которых выполнили кинерадиографическое исследование глотки и шейного отдела пищевода, стриктуры были обнаружены в 5,5%, но только у 6 больных была дисфагия и ни одно из этих наблюдений в полной мере не отвечало критериям сПВ [23].
В последнее время в литературе можно найти лишь отдельные клинические наблюдения. Раньше сПВ часто выявляли в Скандинавских странах, особенно среди сельского населения Швеции. Прогрессивное уменьшение частоты синдрома многие связывают с улучшением питания и коррекцией железодефицитной анемии в странах, где ранее часто выявляли сПВ [3]. Даже в Африке, где алиментарная железодефицитная анемия и недоедание – это подчас обычные явления, сПВ встречается крайне редко.
Основными клиническими проявлениями синдрома считают посткрикоидную дисфагию, мембранозные («пленочные») стриктуры верхних отделов пищевода и железодефицитную анемию. Большинство больных составляют белые женщины 40-70 лет, однако в литературе также описано заболевание у детей и подростков [1, 10, 16, 20, 34]. Дисфагия, как правило, безболезненная, временная или прогрессирующая в течение нескольких лет, что является ограничивающим фактором в приеме твердой пищи и приводит к потере в массе тела. В клинической картине могут доминировать симптомы, характерные для анемии, – слабость, бледность, усталость и тахикардия. Среди симптомов иногда присутствуют глоссит, угловой хейлит и койлонихия (ложкообразные ногти). Спленомегалия и увеличение щитовидной железы также могут быть проявлениями, характерными для сПВ [10].
Синдром Пламмера-Винсона был идентифицирован как фактор риска развития плоскоклеточного рака верхних отделов желудочно-кишечного тракта. Мембранозные стриктуры пищевода состоят из тонких складок слизистой с некоторыми изменениями, распространяющимися до слизистой полости рта. Эти изменения заключаются в атрофии эпителия или гиперкератозе и могут быть причиной высокой заболеваемости (более 16%) злокачественными опухолями дыхательной и пищеварительной систем. Известно, что у 3-15% женщин 15-50 лет, больных сПВ, развивается рак глотки или пищевода [8, 27]. Уменьшение частоты рака этой локализации у женщин, возможно, связано с уменьшением частоты сПВ [31].
Анализ зарубежной литературы за 7 лет (1999-2005 гг.) показал, что 25 (89%) из 28 взрослых пациентов с синдромом Пламмера-Винсона были женского пола [2, 4-7, 11-15, 17-19, 21, 22, 28-30, 35, 36]. Средний возраст составил 47 лет (28-80 лет).
У всех больных диагностирована железодефицитная анемия со средним показателем гемоглобина 82 г/л. Наиболее частыми сопутствующими заболеваниями были целиакия (n=6) [8, 12, 17, 19, 27], меноррагия (n=5), а также грыжа пищеводного отверстия диафрагмы с хроническим желудочно-кишечным кровотечением неясного генеза (n=3) [4, 12, 14, 22, 35, 36]. Одна пациентка была многорожавшая, у другой диагностирован ревматоидный артрит и еще у одной была лимфангиоматозная макроглоссия [2, 4, 18]. Две пациентки получали трансфузию эритроцитной массы, все остальные принимали препараты железа. Подавляющему большинству больных проводили дилатацию стриктур пищевода (n=20) и лишь в одном наблюдении стриктура была ликвидирована с помощью эндоскопических щипцов [17]. Одной больной была выполнена микроларингохирургическая операция с резекцией стриктуры [16]. У всех больных проведенное лечение позволило ликвидировать дисфагию. Однако в 2 наблюдениях был диагностирован плоскоклеточный рак шейного отдела пищевода [12, 27], в третьем – рак желудка при контрольном обследовании через год после проведенного лечения [14]. Со времени первого упоминания сПВ было описано лишь 2 наблюдения рака желудка у этих больных [15, 22].
Диагноз основывают на лабораторных показателях – доказанной железодефицитной анемии (уровень гемоглобина, гематокритное число, средний объем числа эритроцитов, железо сыворотки, ферритин, трансферрин, повышение железосвязываюшей способности сыворотки крови) и посткрикоидной дисфагии, обусловленной одной или более стриктурами пищевода. Стриктуры могут быть диагностированы при рентгенографии, а также при ЭГДС [4, 10]. Как правило, эндоскопически стриктуры гладкие, тонкие, серые с эксцентричным или центральным входом, типично расположены в проксимальных отделах пищевода и могут быть пропущены и случайно разорваны, если эндоскоп не введен под достаточным контролем при прямой визуализации [10].
Поскольку дисфагия является основным клиническим признаком сПВ, дифференциальная диагностика должна быть направлена на исключение других заболеваний, вызывающих дисфагию. В перечень дифференциально-диагностического поиска необходимо включать рак пищевода, дивертикулы пищевода, нервно-мышечные заболевания пищевода (ахалазия, кардиоспазм, диффузный эзофагоспазм), склеродермию, пептические и ожоговые стриктуры, грыжу пищеводного отверстия диафрагмы, сдавливающие пищевод образования средостения.
Этиология и патогенез синдрома Пламмера-Винсона неизвестны. Вероятно, основным возможным этиологическим фактором является дефицит железа. Известно, что железодефицитная анемия – это неотъемлемая составляющая триады симптомов наряду с дисфагией и стриктурами пищевода, а восполнение дефицита железа уменьшает проявления дисфагии [5, 6]. Доказано, что развитие железодефицитной анемии предшествует дисфагии [5]. В то же время масштабные клинические исследования показали, что у многих больных дефицит железа не является основной причиной формирования стриктур пищевода. Другие этиологические факторы, включая недоедание, генетическую предрасположенность или даже аутоиммунные процессы, также неоднократно рассматривали в качестве возможных причин развития заболевания. Основано это было на довольно частом сочетании синдрома Пламмера-Винсона с аутоиммунными заболеваниями (целиакия, аутоиммунный тиреоидит, ревматоидный артрит) [8, 12, 17, 19, 21, 27, 30].
Наиболее простыми и эффективными способами лечения заболевания являются восполнение дефицита железа и дилатация стриктуры пищевода. Как правило, прием препаратов железа купирует основные клинические проявления синдрома [10]. При выраженной дисфагии, обусловленной значимым сужением пищевода, необходимо прибегать к механическому расширению бужированием или дилатации. Согласно данным литературы, одного сеанса дилатации бывает достаточно для ликвидации дисфагии, однако рекомендуется проведение нескольких сеансов во избежание быстрого рецидива стриктуры [7].
Приводим собственные клинические наблюдения.
Больная Р., 48 лет, госпитализирована с жалобами на затруднение прохождения твердой и жидкой пищи по пищеводу, чувство тяжести за грудиной, ощущение застревания пищевого комка в области шеи, выраженную слабость, приступы сердцебиения, осиплость голоса, одышку при физической нагрузке. В 2006 г. при плановом обследовании была диагностирована железодефицитная анемия, гемоглобин 75 г/л. Проведенная тогда же ЭГДС позволила выявить лишь признаки хронического атрофического гастрита. С этого момента пациентка самостоятельно бессистемно принимала препараты железа без выраженного эффекта. Признаки дисфагии впервые появились лишь спустя 3 года, однако за медицинской помощью больная обратилась лишь в июне 2011 г. В анализах крови была выявлена хроническая гипохромная железодефицитная анемия (гемоглобин 77,9 г/л, цветовой показатель 0,49, гематокритное число 26,62%, средний объем клетки 56,3 мкм3) и сидеропения (железо 4,3 мкмоль/л, насыщение железом 5,5%, ферритин 3 мкг/л, трансферрин 3,07 г/л). Полипозиционная рентгенография: в шейном отделе пищевода на уровне C6 участок циркулярного сужения протяженностью около 1-2 мм и диаметром до 3 мм (рис. 1). Рисунок 1. Рентгенограммы. а – короткая мембранозная стриктура шейного отдела пищевода больной Р., 48 лет.
Рисунок 1. Рентгенограммы. а – короткая мембранозная стриктура шейного отдела пищевода больной Р., 48 лет. Рисунок 1. Рентгенограммы. б – баллонная дилатация стриктуры до полного расправления диаметром 2 см.
Рисунок 1. Рентгенограммы. б – баллонная дилатация стриктуры до полного расправления диаметром 2 см. Рисунок 1. Рентгенограммы. в – после дилатации. После приема густой взвеси бария явного супрастенотического расширения не выявлено. ЭГДС: устье пищевода проходимо, в шейном отделе пищевода просвет сужен до 2-3 мм, для аппарата непроходим. Выполнено два сеанса баллонной дилатации стриктуры под контролем рентгенотелевидения до максимального диаметра 2 см. Восполнен дефицит железа (космофер, ферлатум), уровень гемоглобина поднялся до 118 г/л.
Рисунок 1. Рентгенограммы. в – после дилатации. После приема густой взвеси бария явного супрастенотического расширения не выявлено. ЭГДС: устье пищевода проходимо, в шейном отделе пищевода просвет сужен до 2-3 мм, для аппарата непроходим. Выполнено два сеанса баллонной дилатации стриктуры под контролем рентгенотелевидения до максимального диаметра 2 см. Восполнен дефицит железа (космофер, ферлатум), уровень гемоглобина поднялся до 118 г/л.
Больная Я., 39 лет, госпитализирована с аналогичными жалобами, среди которых превалировала дисфагия. В 2004 г. впервые обратила внимание на чувство дискомфорта и инородного тела в горле во время приема пищи, однако за медицинской помощью не обратилась. В течение последующих 5 лет клиническая картина нарастала: появилась выраженная слабость, быстрая утомляемость, прогрессировала дисфагия вплоть до затруднения прохождения жидкой пищи по пищеводу. Госпитализирована в хирургическое отделение, где при рентгенографии была выявлена короткая стриктура шейного отдела пищевода (рис. 2). Рисунок 2. Рентгенограмма. Короткая мембранозная стриктура шейного отдела пищевода больной Я., 39 лет. Общий анализ крови: гемоглобин 42,0 г/л, цветовой показатель 0,45, сидеропения (железо 10 мкг/дл, насыщение железом 2,1%). ЭГДС: устье пищевода проходимо, в шейном отделе пищевода просвет сужен до 3-4 мм, для аппарата непроходим, ткани в этом отделе рубцово изменены. Лечение начато с переливания эритроцитной массы. Последовательное применение препаратов железа (космофер, ферлатум, венофер, ферофольгамма) позволило поднять уровень гемоглобина крови до 115 г/л. Проведение трех сеансов баллонной дилатации стриктуры под контролем рентгенотелевидения до максимального расправления баллона (2 см) позволило ликвидировать стриктуру и проявления дисфагии.
Рисунок 2. Рентгенограмма. Короткая мембранозная стриктура шейного отдела пищевода больной Я., 39 лет. Общий анализ крови: гемоглобин 42,0 г/л, цветовой показатель 0,45, сидеропения (железо 10 мкг/дл, насыщение железом 2,1%). ЭГДС: устье пищевода проходимо, в шейном отделе пищевода просвет сужен до 3-4 мм, для аппарата непроходим, ткани в этом отделе рубцово изменены. Лечение начато с переливания эритроцитной массы. Последовательное применение препаратов железа (космофер, ферлатум, венофер, ферофольгамма) позволило поднять уровень гемоглобина крови до 115 г/л. Проведение трех сеансов баллонной дилатации стриктуры под контролем рентгенотелевидения до максимального расправления баллона (2 см) позволило ликвидировать стриктуру и проявления дисфагии.
Обе пациентки проходят регулярное обследование в течение более 3 лет. Регулярные курсовые приемы препаратов железа позволяют поддерживать гемоглобин на уровне 110-120 г/л. Лишь одной больной потребовался повторный сеанс баллонной дилатации стриктуры через 6 мес после проведенного лечения. В настоящее время проявления дисфагии у обеих пациенток купированы полностью. При рентгенографии и ЭГДС признаков сужения пищевода не выявлено.
Изложенное позволяет сделать заключение, что диагностика сПВ не вызывает серьезных затруднений, если врач обладает по сути элементарными сведениями о заболевании, т.е. осведомлен о триаде симптомов. В то же время лечение этой категории больных целесообразно проводить в стационарах, располагающих достаточным опытом и всем арсеналом современных диагностических и лечебных технологий. Крайне важно провести дифференциальную диагностику и исключить другие заболевания, проявлениями которых может быть дисфагия. Важно помнить, что целиакия, гигантская грыжа пищеводного отверстия диафрагмы, рак желудка, синдром Шегрена и пернициозная анемия могут быть причиной синдрома Пламмера-Винсона. В целом больные с сПВ хорошо поддаются лечению, однако нуждаются в динамическом наблюдении в течение многих лет.
Источник
