Синдром при котором короткие пальцы

Синдром Рубинштейна-Тейби – генетически гетерогенное (по последним данным) наследственное заболевание, характеризующееся поражением центральной нервной системы, деформациями костей скелета и рядом других пороков развития. Симптомами этого состояния являются прогрессирующая умственная отсталость, низкий рост, расширение фаланг пальцев, полидактилия на ногах, разнообразные нарушения со стороны внутренних органов. Диагностика синдрома Рубинштейна-Тейби производится на основании данных настоящего статуса пациента, молекулярно-генетических анализов и других исследований. Специфического лечения данной патологии не существует, применяют симптоматическую терапию в зависимости от типа пороков и нарушений.
Общие сведения
Синдром Рубинштейна-Тейби – генетическое заболевание, которое сопровождается нарушениями интеллектуального и физического развития, а также разнообразными пороками скелета и внутренних органов. Впервые данная патология была выявлена в 1963 году и описана американскими педиатрами Дж. Рубинштейном и Г. Тейби – сами исследователи назвали заболевание «синдромом широкого первого пальца кистей и стоп, специфического лица и умственной отсталости». Дальнейшие исследования в области генетики подтвердили, что синдром Рубинштейна-Тейби является аутосомно-доминантной патологией, но подавляющее большинство случаев возникает вследствие спонтанных мутаций различного типа. Встречаемость составляет порядка 1:100 000-125 000, мальчики и девочки поражаются примерно с одинаковой частотой. Особенностью синдрома Рубинштейна-Тейби является повышенный риск развития различных онкологических заболеваний – главным образом, некоторых типов лейкозов, опухолей мозговых оболочек и нервных тканей.
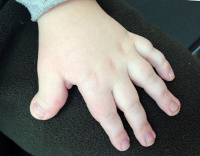
Синдром Рубинштейна-Тейби
Причины синдрома Рубинштейна-Тейби
Синдром Рубинштейна-Тейби обладает выраженной генетической гетерогенностью, однако различные типы этого заболевания не имеют каких-либо особенностей клинического течения. Наиболее часто причиной этой патологии выступают повреждения гена CREBBP, который расположен на 16-й хромосоме. Он кодирует так называемый CREB-связывающий белок, являющийся важным транскрипционным фактором, контролирующим экспрессию огромного количества генов. Появление в гене CREBBP различных изменений (точечных мутаций, транслокаций, микроделеций в 16-й хромосоме) приводит либо к образованию дефектного белка, неспособного выполнять свои функции, либо к полной блокировке его выделения. Это становится причиной развития синдрома Рубинштейна-Тейби.
В последние годы молекулярно-генетические исследования данной патологии подтвердили, что в ее развитии играют роль и мутации гена EP300, который располагается на 22-й хромосоме. Продуктом экспрессии данного гена является протеин p300, который, как и CREB-связывающий белок, относится к группе транскрипционных факторов. По данным исследований, идентифицировать характер генетического дефекта при синдроме Рубинштейна-Тейби удается в 55-60% случаев, примерно у половины пациентов обнаруживаются мутации гена CREBBP, еще у 40-45% выявляются делеции и другие хромосомные перестройки, затрагивающую 16-ю хромосому, и лишь у 3% больных наблюдаются мутации гена EP300. Все это указывает на возможность участия других генов в развитии этого заболевания.
Дефект белка-фактора транскрипции или его малое выделение (по причине гаплонедостаточности) приводит к многочисленным нарушениям, обусловленным недостаточной стимуляцией ряда других генов. Это можно заметить по характерной клинической картине синдрома Рубинштейна-Тейби. Оба транскрипционных фактора влияют на активность образования новых связей между нейронами, формирование долговременной памяти, стимуляцию иммунного ответа, развитие репродуктивной системы. Недостаточность этих белков ведет к целому каскаду патологических процессов в организме, что и составляет клинику синдрома Рубинштейна-Тейби. Кроме того, вышеуказанные транскрипционные факторы также влияют на активность антионкогенов, поэтому при их дефекте значительно возрастает риск развития злокачественных новообразований.
Симптомы синдрома Рубинштейна-Тейби
Симптоматика синдрома Рубинштейна-Тейби характеризуется значительным разнообразием у разных больных, что отражается на тяжести течения заболевания и его прогнозе. Обычно уже при рождении можно обнаружить некоторые признаки этой патологии – деформации лица и черепа (микро- или брахицефалия, расширение переносицы, эпикант, клювовидный нос), высокое арковидное нёбо, изменение формы и положения ушных раковин, расширенные фаланги пальцев, особенно первых. На ногах у больных синдромом Рубинштейна-Тейби нередко выявляется полидактилия. Иногда уже при рождении определяются признаки пороков развития внутренних органов – бледность или цианоз (при поражении легких или сердца), длительная желтуха новорожденных, крипторхизм.
При дальнейшем течении синдрома Рубинштейна-Тейби отмечается прогрессирующее отставание ребенка в физическом и умственном развитии от здоровых сверстников, затрудненное развитие речи и моторных навыков. Также наблюдается косоглазие, миопия. Выражение лица больных характеризуется гримасой, напоминающей улыбку, возникает гирсутизм, примерно у половины пациентов определяется наличие красного невуса в области лба, затылка или шеи. В старшем возрасте у больных синдромом Рубинштейна-Тейби выявляются искривления позвоночного столба различного характера и низкий рост (не более 150-160 сантиметров). Могут определяться деформации грудной клетки и (реже) другие скелетные аномалии, у мальчиков в большинстве случаев отмечается крипторхизм.
Постоянным признаком синдрома Рубинштейна-Тейби является умственная отсталость. Как правило, диагностируется ЗПР, олигофрения, значительная задержка речевого развития по сравнению со здоровыми сверстниками. Отмечаются нарушения концентрации внимания, больные легко отвлекаются на посторонние раздражители при выполнении какого-либо задания, возможны резкие перепады настроения. При этом лица с синдромом Рубинштейна-Тейби хорошо идут на контакт, легко социализируются. Среди других неврологических симптомов заболевания нередко обнаруживается плохая координация движений, изредка наблюдаются судорожные приступы.
Синдром Рубинштейна-Тейби может также проявляться различными нарушениями со стороны внутренних органов – головного мозга, сердца, почек и мочевыделительных путей, терминальных отделов пищеварительной системы. Кроме того, у таких больных значительно повышается риск возникновения онкологических заболеваний, в основном развивающихся в раннем возрасте. К ним относят различные формы лейкозов, меланому, некоторые типы лимфом. Поэтому до пубертатного периода больные синдромом Рубинштейна-Тейби должны периодически проходить обследования у онколога для ранней диагностики злокачественных новообразований.
Диагностика и лечение синдрома Рубинштейна-Тейби
Для выявления синдрома Рубинштейна-Тейби используют данные общего осмотра больного, рентгенологических исследований и молекулярно-генетических анализов, вспомогательную роль могут играть УЗИ и МРТ. При осмотре определяются характерные для этого заболевания аномалии развития лица (изменение формы и размеров черепа и носа, антимонголоидный разрез глаз), укорочение и расширение фаланг больших пальцев на руках и ногах, иногда – полидактилия. У взрослых больных синдромом Рубинштейна-Тейби также выявляют уменьшение роста, глубокую умственную отсталость, искривления позвоночника. На рентгенограммах можно увидеть изменения костей фаланг, позвоночника и грудной клетки, костный возраст несколько отстает от фактического.
Молекулярно-генетическая диагностика синдрома Рубинштейна-Тейби выполняется врачом-генетиком, который может использовать множество методов для определения этого заболевания. Точечные мутации в генах CREBBP и ЕР300 выявляются посредством прямого автоматического секвенирования кодирующей последовательности. Методика FISH используется в том случае, когда подозревается наличие делеций или транслокаций на 16-й хромосоме, также приводящих к развитию синдрома Рубинштейна-Тейби. Так как на основании фенотипических данных крайне сложно определить возможный тип генетического дефекта, в рамках диагностики этого заболевания нередко приходится применять сразу несколько техник современной молекулярной генетики.
Вспомогательные методы диагностики позволяют выявить сопутствующие нарушения внутренних органов при синдроме Рубинштейна-Тейби. К таким методам относят ультразвуковые исследования (УЗИ почек и мочевыделительных путей, ЭхоКГ), электрокардиографию, магнитно-резонансную томографию и другие методики. Нередко у больных синдромом Рубинштейна-Тейби диагностируют врожденные пороки сердца (открытый Боталлов проток, дефект межжелудочковой перегородки), аритмии, аномалии почек (удвоение, гипоплазия) и мочевыделительных путей (атрезии на различных участках). Также при этом заболевании нарушается формирование мозолистого тела головного мозга, что определяется при помощи магнитно-резонансной томографии. У части больных синдромом Рубинштейна-Тейби отмечаются пороки развития легких и пищеварительной системы.
Специфического лечения данной патологии на сегодняшний момент не существует, все терапевтические мероприятия сводятся к облегчению симптомов, коррекции аномалий и пороков развития, угрожающих жизни больных. Назначаются ноотропные средства, препараты кальция и витамина Д, для уменьшения выраженности умственной отсталости рекомендуют специализированную психологическую помощь. В ряде случаев при синдроме Рубинштейна-Тейби применяют хирургические методы лечения – для устранения пороков сердца, аномалий развития прямой кишки и мочевыделительных путей, крипторхизма. Также может потребоваться лечение у офтальмолога, а при признаках развития злокачественного новообразования – консультация и лечение у онколога.
Прогноз и профилактика синдрома Рубинштейна-Тейби
Согласно мнению большинства специалистов, прогноз синдрома Рубинштейна-Тейби чаще всего неопределенный или неблагоприятный. Это связано с тем, что данное заболевание характеризуется значительным спектром разнообразных нарушений – от относительно безопасных для жизни (легкие скелетные аномалии, умственная неполноценность) до ярко выраженных, способных привести к смерти в раннем возрасте (тяжелые пороки развития сердца, легких, почек). Кроме того, значительно повышен риск развития онкологических патологий. Поэтому прогноз синдрома Рубинштейна-Тейби составляется строго индивидуально, исходя из конкретной клинической картины и общего состояния больного. Каких-либо специфических методов профилактики этого заболевания из-за его частого спонтанного развития на сегодняшний день не разработано.
Источник
Содержание статьи
Редкое наследственное заболевание, основным симптомом которого является укорочение пальцев, называется брахидактилия. Короткопалость сопровождается укорочением кисти или стопы, неподвижными фаланговыми суставами, сращением соседних пальцев. Аномалия наследуется по аутосомно-доминантному типу, что приводит к одинаковой частоте заболеваемости среди мальчиков и девочек. Лечение патологии хирургическое, заключается устранении внешнего дефекта: разделении и удлинении пальцев рук или ног.

Причины и характеристика патологии
Брахидактилия – генетическая мутация формирования фаланг пальцев (укорочение или полное недоразвитие), сопровождающийся искривлением костей и изменение формы ногтевой пластины. Патология встречается у пятнадцати человека среди миллиона жителей планеты. Для наследования короткопалости достаточно наличия доминантного видоизмененного гена у одного из родителей.
Аномалия выражается в косметическом дефекте, больные могут жить обычной жизнью, ограничением может стать только выполнение тонкой работы с участием пальцев, что может повлиять на выбор трудовой деятельности. В некоторых случаях брахидактилия сопровождается другими генетическими отклонениями:
- симфалангизм – фаланги пальцев соединены неподвижно, без суставов;
- синдактилия – полное или частичное неразделение пальцев в период внутриутробного развития;
- синдром Дауна – геномная патология с увеличенным количеством хромосом;
- синдром Поланда – заболевание с односторонним отсутствием грудной мышцы;
- синдром Аарскога-Скотта – наследственная патология с изменением форм черт лица, пальцев, мочеполовой системы.
Классификация
В ортопедической практике с учетом симптоматических проявлений брахидактилия подразделяется на пять видов. Клинико-морфологическая классификация составлена с учетом наследственных аномалий, которые проявляются еще в момент эмбрионального развития. Часто аномалия входит в патологический симптомокомплекс генетических заболеваний, которые сочетают дефекты развития, сочетающиеся с умственной отсталостью. Подобные отклонения выявляются во время второго скрининга беременной женщины.
Виды брахидактилии:
- «А» – проявляется кривизной пальцев, недоразвитием средней косточки (фаланги) пальцев, видоизменением ногтя.
- «В» – уменьшение длины пальца за счет неразвитости костей пальца, у некоторых больных на пальцах только две фаланги, наблюдается сращение крайних фаланг среднего и безымянного пальца.
- «С» – укорачиваются вторые и третьи пальцы, уменьшается длина ступней и кистей, сращение пальцев, нарушения в работе гипоталамуса сопровождаются карликовостью, мозг значительно отстает в развитии.
- «D» – мутация касается больших пальцев на руках и ногах.
- «Е» – дефект ступней и кистей (короткая длина).
В свою очередь тип «А» имеет дополнительную классификацию:
- А1 (Фараби) – уменьшенная длина среднего или большого пальца, кривые или сросшиеся фаланги, ногти неправильной формы и длины.
- А2 (Мора-Бита)- второй палец на верхней и нижней конечности имеет сплющенную среднюю косточку неправильной треугольной формы.
- А3 (клинодактилия пятого пальца) – искривленные и короткие мизинцы.
- А4 (Темтами) – мутация средней фаланги второго и четвертого пальца.
- А5 – нарушение строение плюсневых костей, маленькая длина ступней и кистей.
Симптоматика
Если рассматривать брахидактилию, как отдельную аномальную патологию, клиническая картина не имеет ярких проявлений. Ключевым признаком являются короткие и неестественно изогнутые пальцы на руках и ступнях. Косметический дефект будет единственным внешним признаком. Никакой болезненности или дискомфорта больные не испытывают.
В раннем детстве у детей с короткопалостью не развиваются пальцы, следовательно, страдают не только двигательные функции, но и общее развитие ребенка. Развитие мелкой моторики зачастую просто невозможно, что отражается на речи и мыслительных способностях. По мере взросления в пальцах происходят деформационные изменения. При врожденном сращении пальцев ребенку трудно удерживать в руке предметы, освоить навыки письма и рисования.
Проявления брахидактилии на ступнях в некоторых случаях никак не влияют на здоровье опорно-двигательной системы, так как пальцы не участвуют в процессе ходьбы. К развитию плоскостопия или плоско-вальгусной деформации чаще приводят стопы уменьшенного размера. На маленькую площадь опоры приходится нагрузка всего тела во время передвижения, что приводит к опущению сводов стопы и деформации голеностопного сустава.
Если дефект пальцев является одним из признаков генетического заболевания, могут наблюдаться следующие симптомы:
- деформационные изменения грудной клетки (килевидная, воронкообразная);
- нестандартная форма черепа;
- укорочение шейного отдела позвоночника;
- аномально маленький рост;
- умственными отклонениями;
- нарушения работы опорно-двигательного аппарата;
- эндокринные нарушения;
- сплющенность пальцев;
- деструктивные изменения в костях (расщепление).
Диагностика
Выявление патологического отклонения возможно еще в период вынашивания плода. Первые отклонения в генетическом развитии могут стать заметны после первого скрининга (на сроке 11-12 недель) беременной, который состоит из УЗИ и специализированного анализа крови. На УЗИ можно заметить отклонения развития нервной трубки, а показатели крови указывают на возможные риски родить ребенка с геномным заболеванием.
Брахидактилия определяется на втором ультразвуковом исследовании (20 – 22 недель). Современная медицинская техника составляет объемную картинку во время обследования, что позволяет рассмотреть состояние пальцев на руках и ногах. Короткопалость, не сопровождаемая хромосомными отклонениями, не является показанием для искусственного прерывания беременности. При сочетании болезни с тяжелыми отклонениями дальнейшие действия определяются совместно с беременной женщиной.
После рождения диагностику проводить врач неонатолог совместно с детским ортопедом и генетиком. Медицинские специалисты оценивают выраженность внешних проявлений и дают рекомендации родителям по дальнейшему уходу и лечению. В некоторых случаях может понадобиться рентгенологическое исследование стоп и кистей, а также диагностика ДНК.

Лечение
Терапевтические мероприятия при диагнозе «брахидактилия» направлены на устранение эстетического дефекта и частичного восстановления функциональности. Полностью вылечить заболевание нельзя, максимально облегчить состояние можно только при помощи исправления дефектов пальцев хирургическим путем.
В рамках консервативного лечения назначается массаж и лечебная гимнастика. Сеансы массажа улучшают гемодинамику ступней и кистей, делают связки и мышцы эластичными. Лечебная гимнастика разрабатывает пальцы, улучшает качество и объем движений. Кроме того, пассивные движения во время массажа или активные при выполнении упражнений усиливают трофику суставных тканей и препятствуют их дегенерации.
Хирургическое лечение проводится в случаях, когда аномальное развитие имеет выраженный характер и мешает нормальной жизнедеятельности. В этом случае применяют следующие приемы оперативного лечения:
- поллизация – реконструкция первого пальца за счет одной или нескольких фаланг здорового пальца;
- дистракция – растяжение укороченных участков;
- аутотрансплантация – пересадка пальцев;
- разделение срощенных пальцев.
Проведение оперативного вмешательства в первую очередь направлено на восстановление функциональности кисти или стопы, исправление косметического дефекта стоит на втором месте. После операции проводится реабилитационный период, после которого у больного появляются новые возможности самостоятельного выполнения несложных манипуляций.
Профилактика
Полностью предотвратить генетическое заболевание брахидактилия невозможно. Специфической профилактики против доминирования патогенного гена не существует. При отягощенной наследственности, когда у представителей прошлых поколений были случаи короткопалости, с будущими родителями проводится беседа психолога о вероятности появления на свет ребенка с дефектами пальцев. В этом случае женщина находится под наблюдением генетика, который рассчитает риск развития патологии у плода.
Источник
