Синдром системного воспалительного ответа критерии
Синдром системного воспалительного ответа[1] (англ. «systemic inflammatory response syndrome» (SIRS)) — медицинский термин, введённый в 1992 году на конференции Американской коллегии торакальных хирургов (англ. American College of Chest Physicians) и Общества специалистов интенсивной терапии (англ. Society of Critical Care Medicine) в Чикаго[2] для обозначения общей воспалительной реакции организма в ответ на тяжелое поражение, вне зависимости от локализации очага. Процесс идет при участии медиаторов воспаления с вовлечением практически всех систем организма.
Воспалительная реакция организма в ответ на внедрение в организм инфекции, обширные травмы, развития некроза тканей, тяжелые ожоги развивается по одним и тем же общим закономерностям. Эта реакция является приспособительной функцией организма и направлена на уничтожение агента, вызвавшего процесс, и восстановление поврежденной ткани. При легких поражениях воспалительный процесс ограничивается локальными воспалительными изменениями и умеренной, малозаметной общей реакцией органов и систем.
Диагностика[править | править код]
Диагноз синдрома системной воспалительной реакции организма правомочен в случае наличия как минимум двух следующих критериев:
- Температура тела ≥ 38 °C (фебрильная температура) или ≤ 36 °C (гипотермия)
- Частота сердечных сокращений ≥ 90/мин (тахикардия)
- Тахипноэ: частота дыхания ≥ 20/мин или гипервентиляция с содержанием диоксида углерода в крови ≤ 32 mmHg
- Лейкоцитоз (≥ 12000/μl) или лейкопения (≤ 4000/μl) или смещение лейкоцитарной формулы влево.
Комбинация «фебрильная температура+лейкоцитоз» является самой частой для синдрома системной реакции организма на воспаление и соответствует нормальной реакции иммунной системы. В случае «гипотермия+лейкоцитоз», который встречается гораздо реже, говорят о «холодном» синдроме системной реакции организма на воспаление —— подобная реакция организма встречается при иммунодефиците.
Причины[править | править код]
Причинами синдрома системного воспалительного ответа могут быть: сепсис, гипоксия, шок, ожоги, острый панкреатит, обширные хирургические операции, тяжелые травмы и другие тяжелые заболевания. Чаще всего факторы повреждения классифицируют исходя из механизма патологического воздействия:[1]
- Механическое повреждение тканей (примеры: ожоги, синдром длительного сдавления).
- Глобальный недостаток перфузии тканей (примеры: шок, остановка кровообращения).
- Регионарный недостаток перфузии тканей (примеры: тромбоэмболия, травма крупных сосудов).
- Некроз тканей вследствие ишемии (примеры: инфаркт миокарда, острый панкреатит).
- Инфекционный процесс (примеры: иммунодефицит, хирургическая инфекция, инфицированная травма, внутрибольничная инфекция).
- Выброс эндотоксинов (пример: сепсис, вызванный грам-негативными бактериями).
- Невскрытые абсцессы (например, интраабдоминальные).
Примечания[править | править код]
Литература[править | править код]
- М. И. Кузин, О. С. Шкроб, Н. М. Кузин. Синдром системного ответа на воспаление // Хирургические болезни. — 3 издание. — М.: Медицина, 2002. — С. 13-22. — 784 с. — ISBN 5-225-00920-4.
- Определение SIRS (нем.) (недоступная ссылка). Дата обращения: 11 февраля 2014. Архивировано 26 июня 2013 года.
- S-2 Рекомендации по профилактике, диагностике, лечению и реабилитации SIRS (нем.) (недоступная ссылка). Deutsche Sepsis Gesellschaft. Дата обращения: 11 февраля 2014. Архивировано 1 октября 2010 года.
- R. C. Bone; R. A. Balk; F. B. Cerra; R. P. Dellinger; A. M. Fein; W. A. Knaus; R. M. Schein; W. J. Sibbald. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine (англ.) // Chest. — 1992. — Vol. 101, no. 6. — doi:10.1378/chest.101.6.1644.
Источник
Оглавление темы “Хирургическая инфекция.”: LIRS. SIRS. Инфекция. Определение сепсиса. CARS.Если вы порезали ножом палец, рано или поздно проявятся обычные признаки воспаления — краснота, отечность, повышение температуры и болезненность, вызванные воздействием воспалительных медиаторов в окружности очага. Это и есть LIRS — синдром локального воспалительного ответа. А теперь возьмем пациента с более глубокой резаной раной мягких тканей: в довершение к симптомам местного воспаления будут проявляться и симптомы системного воспаления: лихорадка, тахикардия и лейкоцитоз. Это SIRS — синдром системного воспалительного ответа. SIRS появляется, когда местные провоспалительные медиаторы выходят в общее циркуляторное русло и воздействуют на организм в целом. В хирургической практике SIRS чаще всего является вторичным по отношению к LIRS, в частности, при остром панкреатите, забрюшинной гематоме или остром холецистите. Запомните: провоспалительный каскад, приводящий к SIRS, является, по крайней мере вначале, отображением местно ограниченного очага, при котором SIRS представляет собой только верхушку айсберга.
LIRS и SIRS могут быть вызваны как инфекционными (например, острым аппендицитом), так и неинфекционными (например, травмой мягких тканей, некрозом, ожогами) причинами. Клинические проявления их неразличимы. Инфекция — бактериологический феномен, который характеризуется инвазией бактерий в нормальную стерильную биологическую ткань. Местный ответ на внедрение бактерий и есть LIRS, а системный — SIRS. Теперь перейдем к термину «сепсис». Сепсис в настоящее время определяют как системный ответ на инфекцию, состоящий из SIRS и микробиологически доказанной инфекции. Сепсис = воспаление (SIRS) + инфекция. Иными словами, SIRS и сепсис представляют собой один и тот же, зависящий от организма, ответ — в первом случае при отсутствии бактериального подтверждения, а во втором — при документированной бактериальной инфекции. Оба эти процесса проявляются тяжелой клинической картиной заболевания. В соответствии с современными представлениями, SIRS может быть диагностирован у любого больного, если у него имеются хотя бы 2 из следующих признаков: температура тела 38°С, сердечный ритм >90 в минуту, частота дыхания >20 в минуту, лейкоцитоз >12 000 в 1 мм3. С такими низкими пороговыми показателями SIRS можно выявить у любого пациента, находящегося в хирургическом БИН (помнится, кто-то сказал, что клиническая картина SIRS может возникать даже в результате энергичного секса). Стимулы, которые возбуждают провоспалителъные медиаторы и приводят к LIRS и SIRS, параллельно индуцируют и противоположную группу медиаторов, названную покойным Роджером Боуном («отец» SIRS) противовоспалительными, которые вызывают так называемый CARS (компенсаторный противовоспалительный синдром). CARS клинически проявляется иммунодепрессией и повышенной чувствительностью к инфекции, которые особенно заметны после больших операций и травмы. По существу, баланс между SIRS и CARS определяет исход: если CARS уравновешивает SIRS — гомеостаз нормальный; если SIRS более выражен, чем CARS, развивается полиорганная недостаточность; если же превалирует CARS, первичная или вторичная инфекция может прозвучать для больного похоронным колоколом. Как и во многих других серьезных ситуациях в жизни, «слишком много» может оказаться вредным, а «слишком мало» — недостаточным. Это справедливо и для воспалительного и противовоспалительного ответа, которые при определенных величинах являются благоприятными, но оставаясь вне контроля, приносят вред. Учтите, однако, что эти категории являются выражением крайностей — хаотических, непредсказуемых и плохо контролируемых: у некоторых больных с тяжелыми травмами развивается SIRS с органной недостаточностью, в то время как у других никакого прогрессирования системного ответа не происходит. Ваша бабушка, может быть, права — гены играют роль во всем. – Также рекомендуем “Развитие полиорганной недостаточности. Феномен второго удара. Лечение полиорганной недостаточности.” |
Источник
Слово «сепсис» происходит от древнегреческого σῆψις, что означает гниение. Долгое время ведутся споры, касающиеся определения, диагностики и лечения сепсиса. Множество вопросов на сегодняшний день так и остается без ответов.
Определение
Определение сепсиса показывает эволюцию взглядов на этиологию и патогенез данного состояния. Само определение неоднократно менялось, ранее считалось, что главенствующую роль в патогенезе играет системный воспалительный ответ, однако на данный момент центральную роль отводят нарушению действий воспалительной и противовоспалительной систем. Решение о необходимости изменения дефиниции было принято в 2017 году European Society of Intensive Care Medicine и Society of Critical Care Medicine.
Сепсис ― угрожающая жизни органная дисфункция, вызванная дезрегулирующим ответом организма хозяина на инфекцию.
Также на данной конференции было принято решение о ликвидации термина «тяжелый сепсис», который ранее определялся как сепсис с наличием органной дисфункции. Зачастую состояние пациента недооценивалось, и возникала путаница с определением тяжести состояния. При усугублении патологического процесса развивается состояние, называемое септическим шоком. Летальность при развитии септического шока увеличивается в разы по сравнению с сепсисом (40 % против 10 %).
Септический шок ― подвид сепсиса, в основе которого лежит нарушение циркуляции, а патологические изменения в клетках и метаболизме достаточно глубоки, чтобы в значительной степени увеличить летальность.
Диагностика
Исходя из определения и патогенеза, для скрининга сепсиса было предложено использовать шкалу qSOFA (quick Sepsis-related Organ Failure Assessment).
Критерии qSOFA:
- Системное артериальное давление ≤ 100 мм рт. ст.;
- Частота дыхания ≥ 22 в минуту;
- Любое нарушение сознания (< 14 баллов по Шкале комы Глазго).

При наличии ≥ 2 баллов, а также признаков наличия инфекции необходимо обратить внимание на данного пациента и оценить вероятность сепсиса по развернутой шкале SOFA. Данная шкала в отношении определения органной дисфункции имеет специфичность 96 % и чувствительность 30 %, а в отношении определения смертности ― специфичность 91 % и чувствительность 50 %. По сравнению с критериями синдрома системного воспалительного ответа (ССВО/SIRS) данная шкала имеет большую специфичность, однако меньшую чувствительность.

После прохождения скрининга и при наличии ≥ 2 баллов по qSOFA или сохранении подозрения на сепсис проводится оценка по развернутой шкале SOFA.
В критерии SOFA входит определение функций:
- Дыхания: отношение PaO2/FiO2;
- Коагуляции: уровень тромбоцитов;
- Печени: уровень билирубина;
- Сердечно-сосудистой системы: уровень артериального давления и инотропной поддержки;
- ЦНС: определение уровня по Шкале комы Глазго;
- Почек: уровень креатинина и диурез.
При наличии ≥ 2 баллов по развернутой шкале SOFA правомочно выставление сепсиса.
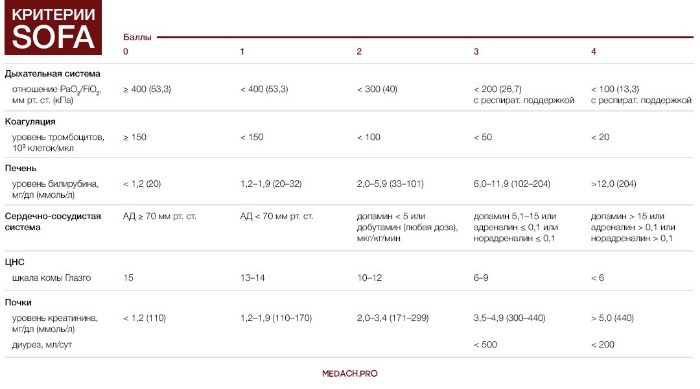 Таблица 1 | Критерии SOFA
Таблица 1 | Критерии SOFA
После выставления диагноза проводится начальная интенсивная терапия, важной частью которой является проведение массивной инфузии, далее определяется среднее артериальное давление (СрАД), а также уровень лактата. Среднее артериальное давление определяется по формуле: СрАД = САД – ДАД + ⅓ ДАД, где САД ― систолическое артериальное давление, а ДАД ― диастолическое артериальное давление. При необходимости применения вазопрессоров для поддержания адекватного среднего артериального давления ( ≥ 65 мм рт. ст.), а также при высоком уровне лактата ( > 2 ммоль/л) выставляется диагноз септический шок.
Терапия
Начальная терапия
Интенсивная терапия сепсиса должна начинаться сразу же после постановки диагноза. Рекомендации по ведению сепсиса 2012 года предлагали использовать цели, которые необходимо было достигнуть за определенное время. К сожалению, после проведения крупных испытаний данная стратегия не показала преимуществ по сравнению со стандартной терапией, а также оказалась более затратной.
После выявления сепсиса для коррекции сепсис-индуцированной гипоперфузии в начальном периоде используются кристаллоиды в объеме 30 мл/кг внутривенно в первые 3 часа. Последующая инфузия должна проводиться на основании имеющихся в наличии данных о физиологии пациента (частота сердечных сокращений, артериальное давление, артериальная сатурация кислорода, частота дыхания, температура и другие данные), полученных с помощью неинвазивных и инвазивных методов. Предпочтение желательно отдавать динамическим методам измерения.
У пациентов с септическим шоком, требующим применения вазопрессоров, необходимо поддерживать среднее артериальное давление на уровне не менее 65 мм рт. ст. Пациентам с повышенными уровнями лактата (маркер тканевой гипоперфузии) необходимо проводить интенсивную инфузионную терапию с целью его снижения до нормальных уровней.
Всем организациям здравоохранения рекомендуется разрабатывать собственные или усовершенствовать имеющиеся программы по ведению сепсиса и септического шока, методам скрининга у тяжелобольных пациентов, а также оценке риска развития сепсиса. Допустимо применение других шкал для скрининга состояния тяжелобольных пациентов: привычная шкала ССВО, LODS (Logistic Organ Disfunction System), NODS (National Organ Disfunction System).
Интенсивная терапия сепсиса
Антибактериальная терапия
До начала антибактериальной терапии необходимо взять посевы (кровь, спинномозговую жидкость, мочу, секрет из дыхательных путей, раневое отделяемое или другие жидкости организма) для определения чувствительности микроорганизмов к антибиотикам с использованием как минимум двух наборов культур: анаэробной и аэробной. Однако взятие посевов не должно существенно затягивать начало антибактериальной терапии сепсиса. Антибиотикотерапия должна начинаться в максимально ранние сроки, до 1 часа после постановки диагноза сепсиса или септического шока. Любое промедление в назначении антибактериальных средств значительно повышает смертность пациентов. Эмпирическую антимикробную терапию рекомендуется начинать с одного или нескольких антибиотиков (АБ) из двух разных классов, с широким спектром активности, действующих на предполагаемую флору (бактериальную и/или грибковую).
При выборе АБ необходимо учитывать: анатомический источник и типичную его флору, преобладающую флору в госпитале или вне его, резистентность преобладающего патогена, иммунные нарушения у пациента (нейтропения, спленэктомия, плохо контролируемая ВИЧ-инфекция, приобретенные или врожденные дефекты иммуноглобулина, системы комплемента или функции лейкоцитов), а также возраст пациента и наличие сопутствующей патологии, хронических заболеваний. Дозу и время введения необходимо оптимизировать на основании фармакодинамики/фармакокинетики и специфических свойств препаратов. Необходимо помнить о том, что у пациентов зачастую есть нарушение функции почек и/или печени, а также о возможной резистентности микроорганизмов. При применении бета-лактамных АБ важно достигнуть концентраций выше минимальной ингибирующей в течение как можно более длительного времени, в то время как для аминогликозидов и фторхинолонов главную роль играет достижение пиковой концентрации.
Деэскалацию (замена АБ широкого спектра действия на АБ более узкого спектра действия) антибактериальной терапии проводят в течение нескольких последующих дней после того, как определены микроорганизмы, вызвавшие сепсис и септический шок, и их спектр чувствительности к антибиотикам, либо наступает значительное клиническое улучшение/ухудшение. По возможности каждый день оцениваются клинические данные, и на их основании проводится решение об деэскалации. Рекомендуемая длительность антибактериальной терапии составляет 7–10 дней, что зачастую достаточно для большинства серьезных инфекций, ассоциированных с развитием сепсиса и септического шока.
При проведении антибиотикотерапии необходимо руководствоваться уровнем прокальцитонина (ПКТ), это позволяет сократить продолжительность курса, а также отменить АБ у пациентов, у которых имелись подозрение на сепсис и слабые доказательства наличия инфекции. При снижении уровня прокальцитонина более, чем на 80 % от пикового значения или снижении ПКТ менее 0,5 мкг/л необходимо прекратить введение АБ.
Контроль очага
Необходимо как можно быстрее (не позже 6‒12 часов после постановки диагноза) выявить или исключить наличие очага инфекции в организме и провести вмешательство по его удалению. Следует обратить особое внимание на внутрисосудистые девайсы (центральные венозные катетеры), так как они могут быть источниками инфекции.
Инфузионная терапия
Препаратами выбора для инфузионной терапии при развитии сепсиса и септического шока являются кристаллоиды. Предпочтительней применять сбалансированные растворы, так как они не вызывают развитие гиперхлоремического метаболического ацидоза (раствор Хартмана или Рингер-лактат), при их отсутствии допустимо применение несбалансированных растворов (Рингер или физиологический раствор NaCl 0,9 %). Недостаточно данных об использовании препаратов желатина для восстановления объема внутрисосудистого русла при сепсисе.
При необходимости инфузии значительных объемов кристаллоидов допускается добавление инфузии коллоидов (альбумина 20 %) с целью достижения плазменного уровня альбумина > 30 г/л. На основании данных проведенных исследований не рекомендуется использование при сепсисе и септическом шоке растворов гидроксиэтилкрахмала.
Вазоактивные препараты
Препаратом выбора при септическом шоке является норадреналин. Для достижения целевого СрАД (≥ 65 мм рт. ст.) или с целью снижения дозировки норадреналина (до < 15 мкг/мин) допустимо использование вазопрессина в дозе вплоть до 0,03 ЕД/кг, или адреналина. Использование вазопрессина обосновывается тем, что при экспериментальных исследованиях обнаруживается относительный дефицит эндогенного вазопрессина через 24‒48 часов от начала шока. Допамин может использоваться как альтернатива норадреналину только у небольшого количества пациентов с низким риском тахиаритмий и абсолютной или относительной брадикардией.
Не рекомендуется применение низких доз допамина, так называемых «почечных», для протекции почек при сепсисе и септическом шоке!
Добутамин может назначаться пациентам, имеющим признаки тканевой гипоперфузии, на фоне адекватной инфузии и использовании других вазопрессоров. Дозу данного препарата необходимо тщательно титровать для достижения желаемого эффекта (восстановление тканевой перфузии), а при развитии аритмий или усугублении гипотензии незамедлительно прекратить его введение. Всем пациентам с септическим шоком желательно установить артериальный катетер для контроля показателей гемодинамики.
Кортикостероиды
Нет необходимости использовать глюкокортикоиды, когда на фоне инфузионной терапии и применения вазопрессоров достигнута гемодинамическая стабильность. Если же невозможно поддерживать гемодинамику на должном уровне на фоне приведенной выше терапии (инфузия + прессоры), допускается применение гидрокортизона внутривенно в дозе 200 мг/сутки.
Препараты крови
Трансфузия эритроцитов проводится при снижении уровня гемоглобина менее 70 г/л у взрослых без признаков тяжелой гипоксемии, ишемии миокарда или острого кровотечения. Эритропоэтин у пациентов с сепсисом не применяется. Свежезамороженная плазма может использоваться при нарушениях свертываемости крови перед планированием инвазивных процедур или при наличии активного кровотечения.
Трансфузия тромбоцитов проводится в зависимости от клинической необходимости при уровне:
- < 10 х 109, если отсутствует риск кровотечения;
- < 20 х 109 при наличии значительного риска развития кровотечения;
- ≤ 50 х 109 при наличии активного кровотечения, проведении хирургического вмешательства или инвазивной процедуры.
Иммуноглобулины
Эксперты не рекомендуют использовать иммуноглобулины у пациентов с сепсисом и септическим шоком.
Очистка крови
Эффект применения различных технологий очистки крови не доказан. Необходимо провести дополнительные исследования.
Искусственная вентиляция легких (ИВЛ)
На фоне сепсиса у пациентов часто развивается сепсис-индуцированный острый респираторный дистресс синдром (ОРДС). При развитии ОРДС проводится ИВЛ со следующими параметрами:
- Целевой дыхательный объем 6 мл/кг на прогнозируемую массу тела (ПМТ). ПМТ у мужчин = 50 + 0,91 * (рост в см – 152,4), ПМТ у женщин = 45,5 + 0,91 * (рост в см –152,4);
- Верхний предел давления плато (Рplat) = 30 см вод. ст.;
- Высокий PEEP — около 10‒12 см вод. ст., для подбора оптимального PEEP можно использовать таблицы, основанные на значениях FiO2;
- Использование рекрутмент маневра и прон-позиции при отношении PaO2/FiO2 < 150 мм рт. ст.;
- Использование мышечных релаксантов в течение ≤ 48 часов у пациентов с сепсис-индуцированным ОРДС и в отношении PaO2/FiO2 < 150 мм рт. ст.;
- В особо тяжелых случаях рефрактерной гипоксемии могут использоваться альтернативные техники: экстракорпоральная мембранная оксигенация и режимы ИВЛ с инверсией отношения вдох/выдох и PEEP (airway pressure release ventilation, APRV);
- Не рекомендовано использование высокочастотной осцилляторной ИВЛ у взрослых, применение бета-2-агонистов (при отсутствии бронхоспазма), рутинная установка катетера в легочной артерии.
При проведении ИВЛ пациентам без ОРДС необходимо использовать низкие дыхательные объемы (4 ‒ 6 мл/кг), поднять изголовье кровати на 30–45° для снижения риска аспирации и развития вентилятор-ассоциированной пневмонии, а также как можно раньше начинать отучение от ИВЛ.
Седация и анальгезия
Необходимо избегать продолжительной или интермиттирующей седации пациентов, которым проводится ИВЛ. Если же все-таки необходима седация, то предпочтительнее использовать короткодействующие препараты (пропофол или дексмедетомидин).
Контроль гликемии
Рекомендуется поддержание уровня глюкозы ≤ 10 ммоль/л. При наличии двух последовательных проб крови с превышением данного уровня глюкозы необходимо незамедлительно начать введение инсулина. Мониторинг гликемии проводится каждые 1–2 часа до момента, когда уровни глюкозы и инфузия инсулина не стабилизируются; после стабилизации контроль проводится каждые 4 часа. Для измерения уровней глюкозы предпочтительнее использовать артериальную кровь. Допустимо использование портативных глюкометров, однако нужно критически относиться к результатам данных исследований.
Почечно-заместительная терапия (ПЗТ)
При развитии у пациентов с сепсисом острого повреждения почек и наличии показаний к диализу может применятся длительная или перемежающаяся почечно-заместительная терапия. Во время ПЗТ возможен контроль и изменение баланса жидкости у гемодинамически нестабильных пациентов.
Применение бикарбоната натрия
Не рекомендуется раннее применение бикарбоната натрия при индуцированном гипоперфузией лактат-ацидозе с pH ≥ 7,15.
Профилактика венозной тромбоэмболии (ВТЭ)
Рекомендуется проводить профилактику ВТЭ у пациентов с сепсисом и септическим шоком, предпочтительнее низкомолекулярными гепаринами (НМГ) либо с помощью нефракционированного гепарина (НФГ). Возможно использование механических методов профилактики (компрессионные чулки или устройства для перемежающейся пневматической компрессии) как дополнение к основной терапии или как самостоятельный метод при наличии противопоказаний к применению НМГ и НФГ .
Не рекомендуется применение антитромбина III.
Профилактика язв
У пациентов с сепсисом и септическим шоком, имеющих факторы риска желудочно-кишечного кровотечения (проведение ИВЛ > 48 часов, заболевания печени, коагулопатии, проведение ПЗТ), необходимо проводить профилактику стрессовых язв с помощью блокаторов протонной помпы или антагонистов Н2-гистаминовых рецепторов.
Питание
Рекомендуется раннее начало энтерального питания у пациентов с сепсисом. В зависимости от переносимости могут использоваться трофические/гипокалорические смеси или полное раннее энтеральное питание. Начинать парентеральное питание следует не ранее 8 суток при невозможности обеспечить раннее энтеральное питание. При непереносимости энтерального питания или наличии высокого риска аспирации может проводиться измерение остаточного объема желудка, а также использоваться пост-пилорические зонды для кормления. Пациентам с гастропарезом, диабетом или получающим седативные и вазоактивные препараты может потребоваться применение прокинетиков (метоклопрамид, домперидон). При применении прокинетиков необходим ЭКГ мониторинг для ранней детекции синдрома удлиненного QT и снижения риска внезапной смерти.
Отсутствуют данные о положительном эффекте применения омега-3-жирных кислот, внутривенного введения селена, аргинина, глютамина и карнитина.
Источники:
- Singer M. et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3) //Jama. – 2016. – Т. 315. – №. 8. – С. 801-810.
- Rhodes A. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016 //Intensive care medicine. – 2017. – Т. 43. – №. 3. – С. 304-377.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
