Синдром токсического шока у новорожденных
Неонатология: новости, мнения, обучение. 2013. № 2. С. 67-79.
Список использованных сокращений
АД – Артериальное давление
АОЛКА – Аномалия отхождения левой коронарной артерии
ВДГ – Врожденная диафрагмальная грыжа
ВПВ – Верхняя полая вена
ВПС – Врожденный порок сердца
ГВ – Гестационный возраст
ИВЛ – Искусственная вентиляция легких
ЛА – Легочная артерия
МАС Синдром мекониальной аспирации
МКБ – Международная классификация болезней
ОАП – Открытый артериальный проток
ОНМТ – Очень низкая масса тела
ОЦК – Объем циркулирующей крови
ПДКВ – Положительное давление в конце выдоха
ПЛГН – Персистирующая легочная гипертензия новорожденных
РДС – Респираторный дистресс-синдром
СВ – Сердечный выброс
СрАД – Среднее артериальное давление
УЗИ – Ультразвуковое исследование
ЭКМО – Экстракорпоральная мембранная оксигенация
ЭНМТ – Экстремально низкая масса тела
I. Определение
Шок – остро развившееся полиэтиологическое патологическое состояние, представляющее синдром циркуляторной дисфункции, проявляющийся нарушением перфузии тканей, характеризующийся вовлечением в процесс нескольких органов и систем.
По мере своего развития шок сопровождается снижением артериального давления (АД). Однако изолированное снижение АД ниже нормативных значений для данного возраста и срока гестации без нарушения перфузии органов и тканей, не является шоком и требует принципиально иных терапевтических подходов.
II. Этиология шока
III. Патогенез шока
В основе развития шока лежит снижение сердечного выброса (СВ) и/или периферического сосудистого сопротивления. СВ определяется преднагрузкой (количеством крови, пришедшей к сердцу), постнагрузкой (сопротивлением, которое сердцу нужно преодолеть) и собственно сократительной способностью миокарда. Любой из факторов (низкая преднагрузка и сократительная способность или высокая постнагрузка) может привести к снижению СВ.
Патологические состояния, которые приводят к описанным изменениям, перечислены в табл.
IV. Виды неонатального шока
Классически выделяют несколько основных видов шока – это дистрибутивный, кардиогенный и гиповолемический шок, который в практике неонатолога, как правило, связан с кровопотерей. В соответствии с этиологической классификацией существуют также болевой, анафилактический, ожоговый шок и другие, однако эти виды шока редко встречаются в неонатальной практике.
Особенностью новорожденных является возможность развития некоторых видов шока, не характерных для взрослых и детей более старшего возраста. К этой категории относятся шок на фоне закрытия ОАП при дуктусзависимом ВПС, шок при фиброэластозе, фето-фетальном синдроме, персистирующей легочной гипертензии и ряде других состояний, описанных в разделе “Этиология шока”. Кроме того, некоторые врожденные нарушения метаболизма, сопровождающиеся гипераммониемией или гипергликемией, также могут симулировать клинику септического шока.
Наиболее тяжелым, молниеносно развивающимся, имеющим высокую летальность и наибольшую частоту осложнений является септический шок. В основе диагностического поиска и планирования тактики в первую очередь нужно исключить развитие септического шока.
V. Стадии шока
Классически выделяют три стадии шока: компенсации, декомпенсации и необратимая стадия. В неонатальной практике четкое выделение стадий шока не всегда возможно. Лечение следует начинать вне зависимости от подозреваемой стадии шока.
VI. Клиническая картина шока
В отличие от артериальной гипотонии, которая может протекать бессимптомно, при шоке отмечаются следующие клинические симптомы:
· Акроцианоз, бледность, мраморность, холодные конечности – первые признаки снижения СВ и централизации кровообращения. Симптом “белого пятна” более 3 с, снижение периферической пульсации позволяют подозревать развитие шока.
· Со стороны сердечно-сосудистой системы. Нарушения сердечного ритма. Наиболее частый признак развивающегося шока – нарастающая тахикардия.
· Учащая сердечный ритм, ребенок компенсирует падающий СВ, не имея возможности адекватно увеличить силу сокращения. У недоношенных детей признаком развивающегося шока, напротив, может быть брадикардия. Нарушения частоты сердечных сокращений – ранний признак развития шока у новорожденного.
· Со стороны дыхательной системы. Тахипноэ характерно для септического и кардиогенного шока, в частности на фоне ацидоза и повышения уровня лактата. При патологии легких возможно быстрое прогрессирование дыхательных нарушений. Периодическое дыхание и апноэ являются следствием сниженной перфузии головного мозга, что может отмечаться при всех видах шока.
· Со стороны ЦНС. Неврологические нарушения могут быть различными – от резкого угнетения вплоть до отказа от кормления до двигательного возбуждения с быстрым истощением. Как правило, развивается мышечная гипотония в покое, сниженная спонтанная двигательная активность с постепенным нарастанием неврологических нарушений.
· Артериальная гипотония. Следует помнить, что артериальная гипотония – это относительно поздний признак шока. В идеальном варианте диагностика и терапия шока должны быть начата раньше развития тяжелой гипотонии. Нижней допустимой границей среднего АД в мм рт.ст. эмпирически принято считать ГВ в неделях. Однако нижняя граница АД вне зависимости от ГВ не должна опускаться ниже 30 мм рт.ст. [1]. Только для новорожденных с весом 600 г и менее нижняя допустимая граница среднего АД может быть 28 мм рт.ст. [2].
· Со стороны мочевыделительной системы. Может отмечаться олигурия вплоть до анурии. Однако при высокой осмолярности (например, в условиях гипергликемии), а также при массивной диуретической терапии нормальные показатели диуреза могут сохраняться достаточно долго.
· Отказ от кормления, срыгивания.
Особенности недоношенных с ОНМТ и ЭНМТ
· Низкая корреляция между АД и тканевой перфузией.
· Низкая специфичность симптома “белого пятна”.
· Для новорожденных ≤30 нед гестации выявлена незначительная специфичность только при длительности заполнения капилляров более 5 с [3].
· На фоне шока часто отмечается брадикардия. Характерна клиническая ситуация, когда эпизоды выраженной брадикардии чередуются нормальным или учащенным сердечным ритмом. Нарушения сердечного ритма практически всегда предшествуют снижению АД.
· У глубоко недоношенных детей следует различать артериальную гипотонию, связанную с незрелостью регуляторных механизмов, относительной адреналовой недостаточностью, и собственно шок.
Терапевтические подходы к этим двум состояниям кардинально отличаются.
Основные диагностические критерии шока, отличающие его от бессимптомной артериальной гипотонии.
На фоне снижения АД отмечается:
· резкое ухудшение состояния;
· нарушение микроциркуляции;
· нарушение сердечного ритма: тахи- или брадикардия.
VII. Протокол терапии шока
(см. Алгоритм, Приложение 1)
1. В первую очередь следует обеспечить адекватную респираторную терапию. Если ребенок дышит самостоятельно, немедленный перевести его на ИВЛ.
2. Обеспечение сосудистого доступа (если отсутствует). Желательно катетеризировать 2 вены (одну центральную и одну периферическую или 2 центральных) для исключения вероятности изменения скорости введения инотропных препаратов при одновременном назначении других инфузий.
В исключительных случаях при наличии жизненных показаний в отсутствие возможности катетеризации центральной вены допустима непродолжительная инфузия вазоактивных препаратов (допамин, адреналин) в периферическую вену. Задержка с назначением инотропных препаратов связана с 20-кратным увеличением риска летальности [4].
3. Если ребенок получал энтеральное питание, оно должно быть отменено, содержимое желудка эвакуировано. Парентеральное питание должно быть продолжено с учетом клинической картины и особенностей новорожденного (см. Протокол проведения парентерального питания).
Непосредственно после катетеризации вены как можно скорее вводится 10-20 мл/кг физиологического раствора медленно болюсно или капельно в течение 15-20 мин. На ранней стадии дистрибутивного шока (септического шока) в первую очередь предпочтительно использовать волюм-эспандерный раствор для поддержания внутрисосудистого пространства. Инотропные препараты назначаются одновременно или немногим позднее. При отсутствии эффекта возможны повторные введения еще 10-15 мл/кг за 15-20 мин с одновременным назначением инотропного препарата. Волюм-эспандерная терапия при септическом (дистрибутивном) шоке может достигать 40 и более мл/кг.
4. Инотропные препараты. Допамин – вазоактивный препарат первой линии в начальной дозе 5 мкг/кг/мин с повышением дозы по мере необходимости [5]. Дозу повышают пошагово, шаг- от 2,0-2,5 до 10 мкг/кг/мин каждые 10-15 мин. Исключение составляет состояние ПЛГ, когда препаратом первой линии может стать добутамин с 5 мкг/кг/мин, увеличивая дозу с шагом 2,0 мкг/кг/мин каждые 10-15 мин. Добутамин (как стартовый препарат) может назначаться при ПЛГ, изолированно или одновременно с допамином.
5. Предварительная оценка вида шока (гиповолемический, дистрибутивный (септический), кардиогенный). Начальные мероприятия направлены на поддержание сосудистого пространства и обеспечение поддержки тонуса миокарда и стенок сосудов, коррекцию гипоперфузии органов и тканей. Дальнейшие действия будут зависеть от полученных результатов обследования.
6. Анализ крови на КОС, электролиты, глюкозу, лактат, посев крови (другие исследования, предусмотренные при ухудшении состояния, в соответствии с внутренним протоколом отделения). Подсчет диуреза за предыдущие часы. При необходимости коррекция анемии, ацидоза, дисэлектолитных нарушений, смена антибактериальной терапии.
7. Эхокардиография для исключения ВПС с оценкой сократительной способности миокарда, системного кровотока (СВ левого желудочка, кровоток в ВПВ), гемодинамической значимости фетальных коммуникаций:
а) при нормальной сократительной способности и низком АД продолжить увеличение допамина до 15- 20 мкг/кг/мин;
б) при сниженной сократительной способности миокарда и/или высокой легочной гипертензии – добутамин с 5 до 20 мкг/кг/мин, увеличивая на 2-5 мкг/кг/мин каждые 15 мин.
Если у новорожденного сохраняется гиповолемия, высокие дозы инотропных препаратов могут вызвать тахикардию. В этом случае следует увеличить волемическую нагрузку (Dempsey et all, 2009).
8. При неэффективности предшествующей терапии и суммарной дозе инотропных препаратов (допамин +добутамин) 25 мкг/кг/мин:
а) для детей с ЭНМТ назначается гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости доза увеличивается до 2-2,5 мг/кг каждые 4 ч) [6]. Можно использовать дексаметазон (0,5 мг/кг, при необходимости повторное введение каждые 2-6 ч) [7]. При отсутствии эффекта от введения кортикостероидов или кратковременном эффекте в терапию включается адреналин 0,05-0,3 мкг/кг/мин. Каждые 15 мин увеличение дозы на 0,1 мкг/кг/мин, максимальные дозы при шоке могут достигать 3-5 мкг/кг/мин.
У детей с ЭНМТ оправданно использование нескольких инотропных препаратов одновременно с целью снижения необходимой дозы адреналина, так как использование адреналина сопряжено с рядом побочных эффектов (повышение тонуса мезентериальных сосудов, гипергликемия, увеличение тонуса легочных сосудов, развитие гипертрофии миокарда) [8];
б) для детей с весом более 1000 г назначается адреналин (0,1-0,5 мкг/кг/мин). Каждые 15 мин увеличение дозы на 0,1 мкг/кг/мин. При отсутствии эффекта от увеличения дозы адреналина назначают кортикостероиды: гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости дозу увеличивают до 2-2,5 мг/кг каждые 4 ч). Можно использовать дексаметазон (0,5 мг/кг, при необходимости повторное введение каждые 2-6 ч). После назначения адреналина возможен переход на монотерапию адреналином или сочетание нескольких инотропных препаратов.
Кортикостероиды при терапии шока вводят болюсно, введение кортикостероидов в виде продленной инфузии может рассматриваться в исключительных случаях по жизненным показаниям.
9. При неэффективности описанной терапии и подтвержденной нормальной сократимости миокарда можно использовать норадреналин [9].
Норадреналин в большей степени увеличивает общее периферическое сопротивление сосудов, что приводит к увеличению постнагрузки. При условии здорового миокарда это может привести к увеличению сократимости. При пораженном миокарде повышение постнагрузки сопровождается снижением СВ. Эффективное и безопасное применение норадреналина возможно после эхокардиографического исследования с оценкой сократительной способности миокарда. Применяется при артериальной гипотонии на фоне сохранной сократительной способности миокарда, только после волемической нагрузки, обычно в комбинации с другими инотропными препаратами. Рекомендованы начальная доза и скорость введения от 0,1 до 0,3 мкг/кг/мин. Максимальная доза и скорость введения могут достигать 3-5 мкг/кг/мин (см. Препараты, приложение 2).
10. Решение о необходимости продолжения введения повышенного объема инфузии принимается на основании клинических данных и данных эхокардиографии:
Повторное введение волюм-эспандеров возможно на любом из этапов терапии шока.
Целевые показатели терапии – через час от начала лечения достичь следующих показателей:
· укорочение длительности симптома “белого пятна” ≤ 3 с;
· нормализация пульса, т. е. отсутствие разницы между центральным и периферическим пульсом;
· нормализация кожной температуры конечностей (разница центральной (ректальная) и периферической (тыльная поверхности стопы) температуры <3 °С);
· нормализация АД (среднее АД в мм рт. ст. больше ГВ в нед, для детей ГВ менее 30 нед – более 30 мм рт. ст.);
· разница пре- и постдуктальной сатурации <5%;
· сатурация крови 90-95%;
· снижение уровня лактата; актуально не абсолютное значение, а динамика снижения;
· увеличение темпа диуреза является одним из целевых параметров терапии шока, однако через час от начала лечения диурез может оставаться нарушенным.
Отмена инотропных препаратов
При использовании высоких доз адреналина возможна как отмена других инотропных препаратов (допамин, добутамин), так и использование нескольких инотропных препаратов одновременно.
При стабилизации состояния в первую очередь снижают дозу и отменяют норадреналин, затем, по возможности, адреналин, затем добутамин, инфузия допамина в невысоких дозах требуется обычно в течение нескольких суток. Кортикостероиды отменяются сразу после стабилизации АД, в том числе на фоне использования инотропных препаратов.
VIII. Особенности мониторинга состояния новорожденного после перенесенного шока
Следствиями шокового состояния могут быть повреждение и дисфункция многих органов и систем. В связи с этим после стабилизации состояния необходимо:
1. Ежедневно:
a. контроль диуреза;
b. своевременная коррекция объема вводимой жидкости, состава парентерального питания, дозировки нефротоксичных препаратов в зависимости от функции почек;
2. 1 раз в 3-4 дня в течение 1-й недели:
a. биохимия крови – креатинин, электролиты, белок, печеночные ферменты;
b. общий анализ мочи;
c. мониторинг сократительной способности миокарда и показателей центральной гемодинамики;
d. УЗИ головного мозга.
3. 1 раз в неделю:
a. гемостазиограмма.
Шоковое поражение кишечника может привести к желудочно-кишечным кровотечениям, некротизирующему энтероколиту (особенно у недоношенных новорожденных).Энтеральное питание может быть возобновлено после стабилизации состояния с небольших объемов через 48-72 ч после эпизода шока. В группе высокого риска находятся дети, получавшие в период терапии шока гидрокортизон в сочетании с адреналином и, особенно, норадреналином.
Литература
1. Jonathan M. Fanaroff, Avroy A. Fanaroff. Blood pressure disorders in neonate: Hypotension and hypertension // Semin. Fetal Neonatal Med. – 2006. – Vol. xx. – P. 1e.
2. Cordero L., Сhristopher J. Timan, Heather H. Waters, Larry A. Sachs. Mean Arterial Pressures during the First 24 Hours of Life in 600-Gram Birth Weight Infants // J. Perinatol. – 2002. – Vol. 22. – P. 348-353.
3. Tibby S.M., Hatherill M., Murdoch I.A. Capillary refill and coreperipheral temperature gap as indicators of haemodynamic status in paediatric intensive care patients // Arch. Dis. Child. – 1999. – Feb. – Vol. 80(2). – P. 163-166.
4. Kissoon N., Orr R.A., Carcillo J. Updated American College of Critical Care Medicine Pediatric Advanced Life Support Guidelines for Management of Pediatric and Neonatal Septic Shock. Relevance to the Emergency Care Clinician // Pediatr. Emerg. Care. – 2010. – Vol. 26. – P. 867-869.
5. Wynn J.L., Wong H.R. Pathophysiology and Treatment of Septic Shock in Neonates // Clin. Perinatol. – 2010. – June. – Vol. 37(2). – P. 439-479.
6. Ibrahim H., Sinha I.P., Subhedar N.V. Corticosteroids for treating hypotension in preterm infants // Cochrane Database Syst. Rev. – 2011 Dec. 7. – Is. 12: CD003662. doi: .1002/14651858. CD003662.pub4.
7. Noori S., Siassi B., Durand M. et al. Cardiovascular effects of low-dose dexamethasone in very low birth weight neonates with refractory hypotension // Biol. Neonate. – 2006. – Vol. 89(2). – P. 82-87.
8. Valverde E., Pellicer A., Madero R. et al. Dopamine versus epinephrine for cardiovascular support in low birth weight infants: analysis of systemic effects and neonatal clinical outcome // Pediatrics. – 2006. – Jun. – Vol. 117(6). – P. e1213-1222.
9. Decembrino L., Ruffinazzi G., D’Angelo A. et al. Septic Shock in Neonates, Severe Sepsis and Septic Shock – Understanding a Serious Killer / Ed. Dr Ricardo Fernandez. – 2012. ISBN: 978-953-307-950-9, InTech, Available from:https://www. intechopen.com/books/severe-sepsis-and-septic-shockunderstandinga-serious-killer/septic-shockin-neonates
10. Barrington K.J. Hypotension and shock in the preterm infant // Semin. Fetal Neonatal Med. – 2008. – Feb. – Vol. 13(1). – P. 16-23.
11. Barrington K.J. Common Hemodynamic Problems in the Neonate // Neonatology. – 2013. – Vol. 103. – P. 335-340.
Источник
Синдром токсического шока — тяжелое острое полиорганное поражение, вызванное экзотоксинами золотистого стафилококка или пиогенного стрептококка. Проявляется внезапным повышением температуры до 38,9°С и более, падением артериального давления, эритематозными кожными высыпаниями с последующим шелушением, профузным поносом, рвотой, признаками поражения разных органов и систем. Диагноз СТШ устанавливают на основе клинической картины, данных физикального обследования, лабораторных, в том числе бактериологических, анализов. Лечение предусматривает санацию бактериального очага, назначение антибиотиков, инфузионной и симптоматической терапии.
Общие сведения
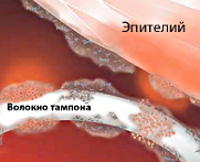
Синдром токсического шока (СТШ) впервые диагностирован в 1978 г. у семи детей со стафилококковой инфекцией. Специалисты в области гинекологии столкнулись с ним двумя годами позже, отметив связь развития синдрома у молодых женщин с использованием суперадсорбирующих гигиенических тампонов во время месячных. Абсолютное большинство пациенток — женщины в возрасте 17-30 лет. Приблизительно у половины из них развитие синдрома связано с менструацией. В четверти случаев неменструального СТШ заболевание возникает в послеродовом периоде у носительниц Staphylococcus aureus, в 75% — в результате других причин (кожного и подкожного инфицирования, перенесенных операций с тампонированием и пр.).
Синдром токсического шока
Причины СТШ
Синдром токсического шока вызывают экзотоксин-продуцирующие микроорганизмы, оказывающие системное воздействие на разные органы и ткани, — золотистый стафилококк (Staphylococcus aureus) и пиогенный β-гемолитический стрептококк группы А (Streptococcus pyogenes). В большинстве случаев заболевание возникает не в момент первичного заражения бактериями, а на фоне носительства инфекционных возбудителей при воздействии следующих предрасполагающих факторов:
- Использование тампонов. Вероятность развития СТШ возрастает при пользовании гигиеническими средствами с повышенными адсорбирующими свойствами и нарушении рекомендуемой частоты их замены.
- Использование интравагинальных контрацептивов. Наличие во влагалище диафрагм, губок, колпачков создает благоприятные условия для размножения микроорганизмов.
- Нарушение целостности слизистых оболочек. При травмах половых органов, наличии в матке остатков плацентарной ткани, плодных оболочек, крови после родов и гинекологических операций возникают оптимальные условия для бактериального обсеменения и проникновения микроорганизмов или их токсинов в кровь.
Неменструальный синдром токсического шока может осложнять хирургические процедуры, при которых применяется перевязочный материал, накапливающий кровь (операции на полости носа с использованием турунд, тампонирование ран и др.), и травматические повреждения кожи. Сочетание указанных факторов с вирусными заболеваниями (ветрянкой, гриппом), приемом иммуносупрессивных препаратов повышает риск развития токсемии и бактериемии.
Патогенез
Ключевую роль в развитии синдрома токсического шока играют механические и химические воздействия, которые способствуют размножению бактерий и влияют на проницаемость тканей. Пусковым моментом служит проникновение в кровь значительных количеств специфических токсинов (TSST) и их взаимодействие с Т-лимфоцитами. В результате массивно высвобождаются цитокины, вызывающие полиорганную токсическую реакцию. Расширяются сосуды и повышается проницаемость их стенки, что приводит к перемещению плазмы крови и сывороточных протеинов во внесосудистое пространство. При этом наблюдается резкое падение давления, возникают отеки, нарушается коагуляция, повышается температура. Под влиянием опосредованных иммунных реакций и прямого действия токсинов поражаются кожа, паренхима печени, легких и других органов.
Симптомы СТШ
У менструирующих женщин, использующих тампоны, признаки СТШ появляются на 3—5-й день менструации. При синдроме токсического шока, осложнившем роды или гинекологические операции, патология проявляется в первые 2 дня послеродового или послеоперационного периода. Как правило, заболевание возникает остро. В редких случаях наблюдается продром в виде общего недомогания, тошноты, головной и мышечных болей. Первым признаком СТШ становится сильный озноб с повышением температуры до 39—40°С, после чего в течение 1—4 суток разворачивается полная клиническая картина.
Практически у всех пациенток возникают мышечная слабость и диффузные боли в мышцах, особенно в мускулатуре проксимальных отделов конечностей, брюшного пресса и спины. Часто беспокоят боли в суставах. Более чем 90% заболевших отмечают упорную рвоту и профузный водянистый понос, скудное количество мочи. Возникают першение в горле, парестезии, головная боль, светобоязнь, головокружение и обмороки на фоне падения АД. В ряде случаев беспокоит кашель, болезненные ощущения при глотании. В острой стадии, длящейся от 24 до 48 часов, пациентка выглядит заторможенной и дезориентированной.
Специфическое проявление синдрома — кожные высыпания в виде диффузного покраснения, которое напоминает солнечный ожог и начинает постепенно бледнеть на протяжении первых 3 дней. В последующем возникает грубое шелушение кожи, особенно заметное на подошвах и ладонях. У некоторых женщин покраснение носит характер пятен различных размеров, к которым присоединяются мелкие узелковые высыпания или точечные петехиальные кровоизлияния. Почти у четверти заболевших на 5—10-е сутки возникает сильный зуд на фоне пятнисто-узелковой сыпи. Практически у 100% пациенток к концу 1—2-ой недели наблюдается неглубокое генерализованное чешуйчатое отслаивание кожного эпителия с более выраженным пластинчатым шелушением ладоней, подошв, пальцев рук и ног. Половина пациенток, перенесших СТШ, к концу 2—3-го месяца отмечает выпадение волос и схождение ногтей.
Почти в 3/4 случаев выявляются гиперемия конъюнктивы, покраснение задней стенки глотки и слизистой рта, малиново-красный цвет языка. Каждую третью менструирующую женщину с СТШ беспокоят болезненность и отечность в области больших и малых половых губ. При тяжелом течении синдрома возникают признаки токсического поражения печени, почек, дыхательной системы с преходящей желтушностью кожи, болью в животе, пояснице, правом подреберье, помутнением мочи, одышкой и т. п.
Кроме клинически выраженного синдрома токсического шока, существует его стертая форма (при первичном проявлении или повторном эпизоде): у пациентки повышается температура, возникает озноб, умеренные мышечные боли, тошнота, рвота, понос, першение в горле. Однако артериальное давление не снижается, и патологическое состояние разрешается без лечения.
Осложнения
При тяжелом течении синдрома наблюдается токсический шок, приводящий к нарушению микроциркуляции и усугубляющий поражение паренхиматозных органов. Возникает дыхательная недостаточность с одышкой и ухудшением оксигенации крови, ДВС-синдром с тромбоэмболией и обильными кровотечениями, нарушается сердечный ритм, в результате острого тубулярного некроза отказывают почки. У пациенток со стрептококковым СТШ более чем в 50% случаев развиваются бактриемия и некротизирующий фасциит. В отдаленном периоде возможна временная потеря ногтей и волос, неврологические нарушения (парестезии, расстройства памяти, повышенная утомляемость).
Диагностика
С учетом полиорганного характера заболевания для постановки диагноза необходимо оценивать как локальные изменения со стороны женских органов, так и признаки нарушения других систем. В комплексное обследование включены:
- Осмотр гинеколога. Выявляются отечность и гиперемия половых органов, в некоторых случаях — скудные выделения гнойного характера из цервикального канала. Пальпаторно может определяться болезненность в области придатков.
- Физикальное обследование. В 100% случаев наблюдается повышение температуры более 38,9°С и падение систолического давления ниже 90 мм рт.ст. (обычно с ортостатическим снижением на 15 мм рт.ст.).
- Общеклинические анализы. Для ОАК характерны лейкоцитоз с высоким нейтрофилезом, сдвиг лейкоцитарной формулы влево, тромбоцитопения, анемия, повышение СОЭ. В общем анализе мочи определяется аномальный мочевой осадок с выщелоченными эритроцитами и стерильной пиурией.
- Биохимический анализ крови. При нарушенной функции печени повышаются уровень билирубина и активность трансфераз (выявляется почти у половины заболевших), при почечной недостаточности возникает азотемия, креатининемия, при поражении мышц — повышенное содержание КФК. В коагулограмме увеличивается протромбиновое время и частичное тромбопластиновое время, определяются продукты деградации фибрина. Анализ крови на электролиты выявляет метаболический ацидоз, снижение уровня кальция, фосфора, натрия, калия.
- Методы определения возбудителя. Для выявления инфекционного агента используют бакпосев мазка из половых органов с антибиотикограммой и посев крови (показан при подозрении на стрептококковый СТШ). Серологические исследования позволяют провести оценку показателей иммунной системы, исключить инфекционные заболевания со сходной клинической картиной.
- Инструментальная диагностика. ЭКГ позволяет своевременно выявить нарушения сердечного ритма. Флюорография или рентгенография ОГК рекомендованы для оценки состояния легких.
Синдром ТШ дифференцируют от сепсиса и инфекционных заболеваний (кори, скарлатины, лептоспироза, гепатита В, пятнистой лихорадки Скалистых гор, брюшного тифа, менингококцемии, вирусных экзантем). Пациентку консультируют анестезиолог-реаниматолог, инфекционист, кардиолог, хирург, уролог, дерматолог, пульмонолог, невропатолог.
Лечение синдрома токсического шока
При выборе схемы лечения синдрома токсического шока важно предусмотреть воздействие на факторы, вызвавшие заболевание, и мероприятия для стабилизации функций пораженных систем. Пациентке показаны:
- Санация бактериального очага. В первую очередь удаляют тампон, диафрагму, колпачок (при их наличии) и промывают влагалище стерильным раствором. При выявлении бактериально обсемененных ран возможно иссечение тканей с участками некроза.
- Антибиотикотерапия. Выбор препарата основан на результатах определения чувствительности к противомикробным средствам. До получения таких данных назначается эмпирическая терапия с учетом вероятного возбудителя и его возможной антибиотикорезистентности. Курс составляет до 10 дней.
- Инфузионная терапия. Ключевой элемент лечения — восстановление внутрисосудистого объема жидкости и стабилизация показателей гемодинамики. В зависимости от характера нарушений пациентке вливают кристаллоидные растворы, электролиты, свежезамороженную плазму крови, тромбоцитарную массу и т. п.
- Вазопрессорные средства. Если коррекция объема внутрисосудистой жидкости не позволяет нормализовать АД, вводят препараты с прессорным эффектом.
При выраженной органной недостаточности пациентке могут назначаться гемодиализ (при острой почечной недостаточности), искусственная вентиляция легких с положительным давлением на выдохе (при респираторном дистресс-синдроме). Ряд авторов отмечают более быстрое выздоровление при назначении кортикостероидов и иммуноглобулинов.
Прогноз и профилактика
В большинстве случаев благодаря достижениям современной гинекологии, своевременной диагностике и лечению пациентки со стафилококковым СТШ выздоравливают за 1—2 недели, при этом смертность на современном этапе составляет 2,6%. Температура и АД нормализуются в течение 2-х суток с момента госпитализации, а лабораторные показатели — на 7—14-ый день. Уровень эритроцитов восстанавливается через 4—6 недель. При стрептококковом токсическом шоке смертность до сих пор остается высокой и достигает 50%. Для профилактики СТШ важно соблюдать рекомендации по использованию тампонов и протоколы обследования перед родами и гинекологическими операциями для своевременного выявления возбудителей.
Источник
