Синдром ван дер вуда это
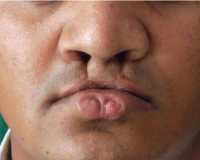
Синдром Ван дер Вуда – это генетически обусловленный комплекс орофациальных пороков, наиболее специфичными из которых являются лицевые расщелины, гиподонтия, парамедианные синусы нижней губы. Также встречаются другие диспластические стигмы: короткая язычная уздечка, аркообразный небный свод, редко – ВПС, аномалии развития конечностей. Обследование включает проведение генодиагностики, Rg/КТ лицевого черепа, УЗИ внутренних органов, оценку неврологического статуса. Лечение пороков ЧЛО хирургическое (хейлоринопластика, уранопластика). Детям с данным заболеванием требуется помощь логопеда-дефектолога.
Общие сведения
Синдром Ван дер Вуда (СВВ) – редко встречающаяся врожденная патология, для которой характерна триада челюстно-лицевых аномалий: ямочки в области нижней губы (80%), заячья губа либо волчья пасть (21%) и отсутствие некоторых зубов (10-81%). Как самостоятельное заболевание СВВ описан в 1954 г. Частота в европейской и азиатской популяции ‒ 1:80000–100000 независимо от пола новорожденных. Синдром Ван дер Вуда – самая частая генетическая причина челюстно-лицевых расщелин.

Синдром Ван дер Вуда
Причины
Синдром Ван дер Вуда является аутосомно-доминантным пороком развития с неполной с пенетрантностью (80%) и переменной экспрессивностью. Более 68% случаев патологии вызываются мутацией гена IRF6, который расположен в области 1q32-q41 на длинном плече 1-ой хромосомы.
Ген IRF6 кодирует особый белок ‒ интерферон-регулирующий транскрипционный фактор 6, функция которого заключается в регуляции дифференцировки эпителиальной ткани, в том числе, выстилающей полость рта и небо. Мутации IRF6 ассоциированы с синдромом Ван дер Вуда и фенотипически сходным синдромом подколенного птеригиума.
Меньшая часть случаев синдрома Ван дер Вуда (примерно 5%) связана с генетическим повреждением другого активатора эпидермальной дифференцировки ‒ гена GRHL3. Также рассматривается участие в развитии синдрома других генов-кандидатов, в частности, расположенных в регионе 17p11.2-p11.1.
Патогенез
Наследование дефектного гена происходит от одного из родителей, однако примерно 30-50% случаев заболевания вызваны мутациями de novo. Наиболее типичные для синдрома аномалии губ и неба формируются с между 30 и 50 днями внутриутробного развития.
В норме на 32 день эмбриогенеза имеются 4 центра развития нижней губы, разделенные одной срединной и двумя боковыми бороздами. К 38 дню происходит слияние зачатков с исчезновением бороздок. Однако при нарушении развития нижнечелюстного отростка боковые борозды сохраняются, и на 36 сутки эмбрионального развития из них формируются парамедианные синусы (ямочки) нижней губы.
Формирование расщелин губы (хейлосхизис) происходит в результате неполного слияния носолобного бугра и верхнечелюстного отростка. Расщепление твердого неба возникает вследствие неслияния нёбных выступов верхнечелюстных отростков.
Симптомы
Проявления синдрома Ван дер Вуда вариабельны даже внутри одной семьи. Основные орофациальные аномалии, характеризующие наследственную патологию, ‒ ямочки на губе, лицевые расщелины и гиподонтия ‒ могут встречаться в различных вариациях. 44% пациентов имеют ямочки без расщепления губы и неба, 26% ‒ ямочки с расщелинами, 10% ‒ расщелины без ямочек и 20% ‒ другие зубочелюстные аномалии, чаще гиподонтию.
Челюстно-лицевые расщелины при СВВ варьируют от субмукозных дефектов и односторонней заячьей губы до полного двустороннего расщепления неба и губы. С наличием этих дефектов у детей связан целый спектр проблем: трудности кормления, частые инфекции, открытая ринолалия.
Губные ямки, или парамедианные синусы, представляют небольшие углубления на нижней губе. Обычно они парные, их дно выстлано слизистой оболочкой, а внутри синусов образуется слюна, которая оттекает наружу через выводные протоки, открывающиеся на красной кайме. В некоторых случаях синдрома Ван дер Вуда встречаются свищи или кисты нижней губы. Все дети с подобными дефектами имеют визуально заметную деформацию губы.
У носителей синдрома часто отсутствуют некоторые зубы в обеих зубных дугах (резцы, клыки, премоляры). Нередко имеется готический свод неба, укороченная подъязычная связка, приводящая к раздвоению кончика языка.
Сопутствующие скелетные аномалии могут включать синдактилию кистей, гипоплазию большого пальца, косолапость. Другие ассоциированные пороки представлены добавочными сосками (полителия), шумами в сердце, врожденными кардиальными пороками. Интеллектуальное и физическое развитие при синдроме Ван дер Вуда не страдает.
Осложнения
Наличие целого ряда орофациальных пороков накладывает отпечаток на функционирование зубо-челюстной, дыхательной, речевой системы. Пациенты с небными расщелинами склонны к рецидивирующему течению ЛОР-инфекций: синусита, отита, ларинготрахеита. Аномальное развитие зубов приводит к формированию дефектного прикуса, нарушению жевания, раннему и множественному кариесу.
Постоянное выделение слюны из губных ямок вызывает хронический хейлит, возможно формирование мукоцеле и даже плоскоклеточного рака губы. В речевом статусе у детей выявляется ринолалия, реже – механическая дислалия, следствием которых становится ФФН либо ОНР.
Диагностика
Установление диагноза базируется на выявлении типичных клинических признаков, подтвержденных молекулярно-генетическим исследованием. Члены семьи должны быть проконсультированы медицинским генетиком, ребенок дополнительно – челюстно-лицевым хирургом, стоматологом, логопедом.
- Общий осмотр. Необходим для правильной оценки фенотипа. Для синдрома Ван дер Вуда патогномонично наличие ямок нижней губы в сочетании с небной или губной расщелиной, гиподонтией. Осуществляется оценка физического развития (антропометрия), исследование неврологического статуса.
- Генетическая диагностика. Врачом-генетиком проводится сбор семейного анамнеза, выявляются особенности течения беременности у матери больного ребенка. Методом прямого секвенирования выполняется поиск мутаций в гене IRF6 и при необходимости – в гене GRHL3, поиск выявленных мутаций у родственников.
- Обследование челюстно-лицевой системы. Требуется в предоперационном периоде для уточнения характера дефектов ЧЛО. Достаточной степенью информативности обладают рентгенография и КТ лицевого скелета, челюстей.
- Обследование других органов и систем. С целью исключения сопутствующих патологий выполняется УЗИ сердца и внутренних органов, ЭКГ. При наличии патологии скелета назначается рентгенография кистей рук, костей стопы. При подозрении на нейросенсорную тугоухость проводится аудиометрическая оценка слуха.
- Консультация логопеда. Показана детям, имеющим речевые проблемы, связанные с анкилоглоссией или расщелинами лица. В рамках логопедической диагностики обследуется звуковая сторона речи, фонематический слух, словарный запас, грамматика и пр. Определяется структура речевого дефекта, выстраивается план логотерапии.
Пренатальная диагностика синдрома Ван дер Вуда показана в том случае, если известно, что в семье есть носитель патогенного гена. Расщелины ЧЛО у плода могут быть обнаружены в ходе УЗИ-скрининга. Синдром Ване дер Вуда дифференцируют с несиндромными челюстно-лицевыми расщелинами, синдромом подколенной складки, синдромом Кабуки.
Лечение синдрома Ван дер Вуда
Хирургическое лечение
Коррекция аномалий челюстно-лицевой области проводится хирургическим путем. Сроки и методы зависят от характера дефектов, их влияния на жизнедеятельность пациента. Первичная ринохейлопластика выполняется в первые месяцы жизни ребенка, велофарингопластика – в 6-8 мес., уранопластика – в 10-14 мес. Также в раннем возрасте показано иссечение парамедианных синусов, врожденных свищей, кист нижней губы.
В дальнейшем осуществляются дополнительные реконструктивные операции (костная пластика альвеолярного отростка, эстетическая хейлопластика и др.). По показаниям решается вопрос о хирургической коррекции синдактилии, ВПС, удалении добавочных молочных желез.
Другое лечение и реабилитация
Занятия с логопедом проводятся как до оперативного лечения, так и после него. Обязательными компонентами речевой реабилитации являются логопедический массаж, дыхательная и артикуляционная гимнастика. Ведется работа над формированием полноценного небно-глоточного смыкания, правильного звукопроизношения, фонематического слуха, связной речи, голосовых модуляций.
Кариозные очаги подлежат санации, нарушения прикуса требуют исправления с помощью брекет-систем. Ребенка и родителей обучают правилам гигиены полости рта.
Прогноз и профилактика
Качество жизни пациентов с синдромом Ван дер Вуда зависит от количества и сочетания аномалий развития, возможности и сроков их коррекции. Изолированные расщелины ЧЛО подлежат хирургическому лечению в раннем детстве. В дальнейшем дети могут вести полноценный образ жизни наравне со сверстниками. Утяжеляет прогноз наличие пороков жизненно важных органов.
Профилактическая работа ведется в направлении медико-генетического консультирования, прогнозирования вероятности возникновения синдрома Ван дер Вуда у последующих поколений. При выявлении пороков развития плода в рамках пренатального ультразвукового скрининга беременных родителей информируют о возможных рисках и тактике лечения.
Источник
Синдром Ван дер Вуда является аутосомно-доминантным синдромом, который характеризуется развитием расщелин губ или нёба, развитием отличительных ямок в нижней губе, или в обоих губах. Это наиболее распространенный синдром, связанный с заячьей губой или волчьей пастью.
Синдром Ван дер Вуда. Причины
Синдром Ван дер Вуда имеет аутосомно-доминантный признак. Ген синдрома Ван дер Вуда находится на первой хромосоме в регионе 1q32-q41. Совсем недавно, исследователи предположили, что за развитие этого синдрома также может отвечать еще два других гена. Первый ген находится на хромосоме 17 в регионе 17p11.2-p11.1. И второй ген — IRF-6 (теоретически), который был идентифицирован как специфический. По второму гену еще остаются вопросы, так как исследования над ним проводились на лабораторных мышах. И мутации в этом гене приводили к развитию проблем в регуляции развития лицевых костей плода у мышей.
Синдром Ван дер Вуда. Патофизиология
Наиболее известные и устойчивые проявления синдрома Ван дер Вуда (аномалии неба и губ) уже начинают развиваться в спустя 30-50 дней после зачатия ребенка. В большинстве реальных случаев развитие этого синдрома было связано с делециями в хромосоме №1 в регионе 1q32-q41. Возможно, ответственность за развитие этого синдрома может также лежать на мутациях в гене IRF-6, но точный механизм влияния мутаций в этом гене на развитие черепно-лицевых аномалий является неопределенным. Ну и как мы уже говорили выше, мутации в хромосоме №17 в регионе 17p11.2-p11.1 также имеют отношение к развитию этого синдрома.
Синдром Ван дер Вуда. Симптомы и проявления
Орофациальные проявления
- Синдром Ван дер Вуда характеризуется развитием расщелин в губах и / или в нёбе и отличительными ямками в нижней губе. Эта комбинация присутствует у приблизительно 70% лиц с этим синдромом, но присутствует менее чем у половины тех, кто является носителем дефектного гена.
- Тяжесть проявлений может варьироваться в широких пределах, даже у членов одной семьи.
Заячья губа и волчья пасть
- Заячья губа и волчья пасть являются относительно распространенным проявлением синдрома.
- Тяжесть этих аномалий варьируется в широких пределах и может быть односторонней или двусторонней.
- Субмукозная волчья пасть также является очень частым проявлением и она может быть легко пропущенна во время обычного физического обследования.
- Раздвоенный язычок также может присутствовать у некоторых лиц с синдромом Ван дер Вуда.
Ямки на губах
- Образование ямок на губах является довольно своеобразным проявлением. Ямки, как правило, медиальные, часто (но не всегда) появляются на ярко-красной части нижней губы. И уже с возрастом, они часто становятся простыми и относительно малозаметными углублениями. Тем не менее, глубина, диаметр и другие хар-ки этих ямок могут сильно изменяться между несколькими лицами с этим синдромом. Эти ямки, как правило, двусторонние и наиболее часто встречаются на нижней губе, хотя на сегодня уже также известно и о существовании других моделей расположения этих ямок.
- У некоторых детей, в ямках можно обнаружить постоянные накопления слюны, это может происходить из-за того, что в этих ямках могут находиться дополнительные слюнные железы.
Заячья губа и волчья пасть у младенца с синдромом Ван дер Вуда
У этого же ребенка, с синдромом Ван дер Вуда, на нижней губе расположено две ямки
Интраоральный вид заячьей губы и волчьей пасти у ребенка с синдромом
Зубы: гиподонтия (отсутствие некоторых зубов) является одним из самых распространенных зубных проявлений у детей с этим синдромом, чаще всего у детей отсутствуют боковые резцы на нижней челюсти. В некоторых случаях, это может быть единственным проявлением. Другие пероральные проявления: хотя они и редко встречаются, эти другие проявления включают врожденную адгезию челюстей, узкое, высокое, арочное небо и анкилоглоссию. Внеротовые проявления:
- Внеротовые проявления встречаются редко, но они включают развитие аномалий конечностей и развитие аномалий в головном мозгу.
- В некоторых случаях, внеротовые проявления могут быть несвязанными или очень нечастыми, что может привести в замешательство работников здравоохранения.
Синдром Ван дер Вуда. Диагностика
Хотя постановка диагноза синдрома Ван дер Вуда, прежде всего, проводится на основе определения клинических проявлений и аномалий, хромосомный анализ может быть целесообразным у большинства пациентов. Эта технология быстро улучшается и ее можно проводить неинвазивно с использованием образцов тканей, которые можно легко и безболезненно получить от пациента (например, кусок ногтя).
Синдром Ван дер Вуда. Лечение
Наряду с тщательным анализом аномалий, тщательно общее физическое обследование может помочь в определении других связанных с синдромом отклонений, например это касается сердечно-сосудистой системы, мочеполовой системы, конечностей или других органов и систем. Расщелины губ и нёба или другие аномалии часто требуют хирургического вмешательства.
- Реконструкция нижней губы может включать применение аллотрансплантата.
- Даже у менее пострадавших лиц, хирургическое иссечение ямок на губе выполняется часто, это необходимо для облегчения дискомфорта или в косметических целях (например, для улучшения внешнего вида губ или для уменьшения слизистых выделений). Хирургическое удаление слюнных путей проводится очень редко, так как эта операция может быть сложной задачей, а сложности могут заключаться в том, что эти пути могут быть довольно длинными и они могут проникать в другие близлежащие структуры.
Синдром Ван дер Вуда. Осложнения
Волчья пасть может быть связана с трудностями в кормлении, речи. Такие дети также часто развивают средний отит и потерю слуха.
Синдром Ван дер Вуда. Прогноз
Тяжесть синдрома Ван дер Вуда варьирует в широких пределах, даже в отдельных семьях. Примерно 25% людей с синдрома являются бессимптомными или ощущают только минимальный дискомфорт, связанный с отсутствующими зубами или с углублениями в нижней губе. С другой стороны, другие лица могут иметь серьезные аномалии губ или неба. Ямы в губе часто связаны с дополнительными слюнными железами, которые иногда приводят к неловкому видимому слюновыделению.
Источник
Van der Woude syndrome (VDWS) is a genetic disorder characterized by the combination of lower lip pits, cleft lip with or without cleft palate (CL/P), and cleft palate only (CPO).[1] The frequency of orofacial clefts ranges from 1:1000 to 1:500 births worldwide, and there are more than 400 syndromes that involve CL/P.[2] VWS is distinct from other clefting syndromes due to the combination of cleft lip and palate (CLP) and CPO within the same family. Other features frequently associated with VWS include hypodontia in 10-81% of cases, narrow arched palate, congenital heart disease, heart murmur and cerebral abnormalities, syndactyly of the hands, polythelia, ankyloglossia, and adhesions between the upper and lower gum pads.[3]
The association between lower lip pits and cleft lip and/or palate was first described by Anne Van der Woude in 1954. The worldwide disease incidence ranges from 1:100,000 to 1:40,000.[4]
Genetics[edit]
Van der Woude syndrome is inherited as an autosomal dominant disease caused by a mutation in a single gene with equal distribution between the sexes. The disease has high penetrance at about 96% but the phenotypic expression varies from lower lip pits with cleft lip and cleft palate to no visible abnormalities.[2][4] Approximately 88% of VWS patients display lower lip pits, and in about 64% of cases lip pits are the only visible defect. Reported clefting covers a wide range including submucous cleft palate, incomplete unilateral CL, bifid uvula, and complete bilateral CLP. VWS is the most common orofacial clefting syndrome, accounting for 2% of CLP cases.[3]
The majority of VWS cases are caused by haploinsufficiency due to mutations in the interferon regulatory factor 6 gene (IRF6) on chromosome 1 in the 1q32-q41 region known as VWS locus 1. A second, less common, causative locus is found at 1p34, known as VWS locus 2 (VWS2). More recent work has shown that GRHL3 is the VWS2 gene. Grhl3 is downstream of Irf6 in oral epithelium, suggesting a common molecular pathway leading to VWS. Prior work also suggested WDR65 as a candidate gene.[4][5]IRF6 contains two non-coding and seven coding exons and is part of a family of nine transcription factors with a highly conserved helix-turn-helix DNA binding domain called the Smad-interferon regulatory factor binding domain (SMIR). Mutations in coding or non-coding IRF6 exons can result in Van der Woude syndrome.[2] Due to the wide range of expressivity, it is also believed that other unidentified loci contribute to disease development.[4]
An example of the clear phenotypic variability is a monozygotic twin study conducted by Jobling et al. (2010). Two monozygotic female twins had the same IRF6 mutation; however Twin A was born with a bilateral cleft lip, whereas Twin B had bilateral lip pits and no orofacial clefting. Both twins were diagnosed with VWS. The twins’ father had lip pits alone and a family history of CLP, CP, CL, and/or lip pits. Both twins were diagnosed with VWS. Polymerase chain reaction (PCR) amplification was done for all exons of IRF6, and a missense mutation was discovered in exon 4. The tyrosine in the normal protein at this position is conserved across mammals, frogs, and chickens, so despite the fact that it was a previously unreported mutation, it was expected to be deleterious. This study is not the first case of different phenotypes occurring between monozygotic twins. Possible causes of phenotypic variability include variations in the intrauterine environment, epigenetic differences, or chance effects.[6]
Pathophysiology[edit]
Lip pits were first reported in 1845 by Demarquay who thought they were indentations made by the upper incisors. Today it is known that they occur during embryogenesis due to IRF6 mutations. On day 32 of embryonic development there are four growth centers of the lower lip divided by two lateral grooves and one median. By day 38 of normal development, the grooves have disappeared. However, when growth of the mandibular process is impeded, a lip pit occurs. Lip pits begin to develop on day 36. Cleft lip begins to develop on day 40, and cleft palate emerges on day 50 of development.[3]
There are three types of lip pits, which are classified according to their location: midline upper, comissural, and lower lip. The most common phenotype is two symmetrical lower lip pits flanking both sides of the midline in the bilateral paramedial sinuses. Lower lip pits may also be bilaterally, unilaterally, or medially asymmetrical. The occurrence of a single lip pit is considered incomplete expression, and it typically occurs on the left side of the lower lip. There are also three different shapes for lip pits, the most common being circular or oval; less common forms include slit-like or transverse. The lip pits extend into the orbicularis oris muscle, ending in blind sacs surrounded by mucous glands. In some cases mucous is excreted when the muscles contract.[3]
Diagnosis[edit]
Clinical diagnosis based on orofacial clefts and lip pits typically occurs shortly after birth. Certain defects may be difficult to diagnose, particularly a submucous cleft palate. This form of CP may not be detected except through finger palpation, as the mucosa covering the palate is intact, but the muscles underneath have lost their proper attachments. Feeding problems, impaired speech, and hearing loss are symptoms of a submucous cleft palate.[4] Furthermore, approximately 15% of VWS cases with orofacial clefts, in the absence of prominent lip pits, cannot be easily distinguished from non-syndromic forms of orofacial clefting.[7] Therefore, it is very important to closely examine these patients as well as their relatives for lip pits, especially when there is a family history of mixed clefting, in order to make the VWS diagnosis.[3] Dentists may also play an important role in diagnosing cases not detected at birth, as they detect hypodontia commonly associated with VWS. The
patients most commonly lack the upper second premolars followed by the lower second premolars and upper lateral incisors. The absence of these teeth might play a role in the constricting of the dental arches.[3][4]
The clinical signs seen in VWS are similar to those of popliteal pterygium syndrome (PPS), which is also an autosomal dominant disease. Approximately 46% of affected individuals have lip pits; other features include genital abnormalities, abnormal skin near nails, syndactyly of fingers and toes, and webbed skin. The disease is also caused by mutations in IRF6; however, they occur in the DNA-binding domain of IRF6 and result in a dominant negative effect in which the mutated IRF6 transcription factor interferes with the ability of the wild type copy to function, in the case of a heterozygous individual.[2]
Genetic Counseling[edit]
Genetic counseling for VWS involves discussion of disease transmission in the autosomal dominant manner and possibilities for penetrance and expression in offspring.[3] Autosomal dominance means affected parents have a 50% chance of passing on their mutated IRF6 allele to a their child. Furthermore, if a cleft patient has lip pits, he or she has a ten times greater risk of having a child with cleft lip with or without cleft palate than a cleft patient who does not have lip pits.[4] Types of clefting between parents and affected children are significantly associated; however, different types of clefts may occur horizontally and vertically within the same pedigree. In cases where clefting is the only symptom, a complete family history must be taken to ensure the patient does not have non-syndromic clefting.[3]
Treatment[edit]
Lip pits may be surgically removed either for aesthetic reasons or discomfort due to inflammation caused by bacterial infections or chronic saliva excretion, though spontaneous shrinkage of the lip pits has occurred in some rare cases. Chronic inflammation has also been reported to cause squamous-cell carcinoma. It is essential to completely remove the entire lip pit canal, as mucoid cysts can develop if mucous glands are not removed. A possible side effect of removing the lip pits is a loose lip muscle. Other conditions associated with VWS, including CL, CP, congenital heart defects, etc. are surgically corrected or otherwise treated as they would be if they were non-syndromic.[3]
References[edit]
- ^ “Van der Woude syndrome | Genetic and Rare Diseases Information Center (GARD) – an NCATS Program”. rarediseases.info.nih.gov. Retrieved 2018-04-17.
- ^ a b c d Malik S, Kakar N, Hasnain S, Ahmad J, Wilcox ER, Naz S (2010). “Epidemiology of Van der Woude syndrome from mutational analyses in affected patients from Pakistan”. Clinical Genetics. 78 (3): 247–256. doi:10.1111/j.1399-0004.2010.01375.x. PMID 20184620.
- ^ a b c d e f g h i Rizos M, Spyropoulos MN (2004). “Van der Woude syndrome: a review. Cardinal signs, epidemiology, associated features, differential diagnosis, expressivity, genetic counselling, and treatment”. European Journal of Orthodontics. 26 (1): 17–24. doi:10.1093/ejo/26.1.17. PMID 14994878.
- ^ a b c d e f g Lam AK, David DJ, Townsend GC, Anderson PJ (2010). “Van der Woude syndrome: dentofacial features and implications for clinical practice”. Australian Dental Journal. 55 (1): 51–58. doi:10.1111/j.1834-7819.2009.01178.x. PMID 20415912.
- ^ [1], OMIM Van der Woude Syndrome 2
- ^ Jobling R, Ferrier RA, McLeod R, Petrin AL, Murray JC, Thomas MA (2011). “Monozygotic twins with variable expression of Van der Woude syndrome”. American Journal of Medical Genetics. 155A (8): 2008–2010. doi:10.1002/ajmg.a.34022. PMC 3140610. PMID 21739575.
- ^ Salahshourifar I, Sulaiman WA, Halim AS, Zilfalil BA (2012). “Mutation screening of IRF6 among families with non-syndromic oral clefts and identification of two novel variants: review of the literature”. European Journal of Medical Genetics. 55 (6–7): 389–393. doi:10.1016/j.ejmg.2012.02.006. PMID 22440537.
External links[edit]
Источник
