Синдромы вызванные нарушениями х хромосомы называются
Хромосомные болезни (греческий chroma цвет, окраска + soma тело) — группа болезней, в основе развития которых лежат нарушения числа или структуры хромосом, возникающие в гаметах (зрелых половых клетках) родителей или на ранних стадиях дробления зиготы (оплодотворенной яйцеклетки).
История изучения хромосомных болезней берет начало с клин, исследований, проводившихся задолго до описания хромосом человека (см. Хромосомы) и открытия хромосомных аномалий. Некоторые хромосомные болезни (например, болезнь Дауна) были описаны клиницистами как самостоятельные нозологические формы еще до раскрытия их хромосомной природы.
С 1959 года, когда франц. исследователи Ж. Лежен, Готье (М. Gauthier) и Тюрпен (R. Turpin) впервые описали нарушение кариотипа при болезни Дауна (см. Дауна болезнь, Кариотип), началось быстрое развитие клинической цитогенетики человека. Вскоре была раскрыта этиология синдромов Шерешевского — Тернера (см. Тернера синдром), Клайнфелтера (см. Клайнфелтера синдром), синдромов Патау (см. Патау синдром) и Эдвардса (см. Эдвардса синдром).
С разработкой методов авторадиографии (см.) стала возможной идентификация некоторых индивидуальных хромосом, что способствовало открытию группы хромосомных болезней, связанных со структурными перестройками хромосом — синдромы делеции (см.) коротких плеч 4-й и 5-й хромосом, синдром делеции 13-й хромосомы и др. В течение нескольких лет было открыто более десяти хромосомных болезней, детализированы особенности проявлений каждой из них на клиническом, цитологическом, биохимическом уровнях, определена их частота.
Интенсивное развитие учения о хромосомных болезнях началось в 70-х годах 20 века после разработки методов дифференциального окрашивания хромосом, что позволило точно идентифицировать индивидуальные хромосомы человека и даже их участки. Это обеспечило быстрое накопление клинико-цитогенетического материала и вычленение новых форм хромосомных болезней. В настоящее время известна клинико-цитогенетическая характеристика около ста хромосомных болезней и синдромов.
Классификация хромосомных болезней основана на типах мутаций (см. Мутация) вовлеченных в них хромосом. Мутации в половых клетках приводят к развитию полных форм Хромосомные болезни при которых все клетки организма имеют одну и ту же хромосомную аномалию. Мутации, возникшие в эмбриогенезе (особенно на начальных стадиях дробления зиготы), обусловливают возникновение мозаичных форм, при которых только часть клеток имеет хромосомную аномалию (см. Мозаицизм).
У человека обнаружены все основные формы и типы хромосомных аномалий. В настоящее время описано 2 варианта нарушений числа хромосомных наборов (см. Хромосомный набор) — тетраплоидия и триплоидия как в виде полных форм, так и мозаичных. Другая группа синдромов обусловлена нарушениями числа отдельных хромосом — трисомиями (когда имеется добавочная хромосома в диплоидном наборе) или моносомиями (одна из хромосом отсутствует). Моносомии аутосом (любые хромосомы, кроме X- и Y-хромосом) несовместимы с жизнью. Трисомии — более часто встречающаяся патология у человека. Так, наблюдаются хромосомные болезни, вызванные трисомией аутосом: по 13-й паре хромосом — синдром Патау, по 18-й паре — синдром Эдвардса, по 21-й паре — болезнь Дауна; значительно реже встречаются хромосомные болезни, вызванные трисомиями 8,9, 10,14,16,22-й пар хромосом. Ряд хромосомных болезней связан с нарушением числа половых хромосом. Так, моносомия X-хромосомы (генотип ХО) лежит в основе синдрома Шерешевского — Тернера, трисомия половых хромосом (генотип XXY) является причиной развития синдрома Клайнфелтера.
Самая многочисленная группа хромосомных болезней — это синдромы, обусловленные структурными перестройками хромосом. Описано более 700 типов этих нарушений. Однако не все они могут рассматриваться как самостоятельные клинические синдромы, так как при единичных наблюдениях нельзя связывать клин, картину непосредственно с хромосомной аномалией как этиологическим фактором. Тем не менее только лишь по аутосомам можно выделить около 80 синдромов, вызванных перестройками, сопровождающимися либо утратой (делецией) части хромосомного материала, либо его избытком. В связи с этим выделяют хромосомные синдромы так называемых частичных моносомий и синдромы частичных трисомий (уменьшение или увеличение числа отдельных хромосом не на целую хромосому, а на ее часть).
В связи с тем, что подавляющая часть хромосомных аномалий относится к категории летальных мутаций, для характеристики их количественных параметров используются два показателя — частота распространения и частота возникновения.
Фактический материал цитогенетического обследования новорожденных, проведенного в нескольких странах (СССР, Дания, Шотландия, Канада, США), дает достаточно полное и точное представление об общей частоте хромосомных болезней в популяциях человека, которая достигает 1%. При этом частота отдельных типов составляет: аномалии в системе половых хромосом среди мальчиков — 0,3% (из них XXY—0,15%, XYY — 0,11%, структурные перестройки X-и Y-хромосомы — 0,04%); среди девочек — 0,22% (ХО полная форма — 0,01 %, ХО мозаичная форма — 0,07%, XXX — 0,14%); трисомии аутосом — 0,14% ( из них трисомия 13—0,007%, трисомия 18— 0,013%, трисомия 21—0,12%); структурные перестройки аутосом — 0,24% (робертсоновские транслокации — 0,1%; реципрокные транслокации — 0,09%; инверсии — 0,02%; дупликации — 0,03%).
Выяснено, что около 170 из 1000 эмбрионов и плодов погибают до рождения (подвергаются так называемому внутриутробному отбору, что клинически выражается спонтанным абортом или мертворождением), из них около 40% — вследствие влияния хромосомных нарушений. Тем не менее значительная часть мутантов (носителей хромосомной аномалии) минует действие внутриутробного отбора. В среднем у 7 из 1000 живорожденных детей определяются различные хромосомные аномалии. Вследствие тяжести морфологических, физиологических и биохимических нарушений большинство больных с синдромом Пата у и Эдвардса погибает в раннем возрасте, с болезнью Дауна — до достижения пубертатного возраста. Больные с аномалиями половых хромосом из-за нарушений полового развития и нередко выраженных эндокринопатий, как правило, не оставляют потомства. Следовательно, все аномалии кариотипа (числа хромосом) являются вновь возникшими и их можно отнести к мутациям, элиминирующимся в первом поколении, то есть они существуют в популяции с той частотой, с к-рой возникают. Действию естественного отбора на разных этапах онтогенеза подвергаются и аномалии структуры хромосом. Показано, что в общем случае хромосомные мутации почти полностью исчезают из популяции через 15—17 поколений после своего возникновения.
Для всех форм хромосомных болезней общим признаком является множественность морфологических, физиологических и биохимических нарушений. Основные клин, проявления характеризуются нарушениями морфогенеза в виде множественных врожденных пороков развития. Их формирование начинается со стадии гистогенеза и продолжается в органогенезе, что, вероятно, и объясняет сходство клинической картины при разных формах хромосомных болезней. Общими проявлениями разных хромосомных болезней являются: задержка физического и психомоторного развития, умственная отсталость различной степени выраженности, черепно-лицевые дисплазии, костномышечные аномалии, пороки сердечно-сосудистой, мочеполовой, нервной и других систем, отклонения в гормональном, биохимическом и иммунологическом статусе.
Степень поражения органов и систем при хромосомной болезни зависит от многих факторов — типа хромосомной аномалии, индивидуальности по генному составу вовлеченной в аномалию хромосомы, размера недостающего или избыточного материала индивидуальной хромосомы, степени мозаичности организма (см. Мозаицизм) по аномальному клеточному клону (см.), генотипа организма, условий среды, в которых развивается организм.
Диагностика хромосомных болезней основана на клинико-морфологических и цитогенетических методах. Нарушения морфогенеза, клинически определяемые как врожденные пороки развития, являются характерной чертой почти всех хромосомных болезней. При отдельных формах выявляется до 20 врожденных аномалий и пороков развития различных органов и систем. Одни признаки относительно постоянны для всех или большинства хромосомных аномалий, другие — встречаются только при определенных хромосомных болезнях, третьи — лишь при данной хромосомной болезни. Постановка диагноза по клин, картине не очень надежна и всегда требует цитогенетического подтверждения.
В зависимости от целей исследования применяют цитогенетические экспресс-методы — анализ X- и Y-хроматина (см. Половой хроматин) и методы точного хромосомного анализа со специальной дифференциальной окраской хромосом (см. Хромосомы). Выбор того или иного метода анализа хромосом зависит от цели исследования и требуемой степени точности. В случае необычной клинической картины синдромов с численными аномалиями хромосом или при подозрении на наличие структурной перестройки необходимо исследовать хромосомные наборы, используя несколько методов дифференциальной окраски хромосом. В ряде случаев для уточнения наличия микроперестройки или варианта хромосомы требуется применение высоко разрешающих методов анализа прометафазных или профазных хромосом.
Этиологическое лечение хромосомных болезней в настоящее время не разработано. Патогенетические методы лечения включают коррекцию метаболических и гормональных нарушений.
Симптоматическое лечение применяется практически при всех формах хромосомных болезней и включает физиотерапию, назначение витаминов и другие лечебные мероприятия. Необходимо при этом исключить факторы, усиливающие проявления хромосомных болезней, а также применять специальные методы воспитания и обучения, что позволяет во многих случаях обеспечить достаточную социальную адаптацию.
Прогноз при хромосомных болезнях зависит от тяжести поражения органов и систем, адекватности проводимых лечебных мероприятий. Основой профилактики хромосомных болезней является медико-генетическое консультирование, которое заключается в определении прогноза рождения ребенка с хромосомной патологией (см. Медико-генетическая консультация). Разработка методов пренатальной диагностики делает этот подход одним из самых эффективных в борьбе не только с хромосомными, но и с другими наследственными болезнями (см.).
Библиогр.: Бочков Н. П. Хромосомы человека и облучение, М., 1971; он же, Генетика человека, наследственность и патология, М.,1978; Бочков Н. П., 3ахаров А. Ф. и Иванов В. И. Медицинская генетика, М., 1984; Захаров А. Ф. и др. Хромосомы человека, Атлас, М., 1982; Перспективы медицинской генетики, под ред. Н. П. Бочкова, М., 1982; Тератология человека, под ред. Г. И. Лазюка, М., 1979; Hamerton J. L. Human cytogenetics, v. 1—2, N. Y.—L., 1971; Hamerton J. L. a. o. A cytogenetic survey of 14069 newborn infants, Clin. Genet., v. 8, p. 223, 1975; Jacobs P. A. a. o. A cytogenetic survey of 11680 newborn infants, Ann. hum. Genet., v. 37, p. 359, 1974; LejeuneJ., Gauthier M. et Turpin R. Les chromosomes humains en culture de tissus, C. R. Acad. Sci. (Paris), t. 248, p. 602, 1959; Nielsen J. a. Sillesen I. Incidence of chromosome aberrations among 11148 newborn children, Humangenetik, v. 30, p. 1, 1975.
H. П. Кулешов.
Источник
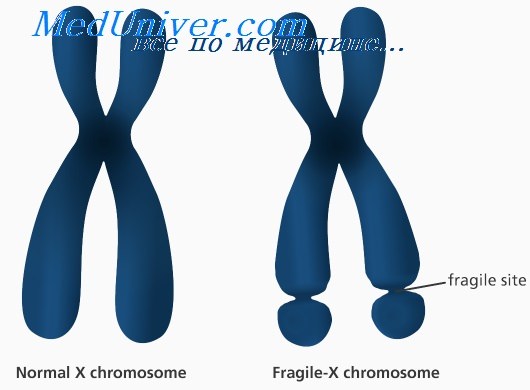
Синдром ломкой Х-хромосомы: причины, диагностика, лечениеЭтиология и встречаемость синдрома ломкой Х-хромосомы. Синдром ломкой Х-хромосомы (MIM №309550) — Х-сцепленное заболевание с задержкой умственного развития, вызванное мутациями в гене FMR1 в Xq27.3. Синдром ломкой Х-хромосомы встречается с частотой 16-25 на 100 000 в общей популяции среди мужчин и в два раза реже среди женщин. Синдром ломкой Х-хромосомы составляет 3-6% всех случаев умственной отсталости среди мальчиков с положительным семейным анамнезом по умственной отсталости при отсутствии врожденных пороков. Патогенез синдрома ломкой Х-хромосомыПродукт гена FMR1, FMRP, экспрессируется во многих типах клеток, но наиболее сильно в нейронах. FMRP может сопровождать определенный подкласс мРНК от ядра к рибосомам. Более 99% мутаций в гене FMR1 — экспансия нуклеотидного повтора (CGG)n в 5′-нетранслируемом участке гена. В нормальных аллелях FMR1 число повторов CGG составляет от 6 до приблизительно 50. В патогенных аллелях (или при полных мутациях) количество повторов более 200. Аллели с более чем 200 повторами CGG обычно имеют гиперметилированную последовательность повторов CGG и смежного промотора FMR1. Гиперметилирование инактивирует промотор FMR1, вызывая снижение экспрессии FMRP. Полные мутации возникают из аллелей премутации (от 59 до 200 повторов CGG) с передачей мутантного аллеля FMR1 от матери (но не от отца); фактически при отцовской передаче премутации часто, наоборот, сокращаются. Полные мутации не могут возникать из нормальных аллелей. Поскольку длина неустойчивых повторов CGG увеличивается в каждом последующем поколении, если они передаются женщиной, обычно наблюдается увеличение числа пораженных потомков в последующих поколениях в семье; этот феномен называется генетической антиципацией. Риск экспансии премутации в полную мутацию возрастает с увеличением числа повторов в премутации. Тем не менее не все премутации одинаково предрасположены к экспансии. Хотя премутации встречаются сравнительно часто, переход в полную мутацию наблюдают только в ограниченном количестве гаплотипов, т.е. когда есть склонность гаплотипа к экспансии. Эта склонность гаплотипа частично может быть связана с присутствием нескольких триплетов AGG, вставленных в последовательность повторов CGG; оказывается, такие триплеты AGG тормозят экспансию повторов CGG, следовательно, их отсутствие в некоторых гаплотипах может предрасполагать к экспансии.
Фенотип и развитие синдрома ломкой Х-хромосомыСиндром ломкой Х-хромосомы вызывает умеренную умственную отсталость у мужчин и легкую умственную задержку у женщин. Наиболее пораженные индивидуумы также имеют поведенческие аномалии, включая гиперактивность, размахивание руками, истерики, плохой зрительный контакт и признаки аутизма. Физические характеристики мужчин изменяются с пубертатом. До полового созревания пораженные мальчики имеют несколько увеличенный размер головы и некоторые другие неотчетливые симптомы; после наступления половой зрелости у них частые более отчетливые признаки (длинное лицо с выдающейся челюстью и лбом, крупные ушные раковины, макроорхидизм). Поскольку эти клинические признаки не уникальны для синдрома ломкой Х-хромосомы, диагноз зависит от молекулярного обнаружения мутаций. Пациенты с синдромом ломкой Х-хромосомы имеют нормальную продолжительность жизни. Почти все мужчины и 40-50% женщин, унаследовавших полную мутацию, будут иметь синдром ломкой Х-хромосомы. Тяжесть фенотипа зависит от мозаицизма метилирования повторов и их числа. Поскольку полные мутации неустойчивы, некоторые пациенты имеют смесь клеток с числом повторов, колеблющимся от премутации до полной мутации (мозаицизм числа повторов). Все мужчины с мозаицизмом числа повторов больны, но часто имеют более высокие показатели умственного развития, чем пациенты с полной мутацией в каждой клетке; у женщин с мозаицизмом числа повторов клинические проявления варьируют от нормы до полного проявления. Аналогично некоторые пациенты имеют смесь клеток с метилированием повторов CGG и без него (мозаицизм метилирования повторов). Все мужчины с мозаицизмом метилирования больны, но часто имеют более высокие показатели умственного развития, чем с гиперметилированием в каждой клетке; женщины с мозаицизмом метилирования также могут быть здоровыми или больными.
Очень редко пациенты имеют полную мутацию, неметилированную во всех клетках; независимо от пола, степень тяжести у них варьирует от нормы до полной клиники. Кроме того, у женщин фенотип зависит от степени смещения инактивации Х-хромосомы. Носительницы премутации (но не полных мутаций) имеют 20% риск ранней дисфункции яичников. Мужчины-носители премутации имеют риск развития синдрома FXTAS. FXTAS проявляет себя как поздняя прогрессирующая мозжечковая атаксия с интенционным тремором. У больных могут также присутствовать снижение краткосрочной памяти и двигательных функций, когнитивные нарушения, а также паркинсонизм, периферическая нейропатия, проксимальная мышечная слабость нижних конечности и дизавтономия. Пенетрантность FXTAS зависит от возраста, обнаруживается в 17% в течение шестого десятилетия жизни, в 38% в течение седьмого десятилетия, в 47% в течение восьмого десятилетия и в трех четвертях старше 80 лет. FXTAS может встречаться и у некоторых женщин — носительниц премутации. Особенности фенотипических проявлений синдрома ломкой Х-хромосомы: Лечение синдрома ломкой Х-хромосомыК настоящему времени никакого патогенетического лечения при синдроме ломкой Х-хромосомы нет. Помощь направлена на обучение и фармакологическое лечение поведенческих проблем. Риски наследования синдрома ломкой Х-хромосомыРиск того, что женщина с премутацией будет иметь больного ребенка, определяется размером премутации, полом плода и семейным анамнезом. Эмпирически риск для носителя перестройки иметь больного ребенка может достигать 50% для каждого мальчика и 25% для каждой девочки, но зависит от размера премутации. На основе анализа сравнительно небольшого количества матерей-носительниц известно, что риск повторения может снижаться, если премутация уменьшается со 100 до 59 повторов. Пренатальная диагностика доступна за счет использования ДНК плода из ворсин хориона или амниоцитов. Пример синдрома ломкой Х-хромосомы. Р.Л., 7-летний мальчик, направлен в клинику педиатрии в связи с умственной задержкой и гиперактивностью. Он не смог посещать детский сад, поскольку был агрессивным, не в состоянии выполнять задания, имел бедные речевые и двигательные навыки. Несмотря на задержанное развитие, он не потерял основных этапов: сидел к 10-11 мес, ходить начал в 20 мес, говорил два или три ясных слова в 24 мес. В остальном ребенок здоров. Его мать и тетя по матери имели небольшие проблемы обучения в детстве, дядя по матери умственно задержан. Данные медицинского осмотра в норме, за исключением гиперактивности. Врач рекомендовал несколько тестов, включая кариотипирование, функциональные исследования щитовидной железы и ДНК-анализ на синдром ломкой Х-хромосомы. Анализ гена FMR1 методом блот-гибридизации по Саузерну соответствовал синдрому ломкой Х-хромосомы. – Также рекомендуем “Недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД): причины, диагностика, лечение” Оглавление темы “Генетические болезни”:
|
Источник

