Сублейкемический миелоз код мкб по мкб 10
Миелофиброз – это хроническое гематологическое заболевание, характеризующееся опухолевой пролиферацией гемопоэтических стволовых клеток и фиброзом костного мозга. Основные клинические проявления включают симптомы опухолевой интоксикации и анемического синдрома (прогрессирующую слабость, бледность кожи и слизистых оболочек, потерю веса), а также увеличение селезенки (спленомегалию). Диагноз устанавливается на основании молекулярно-генетических исследований, изучения гистологической картины костного мозга. Лечение проводится с помощью химиотерапевтических препаратов. Хирургические методы лечения подразумевают трансплантацию костного мозга и удаление селезенки.
Общие сведения
Миелофиброз (агногенная миелоидная метаплазия, сублейкемический миелоз) – злокачественное заболевание, при котором происходит постепенное замещение костного мозга опухолевыми стволовыми клетками и разрастающейся соединительной тканью. Впервые эту патологию описал немецкий врач Г. Хойк в 1879 году. А в 1951 году американским гематологом Уильямом Дамешеком миелофиброз был выделен в самостоятельную нозологическую единицу. При неблагоприятном течении миелофиброз способен трансформироваться в более тяжелую болезнь ‒ острый лейкоз. Распространенность миелофиброза составляет от 0,3 до 0,7 случаев на 100 тыс. населения. Пик заболеваемости приходится на возраст от 50 до 70 лет, но встречаются и молодые пациенты. Чаще страдают мужчины.

Миелофиброз
Причины миелофиброза
Существует первичный и вторичный сублейкемический миелоз. Точная причина первичного миелофиброза до сих пор не установлена. Наибольшей популярностью среди специалистов в области гематологии пользуется теория влияния генетической мутации. У большинства пациентов выявляются мутации гена тирозинкиназы (JAK2V617F), кальретикулина (CALR), тромбопоэтина (MPL), регулирующих экспрессию белков JAK-STAT сигнального пути. Гены локализуются в локусе хромосомы del3p24.
В качестве этиологического фактора изучается действие большой дозы радиоактивного излучения. Также рассматривается роль персистирующих вирусных инфекций (вируса простого герпеса, Эпштейна-Барра, цитомегаловируса), длительного приема оральных контрацептивов, миелосупрессивных лекарственных препаратов, контакта с различными органическими и неорганическими соединениями (бензолом, мышьяком). Вторичный миелофиброз развивается как исход других хронических миелопролиферативных заболеваний – истинной полицитемии, эссенциальной тромбоцитемии, хронического миелолейкоза.
Патогенез
В результате повышенной экспрессии сигнальных белков в одной из стволовых костномозговых клеток запускается активная пролиферация (опухолевая трансформация). Этот процесс сопровождается вторичным воспалением с выделением цитокинов и факторов роста. Факторы роста фибробластов и эндотелия сосудов индуцируют выработку стромальными клетками костного мозга большого количества коллагена и разрастание соединительной ткани (собственно фиброз). Постепенно нормальная ткань костного мозга замещается опухолью и соединительной тканью.
При массивном поражении опухолью костного мозга клетки крови, не достигнув стадии полного созревания, попадают в системный кровоток. Это приводит к образованию очагов экстрамедуллярного (внекостномозгового) кроветворения, главным образом в печени и селезенке. Распад опухоли ведет к высвобождению мочевой кислоты, которая откладывается в тканях суставов и почечных канальцах.
Симптомы миелофиброза
Длительное время пациент чувствует себя удовлетворительно. Через несколько лет от начала заболевания постепенно появляется опухолевая интоксикация в виде общей слабости, повышения температуры до субфебрильных цифр, потливости, усиливающейся по ночам. У больного снижается аппетит, он стремительно теряет в весе. Присоединяется анемический синдром (бледность кожных покровов, головокружение, учащение сердцебиения). Характерны носовые, десневые кровотечения, геморрагические высыпания на коже. Возникают боли в суставах, кожный зуд, боли в костях.
Пациент ощущает тяжесть и боли в левом подреберье вследствие выраженного увеличения селезенки. На фоне спленомегалии развивается синдром гиперспленизма, который заключается в массивном разрушении клеток крови (в основном эритроцитов) в синусоидах селезенки. В этом случае встречаются признаки гемолиза (желтушность кожи, слизистых оболочек, потемнение мочи).
Редкие симптомы связаны с необычной локализацией очагов экстрамедуллярного кроветворения – в легких (кашель, затруднение дыхания, кровохарканье), желудочно-кишечном тракте (боли в животе, кровавая диарея). При расположении очагов в центральной и периферической нервной системе наблюдаются эпилептические судороги, нарушения чувствительности, слабость движений в конечностях, вплоть до полного паралича.
Осложнения
При миелофиброзе часто образуются тромбы, которые приводят к острому нарушению мозгового кровообращения, инфаркту миокарда, тромбоэмболии легочной артерии. Стойкое снижение уровня лейкоцитов нередко сопряжено с различными инфекциями, приобретающими тяжелое течение. Наиболее неблагоприятным осложнением считается трансформация миелофиброза в миелолейкоз (бластный криз), трудно поддающийся терапии. К нетипичным осложнениям следует отнести патологические переломы из-за деструкции трубчатых костей и портальную гипертензию, причиной которой служит длительная обструкция микротромбами внутрипеченочных вен.
Диагностика
Курацией пациентов с миелофиброзом занимаются врачи-гематологи. При общем осмотре обращает на себя внимание изменение цвета кожных покровов, слизистых (бледность или желтушность), спленомегалия при пальпации и перкуссии селезенки, иногда достигающей гигантских размеров (до лобкового симфиза). Дополнительные методы диагностики включают:
- Общие лабораторные исследования. В начале заболевания в общем анализе крови выявляется увеличение эритроцитов, тромбоцитов, лейкоцитов, со временем сменяющееся на низкие показатели. Часто в периферической крови присутствуют незрелые формы эритроцитов, лейкоцитов (миелоциты, промиелоциты). В биохимическом анализе крови наблюдаются повышенные концентрации лактатдегидрогеназы (ЛДГ), ионизированного кальция. Отмечаются изменения коагулограммы – ускорение свертывания крови, уменьшение активированного частичного тромбопластинового времени, торможение процессов фибринолиза. В анализе мочи обнаруживаются уробилин, гемоглобин, ураты (соли мочевой кислоты).
- Исследование костного мозга. Образец костного мозга получают с помощью трепанобиопсии. Гистологическая картина зависит от фазы заболевания. Для ранней (префибротической фазы) характерны гиперплазия всех ростков кроветворения (гранулоцитарного, мегакариоцитарного, эритроидного) с незрелостью клеток. В позднюю (фибротическую) фазу определяется большое количество коллагеновых и ретикулярных волокон (фиброз), замещающих гемопоэтическую ткань, выраженная клеточная атипия. Высокий уровень бластных клеток (более 20%) свидетельствует о трансформации миелофиброза в острый лейкоз.
- Молекулярно-генетические тесты. Диагностика мутации генов JAK2V617F, CALR, MPL осуществляется методом FISH. Для идентификации аллельной нагрузки мутации проводится полимеразная цепная реакция real-time. Также выполняется HLA-типирование для решения вопроса о возможности трансплантации костного мозга.
- Цитогенетические и цитохимические анализы. При цитогенетическом исследовании (кариотипировании) клеток костного мозга находят аномалии 1, 3, 6 хромосом (транслокация, трисомия, комплексные нарушения). При анализе химического состава (цитохимии) нейтрофилов активность щелочной фосфатазы оказывается в 3 раза выше нормы.
Для достоверной постановки диагноза гематологическим сообществом разработаны специальные критерии. Большие критерии включают повышенную клеточность костного мозга с ретикулярным и коллагеновым фиброзом, наличие мутаций генов JAK2V617F, MPL, CALR. К малым критериям относятся анемия, спленомегалия, лейкоэритробластоз (присутствие в крови незрелых форм лейкоцитов, эритроцитов), а также повышение лактатдегидрогеназы. Диагноз считается подтвержденным, если имеются 2 больших критерия или 1 большой и 3 малых критерия.
Миелофиброз следует дифференцировать в первую очередь с гематологическими заболеваниями, такими как аутоиммунные гемолитические анемии, гемобластозы (лейкозы, лимфомы). Сочетание спленомегалии с симптомами интоксикации (слабостью, субфебрилитетом, ночной потливостью) требует исключения туберкулеза, подострого инфекционного эндокардита.

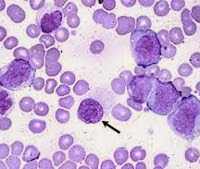
Незрелые формы эритроцитов (черная стрелка) и гранулоцитов (контурная стрелка) в периферической крови
Лечение миелофиброза
После постановки диагноза пациент должен быть госпитализирован в гематологический стационар. Для принятия решения о выборе тактики лечения необходимо определить степень риска, а именно – вероятность бластной трансформации и ориентировочную продолжительность жизни. С этой целью была создана «Международная шкала оценки риска и прогноза» (DIPSS). Она учитывает возраст пациента, количество форменных элементов крови, выраженность симптомов опухолевой интоксикации. Каждый признак соответствует одному баллу. Различают низкий, первый и второй промежуточный, высокий риски, при которых проводится дифференцированная терапия:
- Медикаментозное лечение. При низком и 1-м промежуточном риске применяют глюкокортикостероиды (преднизолон, дексаметазон), эритропоэтин, альфа-интерферон. При выраженной кахексии используют анаболические стероиды (ретаболил). В ряде случаев прибегают к переливанию компонентов крови (плазмы, эритроцитарной массы, тромбоконцентрата).
- Хирургические методы. Для пациентов со 2-м промежуточным и высоким риском терапией выбора является трансплантация костного мозга. Данная операция позволяет добиться полной ремиссии заболевания. При значительном увеличении селезенки, вызывающем компрессию соседних органов с портальной гипертензией, показано ее удаление (спленэктомия).
- Таргетная терапия. При невозможности выполнения ТКМ назначается таргетная (прицельная) патогенетическая терапия ингибиторами JAK-киназы, которые действуют на ключевое звено патогенеза (внутриклеточный сигнальный путь). На сегодняшний день в Российской Федерации зарегистрирован только один препарат из этой группы – руксолитиниб.
- Химиотерапия. При миелофиброзе также проводится химиотерапия цитостатиками (гидроксимочевиной, меркаптопурином, цитарабином), гамма-облучение очагов экстрамедуллярного гемопоэза. При бластной трансформации переходят к стандартному химиотерапевтическому протоколу острых лейкозов.
Прогноз и профилактика
Миелофиброз – это тяжелое заболевание с неблагоприятным прогнозом. С момента постановки диагноза средняя продолжительность жизни составляет около 5 лет. При манифестации в более молодом возрасте миелофиброз имеет менее агрессивное течение, что сопряжено с лучшим ответом на терапию и большей выживаемостью больных. Эффективных методов профилактики не разработано ввиду неизвестности этиологического фактора. Предупреждение развития вторичного миелофиброза заключается в своевременной диагностике и лечении патологий, на фоне которых он возникает – истинной полицитемии и эссенциальной тромбоцитемии.
Источник
Рубрика МКБ-10: D47.1
МКБ-10 / C00-D48 КЛАСС II Новообразования / D37-D48 Новообразования неопределенного или неизвестного характера / D47 Другие новообразования неопределенного или неизвестного характера лимфоидной, кроветворной и родственных им тканей
Определение и общие сведения[править]
Первичный миелофиброз
Первичный миелофиброз (ПМФ, идиопатический миелофиброз, сублейкемический миелоз, остеомиелофиброз, остеомиелосклероз, агногенная миелоидная метаплазия с миелофиброзом, идиопатическая миелоидная метаплазия, миелосклероз) – хроническое клональное миелопролиферативное заболевание, возникающее вследствие трансформации клетки-предшественника миелопоэза c развитием фиброза КМ, наличием очагов экстрамедуллярного гемопоэза, особенно трехростковой миелоидной метаплазией селезенки с выраженной спленомегалией и появлением лейкоэритробластической картины периферической крови, каплевидной формы эритроцитов периферической крови, симптомов цитопении или цитоза.
Эпидемиология
Ежегодная частота ПМФ составляет 0,5-1,5 случаев на 100 000 жителей (в США). Заболевание несколько чаще выявляется у мужчин, обычно во второй половине жизни: средний возраст пациентов превышает 50 лет с медианой около 65 лет, количество случаев нарастает с возрастом. В то же время имеются сообщения о начале ПМФ у взрослых моложе 30 лет и даже в подростковом и детском возрасте (чаще у девочек).
Этиология и патогенез[править]
Патогенез
Миелофиброз рассматривается как сочетание двух различных, но взаимосвязанных патогенетических процессов: клональной миелопролиферации в качестве главного двигателя заболевания и воспалительного состояния, характеризующегося изменением стромы КМс повышенной экспрессией провоспалительных цитокинов. У 60% больных ПМФ выявлена мутация тирозинкиназы JAK2V617F, однако нарушение сигнального пути, опосредованного JAK2-киназой, и активация транскрипционных факторов имеется у всех пациентов, вне зависимости от мутационного статуса JAK2-киназы. В 5-20% также выявляются мутации других генов: MPL (5-10%), TET2 и ASXL1 – до 17%, CBL – в 6%, LNK (менее 5%), IDH1/2 – до 4%, а также IKZF1 или EZH2. При этом фибробласты костного мозга являются поликлональными. Причина чрезмерного фиброза КМ остается неясной. Собственно миелофиброз является неспецифической воспалительной реакцией на медиаторы воспаления и цитокины, вырабатываемые трансформированным клоном и клетками микроокружения.
Клинические проявления[править]
У 25% больных ПМФ заболевание протекает бессимптомно и диагностируется при случайном выявлении спленомегалии или изменений в периферической крови. Прогрессирование миелофиброза коррелирует с клинико-лабораторными данными: нарастанием анемии и увеличением размеров селезенки. Другим характерным признаком является развитие экстрамедуллярных очагов гемопоэза, прежде всего в селезенке и печени, реже – в легких (кровохарканье, легочная гипертензия, дыхательная недостаточность), ЖКТ (с кровотечением), выпот в плевру и перикард, асцит. Встречаются очаги в средостении, центральной нервной системе – сдавление спинного мозга, фокальные судороги; компрессионная боль (или неврологический дефект) в нижних и верхних конечностях, резистентная к анальгетикам, а также в почках и мочевом пузыре (с появлением гематурии), периферических лимфатических узлах, мезентериальных или забрюшинных лимфатических узлах, коже.
Хроническая миелопролиферативная болезнь: Диагностика[править]
Для диагностики ПМФ необходимо выполнить клинический анализ крови, рентгенографию или МРТ костей (неоднородное повышение плотности), МРТ (КТ, УЗИ) селезенки и печени, аспирацию и биопсию КМ, цитогенетическое исследование КМ и/или периферической крови (FISH для выявления цитогенетических аномалий), ПЦР лейкоцитов периферической крови (или КМ) для выявления мутации JAK2V617F, (а также для исключения bcr/abl). Классическими критериями диагноза ПМФ ранее являлись спленомегалия, коллагеновый миелофиброз и лейкоэритробластическая картина периферической крови. В соответствии с критериями ВОЗ (2008), современный диагноз ПМФ базируется на оценке клинических, морфологических, цитогенетических и молекулярных данных.
Одним из основных методов диагностики ПМФ остается трепанобиопсия с последующим гистологическим и/или гистоморфометрическим исследованием КМ.
Дифференциальный диагноз[править]
При дифференциальном диагнозе следует исключить заболевания, которые могут быть причиной развития миелофиброза.
Хроническая миелопролиферативная болезнь: Лечение[править]
Современное лечение ПМФ все еще незначительно увеличивает общую выживаемость, а также не является излечивающим, хотя в последнее время появились многообещающие исследовательские препараты, модифицирующие течение болезни и способствующие полной ремиссии.
Одним из традиционных методов является лечение симптоматической анемии. У небольшой части трансфузионно независимых пациентов с гемоглобином менее 100 г/л при отсутствии значительной спленомегалии (пальпируемая селезенка менее 5 см ниже края левой реберной дуги) возможно применение ЭПО (эритропоэтин) при невысоком уровне сывороточного ЭПО (в исследовании F. Cervantes и соавт., 2004 г., этот уровень составил менее 125 МЕ/л). При спленомегалии более 5 см ниже левого края реберной дуги применение ЭПО опасно вследствие возможности ятрогенного нарастания спленомегалии и лейкемической трансформации. Это может быть обусловлено тем, что в норме связывание ЭПО со своим рецептором также приводит к активации JAK2-киназ.
Более традиционное лечение анемии при ПМФ проводится андрогенами (например, тестостерона энантат 400-600 мг внутримышечно 1 раз в неделю, флюоксиместерон 10 мг 2-3 раза в день внутрь или даназол по 600 мг/день внутрь) и преднизолон (0,5 мг/кг в день). Андрогены обычно используют при анемии с низким числом ретикулоцитов и неэффективности терапии преднизолоном. Больные, имеющие хромосомные нарушения, менее чувствительны к лечению андрогенами. Преднизолон per os используется и для лечения гемолитической анемии. Также эффективны при анемии талидомид 50 мг/день с/или без преднизолона или леналидомид (10 мг/день) с/или без преднизолона (10 мг/день). Частота ответа на каждый упомянутый метод составляет 15-25%, длительность ответа 1-2 года. Следует отметить, что леналидомид наиболее эффективен в присутствии del(5q): на фоне терапии у этих пациентов показано достижение полной ремиссии, поэтому выявление у пациентов 5q может служить основанием для дифференцированного раннего назначения этого препарата при наличии симптомов ПМФ. Еще одно современное производное талидомида – препарат помалидомид – также эффективен при анемии, но преимущественно у JAK2V617F-позитивных пациентов с выраженной спленомегалией. Основные побочные эффекты: гепатотоксичность и вирилизующие эффекты у андрогенов, периферическая нейропатия у талидомида и миелосупрессия (нейтропения и тромбоцитопения) у леналидомида, склонность к тромбозам (показано сопутствующее назначение ацетилсалициловой кислоты). Талидомид с леналидомидом противопоказаны женщинам в детородном возрасте. Глюкокортикоидов следует избегать при диабете и остеопорозе, андрогенов или даназола – при повышении уровня простатоспецифического антигена или раке предстательной железы в анамнезе. Трансфузии эритроцитной массы показаны больным с клиническими проявлениями анемического синдрома с целью поддержания уровня гемоглобина на таком уровне, при котором исчезают симптомы, обусловленные анемией. В лечении анемии, зависящей от трансфузий, у больных ПМФ может применяться также и циклоспорин А.
В настоящее время продолжает накапливаться опыт трансплантации гемопоэтических стволовых клеток (ТГСК) – единственного радикального метода лечения, который может быть применен у больных ПМФ. Возможность применения метода уже не ограничивается возрастом моложе 45-50 лет, так как разрабатываются новые редуцированные режимы кондиционирования, позволяющие проводить ТГСК и в более старшем возрасте. Наиболее эффективной при ПМФ является аллогенная ТГСК, после которой удается отметить регрессию фиброза. Полной ремиссии удавалось достичь и при инфузии донорских лимфоцитов после безуспешной аллогенной ТГСК. При ТГСК наблюдается эффект «трансплантат против фиброза» с обратным развитием фиброза КМ. Однако этот вид лечения сопряжен с большой посттрансплантационной смертностью: 27% в 1-й год и 35% в течение 5 лет; для неродственных доноров – еще больше: 43% в 1-й год и 50% в течение 5 лет. Такой подход не может быть рекомендован для пациентов как с низким риском, так и для имеющих промежуточный или даже высокий риск, кроме небольшой когорты молодых больных с высоким и очень высоким риском (до 50 лет), которые могут перенести полнодозовое кондиционирование.
В целом, направление лечения больных с ПМФ выбирается исходя из группы риска – от стратегии «наблюдай и жди» при низком риске до интенсивного лечения, включая аллотрансплантацию ПСГК для кандидатов с высоким и очень высоким риском, и исследовательские препараты (предпочтительно в рамках клинического исследования). Новые исследовательские препараты активно занимают свое место в терапии ПМФ, особенно в группе некандидатов для аллотрансплантации ПГСК с выраженной клинической симптоматикой в фибротической фазе заболевания, где традиционно большая роль отводилась терапии поддержки (в основном, гемокомпонентной).
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
1. Mesa RA. The evolving treatment paradigm in myelofibrosis // Leuk Lymphoma. 2013. – Vol. 54. – N. 2. – P. 242-251.
2. Tefferi A. How I treat myelofibrosis // Blood. 2011. – Vol. 117. – N. 13. – P. 3494-3504.
3. Mascarenhas J.O., Orazi A., Bhalla K.N., et al. Advances in myelofibrosis: a clinical case approach // Haematologica. 2013. – Vol. 98. – N. 10. – P. 1499-509.
4. Keohane C., Radia D.H., Harrison C.N. Treatment and management of myelofibrosis in the era of JAK inhibitors // Biologics. 2013. – Vol. 7. – P. 189-198.
5. Thiele J., Kvasnicka H.M., Facchetti F. et al. European consensus on grading bone marrow fibrosis and assessment of cellularity // Haematologica. 2005. – Vol. 90. – N. 8. – P. 1128-1132.
6. Klampfl T., Gisslinger H., Harutyunyan A.S. et al. Somatic mutations of calreticulin in myeloproliferative neoplasms // N. Engl. J. Med. 2013. – Vol. 369. – N. 25. – P. 2379-2390.
7. Nangalia J., Massie C.E., Baxter E.J., et al. Somatic CALR mutations in myeloproliferative neoplasms with non-mutated JAK2 // N. Engl. J. Med. 2013. – Vol. 369. – N. 25. – P. 2391-2405.
8. Tefferi A., Cervantes F., Mesa R., et al. Revised response criteria for myelofibrosis: International Working Group-Myeloproliferative Neoplasms Research and Treatment (IWG-MRT) and European Leukemia Net (ELN) consensus report // Blood. 2013. – Vol. 122. – N. 8. – P. 1395-1398.
9. Tefferi A. JAK inhibitors for myeloproliferative neoplasms: clarifying facts from myths // Blood. 2012. – Vol. 119. – N. 12. – P. 2721-2730.
10. Odenike O. Beyond JAK inhibitor therapy in myelo-fibrosis // Hematology Am. Soc. Hematol Educ Program. 2013. – Vol. 2013. – P. 545-552.
Гематология [Электронный ресурс] : национальное руководство / под ред. О.А. Рукавицына – М. : ГЭОТАР-Медиа, 2015. – https://www.rosmedlib.ru/book/ISBN9785970433270.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
- Иматиниб
- Федратиниб
Источник
