Тема на тему двс синдром
ДВС-синдром – расстройство гемостаза, связанное с гиперстимуляцией и дефицитом резервов свертывающей системы крови, приводящее к развитию тромботических, микроциркуляторных и геморрагических нарушений. При ДВС-синдроме наблюдается петехиально-гематомная сыпь, повышенная кровоточивость, дисфункция органов, а в острых случаях – развитие шока, гипотонии, сильных кровотечений, ОДН и ОПН. Диагноз устанавливают по характерным признакам и лабораторным тестам системы гемостаза. Лечение ДВС-синдрома направлено на коррекцию гемодинамики и нарушений свертывающей системы (антиагреганты, антикоагулянты, ангиопротекторы, гемотрансфузии, плазмаферез и др.).
Общие сведения
ДВС-синдром (диссеминированное внутрисосудистое свертывание, тромбогеморрагический синдром) – геморрагический диатез, характеризующийся чрезмерным ускорением внутрисосудистой коагуляции, образованием рыхлых сгустков крови в микроциркуляторной сети с развитием гипоксических и дистрофически-некротических измерений в органах. ДВС-синдром представляет опасность для жизни пациента из-за риска возникновения обширных, плохо купируемых кровотечений и острой дисфункции органов (главным образом, легких, почек, надпочечников, печени, селезенки), имеющих обширную микроциркуляторную сеть.
ДВС-синдром можно рассматривать, как неадекватную защитную реакцию, направленную на ликвидацию кровотечения при повреждении кровеносных сосудов и изоляцию организма от пораженных тканей. Встречаемость ДВС-синдрома в различных отраслях практической медицины (гематологии, реаниматологии, хирургии, акушерстве и гинекологии, травматологии и др.) достаточно велика.
ДВС-синдром
Причины ДВС-синдрома
ДВС-синдром развивается на фоне заболеваний, протекающих с повреждением тканей, эндотелия сосудов и клеток крови, сопровождаемых микрогемодинамическими нарушениями и сдвигом гемостаза в сторону гиперкоагуляции. Основной причиной ДВС-синдрома выступают септические осложнения бактериальных и вирусных инфекций, шок любой природы. ДВС-синдром часто сопутствует акушерской патологии – тяжелому гестозу, предлежанию и преждевременной отслойке плаценты, внутриутробной гибели плода, эмболии амниотической жидкостью, ручному отделению последа, атоническим маточным кровотечениям, а также операции кесарево сечение.
Развитие тромбогеморрагического синдрома могут инициировать метастазирующие злокачественные опухоли (рак легкого, рак желудка), обширные травмы, ожоги, серьезные хирургические вмешательства. Нередко ДВС-синдром сопровождает трансфузию крови и ее компонентов, трансплантацию тканей и органов, протезирование сосудов и клапанов сердца, применение искусственного кровообращения.
Способствовать возникновению ДВС-синдрома могут сердечно-сосудистые заболевания, протекающие с гиперфибриногенемией, увеличением вязкости и снижением текучести крови, механическим препятствием кровотоку атеросклеротической бляшкой. К ДВС-синдрому могут приводить прием медикаментов (ОК, ристомицина, диуретиков), острые отравления (например, ядом змеи) и острые аллергические реакции.
Патогенез ДВС-синдрома
Несостоятельность гемостаза при ДВС-синдроме возникает за счет гиперстимуляции свертывающей и быстрого истощения антикоагулянтной и фибринолитической систем гемостаза.
Развитие ДВС-синдрома обуславливается различными факторами, которые появляются в кровяном русле и напрямую активируют процесс свертывания, либо осуществляют это через медиаторы, воздействующие на эндотелий. В качестве активаторов ДВС-синдрома могут выступать токсины, ферменты бактерий, околоплодные воды, иммунные комплексы, стрессовые катехоламины, фосфолипиды, снижение сердечного выброса и кровотока, ацидоз, гиповолемия и др.
Развитие ДВС-синдрома происходит с последовательной сменой 4-х стадий.
I – начальная стадия гиперкоагуляции и внутрисосудистой агрегации клеток. Обусловлена выбросом в кровь тканевого тромбопластина или веществ, обладающих тромбопластиноподобным действием и запускающих внутренний и внешний пути свертывания. Может продолжаться от нескольких минут и часов (при острой форме) до нескольких дней и месяцев (при хронической).
II – стадия прогрессирующей коагулопатии потребления. Характеризуется дефицитом фибриногена, кровяных пластинок и плазменных факторов вследствие их избыточного расхода на тромбообразование и недостаточного возмещения.
III – критическая стадия вторичного фибринолиза и выраженной гипокоагуляции. Отмечается разбалансировка гемостатического процесса (афибриногенемия, накопление патологических продуктов, разрушение эритроцитов) с замедлением свертывания крови (вплоть до полной неспособности к свертыванию).
IV – стадия восстановления. Наблюдаются либо остаточные очаговые дистрофические и некротические изменения в тканях тех или иных органов и выздоровление, либо осложнения в виде острой органной недостаточности.

ДВС-синдром
Классификация ДВС-синдрома
По выраженности и скорости развития ДВС-синдром может быть острым (в т.ч., молниеносным), подострым, хроническим и рецидивирующим. Острая форма тромбогеморрагического синдрома возникает при массивном выбросе в кровь тромбопластина и ему подобных факторов (при акушерской патологии, обширных операциях, травмах, ожогах, синдроме длительного сдавления тканей). Характеризуется ускоренной сменой стадий ДВС-синдрома, отсутствием нормального защитного антикоагуляционного механизма. Подострая и хроническая формы ДВС-синдрома связаны с обширным изменением поверхности эндотелия сосудов (например, вследствие атеросклеротических отложений), выступающим в роли активирующей субстанции.
ДВС-синдром может проявляться локально (ограниченно, в одном органе) и генерализованно (с поражением нескольких органов или всего организма). По компенсаторному потенциалу организма можно выделить компенсированный, субкомпенсированный и декомпенсированный ДВС-синдром. Компенсированная форма протекает бессимптомно, микросгустки лизируются за счет усиления фибринолиза, факторы свертывания восполняются из резервов и путем биосинтеза. Субкомпенсированная форма проявляется в виде гемосиндрома средней степени тяжести; декомпенсированная – характеризуется каскадными реакциями реактивного фибринолиза, несостоятельностью коагуляционных процессов, несворачиваемостью крови.
ДВС-синдром может протекать с одинаковой активностью прокоагулянтного и сосудисто-тромбоцитарного звеньев гемостаза (смешанный патогенез) или с преобладанием активности одного из них.
Симптомы ДВС-синдрома
Клинические проявления ДВС-синдрома определяются темпом развития и распространенностью поражения, стадией процесса, состоянием компенсаторных механизмов, наслоением симптомов заболевания-индуктора. В основе ДВС-синдрома лежит комплекс тромбогеморрагических реакций и дисфункции органов.
При острой манифестной форме быстро (за несколько часов) развивается генерализованный ДВС-синдром, для которого характерно шоковое состояние с гипотонией, потерей сознания, признаками отека легких и острой дыхательной недостаточности. Гемосиндром выражается нарастающей кровоточивостью, массивными и профузными кровотечениями (легочными, маточными, носовыми, желудочно-кишечными). Характерно развитие очагов ишемической дистрофии миокарда, панкреонекроза, эрозивно-язвенного гастроэнтерита. Молниеносная форма ДВС-синдрома свойственна эмболии околоплодными водами, когда коагулопатия стремительно (в течение нескольких минут) переходит в критическую стадию, сопровождаясь кардиопульмонарным и геморрагическим шоком. Летальность матери и ребенка при этой форме ДВС-синдрома приближается к 80%.
Подострая форма ДВС-синдрома носит локальный характер с более благоприятным течением. Незначительный или умеренный гемосиндром проявляется петехиальной или сливной геморрагической сыпью, синяками и гематомами, усиленной кровоточивостью из мест инъекций и ран, кровотечениями из слизистых оболочек (иногда – «кровавый пот», «кровавые слезы»). Кожа приобретает бледный вид, мраморность, становится холодной на ощупь. В ткани почек, легких, печени, надпочечников, ЖКТ развиваются отек, резкое полнокровие, внутрисосудистая коагуляция, сочетание очагов некроза и множественных кровоизлияний. Самая распространенная – хроническая форма ДВС-синдрома часто имеет бессимптомное течение. Но по мере прогрессирования фонового заболевания нарастают проявления геморрагического диатеза и нарушения функции органов.
ДВС-синдром сопровождается астеническим синдромом, плохим заживлением ран, присоединением гнойной инфекции, развитием келоидных рубцов. К осложнениям ДВС-синдрома относятся гемокоагуляционный шок, острая дыхательная недостаточность, ОПН, некроз печени, язвенная болезнь желудка, инфаркт кишечника, панкреонекроз, ишемический инсульт, острая постгеморрагическая анемия.

Геморрагические элементы на коже при ДВС-синдроме
Диагностика ДВС-синдрома
Для установления ДВС-синдрома необходимы тщательный сбор анамнеза с поиском этиологического фактора, анализ клинической картины и данных лабораторных исследований (общего анализа крови и мочи, мазка крови, коагулограммы, паракоагуляционных проб, ИФА). Важно оценить характер кровоточивости, уточнить стадию коагулопатии, отражающую глубину нарушений.
Для ДВС-синдрома характерна петехиально-гематомная кровоточивость, геморрагии сразу из нескольких мест. При малосимптомном течении гиперкоагуляция выявляется только лабораторными методами. К обязательным скрининговым тестам относятся определение количества тромбоцитов, фибриногена, АПТВ, протромбинового и тромбинового времени, времени свертывания по Ли-Уайту. Исследование маркеров внутрисосудистого свертывания – РФМК и ПДФ, D-димера методом ИФА и паракоагуляционных проб помогает подтвердить ДВС-синдром.
Критериями ДВС-синдрома являются наличие фрагментированных эритроцитов в мазке крови, дефицит тромбоцитов и фибриногена, повышение концентрации ПДФ, падение активности антитромбина III в сыворотке крови, удлинение АПТВ и тромбинового времени, отсутствие образования или нестабильность сгустка или in vitro. Выполняется оценка функционального состояния «шоковых органов»: легких, почек, печени, сердечно-сосудистой системы, головного мозга. ДВС-синдром необходимо дифференцировать от первичного фибринолиза, других коагулопатических синдромов.
Лечение ДВС-синдрома
Успех лечения ДВС-синдрома возможен при его ранней диагностике. Активные лечебные мероприятия требуются при выраженной симптоматике в виде кровотечений и органной недостаточности. Больных с ДВС-синдромом следует госпитализировать в ОРИТ и при необходимости проводить ИВЛ, активную противошоковую терапию. При малосимптомном ДВС-синдроме основным представляется лечение фоновой патологии, коррекция параметров гемодинамики и функциональных нарушений органов.
Острый ДВС-синдром требует срочного устранения его первопричины, например, экстренного родоразрешения, гистерэктомии – при акушерской патологии или антибиотикотерапии – при септических осложнениях. Для ликвидации гиперкоагуляции показано введение антикоагулянтов (гепарина), дезагрегантов (дипиридамола, пентоксифиллина), фибринолитиков. Больные должны находиться под постоянным динамическим контролем показателей гемостаза.
В качестве заместительной терапии при ДВС-синдроме применяются трансинфузии свежезамороженной плазмы, тромбоцитарной или эритроцитарной массы (при падении уровня тромбоцитов или Hb); криопреципитата (при сердечной недостаточности), физраствора. При кровотечениях, угрожающих жизни, возможно назначение антифибринолитических средств (аминокапроновой к-ты, ингибиторов протеаз). При кожных геморрагиях и ранах накладываются повязки с этамзилатом, гемостатическая губка.
По показаниям применяют кортикостероиды, оксигенотерапию, плазмаферез. Для восстановления микроциркуляции и нарушенных функций органов назначают ангиопротекторы, ноотропные препараты, посиндромную терапию. В случае ОПН проводят гемодиализ, гемодиафильтрацию. При хроническом ДВС-синдроме целесообразно использование дезагрегантов, вазодилататоров, в послеоперационном периоде – гепаринотерапии.
Прогноз и профилактика ДВС-синдрома
Прогноз ДВС-синдрома – вариативный, зависит от основного, этиологически значимого заболевания, тяжести нарушений гемостаза и своевременности начатого лечения. При остром ДВС-синдроме не исключен летальный исход в результате некупируемой большой кровопотери, развития шока, ОПН, острой дыхательной недостаточности, внутренних кровоизлияний. Предупреждение ДВС-синдрома заключается в выявлении пациентов группы риска (особенно, среди беременных и лиц пожилого возраста), лечении фонового заболевания.
Источник

Диссеминированное внутрисосудистое свертывание (ДВС) ㅡ клинико-патологический синдром, осложняющий течение различных заболеваний. ДВС характеризуется системной активацией патологических путей, приводящей к нарушению регуляции коагуляции; проявляется образованием фибриновых сгустков с последующей органной дисфункцией и сопутствующим потреблением тромбоцитов и факторов свертывания, клинически проявляющимся кровотечениями.
Смертность от ДВС за последние годы значительно снизилась. По данным министерства здравоохранения Японии, смертность от ДВС упала с 65 % в 1998 году до 46 % в 2010 и 2012 годах, такая же тенденция наблюдается и в США (с 76 до 51 % между 2006 и 2010 годами). Данное снижение смертности обусловлено более глубоким пониманием патогенеза заболевания, улучшением ранней диагностики и применением новых протоколов лечения ДВС.
Этиология
ДВС часто развивается на фоне сепсиса либо инфекции (30–51 %), травмы (черепно-мозговая травма, ожоги, жировая эмболия) или больших оперативных вмешательств (45 %). Другими причинами ДВС могут быть деструкция органов (тяжелый панкреатит), злокачественный процесс, тяжелые акушерские патологии (эмболия амниотической жидкостью, отслойка плаценты, тяжелая преэклампсия, послеродовое кровотечение), фульминантная печеночная недостаточность, цирроз печени, тяжелые токсические или иммунологические реакции (отравление ядами змей, переливание несовместимой крови, отторжение трансплантата), сосудистые заболевания (гемангиомы, аневризмы аорты, синдром Казабаха-Мерритта).
Патофизиология ДВС
К развитию ДВС приводит нарушение регуляции противосвертывающей и свертывающей систем крови. Формирование фибринового сгустка является продуктом целого каскада реакций, в которых задействованы как факторы свертывания, так и клеточные элементы. Выделяют внутренний и внешний пути активации коагуляции. Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь) (рис. 1).
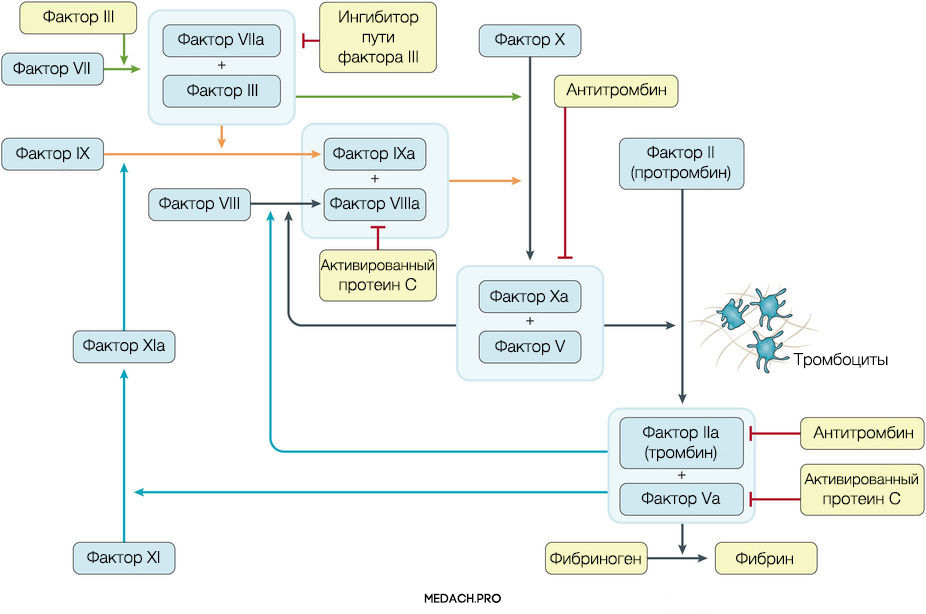
Рисунок 1 | Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь)
Тканевой фактор (ТФ) представляет собой мембрано-ассоциированный гликопротеин, находящийся в субэндотелиальном слое сосудов, в физиологических условиях не контактирующий с кровью. Выброс тканевого фактора могут спровоцировать различные процессы, такие как прямое повреждение сосудов, воспалительные и иммунологические реакции. При сепсисе ТФ непосредственно продуцируется моноцитами, а также выделяется в результате взаимодействия тромбоцитов со стенкой сосудов, что приводит к значительному усилению коагуляции. Выброс провоспалительных цитокинов и хемокинов провоцируется взаимодействием ТФ, тромбина и других факторов коагуляции с воспалительными клетками через специфические протеаза-активируемые рецепторы (PARs) 1–4 типа, а также дополнительно тромбином через Toll-like рецепторы 4 типа (TLR4). Развитие ДВС на фоне онкологических процессов имеет свои особенности, так как некоторые опухоли могут производить прокоагулянтные факторы (тканевой фактор и цистеиновая протеаза фактора X) (рис. 2).
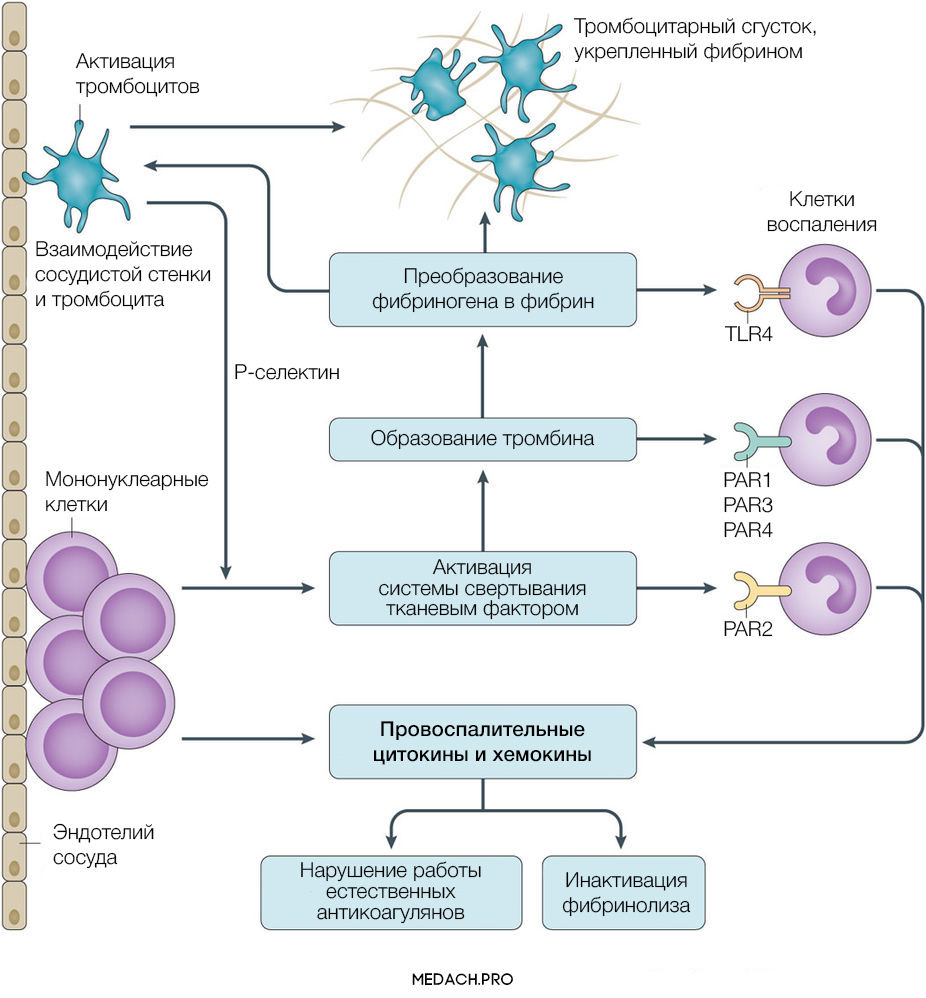
Рисунок 2 | Активация прокоагулянтных факторов в патогенезе ДВС-синдрома
Важное место в процессе свертывания занимает тромбин: он не только участвует в преобразовании фибриногена в фибрин, но также активирует другие факторы и ко-факторы свертывания (факторы VII, IX и XI). Тромбин инициирует скрепление частиц фибриногена в мономеры, а затем и в полимеры. Последующая стабилизация тромба происходит с помощью тромбин-активируемых факторов XIII (фактора XIIIа).
Реакции коагуляции контролируются противосвертывающей системой крови, включающей в себя: антитромбин (блокирует фактор Xa и тромбин), протеин С (протеолитически разрушает Va и VIIIa факторы), ингибитор пути тканевого фактора (ингибирует комплекс тканевой фактор-VIIa фактор).
При сепсис-индуцированном ДВС нарушаются все три компонента противосвертывающей системы. Во-первых, снижается уровень антитромбина в результате нарушения его синтеза в печени, увеличения его клиренса из-за образования протеаза-антитромбинового комплекса, экстраваскулярных потерь из-за повышения проницаемости клеточной стенки и разрушения эстеразой нейтрофилов. В дополнение к этому, в стенке сосудов нарушается синтез протеогликанов, способствующих связи антитромбина с гепарин-сульфатом. Во-вторых, при сепсисе снижается активность протеина С и его кофактора — протеина S, который обладает как антикоагулянтным, так и в некоторой степени противовоспалительным эффектами. В-третьих, нарушается работа системы ингибитора пути активации тканевого фактора (ИПТФ). В норме ИПТФ присутствует на поверхности эндотелия сосудов или циркулирует в крови в связанном с липопротеинами виде. Его роль в развитии ДВС пока плохо изучена.
Повреждение тромбоцитов играет центральную роль в нарушении коагуляции при ДВС. Тромбоциты могут активироваться как напрямую, через провоспалительные медиаторы (фактор активации тромбоцитов), так и опосредованно через тканевой фактор и тромбин. Впоследствии на мембране активированных тромбоцитов происходит фиксация фибрина. Тромбин стимулирует экспрессию на мембране тромбоцитов Т-селектина, который регулирует адгезию тромбоцитов к лейкоцитам и эндотелию сосудистой стенки, а также ускоряет секрецию ТФ мононуклеарами. В дополнение ко всему повреждение эндотелия и взаимодействие тромбоцит-сосудистая стенка вызывает выброс в кровь ультра-больших мономеров фактора фон Виллебранда (vWF). Фактор фон Виллебранда является важным медиатором адгезии тромбоцитов и коагуляции крови, его деградация осуществляется с помощью металлопротеиназы ADAMTS-13. Доказано, что недостаток металлопротеиназы и, вследствие этого, снижение деградации vWF способствует развитию ДВС-синдрома и более тяжелому его течению.
Фенотип ДВС синдрома
Повышенное образование тромбина при ДВС-синдроме приводит к манифестации различных фенотипов, которые не обязательно характеризуются повышенным тромбообразованием. Например, ранняя гиперфибринолитическая (геморрагическая) фаза, вызывающая всплеск продукции тромбина в ранней фазе тяжелой травмы. Через 24–48 часов она сменяется прокоагулянтной (тромботической) фазой, характерной чертой которой является гиперпродукция плазмин-ингибирующего комплекса, приводящая к супрессии активности протеина С. Фенотип ДВС частично зависит от этиологического фактора, но в большей степени обусловлен преобладающим нарушением в регуляции гемостаза организма [2, 3]. Часто наблюдается активация системы свертывания (повышение тромбин-антитромбинового комплекса), однако степень фибринолитической активности (ингибитора активатора плазминогена) варьирует в зависимости от причины (рис. 3).
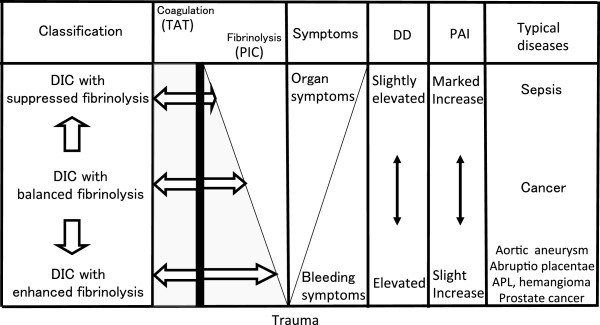
Рисунок 3 | Фенотипы ДВС-синдрома. TAT — комплекс тромбин-антитромбин; PIC — комплекс плазмин-альфа-2-антиплазмин; DD — Д-димер; PAI — ингибитор активатора плазминогена
В столбце «Symptoms» обозначен переход от кровотечений к органному поражению (развитие микро- и макротромбозов). На данном рисунке не обозначены продукты деградации фибрина (ПДФ), тем не менее при гиперфибринолитическом фенотипе ДВС имеется тенденция к преобладанию ПДФ над количеством Д-димеров. При терапии препаратами транс-ретиноевой кислоты при остром промиелоцитарном лейкозе ингибируется экспрессия опухолевыми клетками аннексина II, в результате чего меняется и фенотип ДВС (теряет характеристики гиперфибринолитического, приобретая характеристики прокоагулянтного фенотипа).
Диагностика
Критерии для выявления ДВС-синдрома по шкале ISTH (International Society of Thrombosis and Haemostasis Scoring System):

Рисунок 4 | ISTH (International Society of Thrombosis and Haemostasis Scoring System)
Критерии Japanese Association for Acute Medicine (JAAM):

Рисунок 5 | Japanese Association for Acute Medicine (JAAM)
Данные шкалы отличаются различной чувствительностью в отношении прогнозирования смертности: считается, что шкала JAAM имеет бо́льшую чувствительность к неявному ДВС-синдрому, в результате чего смертность при ДВС-синдроме, выявленном по данной шкале, почти в два раза ниже (около 22%).
Критерии ДВС Japanese Ministry of Health, Labor and Welfare (JMHLW):

Рисунок 6 | Japanese Ministry of Health, Labor and Welfare (JMHLW)
Данные критерии не адаптированы для пациентов с заболеваниями печени или нефротическим синдромом.
На основании представленных выше шкал выставляется диагноз ДВС. Наиболее подходящая шкала выбирается в зависимости от возможности проведения определенных лабораторных тестов и клинической ситуации. При возможности пациенту рекомендуется проводить контроль лабораторных показателей коагуляции каждые 8 часов.
Лечение
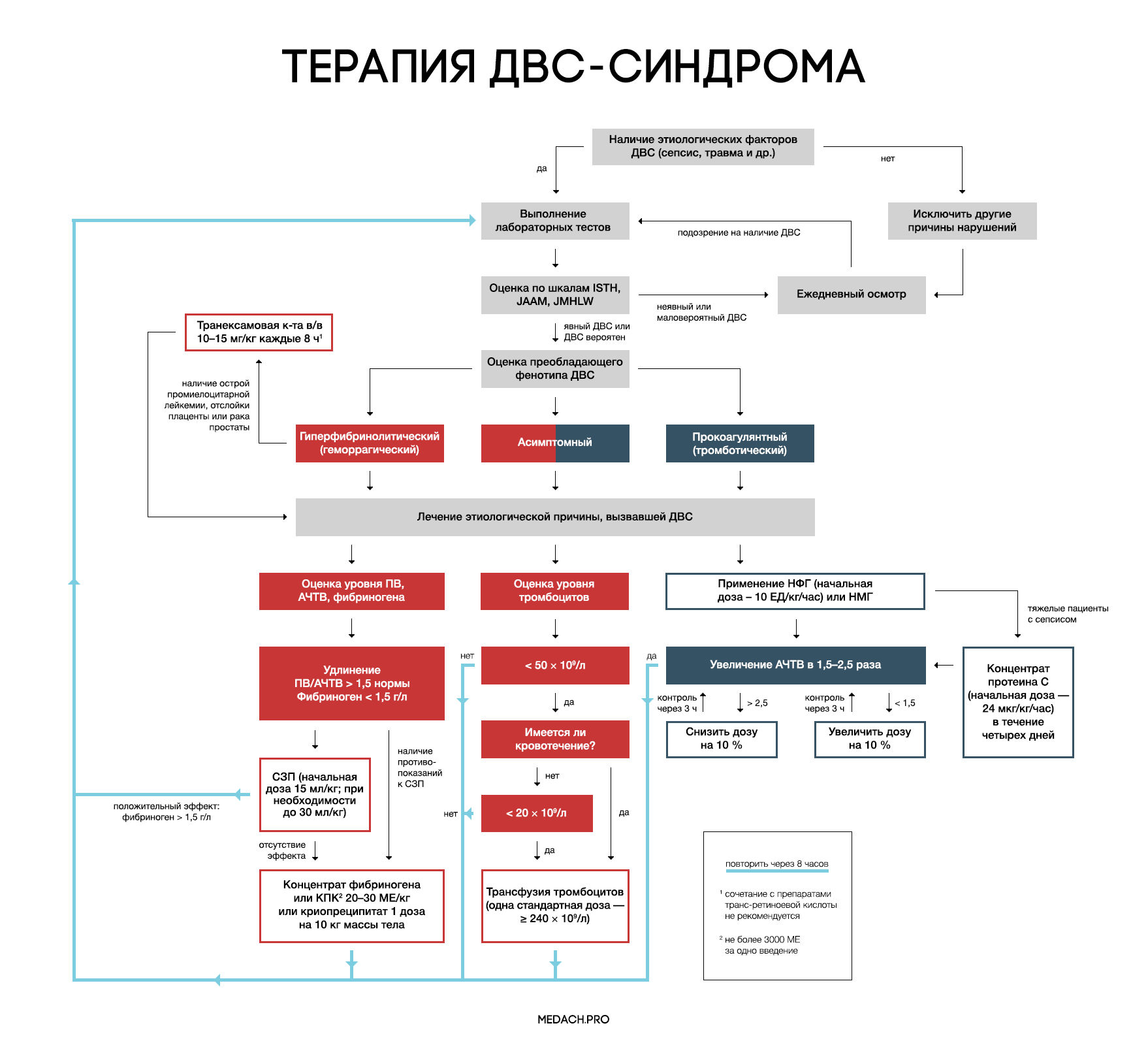
Рисунок 7 | Алгоритм тактики ведения пациентов с ДВС-синдромом (авторская работа Medach)
Терапия этиологического фактора
Главным в терапии ДВС-синдрома является лечение состояния, вызвавшего его развитие. Выделяют два варианта течения ДВС-синдрома:
— Контролируемый ДВС-синдром: характеризуется временным нарушением регуляции коагуляционных механизмов и быстрым восстановлением после ликвидации провоцирующего состояния (трансфузионная реакция, отслойка плаценты). В ряде случаев может разрешаться самостоятельно.
— Неконтролируемый ДВС-синдром (вызван сепсисом или травмой): в этом случае помимо ликвидации основной этиологической причины требуется незамедлительное начало терапии.
Важно отметить, что раннее начало применения препаратов, влияющих на систему свертывания крови (до развития ДВС-синдрома), может в значительной степени нарушить регуляцию гемостаза и, вследствие этого, ухудшить состояние пациента.
Заместительная терапия
Рекомендации по заместительной терапии ДВС сделаны на основании объединения данных гайдлайнов различных сообществ (British Committee for Standards in Haematology (BCSH), Japanese Society of Thrombosis and Hemostasis (JSTH), Italian Society for Thrombosis and Hemostasis (SISET)), занимающихся интенсивной терапией ДВС. При сочетании активного кровотечения или риска его развития и определенных уровней лабораторных показателей рекомендуется применение тромбоцитарной массы, свежезамороженной плазмы (СЗП), криопреципитата или концентрата фибриногена, концентрата протромбинового комплекса (КПК). Все нижеперечисленные рекомендации касаются категории пациентов с активным кровотечением.
Рекомендуется трансфузия тромбоцитов при наличии признаков активного кровотечениями и уровне тромбоцитов < 50 × 10^9 /л либо при отсутствии кровотечения, но наличии высокого риска его развития и уровне тромбоцитов < 20 × 10^9 /л. Трансфузия тромбоцитарной массы начинается с одной стандартной взрослой дозы (более 240 × 10^9/л). Переливание СЗП может применяться при удлинении ПВ/АЧТВ (больше 1,5 от нормы) или снижении уровня фибриногена менее 1,5 г/дл. Начальная доза СЗП составляет 15 мл/кг, при необходимости более жесткой коррекции уровня факторов свертывания допустимо использование дозы 30 мл/кг, однако следует помнить, что такие высокие дозы СЗП могут вызвать перегрузку объемом. КПК или концентрат фибриногена применяются при наличии подтвержденной тяжелой гипофибриногенемии (< 1,5 г/дл), несмотря на использование СЗП либо при наличии противопоказаний к ее применению. При применении 3 грамм концентрата фибриногена уровень фибриногена плазмы крови повышается примерно на 1 г/л. Такой же эффект достигается при переливании 4 единиц СЗП или 2 доз криопреципитата (10 донорских единиц). При планировании у пациентов инвазивных процедур необходимо контролировать уровень лабораторных показателей свертывания крови, и при необходимости превентивно провести трансфузию тромбоцитов или СЗП. Эффективность и безопасность применения рекомбинантного фактора VIIа у пациентов с ДВС требует дальнейшего исследования.
Антикоагулянтная терапия
Применение антикоагулянтов противопоказано при развитии ДВС-синдрома в результате травмы, или при травматическом шоке в сочетании с активным кровотечением. Для использования при ДВС-синдроме с преобладанием тромбозов рекомендуется нефракционированный гепарин (НФГ) или низкомолекулярные гепарины (НМГ). НФГ применяется в начальной дозе 10 ЕД/кг/час под контролем АЧТВ с поддержанием его увеличения в 1,5–2,5 раза от нормы. Необходимо помнить о профилактике тромбоэмболии НФГ или НМГ у тяжелых пациентов без признаков кровотечений. Уровень антитромбина III может частично использоваться для оценки дальнейшей эффективности применения гепарина, но зачастую имеются сложности (высокая стоимость, отсутствие реагентов) при измерении активности антитромбина III. На данный момент крупные исследования о применении НМГ у пациентов с ДВС-синдромом отсутствуют, и возможность профилактики НМГ строится на данных их использования у пациентов хирургического профиля.
Синтетические ингибиторы протеаз (габексата мезилат, нафамостата мезилат) разрешены к использованию в Японии, однако крупные РКИ, показывающие их эффективность при ДВС-синдроме, отсутствуют.
Концентраты антикоагулянтных факторов
Исследования в данном направлении ведутся на протяжении уже многих лет; так, с 1980 года проводятся испытания концентрата антитромбина, однако его эффективность при ДВС-синдроме до сих пор не доказана. На основании предположения, что при ДВС происходит угнетение выработки протеина С, зародилась идея применения активированного протеина С. После проведения больших исследований данный препарат показал эффективность в группах с тяжелой сопутствующей патологией (сепсис). Крупных исследований, сравнивающих эффективность рекомбинантного активированного человеческого протеина С и полученного из плазмы концентрата протеина С, не проводилось. Концентрат протеина С применяется в виде продолжительной инфузии со скоростью 24 мкг/кг/час в течении четырех дней. При необходимости проведения инвазивных процедур введение протеина С прерывается до их выполнения (период полувыведения около 20 минут), а затем возобновляется через несколько часов. При применении протеина С необходимо учитывать повышение рисков кровотечения (2–3,5 %) и внутричерепного кровоизлияния (0,1–0,3 %), а также то, что в исследованиях препарата не участвовали пациенты с тромбоцитопенией ( < 30 x 10^9/л). Для контроля терапии используется АЧТВ. Исследования по применению тифакогина (рекомбинантного ингибитора пути тканевого фактора) не увенчались успехом.
На данный момент имеется ряд исследований по безопасности и эффективности рекомбинантного растворимого человеческого тромбомодулина (rhTM), однако их результаты гетерогенны. Проведенный метаанализ данных исследований показал, что препараты rhTM оказывают положительный эффект на выживаемость в группе тяжелого сепсиса и пациентов с количеством баллов по шкале APACHE II более 24 или по шкале SOFA более 11. На данный момент исследования препаратов rhTM перешли в третью фазу.
Антифибринолитики
При ДВС-синдроме фибринолиз заблокирован повышением уровня ингибитора активатора плазминогена (PAI-1). Следовательно, при кровотечениях, вызванных ДВС-синдромом, применение антифибринолитиков не рекомендуется, за исключением случаев развития гиперфибринолитического фенотипа ДВС, возникшего на фоне острой промиелоцитарной лейкемии, отслойки плаценты или карциномы простаты.
Отличительными лабораторными особенностями гиперфибринолитического фенотипа является наличие повышенного уровня тромбин-антитромбинового комплекса (≥ 20 мкг/л) и плазмин-ингибирующего комплекса (≥ 10 мкг/л), а также снижение активности альфа-2-ингибитора плазмина более чем на 50 %.
При таком фенотипе показано использование транексамовой кислоты в дозе по 1 грамму (10–15 мг/кг) через каждые 8 часов. У пациентов с лейкемией часто проводится лечение препаратами транс-ретиноевой кислоты, но, по данным исследований, ее сочетание с транексамовой кислотой повышает риск развития тромбозов. Данную комбинацию необходимо применять в крайнем случае, при наличии признаков жизнеугрожающего кровотечения.
Источники
Levi M. et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation //British journal of haematology. – 2009. – Т. 145. – №. 1. – С. 24-33.
Gando S., Levi M., Toh C. H. Disseminated intravascular coagulation //Nature Reviews Disease Primers. – 2016. – Т. 2. – С. 16037.
Gando S., Wada H., Thachil J. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma‐shock (COT/ACOTS) //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 5. – С. 826-835.
ISTH, International Society on Thrombosis and Haemostasis. Adapted with permission from from Taylor Jr. FB, Toh CH, Hoots WK, et al. Towards Definition, Clinical and Laboratory Criteria, and a Scoring System for Disseminated Intravascular Coagulation. Thromb Haemost 2001; 86: 1327–30.
Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T, Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine Disseminated Intravascular
Coagulation (JAAM DIC) Study Group: A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 2006, 34: 625-631.
Kobayashi N. et al. Criteria for diagnosis of DIC based on the analysis of clinical and laboratory findings in 345 DIC patients collected by the Research Committee on DIC in Japan //Disseminated intravascular coagulation. – Karger Publishers, 1983. – Т. 49. – С. 265-275.
Wada H. et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines //Journal of thrombosis and haemostasis. – 2013. – Т. 11. – №. 4. – С. 761-767.
Afshari, A., Wetterslev, J., Brok, J. & Moller, A. M. Antithrombin III for critically ill patients. Cochrane Database Syst. Rev. 3, CD005370 (2008).
Abraham, E. et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290, 238–247 (2003).
Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models //Journal of intensive care. – 2014. – Т. 2. – №. 1. – С. 20.
Источник
