Типовые нарушения липидного обмена при метаболическом синдроме
На рубеже веков демографическая ситуация в мире заметно меняется: в 2000 г. в популяции преобладали лица молодого возраста, тогда как через 30 лет ожидается заметное старение человеческой популяции. Эксперты ВОЗ прогнозируют увеличение темпов неинфекционных заболеваний, к числу которых относятся ССЗ, ИБС, нарушение мозгового кровообращения, СД типа 2 и онкологические заболевания. В развитии «заболеваний цивилизации» существенную роль играют факторы риска. Если в 60-х гг. XX в. основными факторами риска считались гиперхолестеринемия, курение и артериальная гипертония, то в настоящее время доминируют метаболические факторы риска, такие, как ожирение, метаболический синдром и сахарный диабет (1).
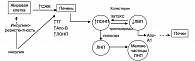
Рисунок 1. Механизм развития дислипидемии при МС

Таблица 1. Мета-анализ крупных исследований по влиянию статинов на риск сердечно-сосудистых осложнений в общей группе и субгруппе больных сахарным диабетом
В 2007 г. были опубликованы рекомендации Европейского общества кардиологов и Европейской ассоциации по изучению диабета, в которых анализируется роль метаболического синдрома (МС) в развитии сердечно-сосудистых заболеваний (ССЗ) и их осложнений. МС является сочетанием инсулинорезистентности, артериальной гипертонии, дислипидемии (гипертриглицеридемия, повышение холестерина ЛНП, низкий уровень холестерина ЛВП), микроальбуминурии, гиперурикемии, нарушения системы гемостаза и хронического субклинического воспаления. В настоящее время существует по крайнем мере 5 определений, предложенных: ВОЗ в 1998 г., Европейской группой по изучению инсулинорезистентности (ЕГИР) в 1999 г., Советом экспертов национальной образовательной программы по холестерину (ATP III NCEP) в 2001 г., Американской ассоциацией клинических эндокринологов в 2003 г. и Международной федерацией диабета в 2005 г. Критерии ВОЗ и ЕГИР были предназначены для исследовательских целей, а критерии NCEP и Международной федерации диабета нацелены на клиническую практику. В нескольких европейских проспективных исследованиях было показано, что МС ассоциируется с увеличением сердечно-сосудистой и общей смертности. Однако в американском исследовании NHANES II с участием 2341 взрослых американцев в возрасте 30-75 лет МС сопровождался умеренным увеличением риска сердечно-сосудистой смерти, но не оказывал достоверного влияния на риск смерти от любых причин или инсульта. Мета-анализ проспективных исследований показывает, что МС по сравнению с отдельными факторами риска ССЗ имеет более выраженный атерогенный потенциал, что способствует высокому риску развития ССЗ (2).
Особенности нарушений липидного обмена при МС
Термин дислипидемия более точно характеризует нарушения липидного обмена при МС, которые проявляются в виде увеличения апо-В-содержащих частиц, таких, как триглицериды, холестерин ЛОНП, мелкие и плотные частицы холестерина ХС ЛНП и снижения апо-А1-содержащих частиц холестерина ХС ЛВП. Эти нарушения имеют определенную последовательность или патогенетическую цепь развития (рисунок 1). При инсулинорезистентности в жировой клетке происходит липолиз, что приводит к выбросу большого количества свободных жирных кислот в кровоток через воротную вену. Они служат субстратом для синтеза триглицеридов печенью и избыточной продукции липопротеидов очень низкой плотности (ЛОНП). Под воздействием фермента печеночная липаза, ЛОНП превращаются в мелкие и плотные частицы ЛНП. Такие частицы подвергаются быстрому окислению и проникают в субэндотелиальное пространство, что усиливает процесс развития атеросклеротического поражения. В то же время увеличение активности белка, переносящего эфиры холестерина, приводит к переходу триглицеридов от ЛОНП к ЛВП (взамен на холестерин). В результате этого уменьшается концентрация ЛВП – основных частиц, осуществляющих обратный транспорт холестерина. Более того, они изменяются качественно (более мелкие частицы), что является причиной их быстрого выведения из кровообращения (9). Таким образом, нарушения липидного обмена при СД отличаются изменением соотношения «плохого» (ХС ЛНП и ХС ЛОНП) и «хорошего» (ХС ЛВП) холестерина, а также увеличением концентрации триглицеридов. В практической медицине эти нарушения именуется как липидная триада (3).
В 2007 г. завершено одномоментное российское исследование по выявлению МС в случайной выборке взрослой популяции в отдельно взятом городе Приволжского федерального округа (г. Чебоксары). В исследовании участвовали 1800 мужчин и женщин в возрасте 30-69 лет. Отклик составил 88,7% (n = 1718).Было показано, что 20,6% лиц имеют МС, причем у женщин он встречается в 2,4 раза чаще, а с возрастом число больных увеличивается. Так, в возрастном диапазоне 30-39 лет МС выявлен у 1%, в 40-49 лет – у 3,6%, в 50-59 лет – у 9%, а в возрасте 60-69 лет – у 7% респондентов. Для диагностики метаболического синдрома использовали критерии NCEP (наличие 3 и более компонентов, включая гипертриглицеридемию и низкий уровень холестерина ЛВП). В целом, у 78% пациентов с МС выявлен низкий уровень холестерина ЛВП, тогда как гипертриглицеридемия диагностирована у 44%. Несмотря на то, что гиперхолестеринемия не включена в критерии диагностики, у 76% пациентов с МС диагностирована мягкая и умеренная гиперхолестеринемия (52 и 24% соответственно) (4).
По данным Британского проспективного исследования по диабету (UKPDS), прогностическая значимость факторов риска в плане развития ИБС (стенокардия напряжения и/или инфаркт миокарда) составляет следующую последовательность: холестерин ЛНП, холестерин ЛВП, гликированный гемоглобин, систолическое АД. В исследовании определяли влияние на риск развития ИБС повышения уровней ключевых факторов риска на одну ступень. Так, повышение уровня холестерина ЛНП на 1 ммоль/л вызывало увеличение риска развития ИБС на 57%, а повышение уровня холестерина ЛВП на 0,1 ммоль/л приводило к снижению риска на 15% (5).
Учитывая сложное взаимодействие триглицеридов и других липопротеидов и вариабельность концентрации триглицеридов, очевидно, что подтвердить их прогностическое значение с помощью математических методов сложно. При мета-анализе популяционных исследований было показано, что при увеличении уровня триглицеридов на 1 ммоль/л сердечно-сосудистый риск повышается на 32% у мужчин и 76% у женщин. С поправкой на уровень холестерина ЛВП степень повышения сердечно-сосудистого риска уменьшилась вдвое, но сохранила статистическое значение (2).
Таким образом, повышенный уровень холестерина ЛНП и низкая концентрация холестерина ЛВП в крови является сильным предиктором развития ИБС у больных с МС.
Принципы лекарственной терапии при дислипидемии и МС
Поиск эффективных методов лечения дислипидемии берет свое начало с 70-х гг. XX в. Применение секвестрантов желчных кислот, никотиновой кислоты и в дальнейшем фибратов (в частности, гемфиброзил) показало, что имеется достоверная корреляция между снижением уровня холестерина и уменьшением частоты сердечно-сосудистых осложнений. По различным причинам эти группы препаратов не нашли широкого применения для коррекции дислипидемии у больных с метаболическими нарушениями и высоким сердечно-сосудистым риском. С появлением статинов открылись новые возможности эффективного и безопасного снижения смертности от сердечно-сосудистых заболеваний. Американский ученый W. Roberts определил значение статинов при лечении атеросклероза таким, каким было значение пенициллина в лечении инфекционных болезней. Основным механизмом действия статинов является умеренное снижение содержания холестерина в клетках печени за счет обратимого подавления ключевого фермента синтеза холестерина – ГМК-КоА редуктазы, что приводит к увеличению количества рецепторов для ЛНП и повышению выведения их из кровотока. В экспериментальных исследованиях было показано, что статины способствуют стабилизации атеросклеротической бляшки за счет уменьшения объема липидного ядра, укрепления оболочки (противовоспалительный эффект) и улучшения локальной функции эндотелия. В 90-х гг. были проведены масштабные клинические исследования, в которых изучалось влияние терапии статинами на различные конечные точки, характеризующие сердечно-сосудистую заболеваемость и смертность, обусловленных атеросклерозом (6). Мета-анализ результатов 4 крупных проспективных исследований показал, что применение статинов у больных с умеренной и выраженной гиперхолестеринемией привело к достоверному снижению сердечно-сосудистой и обшей смертности (таблица 1) (7-10). В большинстве исследований также отслеживалась эффективность статинов у больных СД типа 2 и метаболическими нарушениями (примерно 10-15% общего числа участников). Несмотря на одинаковые исходные уровни холестерина ЛНП, в субгруппе пациентов с СД риск сердечно-сосудистых осложнений снижается достоверно на 7% (от 2 до 10%) больше по сравнению с общей группой больных. Эти данные свидетельствуют о том, что применение статинов у больных СД в сочетании с гиперхолестеринемией приводит к заметному снижению общего риска сердечно-сосудистых осложнений. Более того, эти результаты превосходят таковые по сравнению с общей группой больных (с наличием или без ИБС) без СД. Эксперты Европейского общества кардиологов и Европейской ассоциации по изучению диабета на основании проспективных исследований с твердыми конечными точками статины рекомендуют средством первого ряда в лечении высокого уровня холестерина ЛНП у больных СД и метаболическими нарушениями (класс I, уровень А) (2).
Российский опыт применения статинов у лиц с МС
Одной из актуальных проблем первичной и вторичной профилактики ССЗ является выявление и коррекция нарушений липидного обмена в реальной клинической практике. По сравнению с европейскими странами (по данным исследования REALITY, 58223 пациентов из 10 стран Европы) в России липидснижающая терапия (в частности, статины) назначаются в 5-6 раз реже. В 2006 г. были представлены результаты двух российских исследований (MCC – Московское исследование по статинам и ОСКАР – Эпидемиология и особенности терапии пациентов высокого риска в реальной клинической практике), которые дали представление об адекватности терапии гиперлипидемии в учреждениях первичного здравоохранения. В частности, в исследовании ОСКАР, состоявшего из 2 этапов, было показано, что в клинической практике только 5,3% больных среди пациентов, имеющих факторы риска ССЗ, получают гиполипидемическую терапию статинами, причем только 4,3% достигают целевых уровней липидов. Во второй части программы ОСКАР всем 7098 пациентам рекомендована статинотерапия: большинство пациентов принимали симвастатин (Вазилип, 20 мг в сутки), 20% пациентам был рекомендован аторвастатин (Аторис, 10 мг в сутки). Через 8 недель терапии удалось достичь снижения уровня холестерина на 23%, при этом целевые уровни холестерина (
В двух крупных исследованиях, посвященных первичной профилактике ССЗ (ASCOT-LLA, n = 2532 и CARDS, n = 2838), показано, что терапия с применением аторвастатина в дозе 10 мг на протяжении не менее 3 лет способствует снижению кумулятивного показателя сердечно-сосудистых событий на 36 и 37% соответственно.
Недавно опубликованы результаты клинического исследования А.Л. Хохлова и соавт., посвященного изучению эффективности применения аторвастатина у лиц с дислипидемией и МС. В исследование были включены 40 пациентов в среднем возрасте 54,4 ± 5,0 лет с МС (АГ I-II ст., абдоминальное ожирение, СД типа 2 и дислипидемия). Исходно пациенты имели умеренную гиперхолестеринемию (7,5 ± 1,1 ммоль/л) и мягкую гипертриглицеридемию (2,4 ± 0,9 ммоль/л), при этом коэффициент атерогенности составил 6,1 ± 1,2. На фоне терапии с применением аторвастатина (Аторис, 10 мг в сутки) продолжительностью 5 месяцев общий холестерин снизился на 32%, холестерин ЛНП на 44%, триглицериды на 22,5%, а холестерин ЛВП увеличился на 15%. На фоне терапии целевые уровни общего холестерина достигнуты у 20%, ХС ЛНП у 25% и триглицериды у 55% пациентов с МС. Наряду с этим начальные дозы аторвастатина способствуют снижению уровня гликированного гемоглобина на 1,1%. По данным исследования UKPDS, снижение HbA1с на 1% сопровождается снижением риска ССЗ на 25%. В результатах исследования представлены данные о динамике уровня С-реактивного белка – маркера хронического воспаления. Так, высоко чувствительный С-реактивный белок снизился на 37% (12). Плеотропные эффекты аторвастатина доказаны в крупном российском исследовании ФАРВАТЕР. В частности, применение Аторис 10-20 мг у лиц с документированными ИБС и гиперлипидемией на протяжении 24 недель способствовало снижению С-реактивного белка на 20%, улучшение эндотелий-зависимой вазодилатации на 52%, увеличению растяжимости на 45% и уменьшение жесткости сосудистой стенки на 25% (13).
В целом применение аторвастатина у лиц с МС и ИБС, стенокардией напряжения приводит к снижению частоты ангинозных приступов (1,95 ± 1,76 до исследования и 0,8 ± 0,7 после лечения, p
Таким образом, включение аторвастатина в среднесуточной дозе в стандартную терапию пациентов с МС снижает уровень аторогенных частиц, снижает коэффициент атерогенности, а также достоверно уменьшает уровни гликированного гемоглобина и высоко чувствительного С-реактивного белка, что способствует снижению суммарного показателя сердечно-сосудистого риска.
Заключение
Таким образом, атерогенная дислипидемия является важным фактором развития сердечно-сосудистых осложнений у больных с метаболическими нарушениями.
Данные доказательной медицины убедительно показывают, что статины являются препаратами первого ряда для первичной и вторичной профилактики ССЗ. У больных с СД и ССЗ статины назначают независимо от исходного уровня холестерина ЛНП. У взрослых больных с СД и метаболическими нарушениями статины применяются, если уровень холестерина ЛНП превышает 3,5 ммоль/л.
В рекомендациях Европейского общества кардиологов целевые уровни липидов при первичной профилактике у больных с метаболическими нарушениями и СД соответствуют таковым у больных с ССЗ: общий холестерин 1 ммоль/л у мужчин и > 1,2 ммоль/л у женщин.
В некоторых случаях для снижения уровня холестерина не ЛВП требуется применение высоких доз статинов или комбинированная терапия с использованием эзетимиба, никотиновой кислоты или фибратов.
Источник
Дата публикации 26 марта 2018Обновлено 19 июля 2019
Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне).[4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа.[5]
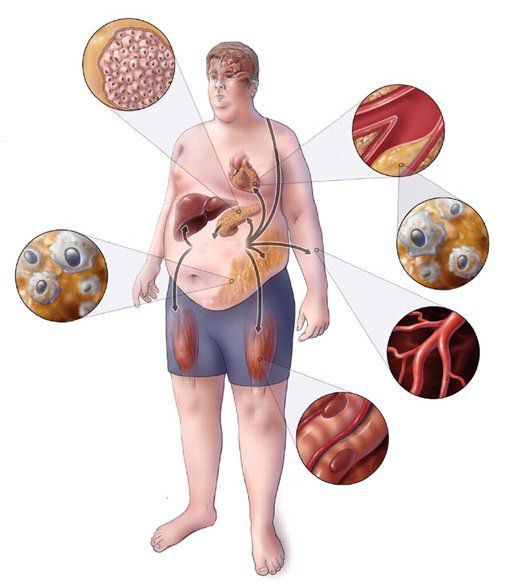
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям.[3][7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м2), классифицируются следующие типы массы тела (МТ):
- нормальная МТ — ИМТ ≥18,5 <25;
- избыточная МТ — ≥25 <30;
- ожирение I степени — ≥30 <35;
- ожирение II степени — ≥35 <40;
- ожирение III степени — ≥40.
ИМТ <18,5 характеризуется как дефицит массы тела.
Важную роль играет распределение жировой ткани. Различают два типа ожирения:
- гиноидный (по типу «груша»), когда избыточная жировая ткань распределяется преимущественно на бёдрах и ягодицах;
- андроидный (по типу «яблоко»; абдоминальное ожирение), с преимущественной локализацией жира в области верхней половины тела (живот, грудь, плечи, спина).

Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма <5,6) и в венозной плазме (норма <6,1) натощак в ммоль/л. Гипергликемией натощак считается показатель ≥5,6 <6,1 и ≥6,1; <7,0; сахарный диабет — ≥6,1 и ≥6,1 <7,0, соответственно. Через 2 часа после углеводной нагрузки (75 гр глюкозы или 125 гр сахара рафинада, растворённых в 200 мл воды) нормальный показатель концентрации глюкозы в капиллярной и венозной крови — <7,8 ммоль/л; НТГ — ≥7,8 <11,1 и сахарный диабет — ≥11,1.
Ещё один важный компонент метаболического синдрома — артериальная гипертензия, которая может носить вторичный характер. Нормальным считается систолическое артериальное давление (САД) 120-129 мм рт.ст и диастолическое артериальное давление (ДАД) 80-84 мм рт.ст. САД <120 и ДАД <80 называют оптимальным давлением, а САД 130-139 и ДАД 85-89 — высоким нормальным артериальным давлением. Различают три степени артериальной гипертензии:
- 1 ст. – САД 140-159, ДАД 90-99;
- 2 ст. – САД 160-179, ДАД 100-109;
- 3 ст. – САД ≥180, ДАД ≥110.
Повышение артериального давления характеризуется повышением риска сердечно-сосудистых событий.
Для метаболического синдрома характерны также изменения липидного обмена, которые классифицированы в таблице ниже (в ммоль/л).
| Параметры липидов | Риск низкий | Риск умеренный | Риск высокий | Риск очень высокий |
|---|---|---|---|---|
| ОХ | ≤5,5 | ≤5 | ≤4,5 | ≤4 |
| ХС-ЛПНП | ≤3,5 | ≤3 | ≤2,5 | ≤1,8 |
| ХС-ЛПВП | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 |
| Триглицериды | ≤1,7 | ≤1,7 | ≤1,7 | ≤1,7 |
| ХС не-ЛПВП | ≤4,3 | ≤3,8 | ≤3,3 | ≤2,6 |
| Примечание: ОХ — общий холестерин; ХС-ЛПНП — холестерин липопротеинов низкой плотности; ХС-ЛПВП — холестерин липопротеинов высокой плотности; ХС не-ЛПВП — холестерин, не связанный с липопротеинами высокой плотности. | ||||
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий.[17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП <1,0 у мужчин; <1,2 у женщин и повышение ХС ЛПНП >3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – <11,1.[8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение < 0,33).[12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность[14], рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия)[15], психотерапевтических методик и обучающих программ.[13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии.[10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности[1]. Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут).[11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.).[9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46%[6].
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
| АО+АГ+НТГ (СД) Умеренный ССР | АО+АГ+ДЛ Высокий ССР | АО+АГ+НТГ (СД)+ДЛ Высокий и очень высокий ССР | ||
|---|---|---|---|---|
| Д/ФН+АГП+ГГП | Д/ФН+АГП+ГЛП | Д/ФН+АГП+ГГП+ГЛП | ||
| Примечание ССР – сердечно-сосудистый риск; АГ – артериальная гипертензия; АО – абдоминальное ожирение; ДЛ – дислипидемия; НТГ – нарушение толерантности к глюкозе; СД – сахарный диабет; Д/ФН – диета/физическая нагрузка; АГП – антигипертензивный препарат; ГГП – гипогликемический препарат; ГЛП – гиполипидемический препарат. | ||||
Источник
