Вид тромба при двс синдроме
Диссеминированное внутрисосудистое свертывание (ДВС) ㅡ клинико-патологический синдром, осложняющий течение различных заболеваний. ДВС характеризуется системной активацией патологических путей, приводящей к нарушению регуляции коагуляции; проявляется образованием фибриновых сгустков с последующей органной дисфункцией и сопутствующим потреблением тромбоцитов и факторов свертывания, клинически проявляющимся кровотечениями.
Смертность от ДВС за последние годы значительно снизилась. По данным министерства здравоохранения Японии, смертность от ДВС упала с 65 % в 1998 году до 46 % в 2010 и 2012 годах, такая же тенденция наблюдается и в США (с 76 до 51 % между 2006 и 2010 годами). Данное снижение смертности обусловлено более глубоким пониманием патогенеза заболевания, улучшением ранней диагностики и применением новых протоколов лечения ДВС.
Этиология
ДВС часто развивается на фоне сепсиса либо инфекции (30–51 %), травмы (черепно-мозговая травма, ожоги, жировая эмболия) или больших оперативных вмешательств (45 %). Другими причинами ДВС могут быть деструкция органов (тяжелый панкреатит), злокачественный процесс, тяжелые акушерские патологии (эмболия амниотической жидкостью, отслойка плаценты, тяжелая преэклампсия, послеродовое кровотечение), фульминантная печеночная недостаточность, цирроз печени, тяжелые токсические или иммунологические реакции (отравление ядами змей, переливание несовместимой крови, отторжение трансплантата), сосудистые заболевания (гемангиомы, аневризмы аорты, синдром Казабаха-Мерритта).
Патофизиология ДВС
К развитию ДВС приводит нарушение регуляции противосвертывающей и свертывающей систем крови. Формирование фибринового сгустка является продуктом целого каскада реакций, в которых задействованы как факторы свертывания, так и клеточные элементы. Выделяют внутренний и внешний пути активации коагуляции. Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь) (рис. 1).
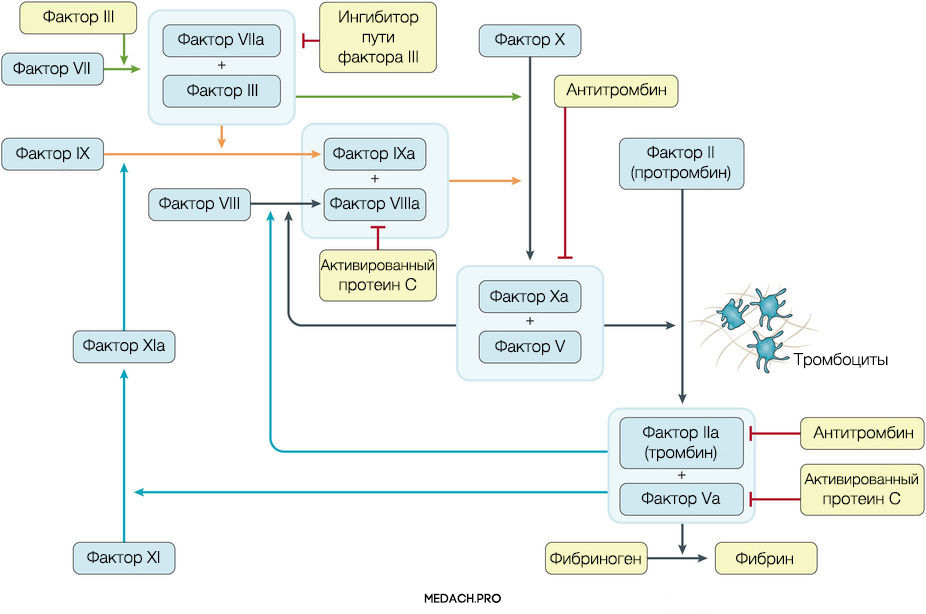
Рисунок 1 | Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь)
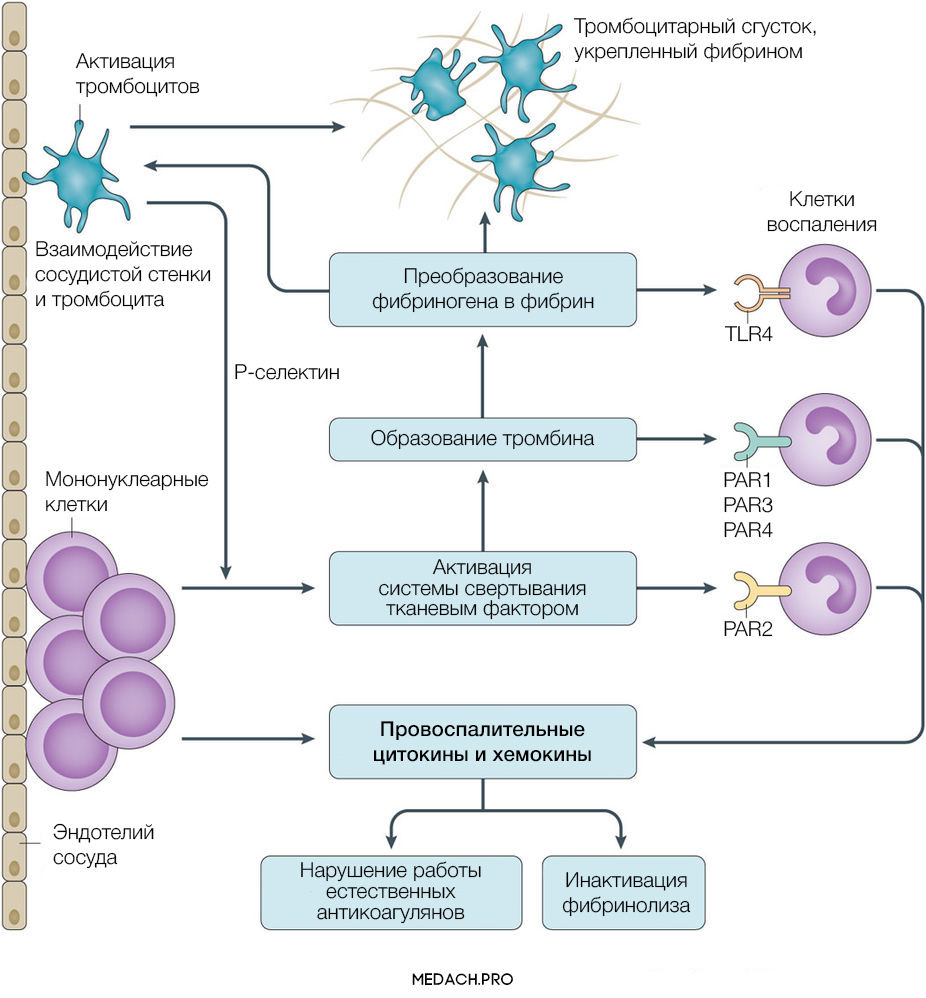
Тканевой фактор (ТФ) представляет собой мембрано-ассоциированный гликопротеин, находящийся в субэндотелиальном слое сосудов, в физиологических условиях не контактирующий с кровью. Выброс тканевого фактора могут спровоцировать различные процессы, такие как прямое повреждение сосудов, воспалительные и иммунологические реакции. При сепсисе ТФ непосредственно продуцируется моноцитами, а также выделяется в результате взаимодействия тромбоцитов со стенкой сосудов, что приводит к значительному усилению коагуляции. Выброс провоспалительных цитокинов и хемокинов провоцируется взаимодействием ТФ, тромбина и других факторов коагуляции с воспалительными клетками через специфические протеаза-активируемые рецепторы (PARs) 1–4 типа, а также дополнительно тромбином через Toll-like рецепторы 4 типа (TLR4). Развитие ДВС на фоне онкологических процессов имеет свои особенности, так как некоторые опухоли могут производить прокоагулянтные факторы (тканевой фактор и цистеиновая протеаза фактора X) (рис. 2).

Рисунок 2 | Активация прокоагулянтных факторов в патогенезе ДВС-синдрома
Важное место в процессе свертывания занимает тромбин: он не только участвует в преобразовании фибриногена в фибрин, но также активирует другие факторы и ко-факторы свертывания (факторы VII, IX и XI). Тромбин инициирует скрепление частиц фибриногена в мономеры, а затем и в полимеры. Последующая стабилизация тромба происходит с помощью тромбин-активируемых факторов XIII (фактора XIIIа).
Реакции коагуляции контролируются противосвертывающей системой крови, включающей в себя: антитромбин (блокирует фактор Xa и тромбин), протеин С (протеолитически разрушает Va и VIIIa факторы), ингибитор пути тканевого фактора (ингибирует комплекс тканевой фактор-VIIa фактор).
При сепсис-индуцированном ДВС нарушаются все три компонента противосвертывающей системы. Во-первых, снижается уровень антитромбина в результате нарушения его синтеза в печени, увеличения его клиренса из-за образования протеаза-антитромбинового комплекса, экстраваскулярных потерь из-за повышения проницаемости клеточной стенки и разрушения эстеразой нейтрофилов. В дополнение к этому, в стенке сосудов нарушается синтез протеогликанов, способствующих связи антитромбина с гепарин-сульфатом. Во-вторых, при сепсисе снижается активность протеина С и его кофактора — протеина S, который обладает как антикоагулянтным, так и в некоторой степени противовоспалительным эффектами. В-третьих, нарушается работа системы ингибитора пути активации тканевого фактора (ИПТФ). В норме ИПТФ присутствует на поверхности эндотелия сосудов или циркулирует в крови в связанном с липопротеинами виде. Его роль в развитии ДВС пока плохо изучена.
Повреждение тромбоцитов играет центральную роль в нарушении коагуляции при ДВС. Тромбоциты могут активироваться как напрямую, через провоспалительные медиаторы (фактор активации тромбоцитов), так и опосредованно через тканевой фактор и тромбин. Впоследствии на мембране активированных тромбоцитов происходит фиксация фибрина. Тромбин стимулирует экспрессию на мембране тромбоцитов Т-селектина, который регулирует адгезию тромбоцитов к лейкоцитам и эндотелию сосудистой стенки, а также ускоряет секрецию ТФ мононуклеарами. В дополнение ко всему повреждение эндотелия и взаимодействие тромбоцит-сосудистая стенка вызывает выброс в кровь ультра-больших мономеров фактора фон Виллебранда (vWF). Фактор фон Виллебранда является важным медиатором адгезии тромбоцитов и коагуляции крови, его деградация осуществляется с помощью металлопротеиназы ADAMTS-13. Доказано, что недостаток металлопротеиназы и, вследствие этого, снижение деградации vWF способствует развитию ДВС-синдрома и более тяжелому его течению.
Фенотип ДВС синдрома
Повышенное образование тромбина при ДВС-синдроме приводит к манифестации различных фенотипов, которые не обязательно характеризуются повышенным тромбообразованием. Например, ранняя гиперфибринолитическая (геморрагическая) фаза, вызывающая всплеск продукции тромбина в ранней фазе тяжелой травмы. Через 24–48 часов она сменяется прокоагулянтной (тромботической) фазой, характерной чертой которой является гиперпродукция плазмин-ингибирующего комплекса, приводящая к супрессии активности протеина С. Фенотип ДВС частично зависит от этиологического фактора, но в большей степени обусловлен преобладающим нарушением в регуляции гемостаза организма [2, 3]. Часто наблюдается активация системы свертывания (повышение тромбин-антитромбинового комплекса), однако степень фибринолитической активности (ингибитора активатора плазминогена) варьирует в зависимости от причины (рис. 3).
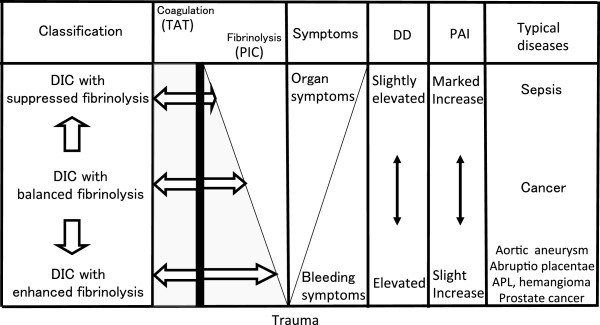
Рисунок 3 | Фенотипы ДВС-синдрома. TAT — комплекс тромбин-антитромбин; PIC — комплекс плазмин-альфа-2-антиплазмин; DD — Д-димер; PAI — ингибитор активатора плазминогена
В столбце «Symptoms» обозначен переход от кровотечений к органному поражению (развитие микро- и макротромбозов). На данном рисунке не обозначены продукты деградации фибрина (ПДФ), тем не менее при гиперфибринолитическом фенотипе ДВС имеется тенденция к преобладанию ПДФ над количеством Д-димеров. При терапии препаратами транс-ретиноевой кислоты при остром промиелоцитарном лейкозе ингибируется экспрессия опухолевыми клетками аннексина II, в результате чего меняется и фенотип ДВС (теряет характеристики гиперфибринолитического, приобретая характеристики прокоагулянтного фенотипа).
Диагностика
Критерии для выявления ДВС-синдрома по шкале ISTH (International Society of Thrombosis and Haemostasis Scoring System):

Рисунок 4 | ISTH (International Society of Thrombosis and Haemostasis Scoring System)
Критерии Japanese Association for Acute Medicine (JAAM):

Рисунок 5 | Japanese Association for Acute Medicine (JAAM)
Данные шкалы отличаются различной чувствительностью в отношении прогнозирования смертности: считается, что шкала JAAM имеет бо́льшую чувствительность к неявному ДВС-синдрому, в результате чего смертность при ДВС-синдроме, выявленном по данной шкале, почти в два раза ниже (около 22%).
Критерии ДВС Japanese Ministry of Health, Labor and Welfare (JMHLW):

Рисунок 6 | Japanese Ministry of Health, Labor and Welfare (JMHLW)
Данные критерии не адаптированы для пациентов с заболеваниями печени или нефротическим синдромом.
На основании представленных выше шкал выставляется диагноз ДВС. Наиболее подходящая шкала выбирается в зависимости от возможности проведения определенных лабораторных тестов и клинической ситуации. При возможности пациенту рекомендуется проводить контроль лабораторных показателей коагуляции каждые 8 часов.
Лечение
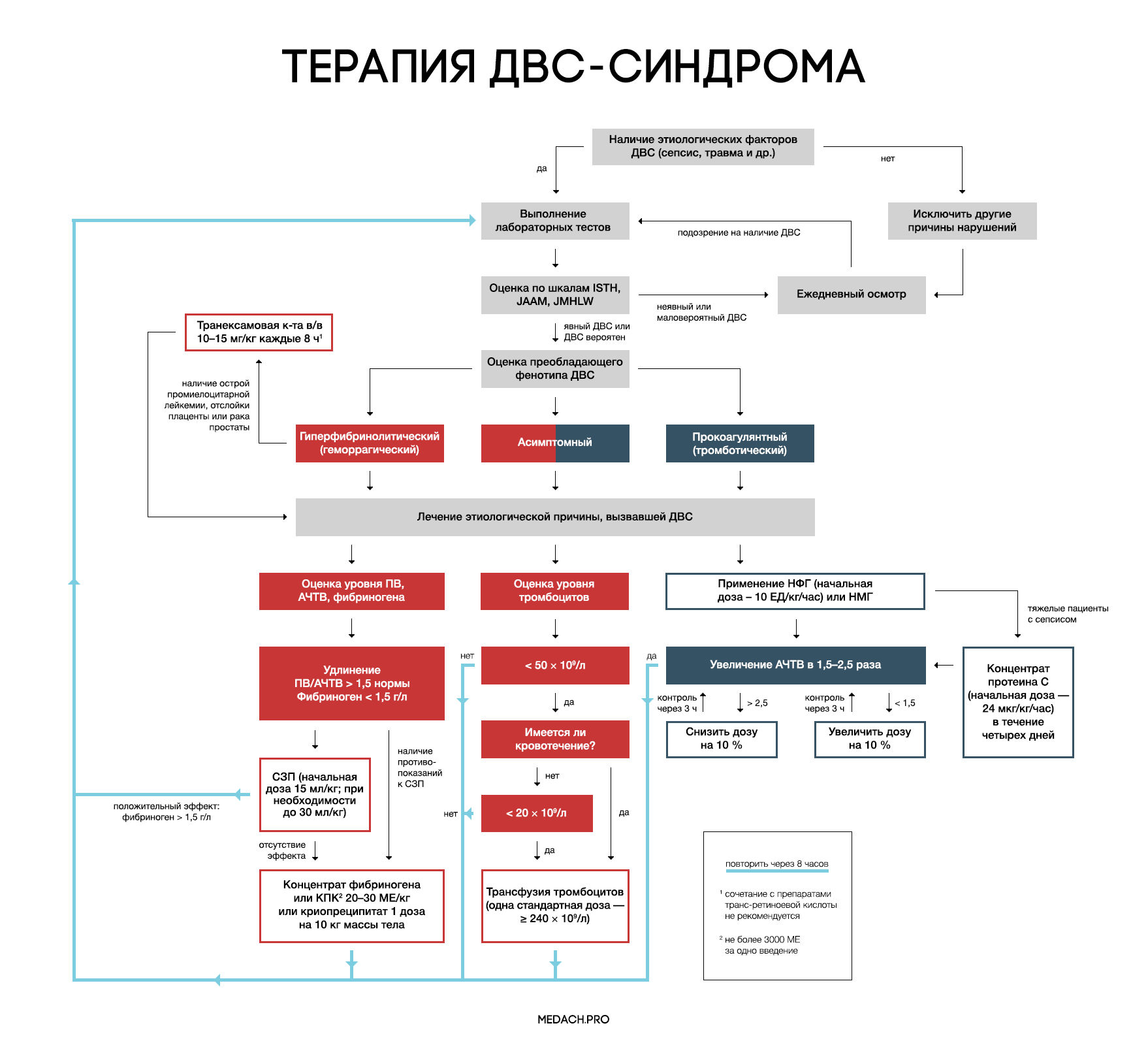
Рисунок 7 | Алгоритм тактики ведения пациентов с ДВС-синдромом (авторская работа Medach)
Терапия этиологического фактора
Главным в терапии ДВС-синдрома является лечение состояния, вызвавшего его развитие. Выделяют два варианта течения ДВС-синдрома:
— Контролируемый ДВС-синдром: характеризуется временным нарушением регуляции коагуляционных механизмов и быстрым восстановлением после ликвидации провоцирующего состояния (трансфузионная реакция, отслойка плаценты). В ряде случаев может разрешаться самостоятельно.
— Неконтролируемый ДВС-синдром (вызван сепсисом или травмой): в этом случае помимо ликвидации основной этиологической причины требуется незамедлительное начало терапии.
Важно отметить, что раннее начало применения препаратов, влияющих на систему свертывания крови (до развития ДВС-синдрома), может в значительной степени нарушить регуляцию гемостаза и, вследствие этого, ухудшить состояние пациента.
Заместительная терапия
Рекомендации по заместительной терапии ДВС сделаны на основании объединения данных гайдлайнов различных сообществ (British Committee for Standards in Haematology (BCSH), Japanese Society of Thrombosis and Hemostasis (JSTH), Italian Society for Thrombosis and Hemostasis (SISET)), занимающихся интенсивной терапией ДВС. При сочетании активного кровотечения или риска его развития и определенных уровней лабораторных показателей рекомендуется применение тромбоцитарной массы, свежезамороженной плазмы (СЗП), криопреципитата или концентрата фибриногена, концентрата протромбинового комплекса (КПК). Все нижеперечисленные рекомендации касаются категории пациентов с активным кровотечением.
Рекомендуется трансфузия тромбоцитов при наличии признаков активного кровотечениями и уровне тромбоцитов < 50 × 10^9 /л либо при отсутствии кровотечения, но наличии высокого риска его развития и уровне тромбоцитов < 20 × 10^9 /л. Трансфузия тромбоцитарной массы начинается с одной стандартной взрослой дозы (более 240 × 10^9/л). Переливание СЗП может применяться при удлинении ПВ/АЧТВ (больше 1,5 от нормы) или снижении уровня фибриногена менее 1,5 г/дл. Начальная доза СЗП составляет 15 мл/кг, при необходимости более жесткой коррекции уровня факторов свертывания допустимо использование дозы 30 мл/кг, однако следует помнить, что такие высокие дозы СЗП могут вызвать перегрузку объемом. КПК или концентрат фибриногена применяются при наличии подтвержденной тяжелой гипофибриногенемии (< 1,5 г/дл), несмотря на использование СЗП либо при наличии противопоказаний к ее применению. При применении 3 грамм концентрата фибриногена уровень фибриногена плазмы крови повышается примерно на 1 г/л. Такой же эффект достигается при переливании 4 единиц СЗП или 2 доз криопреципитата (10 донорских единиц). При планировании у пациентов инвазивных процедур необходимо контролировать уровень лабораторных показателей свертывания крови, и при необходимости превентивно провести трансфузию тромбоцитов или СЗП. Эффективность и безопасность применения рекомбинантного фактора VIIа у пациентов с ДВС требует дальнейшего исследования.
Антикоагулянтная терапия
Применение антикоагулянтов противопоказано при развитии ДВС-синдрома в результате травмы, или при травматическом шоке в сочетании с активным кровотечением. Для использования при ДВС-синдроме с преобладанием тромбозов рекомендуется нефракционированный гепарин (НФГ) или низкомолекулярные гепарины (НМГ). НФГ применяется в начальной дозе 10 ЕД/кг/час под контролем АЧТВ с поддержанием его увеличения в 1,5–2,5 раза от нормы. Необходимо помнить о профилактике тромбоэмболии НФГ или НМГ у тяжелых пациентов без признаков кровотечений. Уровень антитромбина III может частично использоваться для оценки дальнейшей эффективности применения гепарина, но зачастую имеются сложности (высокая стоимость, отсутствие реагентов) при измерении активности антитромбина III. На данный момент крупные исследования о применении НМГ у пациентов с ДВС-синдромом отсутствуют, и возможность профилактики НМГ строится на данных их использования у пациентов хирургического профиля.
Синтетические ингибиторы протеаз (габексата мезилат, нафамостата мезилат) разрешены к использованию в Японии, однако крупные РКИ, показывающие их эффективность при ДВС-синдроме, отсутствуют.
Концентраты антикоагулянтных факторов
Исследования в данном направлении ведутся на протяжении уже многих лет; так, с 1980 года проводятся испытания концентрата антитромбина, однако его эффективность при ДВС-синдроме до сих пор не доказана. На основании предположения, что при ДВС происходит угнетение выработки протеина С, зародилась идея применения активированного протеина С. После проведения больших исследований данный препарат показал эффективность в группах с тяжелой сопутствующей патологией (сепсис). Крупных исследований, сравнивающих эффективность рекомбинантного активированного человеческого протеина С и полученного из плазмы концентрата протеина С, не проводилось. Концентрат протеина С применяется в виде продолжительной инфузии со скоростью 24 мкг/кг/час в течении четырех дней. При необходимости проведения инвазивных процедур введение протеина С прерывается до их выполнения (период полувыведения около 20 минут), а затем возобновляется через несколько часов. При применении протеина С необходимо учитывать повышение рисков кровотечения (2–3,5 %) и внутричерепного кровоизлияния (0,1–0,3 %), а также то, что в исследованиях препарата не участвовали пациенты с тромбоцитопенией ( < 30 x 10^9/л). Для контроля терапии используется АЧТВ. Исследования по применению тифакогина (рекомбинантного ингибитора пути тканевого фактора) не увенчались успехом.
На данный момент имеется ряд исследований по безопасности и эффективности рекомбинантного растворимого человеческого тромбомодулина (rhTM), однако их результаты гетерогенны. Проведенный метаанализ данных исследований показал, что препараты rhTM оказывают положительный эффект на выживаемость в группе тяжелого сепсиса и пациентов с количеством баллов по шкале APACHE II более 24 или по шкале SOFA более 11. На данный момент исследования препаратов rhTM перешли в третью фазу.
Антифибринолитики
При ДВС-синдроме фибринолиз заблокирован повышением уровня ингибитора активатора плазминогена (PAI-1). Следовательно, при кровотечениях, вызванных ДВС-синдромом, применение антифибринолитиков не рекомендуется, за исключением случаев развития гиперфибринолитического фенотипа ДВС, возникшего на фоне острой промиелоцитарной лейкемии, отслойки плаценты или карциномы простаты.
Отличительными лабораторными особенностями гиперфибринолитического фенотипа является наличие повышенного уровня тромбин-антитромбинового комплекса (≥ 20 мкг/л) и плазмин-ингибирующего комплекса (≥ 10 мкг/л), а также снижение активности альфа-2-ингибитора плазмина более чем на 50 %.
При таком фенотипе показано использование транексамовой кислоты в дозе по 1 грамму (10–15 мг/кг) через каждые 8 часов. У пациентов с лейкемией часто проводится лечение препаратами транс-ретиноевой кислоты, но, по данным исследований, ее сочетание с транексамовой кислотой повышает риск развития тромбозов. Данную комбинацию необходимо применять в крайнем случае, при наличии признаков жизнеугрожающего кровотечения.
Источники
Levi M. et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation //British journal of haematology. – 2009. – Т. 145. – №. 1. – С. 24-33.
Gando S., Levi M., Toh C. H. Disseminated intravascular coagulation //Nature Reviews Disease Primers. – 2016. – Т. 2. – С. 16037.
Gando S., Wada H., Thachil J. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma‐shock (COT/ACOTS) //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 5. – С. 826-835.
ISTH, International Society on Thrombosis and Haemostasis. Adapted with permission from from Taylor Jr. FB, Toh CH, Hoots WK, et al. Towards Definition, Clinical and Laboratory Criteria, and a Scoring System for Disseminated Intravascular Coagulation. Thromb Haemost 2001; 86: 1327–30.
Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T, Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine Disseminated Intravascular
Coagulation (JAAM DIC) Study Group: A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 2006, 34: 625-631.
Kobayashi N. et al. Criteria for diagnosis of DIC based on the analysis of clinical and laboratory findings in 345 DIC patients collected by the Research Committee on DIC in Japan //Disseminated intravascular coagulation. – Karger Publishers, 1983. – Т. 49. – С. 265-275.
Wada H. et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines //Journal of thrombosis and haemostasis. – 2013. – Т. 11. – №. 4. – С. 761-767.
Afshari, A., Wetterslev, J., Brok, J. & Moller, A. M. Antithrombin III for critically ill patients. Cochrane Database Syst. Rev. 3, CD005370 (2008).
Abraham, E. et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290, 238–247 (2003).
Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models //Journal of intensive care. – 2014. – Т. 2. – №. 1. – С. 20.
Источник
Тромбоз
– прижизненное свертывание крови с
образованием в просвете сосуда или
полостях сердца сгустка – тромба.
Тромбоз представляет
собой патологическое проявление
гемостаза. Гемостаз – защитный механизм
и его активация возникает при повреждении,
разрыве сосуда и предупреждает или
останавливает кровотечение. Выделяют
три звена гемостаза: 1) тромбоцитарный,
2) компоненты стенки сосудов, 3) плазменные
факторы свёртывания. Тромбоцитарный
аппарат первым включается в процесс
гемостаза. Структурно-функциональные
изменения тромбоцитов возникают при
повреждении сосуда, когда субэндотелий
вступает с ними в контакт. Тромбоциты
не адгезируют к неповреждённым клеткам
эндотелия. При их повреждении происходит
адгезия (распластывание) тромбоцитов.
Начальное прикрепление и распластывание
тромбоцитов на субэндотелии регулирует
белок – фактор Виллебранда, синтезируемый
клетками эндотелия и мегакариоцитами.
В результате комплекса биохимических
реакций изменяется структура мембраны
тромбоцитов и на их поверхности
организуется рецепторный комплекс.
Активированные тромбоциты секретируют
адгезивные белки (фибриноген, фибронектин,
тромбоспондин), которые связываются с
мембраной клеток и эндотелием. В итоге
образуются агрегаты клеток. Плазменные
компоненты свёртывания реализуют своё
действие во внутренней (кровь) или
внешней (ткань) системах. Во внутренней
системе источником их являются тромбоциты,
во внешней – тканевой фактор. Обе системы
тесно связаны между собой. Большая часть
этих компонентов (факторов) направлена
на образование активного тромбопластина.
Свёртывание крови – ферментативный
аутокаталитический процесс и по
современным представлениям включает
4 стадии:
I – протромбокиназа
+ активаторы → активный тромбопластин;
II – протромбин +
Са + активный тромбопластин → тромбин;
III – фибриноген +
тромбин → фибрин-мономер;
IV – фибрин-мономер
+ фибрин-стимулирующий фактор →
фибрин-полимер.
Б.А.Кудряшов
доказал, что жидкое состояние крови
обеспечивается нормальным функционированием
свёртывающей и противосвёртывающей
систем. Последняя представлена
естественными антикоагулянтами
(антитромбин, гепарин, система
фибринолизина) и рефлекторно-гуморальной
регуляцией гемостаза. Тромбоз представляет
собой проявление нарушенной регуляции
единой системы гемостаза жидкого
состояния крови в сосудистом русле.
Образование тромба
можно рассматривать как гемостаз, но
причиняющий вред организму, с возможными
опасными для жизни последствиями.
Структурно-функциональные основы
тромбоза включают в себя механизмы
гемостаза:
1)
реакция поврежденной сосудистой стенки
– выражается в вазоконстрикции, реакции
эндотелия (продуцирует антитромбоцитарные
и тромбогенные факторы – нарушение
баланса между ними в пользу тромбогенных
происходит при повреждении эндотелия,
что приводит к тромбозу) и субэндотелия.
В состав субэндотелия входят разнообразные
белковые соединения, в частности
фибронектин, который формирует связи
с фибрином и участвует в прикреплении
тромбов к сосудистой стенке.
2)
адгезия и агрегация тромбоцитов в
участке повреждения. Адгезия осуществляется
за счет рецепторного взаимодействия
рецепторов тромбоцитов с компонентами
субэндотелия. Происходит дегрануляция
тромбоцитов с выходом фибриногена,
антигепарина, фибронектина и пр.
Завершается агрегацией тромбоцитов с
формированием первичной гемостатической
бляшки.
3)
процесс коагуляции совершается в виде
каскада реакций с участием фермента,
кофакторов и завершается трансформированием
протромбина в тромбин, который способствует
превращению фибриногена в фибрин. Далее
фибриновый свёрток захватывает лейкоциты,
эритроциты, преципитирующие белки
плазмы крови. Формируется вторичная
гемостатическая бляшка.
Стадии морфогенеза
тромба:
1)
агглютинация тромбоцитов с предшествующим
выпадением их из тока крови, адгезией
к месту повреждения эндотелия. Затем
их дегрануляцией, выделением серотонина,
тромбопластического фактора, что ведёт
к образованию активного тромбопластина.
2)
коагуляция фибриногена с образованием
фибрина происходит при активации системы
свёртывания крови (коагуляционного
каскада). Происходит стабилизация
первичной тромбоцитарной бляшки.
3) агглютинация
эритроцитов.
4) преципитация
плазменных белков.
Причины тромбоза:
нарушение
целостности сосудистой стенкинарушение тока
кровинарушение
баланса между свёртывающей и
противосвёртывающей системами крови.
Морфология
тромба. Тромб
состоит из форменных элементов крови,
фибрина и жидкой части крови.
В
зависимости от строения и внешнего вида
различают белый, красный, смешанный и
гиалиновый тромбы. Белый
тромб состоит
в основном из тромбоцитов в виде
многоэтажных балок, фибрина и лейкоцитов.
Образуется медленно, при быстром токе
крови, чаще в артериях, на внутренней
поверхности сердца. Красный
тромб
образован сетью фибрина, в которой
выявляется большое количество эритроцитов,
мелкие скопления тромбоцитов. Чаще
встречается в венах, образуется быстро,
при медленном токе крови. Смешанный
тромб –
состоит из элементов как белого, так и
красного тромба, имеет слоистое строение.
Встречается в венах, артериях, аневризмах.
Гиалиновые
тромбы
образуются в сосудах микроциркуляторного
русла, основу их составляют некротизированные
эритроциты, тромбоциты, преципитирующие
белки плазмы.
По
отношению к просвету сосуда тромб может
быть пристеночным, т.е. оставлять часть
сосуда свободным, или закупоривающим.
По этиологии тромбы делят на марантические
(возникают при истощении, когда развивается
дегидратация организма и кровь становится
более густой, обычно по строению это
смешанные тромбы), опухолевые (при
врастании опухолевых клеток в просвет
вен, поверхность их покрыта тромботическими
массами смешанного типа), септические
(это инфицированный, смешанный тромб)
и при заболеваниях кроветворной системы.
Величина
тромба может быть разной. Поверхность
его как правило тусклая, неровная,
гофрированная, тромбы легко ломаются,
всегда связаны с сосудистой стенкой.
Кровяные сгустки – не связаны с стенкой
сосуда, с гладкой блестящей поверхностью,
эластичной консистенции.
Исходы тромбоза:
I. Благоприятные:
1) асептический
аутолиз (растворение)
2) обызвествление
3)
организация – рассасывание с замещением
его соединительной тканью, которая
врастает со стороны интимы; сопровождается
канализацией, васкуляризацией и
реваскуляризацией.
II. Неблагоприятные:
1) септическое
расплавление тромба
2) отрыв тромба с
развитием тромбоэмболии.
Значение
тромбоза определяется быстротой его
развития, локализацией, распространённостью,
а также возможным исходом. Чаще тромбоз
– опасное явление, которое может
приводить к развитию инфарктов, гангрены;
тромбоэмболий, сепсиса и т.д.
Эмболия
– циркуляция в сосудах свободных тел,
не смешивающихся с кровью, и закупоркой
в просветах сосудов. Эмболия не сводится
к механическому закрытию сосуда, а
связана и с рефлекторными спазмами.
Состав эмболов: тромбы, капли липидов,
колонии микробов, воздух, газы, паразиты,
клетки опухолей, инородные частицы.
Эмболии могут перемещаться по току
крови (ортоградная), против тока крови
(ретроградная), из вен большого круга
кровообращения, минуя легкие, в артерии
большого круга (парадоксальная – при
наличии шунтов между предсердиями или
желудочками сердца). Эмболии могут быть
единичными или множественными. Наиболее
частый вид эмболии – тромбоэмболия,
возникающая при отрыве тромба или его
части. Можно говорить о венозной и
артериальной тромбоэмболии. Источником
венозных тромбоэмболий чаще являются
бедренная вена и вены малого таза, вены
голени. Возникает тромбоэмболия системы
легочной артерии. Она может быть причиной
внезапного прекращения кровообращения
в лёгких, либо внезапной остановки
сердца (чаще) за счёт пульмокоронарного
рефлекса (спазм бронхиол, ветвей лёгочной
и коронарных артерий). Закупорка ветвей
лёгочной артерии приводит к развитию
геморрагического инфаркта лёгких.
Источником
артериальной тромбоэмболии обычно
служат тромбы левого сердца, аорты,
редко легочных вен. Часто развиваются
тромбоэмболический синдром – или
системный тромбоз, при наличии тромбов,
тромбоэмболий в артериях большого круга
с развитием в органах инфарктов, гангрены.
В 30% тромбоэмболия у таких носит
рецидивирующий характер. Наиболее
частый источником при этом бывают
внутрисердечные тромбы при инфарктах,
септическом эндокардите, аритмиях,
сердечных протезах и пр. Чаще возникает
гангрена нижних конечностей, инфаркты
головного мозга.
Жировая
эмболия – закупорка кровеносных сосудов
каплями жира. Чаще всего она возникает
при травме трубчатых костей, при
размозжении клетчатки (после родов,
ожогах, сильных судорогах тела); реже
при введении лекарств или контрастных
веществ, приготовленных на масле.
Различают немедленную, раннюю и позднюю
жировые эмболии. При немедленной развитие
эмболии почти совпадает с моментом
травмы. Ранняя развивается через
несколько часов, поздняя – через
несколько дней или недель. Преимущественно
частицы жира попадают в капилляры
лёгких, приводя к острой лёгочной
недостаточности, асфиксии и остановке
сердца. Эти явления обычно наблюдаются
при закупорке от 2/3 до 3/4 сосудов малого
круга. При длительном течении наблюдаются
симптомы легочного отёка, пневмонии.
Для развития жировой эмболии важно не
просто появление жира в крови, а наличие
его в форме капель определённой величины
(диаметром более 10–12 мкм). Количество
жира, вызывающее у человека смертельную
жировую эмболию, по литературным данным,
составляет от 12 до 120 см3.
Степень опасности жировой эмболии
определяется не только массой жира, но
и индивидуальными рефлекторно-спастическими
явлениями.
Воздушная
эмболия встречается редко. Наблюдается
при ранении вен шеи, лёгких, при случайном
внутривенном введении воздуха вместе
с лекарственным веществом. Попавшие в
кровь пузырьки воздуха вызывают эмболию
капилляров малого круга кровообращения
и приводят к внезапной сердечной смерти
(если их объём в крови более 100 мл), при
попадании пузырьков в большой круг –
эмболия капилляров мозга. При вскрытии
определяется выделение воздуха из
правых отделов сердца при проколе их,
если предварительно заполнить полость
сердечной сорочки водой.
Возможны
также микробная эмболия (циркулирующие
в крови микробы обтурируют мельчайшие
сосуды), газовая эмболия (характерна
для кессонной болезни – при быстром
переходе от повышенного атмосферного
давления к нормальному происходит
освобождение из крови пузырьков азота
с закупоркой капилляров главным образом
большого круга кровообращения), инородными
телами (попадание в кровь осколков
снарядов, пуль, катетеров, а также
кристаллов холестерина, извести и т.п.),
тканевые.
Метастазирование
– это процесс переноса с током крови
или лимфы живого патологического
материала из очага опухолевого или
воспалительного процесса в другие
органы и ткани с образованием вторичных
очагов тождественных исходному. Пути
метастазирования: лимфогенный,
гематогенный, имплантационный.
Синдром
диссеминированного внутрисосудистого
свертывания (ДВС- синдром)
является клинико-анатомическим
симтомокомплексом, который может
осложнять многие заболевания.
Распространенность 1 на 1 тысячу
стационарных больных. Первое описание
С.П.Боткиным. В основе патологического
процесса лежит образование преимущественно
тромбоцитарно-фибриновых свертков
крови в микроциркуляторном русле
вследствие резкого повышения в крови
уровня тромбопластических веществ; в
результате чего наступает блокада
микроциркуляторного русла с последующим
развитием ишемических, некротических
и геморрагических явлений в различных
органах и тканях. При этом расходование
факторов свёртывания и активация
фибринолиза обычно сопровождается
геморрагическим синдромом и кровотечениями.
ДВС-синдром
может быть распространенным, захватывая
всю систему микроциркуляции и
локализованным, ограничиваясь пределами
одного-двух органов. По течению: острый,
подострый, хронический. При подавляющем
большинстве форм ДВС главным инициатором
процесса свёртывания является тканевой
тромбопластин. Он поступает в кровоток
из поврежденных и распадающихся тканей,
околоплодных вод и пр. Обязательным
компонентом патогенеза синдрома является
агрегация тромбоцитов. Укорачивается
продолжительность жизни тромбоцитов
и возникает тромбоцитопения потребления..
В развитии синдрома
выделяют 4 фазы:
I
фаза – гиперкоагуляции и агрегации
клеток крови. Характерны множественные
микротромбы различного строения с
развитием блокады микроциркуляции в
органах. Клиника шока.
II
фаза – нарастание свёртывания крови и
повышения фибринолитической активности.
Эта стадия возникает на высоте
гиперкоагуляции и прогрессирует до
выраженной гипокоагуляции. Проявляется
кровотечениями.
III фаза – глубокой
гипокоагуляции, вплоть до полной
несвёртываемости крови. Характерны
кровотечения, геморрагии.
IV
фаза – восстановления или остаточных
тромбозов, геморрагий, блокады системы
микроциркуляции.
С
наибольшей выраженностью и частотой
ДВС развивается при следующих заболеваниях:
инфекционно-септические состояния,
злокачественные новообразования, все
виды шока, акушерская патология,
хирургические вмешательства,
сердечно-сосудистая патология и пр.
Основными
патологическими проявлениями являются:
микротромбы, некрозы, кровоизлияния.
Причины смерти при ДВС различны.
Микротромбы состоят из фибрина с
небольшим количеством тромбоцитов,
лейкоцитов, эритроцитов. Это округлые,
гомогенные образования – гиалиновые
или фибриновые тромбы. Чаще они образуются
в сосудах головного мозга, сердце,
лёгких, почек, надпочечников, печени,
селезёнки. В органах развивается
дистрофия, некроз. Может проявляться
множественной недостаточностью
внутренних органов. В ранних фазах чаще
это – острая надпочечниковая
недостаточность. Больше всего больные
умирают в III фазе, особенно при наличии
источника кровопотери: плацентарная
площадка в матке, операционная рана,
язвенный дефект в желудке и т.д. Летальность
50–60%.
Источник
