Врожденный лейкоз при синдроме дауна

Распространенность онкологических заболеваний при синдроме Дауна существенно выше по сравнению с распространенностью их в общей популяции. Это касается в основном риска развития острой лейкемии, в то время как солидные опухоли, такие как нейробластома или нефробластома, у детей с синдромом Дауна встречаются крайне редко. Также не часто встречаются хронический миелоидный лейкоз и хронический лимфолейкоз. Эти особенности, безусловно, связаны с наличием дополнительного генетического материала 21-й хромосомы. При синдроме Дауна частота лейкозов приблизительно в 18 раз выше, чем в населении в целом.
Лейкозы (лейкемии) — злокачественные опухоли кроветворной ткани с первичной локализацией в костном мозге с последующей диссеминацией их в периферической крови, селезенке, лимфатических узлах и других тканях. Различают острый и хронический лейкоз. Острый лейкоз – это быстро прогрессирующая форма лейкоза, характеризующаяся замещением нормального костного мозга незрелыми бластными клетками без дифференциации их в зрелые нормальные клетки крови. Выделяют две основные группы острого лейкоза: лимфобластный и нелимфобластный (миелоидный).
У большинства новорожденных с трисомией 21-й хромосомы сразу после рождения отмечаются изменения в регуляции гемопоэза (кроветворения), приводящие к различным нарушениям, таким как полицитемия, тромбоцитопения, тромбоцитоз и др. [1]. Эти нарушения обычно имеют транзиторный (проходящий) характер и возникают вследствие несовершенного контроля гемопоэтических клеток одной или нескольких линий [2]. Е. Генри и его коллеги проанализировали результаты клинических анализов крови, проведенных в первые две недели жизни 158 новорожденных с синдромом Дауна. Они обнаружили, что нейтрофилез (увеличение числа нейтрофилов), тромбоцитопения (снижение количества тромбоцитов) и полицитемия (увеличение числа форменных элементов крови) являются наиболее распространенными гематологическими нарушениями, которые встречаются у этих детей с частотой, равной 80, 66 и 33 % соответственно [3].
Более чем у 10 % новорожденных с синдромом Дауна в анализах крови встречается лейкемоидная реакция (транзиторная лейкемия). Причины возникновения лейкемоидной реакции не ясны, но однозначно связаны с дополнительной 21-й хромосомой. С одной стороны, это состояние не требует никакого лечения. С другой – оно говорит о повышенном риске развития лейкоза у этих детей в более старшем возрасте. В одном исследовании отмечается, что у 25 младенцев из 85 с выявленной лейкемоидной реакцией в неонатальном периоде в течение последующих 3 лет развился острый миелоцитарный лейкоз.
Манифестация лейкемии, как правило, приходится на первые 5 лет жизни детей с синдромом Дауна. В первые 3 года при трисомии 21-й хромосомы наиболее распространенной формой является острая миелоидная лейкемия с преобладанием подтипа мегакариоцитарной лейкемии. Отмечена связь развития мегакариоцитарного лейкоза с возникновением у этих пациентов соматической мутации в гене GATA 1 [4].
У заболевших лейкозом детей с синдромом Дауна старше 3 лет приблизительно в 80 % случаев отмечается острая лимфобластная лейкемия и в 20 % — острый миелоцитарный лейкоз.
Специфического лечения лейкоза для детей с синдромом Дауна не разработано, применяется стандартная терапия. При этом оказалось, что дети с трисомией 21-й хромосомы и острым миелоцитарным лейкозом имеют лучшие результаты лечения и более высокие показатели выживаемости, чем дети без трисомии с тем же заболеванием.
В качестве клинического примера приведем историю болезни девочки К. 2,5 лет.
Ребенок от 2-й физиологически протекавшей беременности, серологических и ультразвуковых признаков патологии плода не было. От 2-х самопроизвольных родов в сроке 39—40 недель гестации. При рождении антропометрические показатели в норме: масса 3450 г., длина 50 см. Оценка по шкале АПГАР 7/8 баллов. Отмечались признаки трисомии 21-й хромосомы, и после проведенного хромосомного анализа был установлен диагноз «синдром Дауна». Клинический анализ крови на первом месяце не проводился, а в возрасте 6 месяцев полученные результаты были в пределах нормы. Больше кровь не исследовалась. В возрасте 1 года 2 месяцев у ребенка поднялась температура до субфибрильных значении (37,5—37,8°). Очевидных признаков респираторного заболевания не было, отмечалась припухлость десен. Был установлен диагноз «Синдром прорезывания зубов». Девочка стала капризной, бледной, мало двигалась, отказывалась от еды. Появилась отечность лица. Субфибрилитет сохранялся более 7 дней. Было проведено исследование мочи. Выявлена протеинурия 0,06 г/л. На 7-й день болезни проведено исследование крови: отмечалась тромбоцитопения до 84×109/л, анемия (78 г/л), СОЭ увеличена до 31 мм/ч. В экстренном порядке ребенок госпитализирован в гематологическое отделение Морозовской детской клинической больницы, где диагностирован острый мегакариоцитарный лейкоз, проведено лечение, достигнута ремиссия.
Повышенный риск развития лейкоза у детей с синдромом Дауна требует регулярного исследования крови на протяжении первых 5 лет жизни ребенка. Ввиду связи между транзиторной лейкемией и развитием миелоцитарного лейкоза у этих детей в первые годы жизни обоснованным становится обязательное исследование крови у новорожденных с трисомией 21-й хромосомы. Выявление детей с повышенным риском развития лейкоза позволит своевременно диагностировать возникновение заболевания и начать адекватное лечение, принимая во внимание известные высокие шансы у этих пациентов на достижение полной ремиссии и выздоровление.
Литература
- Weinstein H. S. Congenital leukemia and the neonatal myeloproliferative disorders associated with Down’s syndrome // Clinical Hematology. 1978. № 7. P. 147—156.
- Miller M., Cosgriff J. M. Hematologic abnormalities in newborns with Down’s syndrome // Journal of Medical Genetics. 1973. Vol. 16. P. 173—179.
- Henry E., Walker D., Wiedmeier S. E., Christensen R. D. Hematological abnormalities during the first week of life among neonates with Down syndrome: data from a multihospital healthcare system // American Journal of Medical Genetetic. A. 2007. Vol. 143, № 1. P. 42—50.
- Management of genetic syndromes. 3rd edition / S. B.Cassidy, J. E. Allanson (Eds.). New York, NY : Wiley-Liss, 2008. P. 309—336.
Источник
Вчера я звонила Любе, маме Коли.
Люба начала мне сразу рассказывать СИМПТОМЫ, которые надо не просмотреть в ребенке. Ей это было очень важно, чтобы я поделилась в Интернете с мамами.
Напомню, у Коли синдром Дауна, месяц не могли поставить диагноз “Лейкоз”.
С чего началось.
Слоение ногтей.
Раздутый живот.
УЗИ показывает увеличение печени и селезенки.
В крови пониженное количество тромбоцитов.
На лице, а затем и на теле мелкая сыпь, похожая на аллергическую.
Сыпь называется геморрагическая, она похожа на подкожные кровоизлияния.
Температура до 37,4 то появлялась, то исчезала.
Врачи ставили аллергию + простуду.
Люба советует регулярно водить ребенка сдавать кровь и делать УЗИ органов брюшной полости, чтобы не запустить болезнь.
Как ей сказали врачи, лейкемия (лейкоз) может быть у 10% процентов детей с синдромом Дауна.
Да, у 90% его нет. Но, с другой стороны, получается, есть у каждого десятого!
Дела у них не очень хорошо. У Юлечки дела хуже, т.к. (как мне вчера сказала Света) до начала лечения от лейкоза она еще перенесла сепсис.
Кровь нужна ОБОИМ детям! Как поняла Люба, каждый месяц по 40-45 доноров в течение 2 лет – ну так ей сказали врачи…
На лекарства деньги пока не требуются, лекарства им дают бесплатно.
UPD
Еще Люба сказала, что актовегин и прочие ноотропы подталкивают развитие лейкоза (и других видов рака в принципе), что ей невролог про это говорила.
Они делали всего 2 курса инъекций актовегина, но сейчас она очень сильно об этом жалеет.
UPD2
Еще стул (экскременты) буроватого цвета. Потом уточнила – что стул был белесый и жирный по виду.
На форуме Наташа Chestnut пишет:
Мы в 15 месяцев пришли на очередной осмотр и прививку к своему педиатру. У Маши за неделю до визита на лице появились красные пятнышки, не сыпь, а как будто кровь запеклась под кожей. А за день до визита и на животике такие пятна выступили. Я обратила внимание врача на это, а она сразу заволновалась и послала нас на анализ крови. Она сказала, что судя по всему у Маши понижены тромбоциты в крови, если это подтвердится по анализу крови, то нас оставят на ночь в больнице и сделают вливание иммоноглобулина. Объяснила, что иногда у детей уровень тромбоцитов падает после перенесенной инфекции или даже безпричинно, и одного вливания иммоноглобулина достаточно, чтобы восстановить уровень. Анализ у Маши показал низкий уровень тромбоцитов и нас оставили в госпитале на ночь и сделали вливание иммоноглобулина. Но наш уровень тромбоцитов не поднялся, а опять пошел вниз. Они сделали второе вливание, но опять безрезультатно. Нас выписали домой и сказали, что направят на консультацию в гематологическую клинику детского госпиталя, а пока мы должны приезжать сдавать кровь на анализ через педиатрическую клинику. Через неделю анализы крови опять показывали еще ниже уровень тромбоцитов – у ребенка при таком уровне могут появлятся синяки на теле даже без ушибов, может возникнуть внутреннее кровотечение, а мы даже и не будем знать. Меня это очень тревожило и я сама позвонила в гематологическую клинику, чтобы ускорить процесс попадания к ним на консультацию.
Но это не помогло и тогда мои соседи мне посоветовали брать ребенка и самой ехать в детский госпиталь в приемное отделение, чтобы там ребенка осмотрели и решили, что с нами делать. Мы в тот же вечер собрались и поехали. В приемном отделении в Канаде обычно надо ждать несколько часов по живой очереди, чтобы тебя приняли и осмотрел врач. Мы же не задержались там и минуты – нас сразу определили в палату и начали делать анализы, а в 2 часа ночи объявили диагноз. Потом Маше делали забор и анализ костной жидкости (желеобразное вещество внутри наших костей), чтобы определить тип лейкемии.
У Маши острая миелоидная лейкемия, а точнее миелоидный синдром (это предлейкемическое состояние, когда число раковых клеток в крови не превышает 25%, у нас он был 13% при поступлении). Но лечение синдрома и самой лейкемии такое же, потому как со временем синдром перерастает в непосредственно лейкемию и другого пути у ребенка нет. При поступлении в больницу и на первом цикле химиотерапии я вела подробный дневник что и как нам делают и как Маша это все переносит. Сейчас же делаю небольшие записи, потому как слишком много всего происходит, а многие циклы по себе похожи. Сейчас Машенька уже на 6-м цикле химиотерапии.
Сдать кровь для нижегородских детей можно в Нижнем Новгороде на Станции переливания крови.
Сказать, что для Коли Енгулатова и Юли Девятовой, 5 отделение детской областной больницы.
Источник
 Лабораторная мышь. (кликните картинку для увеличения) |
Хоть врачам уже давно было известно, что люди, у которых выявляется синдром Дауна, в большей степени подвержены риску развития острого лимфобластного лейкоза (ОЛЛ) в детстве, объяснить природу наблюдений не получалось. В настоящее время группа исследователей из института онкологии «Дана-Фарбер» выявила связь между ОЛЛ и синдромом Дауна.
В исследовании, которое недавно появилось на веб-страницах журнала Nature Genetics, учёные проследили цепь генетических событий, которая связывает хромосомную аномалию синдрома Дауна с тем, что происходит в клетках при развитии ОЛЛ.
«На протяжении 80 лет было непонятно, почему дети с синдромом Дауна сталкиваются с существенно повышенным риском ОЛЛ. Достижения в технологии, что дают возможность исследовать клетки крови и лейкемию в рамках синдрома Дауна в лабораторных условиях, и позволили нам выявить данную связь» — говорит Эндрю Лейн (Andrew Lane, ведущий автор исследования, сотрудник кафедры новообразований крови института онкологии «Дана-Фарбер»).
Люди, у которых выявляется синдром Дауна, характеризуются повышенным риском развития различных проблем со здоровьем, включая пороки сердца, нарушения работы системы дыхания и слуха, болезни щитовидной железы. Вероятность развития ОЛЛ в детстве у людей с синдромом Дауна в 20 раз выше по сравнению со здоровыми людьми.
Синдром Дауна развивается у людей, у которых выявляется дополнительная копия 21-й хромосомы. У них выявляется наличие целой лишней хромосомы или её части.
Чтобы отследить связь между синдромом Дауна и ОЛЛ — а именно наиболее распространённой её формы — B-клеточного острого лимфобластного лейкоза (B-ОЛЛ) — Эндрю Лейн и его коллеги использовали линию мышей, несущих дополнительную копию 31 гена, которые обнаруживаются на 21-й хромосоме человека.
«B-ОЛЛ появляется, когда организм продуцирует слишком много незрелых B-клеток — разновидность белых кровяных клеток, которые в норме борются с инфекцией. Когда мы протестировали B-клетки мышей в лабораторных условиях, то обнаружили, что они атипичны и бесконтрольно растут, так же как и у пациентов с B-ОЛЛ» — говорит Эндрю Лейн. После авторы исследования изучили «молекулярный признак» В-клеток мышей — паттерн генной активности, который отличал их от здоровых мышиных В-клеток. Основным отличием оказалось то, что в атипичных клетках группа белков PRC2 не работала. Почему-то потеря PRC2 стимулировала В-клетки делиться и пролиферировать прежде, чем они полностью созреют.
Чтобы подтвердить тот факт, что прекращение работы PRC2 является критическим моментом для развития В-ОЛЛ у людей с синдромом Дауна, группа учёных под руководством Эндрю Лейна сосредоточилась на генах, контролируемых PRC2. Использовав 2 набора образцов клеток В-ОЛЛ: один из организма пациентов с синдромом Дауна, второй из организма людей без синдрома Дауна — учёные измерили активность тысяч разных генов, пытаясь определить различия между образцами. Около 100 генов, как выяснилось, наиболее активны при синдроме Дауна. Все эти гены контролируются белками группы PRC2. Когда PRC2 молчат, как раз как в случае с В-клетками людей с синдромом Дауна, данные 100 генов отвечают очень высокой активностью, заставляя клетки расти и делиться.
Закономерен был вопрос: какой ген или какая группа генов подавляет PRC2 в B-клетках пациентов с синдромом Дауна. Используя мышей с дополнительной копией 31 гена, авторы проведённого исследования систематически выключали каждый ген, чтобы понять, какое влияние на клетку он оказывает. Когда они инактивировали ген HMGN1, клетки переставали расти и погибали. «Мы пришли к выводу, что дополнительная копия HMGN1 важна для выключения PRC2, что, в свою очередь, и интенсифицирует пролиферацию клеток» — отмечает Эндрю Лейн.
Хоть в настоящее время и не существует лекарственных средств, способных оказывать влияние на работу HMGN1, подавляя развитие лейкемии у людей с синдромом Дауна, авторы проведённого исследования предполагают, что активаторы PRC2 в ряде случаев могут оказывать противолейкозное действие. Работа по улучшению этих препаратов — ингибиторов гистоновых деметилаз — уже ведётся.
Так как другие формы В-ОЛЛ так же имеют 100-генную сигнатуру, аналогичную той, что выявляется в случае В-ОЛЛ, ассоциированном с синдромом Дауна, лекарства, оказывающие влияние на PRC2, могут оказаться эффективными и для борьбы с разными формами болезни, полагает Эндрю Лейн.
Александр Шустер
Также по теме:
- Ангиоцидин способен противостоять развитию острого миелоидного лейкоза
- Лейкемия развивается в результате хромосомной катастрофы
- Подавление белков PAK позволяет противостоять развитию злокачественных новообразований
- Выявлено новое средство, которое может быть использовано для лечения людей, страдающих от хронического лимфоцитарного лейкоза
- Сульфорафан может быть использован для подавления развития лейкемии
Источники:
- Новость подготовлена по материалам www.sciencedaily.com
- Источник фотоматериала — www.topnews.in
Источник
Синдром Дауна – хромосомная аномалия, при которой в кариотипе имеются дополнительные копии генетического материала по 21-ой хромосоме, т. е. наблюдается трисомия по хромосоме 21. Фенотипические признаки синдрома Дауна представлены брахицефалией, плоским лицом и затылком, монголоидным разрезом глазных щелей, эпикантом, кожной складкой на шее, укорочением конечностей, короткопалостью, поперечной ладонной складкой и др. Синдром Дауна у ребенка может быть выявлен пренатально (по данным УЗИ, биопсии ворсин хориона, амниоцентеза, кордоцентеза) или после рождения на основании внешних признаков и генетического исследования. Дети с синдромом Дауна нуждаются в коррекции сопутствующих нарушений развития.
Общие сведения
Синдром Дауна – аутосомный синдром, при котором кариотип представлен 47 хромосомами за счет дополнительной копии хромосомы 21-ой пары. Синдром Дауна регистрируется с частотой 1 случай на 500-800 новорожденных. Соотношение полов среди детей с синдромом Дауна составляет 1:1. Впервые синдром Дауна описал английский педиатр Л. Даун в 1866 г., однако хромосомная природа и суть патологии (трисомия по хромосоме 21) была выявлена почти столетие спустя. Клиническая симптоматика синдрома Дауна разнообразна: от врожденных пороков развития и отклонений в умственном развитии до вторичного иммунодефицита. Детям с синдромом Дауна требуется дополнительная медицинская помощь со стороны различных специалистов, в связи с чем они составляют особую категорию в педиатрии.
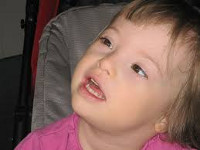
Синдром Дауна
Причины синдрома Дауна
В норме клетки человеческого организма содержат по 23 пары хромосом (нормальный женский кариотип 46,XX; мужской – 46,XY). При этом одна из хромосом каждой пары наследуется от матери, а другая – от отца. Генетические механизмы развития синдрома Дауна кроются в количественном нарушении аутосом, когда к 21-ой паре хромосом присоединяется дополнительный генетический материал. Наличие трисомии по 21-ой хромосоме определяет черты, характерные для синдрома Дауна.
Появление дополнительной хромосомы может быть обусловлено генетической случайностью (нерасхождением парных хромосом в овогенезе или сперматогенезе), нарушением клеточного деления уже после оплодотворения либо наследованием генетической мутации от матери или отца. С учетом этих механизмов в генетике различают три варианта аномалии кариотипа при синдроме Дауна: регулярную (простую) трисомию, мозаицизм и несбалансированную транслокацию.
Большинство случаев синдрома Дауна (около 94%) связано с простой трисомией (кариотип 47,XX, 21+ или 47,ХY, 21+). При этом три копии 21-ой хромосомы присутствуют во всех клетках вследствие нарушения разделения парных хромосом во время мейоза в материнской или отцовской половых клетках.
Около 1-2% случаев синдрома Дауна приходится на мозаичную форму, которая обусловлена нарушением митоза только в одной клетке зародыша, находящегося на стадии бластулы или гаструлы. При мозаицизме трисомия 21-ой хромосомы выявляется только в дериватах этой клетки, а остальная часть клеток имеет нормальный хромосомный набор.
Транслокационная форма синдрома Дауна встречается у 4-5% пациентов. В этом случае 21-я хромосома либо ее фрагмент прикрепляется (транслоцируется) к какой-либо из аутосом и при мейозе отходит вместе с ней во вновь образовавшуюся клетку. Наиболее частыми «объектами» транслокации служат хромосомы 14 и 15, реже – на 13, 22, 4 и 5. Такая перестройка хромосом может носить случайный характер или наследоваться от одного из родителей, являющегося носителем сбалансированной транслокации и имеющего нормальный фенотип. Если носителем транслокации выступает отец, то вероятность рождения ребенка с синдромом Дауна составляет 3%, если носительство связано с материнским генетическим материалом, риск возрастает до 10-15%.
Факторы риска рождения детей с синдромом Дауна
Рождение ребенка с синдромом Дауна не связано с образом жизни, этнической принадлежностью и регионом проживания родителей. Единственным достоверно установленным фактором, повышающим риск появление ребенка с синдромом Дауна, является возраст матери. Так, если у женщин до 25 лет вероятность рождения больного ребенка составляет 1:1400, к 35 годам уже 1:400, к 40 годам – 1:100; а к 45 – 1:35. Прежде всего, это связано со снижением контроля за процессом деления клеток и увеличением риска нерасхождения хромосом. Однако, поскольку частота родов у молодых женщин в целом выше, то, по статистике, 80% детей с синдромом Дауна рождается от матерей в возрасте до 35 лет. По некоторым данным, возраст отца старше 42-45 лет также увеличивает риск развития синдрома Дауна у ребенка.
Известно, что при наличии синдрома Дауна у одного из однояйцовых близнецов, эта патология в 100% случаев будет иметься у другого. Между тем, у разнояйцовых близнецов, а также братьев и сестер, вероятность такого совпадения ничтожно мала. Среди прочих факторов риска – наличие в роду лиц с синдромом Дауна, возраст матери моложе 18 лет, носительство транслокации одним из супругов, близкородственнные браки, случайные события, нарушающие нормальное развитие половых клеток или зародыша.
Благодаря проведению преимлантационной диагностики, зачатие с помощью ВРТ (в т. ч. экстракорпорального оплдотворения) значительно снижает риск рождения ребенка с синдромом Дауна у родителей из групп риска, однако полностью не исключает такой возможности.
Симптомы синдрома Дауна
Вынашивание плода с синдромом Дауна сопряжено с повышенным риском выкидыша: самопроизвольное прерывание беременности случается примерно у 30% женщин на сроке 6-8 недель. В остальных случаях дети с синдромом Дауна, как правило, рождаются доношенными, но имеют умеренно выраженную гипоплазию (массу тела на 8-10% ниже средней). Несмотря на различные цитогенетические варианты хромосомной аномалии, большинству детей с синдромом Дауна свойственны типичные внешние признаки, позволяющие предположить наличие патологии уже при первом осмотре новорожденного неонатологом. У детей с синдромом Дауна могут быть выражены все или некоторые из физических характеристик, описанных ниже.
80-90% детей с синдромом Дауна имеют черепно-лицевые дизморфии: уплощенное лицо и переносицу, брахицефалию, короткую широкую шею, плоский затылок, деформацию ушных раковин; новорожденные – характерную кожную складку на шее. Лицо отличается монголоидным разрезом глаз, наличием эпикантуса (вертикальной складки кожи, прикрывающей внутренний угол глаза), микрогенией, полуоткрытым ртом часто с толстыми губами и большим высунутым языком (макроглоссией). Мышечный тонус у детей с синдромом Дауна обычно понижен; имеет место гипермобильность суставов (в т. ч. атланто-аксиальная нестабильность), деформация грудной клетки (килевидная или воронкообразная).
Характерными физическими признаками синдрома Дауна служат кроткие конечности, брахидактилия (брахимезофалангия), искривление мизинца (клинодактилия), поперечная («обезьянья») складка на ладони, широкое расстояние между 1 и 2 пальцами стоп (сандалевидная щель) и др. При осмотре детей с синдромом Дауна выявляются белые пятна по краю радужки (пятна Брушфильда), готическое (аркообразное нёбо), неправильный прикус, бороздчатый язык.
При транслокационном варианте синдрома Дауна внешние признаки проявляются отчетливее, чем при простой трисомии. Выраженность фенотипа при мозаицизме определяется долей трисомных клеток в составе кариотипа.
У детей с синдромом Дауна чаще, чем у других в популяции встречаются ВПС (открытый артериальный проток, ДМЖП, ДМПП, тетрада Фалло и др.), косоглазие, катаракта, глаукома, тугоухость, эпилепсия, лейкоз, пороки ЖКТ (атрезия пищевода, стеноз и атрезия двенадцатиперстной кишки, болезнь Гиршпрунга), врожденный вывих бедра. Характерными дерматологическими проблемами пубертатного периода являются сухость кожи, экзема, угревая сыпь, фолликулит.
Дети с синдромом Дауна относятся к часто болеющим; они тяжелее переносят детские инфекции, чаще страдают пневмониями, средними отитами, ОРВИ, аденоидами, тонзиллитом. Слабый иммунитет и врожденные пороки являются наиболее вероятной причиной гибели детей в первые 5 лет жизни.
У большинства больных с синдромом Дауна имеются нарушения интеллектуального развития – как правило, умственная отсталость легкой или средней степени. Моторное развитие детей с синдромом Дауна отстает от сверстников; имеет место системное недоразвитие речи.
Пациенты с синдромом Дауна склонны к развитию ожирения, запоров, гипотиреоза, гнездной алопеции, рака яичка, раннему началу болезни Альцгеймера и др. Мужчины с синдромом Дауна, как правило, бесплодны; фертильность женщин заметно снижена ввиду ановуляторных циклов. Рост взрослых больных обычно на 20 см ниже среднего. Продолжительность жизни составляет около 50-60 лет.
Диагностика синдрома Дауна
Для дородового выявления синдрома Дауна у плода предложена система пренатальной диагностики. Скрининг I триместра проводится на сроке беременности 11-13 недель и включает выявление специфических УЗИ-признаков аномалии и определение уровня биохимических маркеров (ХГЧ, РАРР-А) в крови беременной. Между 15 и 22 неделями беременности выполняется скрининг II триместра: акушерское УЗИ, анализ крови матери на альфа-фетопротеин, ХГЧ и эстриол. С учетом возраста женщины рассчитывается риск рождения ребенка с синдромом Дауна (точность – 56-70%; ложноположительные результаты – 5%).
Беременным из группы риска по рождению ребенка с синдромом Дауна предлагается прохождение пренатальной инвазивной диагностики: биопсии хориона, амниоцентеза или кордоцентеза с кариотипированием плода и консультация медицинского генетика. При получении данных за наличие у ребенка синдрома Дауна решение вопроса о пролонгации или прерывании беременности остается за родителями.
Новорожденные с синдромом Дауна в первые дни жизни нуждаются в провдении ЭхоКГ, УЗИ брюшной полости для раннего выявления врожденных пороков развития внутренних органов; осмотре детского кардиолога, детского хирурга, детского офтальмолога, детского травматолога-ортопеда.
Медико-педагогическое сопровождение детей с синдромом Дауна
Излечение хромосомной аномалии на сегодняшний день невозможно; любые предлагаемые методы лечения являются экспериментальными и не имеют доказанной клинической эффективности. Однако систематическое медицинское наблюдение и педагогическая помощь детям с синдромом Дауна позволяют добиться успехов в их развитии, социализации и приобретении ими трудовых навыков.
На протяжении всей жизни больные с синдромом Дауна должны находиться под наблюдением специалистов (педиатра, терапевта, кардиолога, эндокринолога, отоларинголога, офтальмолога, невролога и др.) в связи с сопутствующими заболеваниями или повышенным риском их развития. При выявлении тяжелых врожденных пороков сердца и ЖКТ показана их ранняя хирургическая коррекция. В случае выраженного снижения слуха производится подбор слухового аппарата. При патологии органа зрения может потребоваться очковая коррекция, хирургическое лечение катаракты, глаукомы, косоглазия. При гипотиреозе назначается заместительная терапия тиреоидными гормонами и т. д.
Для стимуляции развития моторных навыков показана физиотерапия, занятия ЛФК. Для развития речевых и коммуникативных навыков детям с синдромом Дауна необходимы занятия с логопедом и олигофренопедагогом.
Обучение детей с синдромом Дауна, как правило, осуществляется в специальной коррекционной школе, однако в рамках интегрированного образования такие дети могут посещать и обычную массовую школу. Во всех случаях дети с синдромом Дауна относятся к категории детей с особыми образовательными потребностями, поэтому нуждаются в дополнительной помощи учителей и социальных педагогов, использовании специальных образовательных программ, создании благоприятной и безопасной среды. Важную роль играет психолого-педагогическая поддержка семей, где воспитываются «солнечные дети».
Прогноз и профилактика синдрома Дауна
Возможности обучаемости и социализации лиц с синдромом Дауна различны; они во многом зависят от интеллектуальных способностей детей и от усилий, прилагаемых родителями и педагогами. В большинстве случаев детям с синдромом Дауна удается привить минимальные бытовые и коммуникационные навыки, необходимые в повседневной жизни. Вместе с тем, известны случаи успехов таких пациентов в области изобразительного искусства, актерского мастерства, спорта, а также получения высшего образования. Взрослые с синдромом Дауна могут вести самостоятельную жизнь, овладевать несложными профессиями, создавать семьи.
О профилактике синдрома Дауна можно говорить только с позиции уменьшения возможных рисков, поскольку вероятность рождения больного ребенка существует в любой паре. Акушеры-гинекологи советуют женщинам не откладывать беременность на поздний возраст. Прогнозировать рождение ребенка с синдромом Дауна призвано помочь генетическое консультирование семей и система пренатального скрининга.
Источник
