Антиагрегантная терапия при метаболическом синдроме
Сосудистые заболевания, в том числе цереброваскулярная патология, являются одной из важнейших медико–социальных проблем во всем мире. Приводя к тяжелой инвалидизации, сосудистые заболевания вызывают преждевременную утрату работоспособности и снижение качества жизни, что значительно увеличивает социальную и экономическую нагрузку на наше общество. В России заболеваемость цереброваскулярными болезнями оценивается, как 350–400 человек на 100 тыс. населения, при этом показатели смертности достигают 296 человек на 100 тыс. населения [4].
Уже в середине XX века было отмечено, что сочетание различных факторов риска сосудистых заболеваний приводит к потенцированию их действия и многократно увеличивает вероятность развития инсульта, инфаркта миокарда и сосудистой деменции. В течение последующих нескольких десятилетий сформировалось представление о синдромокомплексе, включающем в себя нарушения обмена сахара, липидов, мочевой кислоты и артериальную гипертонию, при котором отмечается наиболее быстрое и злокачественное прогрессирование сосудистой патологии [2]. Предлагались различные варианты названия такого состояния – метаболический трисиндром [6], синдром изобилия [13], смертельный квартет [11] и др. В конце концов в медицине утвердилась гипотеза G. Reaven, который предложил термин «метаболический синдром Х», объединив этим значением инсулинорезистентность, гиперинсулинемию, гипертриглицеридемию и артериальную гипертензию [14].
В настоящее время существует несколько классификаций, предложенных различными авторитетными медицинскими организациями, для верификации диагноза метаболический синдром (МС). Одной из наиболее распространенных и простых применяемых клиницистами является ATP III (Adult Treatment Panel III) (табл. 1). По этой классификации МС ставится при сочетании 3 и более факторов [8].
Патогенетически хронические цереброваскулярные заболевания (ХЦВЗ) являются закономерным следствием метаболических нарушений, в основе которых при МС лежит гиперинсулинемия, приводящая к развитию атеросклероза, нарушениям реологических и коагуляционных свойств крови и артериальной гипертонии. Данная триада патологических изменений вызывает нарушение церебрального кровотока и приводит к формированию соответствующей клинической картины цереброваскулярной патологии. Патогенетические механизмы метаболического синдрома реализуются на клеточно–молекулярном уровне и затрагивают в первую очередь эндокринную систему и систему крови, то есть системы, одной из функций которых является управление и регуляция деятельности других органов. Поэтому с проблемой метаболического синдрома вынуждены сталкиваться врачи самых разных специальностей – кардиологи, неврологи, эндокринологи, даже хирурги и многие другие. Все это является стимулом, побуждающим исследователей активно заниматься поиском наиболее эффективных медикаментозных схем коррекции нарушений, вызванных МС.
В нашей работе мы старались выявить возможность медикаментозного влияния на гемореологические и гемостатические показатели у больных хронической цереброваскулярной патологией с МС и оценить взаимосвязь между коррекцией этих показателей и клиническими проявлениями заболевания.
Материалы и методы
Было обследовано 64 больных с хроническими цереброваскулярными заболеваниями, из которых 18 человек (28%) перенесли острое нарушение мозгового кровообращения (НМК), 6 пациентов (9%) страдали транзиторными ишемическими атаками (ТИА) и 40 больных (63%) имели дисциркуляторную энцефалопатию (ДЭП) I–II ст (рис. 1). Обследование проводилось при поступлении и на 14–е сутки пребывания в стационаре, после проведенного курса антиагрегантной терапии. Учитывая гемореологические и гемостатические нарушения при МС, в которых не последнюю роль играют изменения характеристик эритроцитов [1], нами было принято решение использовать в качестве антиагрегантной терапии Трентал (пентоксифиллин), обладающий выраженным антиагрегантным действием в отношении эритроцитов. Его антитромботическое действие обусловлено прежде всего увеличением содержания внутриклеточного цАМФ тромбоцитов и гладкомышечных клеток эндотелия сосудистой стенки. Однако это отнюдь не главное и единственное свойство препарата. Kiesewetter H., Jung F. было показано увеличение деформируемости (эластичности) эритроцитов [12], Dettelbach H.R., Aviado D.M. продемонстрировали уменьшение их агрегационной активности, уменьшение вязкости и улучшение текучести крови на фоне введения Трентала [7]. Вызываемое препаратом изменение пластичности клеточной мембраны эритроцитов обусловливает их лучшее проникновение в сосуды с уменьшенным просветом, приводя к повышению концентрации кислорода в тканях [5]. Препарат угнетает вазоконстрикцию в микроциркуляторном русле, способствует уменьшению уровня фибрина плазмы, стимулирует фибринолиз. В низких дозах Трентал действует также на циклооксигеназный путь, способствуя стимуляции синтеза и высвобождения простациклина и уменьшая продукцию тромбоксана [3]. Таким образом, при МС, в связи с его многокомпонентностью, назначение Трентала, обладающего различными фармакологическими эффектами, представлялось наиболее целесообразным.
Препарат назначался в дозе 200 мг (2 ампулы по 5 мл) в 250 мл физиологического раствора внутривенно капельно ежедневно в течение 2 недель.
Согласно критериям ATP III (2001) у 36 из обследованных нами больных был диагностирован МС.
Для оценки состояния гемореологии исследовались показатели вязкости крови (ВК) на различных скоростях сдвига, гематокрит, агрегация тромбоцитов по методу Born G. (1962) при воздействии индукторов агрегации – АДФ в концентрации 3 мкмоль/л (АТ–АДФ) и адреналина в концентрации 2 мкмоль/л мМ (Адр–АТ). Агрегация и деформируемость эритроцитов определялись лазерным оптическим ротационным клеточным анализатором LORRCA. Для анализа агрегационных свойств эритроцитов использовались такие показатели, как амплитуда агрегации (конечный размер агрегатов), индекс агрегации, отражающий скорость образования эритроцитарных агрегатов, гамма диссоциации (прочность агрегатов), время образования одноцепочечных эритроцитарных агрегатов по типу «монетных столбиков» (Tf), время образования трехмерных эритроцитарных агрегатов (Ts). Анализ деформируемости эритроцитов проводился по двум показателям – предельному индексу деформируемости и времени возвращения эритроцита к исходной форме (Tr).
Для оценки состояния гемостаза исследовали концентрацию в крови фибриногена, антитромбина III, тканевого активатора плазминогена (ТАП) и его ингибитора типа 1 (ИТАП–1), показатели МНО, протромбинового времени, протромбиновый индекс, фибринолитическую активность (ФА) и индекс фибринолиза (ИФ).
Статистическая обработка результатов проводилась на Intel–совместимом персональном компьютере с применением программ Microsoft Excel, а также пакета компьютерных прикладных программ Statistica, версия 6.0 (StatSoft, 2003).
Результаты
В клинической картине у пациентов преобладали симптомы дисциркуляторной энцефалопатии, такие как снижение памяти, концентрации внимания, головокружение, головная боль, шум в ушах, расстройства сна, легкие вестибулярные нарушения и т.д. Для объективизации выраженности неврологической симптоматики мы использовали индекс Бартел, отражающий качество жизни пациентов с ХЦВЗ. В начале исследования его величина оказалась незначительно выше в группе больных без МС – 67% [55;95] по сравнению с группой больных с МС – 62% [53;91]. В конце нашего исследования, после проведенной терапии качество жизни пациентов существенно улучшилось – индекс Бартел увеличился у больных с МС до 87% [65;97], а у больных без МС до 93% [75;99] (рис. 2).
При сравнении гемореологических параметров было обнаружено, что показатель вязкости крови на разных скоростях сдвига у всех пациентов в большинстве случаев с течением времени уменьшался. При этом более выраженное изменение ВК отмечалось в группе больных без сопутствующего МС (рис. 3).
При исследовании агрегации эритроцитов более существенные нарушения были выявлены у больных с сопутствующим МС. Амплитуда агрегации, отражающая конечный размер эритроцитарных агрегатов, в течение всего наблюдения была достоверно выше у больных с МС. Примечательно, что в этой группе больных данный показатель превышал норму (до 10 у.е.) и составлял 13,6 [10,1;15,5] у.е., тогда как у больных без МС он оказался равен 9,2 [7,5;11,4] у.е. В начале и в конце исследования этот показатель существенно не изменился.
Прочность агрегатов, пропорциональная гамма диссоциации на фоне МС оказалась выше, чем без него (табл. 2). В течение динамического наблюдения последняя характеристика у больных с МС уменьшилась на 28%. У больных без МС этот показатель снизился в течение периода наблюдения на 14%.
Показатель времени образования одноцепочечных эритроцитарных агрегатов в виде «монетных столбиков» Tf в течение всего периода наблюдения был ниже нормы (2,25 с) у всех больных. К 14–м суткам терапии у больных с МС этот показатель остался неизменным, тогда как у больных без МС он снизился на 16% (табл. 2).
Деформируемость эритроцитов в нашем исследовании определялась двумя показателями – предельным индексом деформируемости и временем возвращения эритроцита к исходной форме Tr (табл. 2). Их исходный уровень у всех обследованных больных находился в области минимальных значений нормы и составлял, соответственно, на фоне МС 0,522[0,492;0,537] и 87,13[80,4;120,4] с, а без него 0,529[0,511;0,549] и 95,37[76,3;103,9] с. К концу курса лечения деформируемость эритроцитов у больных с МС улучшилась – предельный индекс деформируемости и Tr увеличились, соответственно на 6 и 26%. У больных без МС эти показатели также выросли на 21 и 17% соответственно. Таким образом, под влиянием Трентала деформируемость эритроцитов в обеих группах больных улучшалась, но у больных с МС в меньшей степени.
Подводя итог, можно утверждать, что микрореологические свойства крови в процессе лечения Тренталом претерпели однонаправленные изменения в сторону улучшения, но при наличии сопутствующего МС эти изменения были менее выражены. Это может объяснять значимость нарушения кровообращения на уровне микроциркуляции у больных с МС в патогенезе ХЦВЗ.
Агрегация тромбоцитов под влиянием адреналина при приблизительно одинаковом исходном уровне к 14–м суткам достоверно (р<0,05) снизилась в группе больных без МС, тогда как при наличии МС этот показатель даже увеличился (табл. 3), что свидетельствует о бо’льшей резистентности тромбоцитов при МС, в том числе к проводимой терапии.
При исследовании параметров гемостаза у больных с МС были выявлены более существенные нарушения по сравнению с больными без него. Обращали на себя внимание достоверно (р<0,05) более высокие концентрации фибриногена и ИТАП–1 у больных с МС, сохранявшиеся в течение всего наблюдения, несмотря на проводимую терапию (табл. 3). ФА, исходно сниженная в обеих группах больных, значительно увеличилась в процессе терапии – на 75% у больных с МС и на 88% – у больных без МС.
Выводы
Таким образом, нами была показана высокая эффективность назначения Трентала в качестве корректора гемореологических и гемостатических нарушений у больных с ХЦВЗ. Широкий спектр фармакологических эффектов, включающий воздействие на эритроцитарное звено гемостаза, обусловливает выраженное положительное влияние препарата на микрореологические характеристики у больных с сопутствующим МС. Терапия Тренталом приводит к значительному регрессу неврологической симптоматики и повышению качества жизни больных. При этом на фоне сопутствующего МС показатели гемореологии и гемостаза, исходно нарушенные в большей степени, чем у больных без МС, изменяются в меньшей степени. Это объясняется выраженной ригидностью и резистентностью форменных элементов крови – эритроцитов и тромбоцитов к гемангиокорректорной терапии. Однако уникальное воздействие Трентала на эритроциатрную агрегацию и деформируемость, являющихся при МС одними из ведущих причин нарушения гемореологии и, соответственно, микроциркуляции, позволяет говорить о целесообразности его назначения в качестве антиагрегантной терапии при лечении больных ХЦВЗ с сопутствующим МС.
Литература
1. Орлов С.В., Домашенко М.А., Костырева М.В., Шабалина А.А., Ионова В.Г., Танашян М.М. Гемореология и гемостаз у больных с ишемическими инсультами на фоне метаболического синдрома. Клиническая медицина, №1, 2007, с. 40-44.
2. Ройтберг Г.Е., Струтынский А.В. Метаболический синдром, М.: МЕДпресс, 2007, 224 с.
3. Суслина З.А., Танашян М.М., Ионова В.Г. Ишемический инсульт: кровь, сосудистая стенка. антитромботическая терапия. М.: Медицинская книга, 2005. 248 с.
4. Суслина З.А., Пирадов М.А. Инсульт: диагностика, лечение, профилактика. М.: МЕДпресс-информ, 2008. 288 с.
5. Angelkort B, Maurin N, Boateng K. Influence of pentoxifylline on erythrocyte deformability in peripheral occlusive arterial disease. Curr Med Res Opin. 1979;6(4):255-8.
6. Camus J. Goutte, diabete, hyperlipemie: un trisyndrome metabolique. Rev Rhumat 1966; 33
7. Dettelbach HR, Aviado DM. Clinical pharmacology of pentoxifylline with special reference to its hemorrheologic effect for the treatment of intermittent claudication. J Clin Pharmacol. 1985 Jan-Feb;25(1):8-26.
8. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. JAMA 2001:285;2486–2497.
9. Haffner S.M. Diabetes, hyperlipidemia, and coronary artery disease. Am J Cardiol 1999; 83: 17F–21F.
10. Henefeld M, LeonhardtW. Das metabolische Syndrome. Deutsch Ges Wes 1980; 36: 545–51.
11. Kaplan N.M. The deadly quartet: upper-body obesity, glucose intolerance, hypertriglyceridemia and hypertension. Arch Intern Med 1989; 149: 1514–20.
12. Kiesewetter H, Jung F, Blume J, Bulling B, Gerhards M. Conservative drug therapy and walking exercise in stage IIb peripheral arterial occlusion disease. Klin Wochenschr. 1986 Oct 15;64(20):1061-9.
13. Mehnert H, Kuhlmann H. [Hypertension and diabetes mellitus]. Dtsch Med J. 1968 Aug 20;19(16):567-71.
14. Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes. 1988 Dec;37(12):1595-607.
Источник
ÛwcY+6$gô”lpm8¡»±^®çr³ìVhôw)4SPèÓÑÓcÜÓ1÷ëSú9_Ö£°&flü^²säQ?ÄYaÈáGëVy´¯ïYÌã²½çE£
Ï«-Zñ
s
áÞEpüXÍûC7¹Yd¬Ô÷¨3¶R÷ ò|Dj”Tatt3Ü«ú¾Èýù:DaÒ¶·XA¤IǦ̮2äÞòLaHzC`ü5v6³ºêVÂê®ûKq
ý À¤ÁçøM!ö¯uN>I’Lù”2Ê2ßdí]WXVÖ2«¶±rÈ
Vëø«Xí
mcfõaÕ«.b
Ô]ÅJ`ïr>ÂïG1&ågÃ1y¶ Ôu5·ig_8KHæÍè16?á±Ë$·MЦ!ëTºy1fkU©Ñ#[+Çä
.ém>aîº26m¹ãaAéÿè¤#ëöC¬Àh`IãyX*áq
;
*i}
u
ÐT¯ºÞñâ8ò[ÿañ!dÏ érxX½cÐì#¡Ô dãP#]r^xb5PsZtØP¢døSü´
EÇðçÍ,ôÈô¥-9W¸3S²ýÄ+úf}3=!úq_#ì Ä!µ=ÄõªÄá]VÄEkIèÎɶþ.~Ë.i5
«S’ÝÞMÝFIæÔ³Û.Çæ=·Ì$áJR³;´iz¼ÄÓw«¦/HizÈV.=N~÷îG¿Æ{|üEKS;Ï¡Ó ñÍ’½B£cè±¹ 9Â'[PPH}½ê”x·Èàsa#bÁ&«ûX¢Ñ%8«
M¦$;FYÑmdzQ`JðÜP£HÅÙ$Û§æDÐ8ÑÒ÷*KNB/ô¡Jééî¤W]oõ!ÉyHv Ýf$ÛÄR Û~:5#´N±ö ö%¡§nSVK0#Y¤ ôÒ«.7üÞ¤L¡|ñÚCñøÐ
Í6TÉóëy_ïcÓºý4k²h]eÍÀûø,õ¼B¶:ú²
Jé`
éîaªW]d
oµ(Ö¢Aå Ü¡NÙ-¸3 0k^|!¯¤Eû#
æ¾këëS½jæL/ã#Ð
x%ÜÊ&$ÎÖÛÁA·ºÀA±MgF:n¹oÃVÊñ0Ç7tÛ¬¨sÔíç²K¤Ó*»än%¸é½º ¸péÀY®©Ïâ
m½çi>ë=ó=ìÙY¾Ñô1v2ZÈP¥
Æ÷fõÛ«.ÔáÜ·àÐyïã|°T’ÕÙIÙÞL¬ÔÌfÝ 6Qh`!¬ÎN0Úi]0±ÃºHÝfpJµLïtz`Ù1l
)ê8Sa«õîTHJ@_8uu ¡hffg«µíi
[ßó|@jkâÍrN”” ì°=ZFí{ÕEÛã]7l_4àÀR¢ø{Ö¦|Ñógó=
Iå%}-X^?*u¹¥?[
§¶ýHkÆhmY5Nþô³á_(ÍY®orHAfß”Õb¯º”R÷NAfmãÖdZk§Í²½ú+’ëÏ270}V:È]’»¹jÊsÇà¥ÞIû¬éO`jp”¬ßAQ²ßô¸½ïcXò¨$ÎÅ·Î/ElÆq¹NcXYLØرêßâk>§8Z+8qnúÜÄ¡ç5PV/8ëÔNpÀÄp:(vƽãã%RåIu”ÅH6q¼Ãõ½8=ÌÚj3&ö+uù%d,ÒÕ.Ú¶s͵,ñGKNuþ|aP(ÆÖêÖzÕEÖðNËÎËñ&E#Zøû2¢^WºYÈ¡oüß߸àlí]ÓFkRK¡Kd&;¹3õ~ªfÊ`1ä
ïáÌêã³W]ä©ËeRÂرη ¡¸&ÊxCqûÚ½¹Úú´F²5k_£Æt_åMPüN¸n%v£Ç°½ê¢añ¶³asåÚÈÁlïåèß䡪jn·vµXLÊU`:TþºD7ñÚ£´¿”9éKuak#¢ZÁ»iÛ¥vIØ’`ÆÔLëÕ¼spuHh+h)=¬ôª¬à7Ï
Fp(´æ½Áè¶ÞZÇû5Ù;¬’ÅÙ ØÉÉÑf®Skóµ0ü²S [Ä˹ƹ¬ü®6KÆwjM,`¡È áGú3M ¤,¨¹«Ne+´ÍªäRfô|þ ,lN¯rôn
”±”&&tóAÕ¨ÐÚÎBß,ÞLZÃÅû+8HT_e¦vr&vÔ-I°ëzT/BÉy pmJÛçÿº±¸Ôf
ôÓÕÃÅïúã:ä¥KtÏbºúoïð[ÉMp ]’Óm©Ï¯¿þ^*sÀgHþôç]ájC^:Èòêt ¤·$E³º&ãJ ¾+ù®%âz°E>yWjôÄçä¸æÑK¥-Aþ¹|vî´»µykB(&8}o
‘”þ6xùïÒ¤åd&q«øùßIÙ,HBD[?®k~$ï?zz³
endstream
endobj
21 0 obj
>
endobj
22 0 obj
>
endobj
23 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 24 0 R/Group>/Tabs/S/StructParents 2>>
endobj
24 0 obj
>
stream
xÍMo$·ïôú¸ ßìÌÌJ°9,|XlÖμºäßÝäUMQ²a$I®~«|d=÷§ß¿üòñÓót8Ü?~ú÷çMîÏß¿ýöóýÓÿþóùþÇ¿~ùúñùË·¯Çãt~ÎO·7÷jbP9=ýr{Ã&jÿÃ&%
|èéé·Û:ýêþçï·7Þï~þq{ó`ÝVÅÉ”7ï&àÊYf!¬uéôðÃeîtÏòÃåû÷-üå×þrmïe&c8ÛpcWÕå3åâá(í¯âÑþyò¿JjÿÒ¶/0¶¢ÜÖÞýäÿ|TÍÄpÌE±¹Øa×*Á)´í©Ï¾YõåxÇÝÏ¥·_”Z
E)F¸î
K?ÓN.Æs¢4Y·j&5Øb#.Gýx*h/p¨
3QsáPGo
J¡y°¨©º;a¦PÓÙeÅÂGùÔuFlÈ®vû^lòÑ=}GW}·Ý*2§ÔÆHHèk kSIL¯Q¨ XKi©àú÷CLöÒþ»!AÚ¿¢>Úb¥Cª0¨%$e/U”üÆp¹4Guðw
¢sw
ÊË:´X²Âe:ð·ÂÇÎDð³8VÏQÜ
cïýÏp«sT1~xsÎØ¡íN¤[9¥ÄòPQ̲6ïÂ.QheS¡î û¢QFÐ@Ù0¸çdÌYÏÂXÁG¼¯ q(Àï@ç©_/aú»º£Äöþô«ÈÿìÐFbËfíÚg`©@,q
5ÀÀýXØi]Dt ÀhÍ j¼¶óõè¥èP !È`:@68kK=ûG×ÙçÅ9iÙ¥#v¬ëØ£Ç0ã|Ùø3Ҥ¶©]{!o öÙc¬³Ý¡/óoäþ>8
ø¸vóÎøê%$n¼
+}Èd²C¤âQ{ËRæoä)Õn;
pFk
¸æqúªÊ§ÍñÎ/qçzµËãG2 ¬+u>ºù¨3Zc?Ñvjü
@G×æBëÇMN{OuðnIzdô°=ºz”ßÍÑ/ñyµtå¥ã9ʨ3ûóÉ 6óÉÇ>&¾ôqwòëÁWâ#x¹·ìR1¢Ú/(ud¾º(Úîd¾ÜÉL}#1õ!Qhä>$æ®
«K0¸15|ZbÊÕ=¶Ô$¿:ù z§¦:5¹Y!§¾_¶DrÚpå¹e%$|dÀg*A´pÇû[öÍÒÅfÉi,nìuc¬ ÔAV]BmwÈÊÉd!Q¨ÉR3#äñ%ºBµc²¥N%c^ÜvÉ p2 ]
]¹B6k¨JlêA¯¸¼Æ¥:¶ÖÊѧ®QR[oû@]àÁAë«
,ñI]2,
ÔL´éhê*nÃ`(”^åö¨@,ä*0
ÀOË1HBýU¿?
7¹4¾”¨õRÙØ ÐfkÀ:ƵºP
Úî ; IFÂÐ YhÂXɼ®UáÆ8ÉÖÙÙd$Kää&¹C “9ø«¼® óùç:°>¤åðêáë!éBsbðk@ö!æuÁµÝ8w³Ó!
1ÄLÕµçÂën×¼WD¤SÁPŹîPJιBªç×B³ßl»¥ÆÜFj
´!¨i³t/Å »ú%”QpãÖ’r%+µµDG $-S8Êíö*+Þöu·ùæÕYjuVÈÂAõÎØÆ!¿ÍÆR;ã
ÇvO”$ösãÏëyt¸ó9
Û71êÈü=ÃË Ùá¢t)ÄkO1%u¬ÐA9è5}A,,Û©ó¤T-ü±ÊÌýBÊAó@]jCmwb(b>D@#jægnûËQÚpctïKAÉÒ!këQö¾
8!v {_¹À!ÓÌ#?ñäæå¦×¸0jÍqÅ=?/5gyÏËXLÏò©Íeø´±¥S³ÿ¿¶yкzxÈ2n.{,å(=×¹¯§û- ·3ðO^@îGzTÜíycÜà>(í¯:D]-Dmqî’
¹Qïx#ahpo»/íÚ.uµ7ƹWÌ,ã.ö¨@Üç*0÷÷ÀÁoK¥)U ùH©Çåj2oèzîY¢ûȳ¹·ï¹~¸«
Ñ~fJ%,&KÇТ¿·éoBR¢î(¡BOO>¼ûþûF¢(ܨ«bnÒ#I*(u$©º4Úî$©ÜIÌRI
C#I1í¦2=oÓ×ÜOR|v_+±%)¸Ù£%©NRPÊÆt¤5MÈT¦ªyúiQáNë
‘.¶`UUEZs3¹9»îçËx, A4·pýÞ -Ñ3(íÃ)ëZ
j»gî¤P #
N$5|n¹Õg]IÁq8©”:/¤ÀeËγG 38l§æB îäï@YÅþý
ßgÂíÕèÃ×
Источник
Дата публикации 26 марта 2018Обновлено 19 июля 2019
Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне).[4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа.[5]
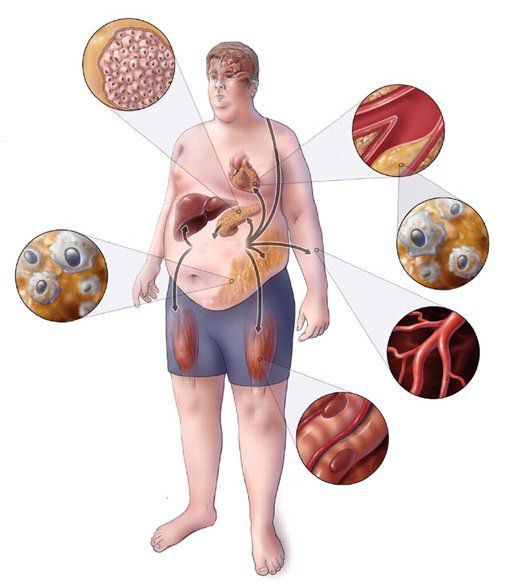
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям.[3][7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м2), классифицируются следующие типы массы тела (МТ):
- нормальная МТ — ИМТ ≥18,5 <25;
- избыточная МТ — ≥25 <30;
- ожирение I степени — ≥30 <35;
- ожирение II степени — ≥35 <40;
- ожирение III степени — ≥40.
ИМТ <18,5 характеризуется как дефицит массы тела.
Важную роль играет распределение жировой ткани. Различают два типа ожирения:
- гиноидный (по типу «груша»), когда избыточная жировая ткань распределяется преимущественно на бёдрах и ягодицах;
- андроидный (по типу «яблоко»; абдоминальное ожирение), с преимущественной локализацией жира в области верхней половины тела (живот, грудь, плечи, спина).

Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Центральным патологическим звеном метаболического синдрома является изменение углеводного обмена. Концентрацию глюкозы оценивают в капиллярной крови (норма <5,6) и в венозной плазме (норма <6,1) натощак в ммоль/л. Гипергликемией натощак считается показатель ≥5,6 <6,1 и ≥6,1; <7,0; сахарный диабет — ≥6,1 и ≥6,1 <7,0, соответственно. Через 2 часа после углеводной нагрузки (75 гр глюкозы или 125 гр сахара рафинада, растворённых в 200 мл воды) нормальный показатель концентрации глюкозы в капиллярной и венозной крови — <7,8 ммоль/л; НТГ — ≥7,8 <11,1 и сахарный диабет — ≥11,1.
Ещё один важный компонент метаболического синдрома — артериальная гипертензия, которая может носить вторичный характер. Нормальным считается систолическое артериальное давление (САД) 120-129 мм рт.ст и диастолическое артериальное давление (ДАД) 80-84 мм рт.ст. САД <120 и ДАД <80 называют оптимальным давлением, а САД 130-139 и ДАД 85-89 — высоким нормальным артериальным давлением. Различают три степени артериальной гипертензии:
- 1 ст. – САД 140-159, ДАД 90-99;
- 2 ст. – САД 160-179, ДАД 100-109;
- 3 ст. – САД ≥180, ДАД ≥110.
Повышение артериального давления характеризуется повышением риска сердечно-сосудистых событий.
Для метаболического синдрома характерны также изменения липидного обмена, которые классифицированы в таблице ниже (в ммоль/л).
| Параметры липидов | Риск низкий | Риск умеренный | Риск высокий | Риск очень высокий |
|---|---|---|---|---|
| ОХ | ≤5,5 | ≤5 | ≤4,5 | ≤4 |
| ХС-ЛПНП | ≤3,5 | ≤3 | ≤2,5 | ≤1,8 |
| ХС-ЛПВП | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 | муж. >1 жен. >1,2 |
| Триглицериды | ≤1,7 | ≤1,7 | ≤1,7 | ≤1,7 |
| ХС не-ЛПВП | ≤4,3 | ≤3,8 | ≤3,3 | ≤2,6 |
| Примечание: ОХ — общий холестерин; ХС-ЛПНП — холестерин липопротеинов низкой плотности; ХС-ЛПВП — холестерин липопротеинов высокой плотности; ХС не-ЛПВП — холестерин, не связанный с липопротеинами высокой плотности. | ||||
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий.[17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП <1,0 у мужчин; <1,2 у женщин и повышение ХС ЛПНП >3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – <11,1.[8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение < 0,33).[12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность[14], рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия)[15], психотерапевтических методик и обучающих программ.[13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии.[10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности[1]. Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут).[11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.).[9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46%[6].
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
| АО+АГ+НТГ (СД) Умеренный ССР | АО+АГ+ДЛ Высокий ССР | АО+АГ+НТГ (СД)+ДЛ Высокий и очень высокий ССР | ||
|---|---|---|---|---|
| Д/ФН+АГП+ГГП | Д/ФН+АГП+ГЛП | Д/ФН+АГП+ГГП+ГЛП | ||
| Примечание ССР – сердечно-сосудистый риск; АГ – артериальная гипертензия; АО – абдоминальное ожирение; ДЛ – дислипидемия; НТГ – нарушение толерантности к глюкозе; СД – сахарный диабет; Д/ФН – диета/физическая нагрузка; АГП – антигипертензивный препарат; ГГП – гипогликемический препарат; ГЛП – гиполипидемический препарат. | ||||
Источник
